2. 宁波大学海洋学院, 宁波 315211
2. School of Marine Sciences, Ningbo University, Ningbo 315211, China
动物的生长主要是骨骼肌的生长,肌纤维的形成受到多种转录因子的调控,其中生肌调节因子(myogenic regulatory factors,MRFs)家族、肌细胞增强因子2(myocyte enhancer factor 2,MEF2)、胰岛素样生长因子(insulin-like growth factors, IGFs)等为正向调节因子,肌细胞生长抑制素(myostatin,MSTN)等为反向调节因子[1]。在脊椎动物的研究中已经发现MRFs家族的4个成员,分别是肌肉转录调节因子(myogenic differentiation antigen,MyoD)、生肌因子5(myogenic factor 5,Myf5)、肌细胞生成素(myogenin,MyoG)和生肌调节因子4(myogenic regulatory factor 4,MRF4)。它们具有不同的时空表达特性,其中MyoD和Myf5主要在成肌过程的早期表达,参与成肌细胞的决定和维持;MyoG和MRF4主要参与肌细胞的终末分化过程,是骨骼肌特异性蛋白基因表达的主要调节因子[1-2]。有研究表明,鱼类骨骼肌在嵌合型生长阶段,MyoD、Myf5和MEF2等基因持续表达。一旦此阶段基因的表达受阻,鱼类个体的生长则受到抑制,致使个体变小[1, 3-5]。因此,及早地激活嵌合型生长阶段,对鱼苗和幼鱼阶段的肌肉发育和个体体重的增加极为重要。
有研究发现配对盒转录因子3(paired box 3,Pax3)和配对盒转录因子7(paired box 7,Pax7)的高表达是肌卫星细胞的特异性标志,同时,它们在肌卫星细胞增殖和分化中发挥重要作用,Pax7被作为体外培养肌卫星细胞的鉴定基因[6]。Pax3和Pax7作为转录因子直接调节生肌调节因子Myf5和MyoD的表达,继而影响肌细胞分化。通过基因表达和细胞定位研究揭示,肌卫星细胞通过非对称性细胞分裂来维持生肌细胞的激活和自我更新,即一部分来自肌卫星分裂的子细胞维持着干细胞功能,而另一些子细胞则被激活形成肌细胞进而发育成肌纤维[1, 7]。
然而,水产养殖动物关于肌源性生长转录因子在蛋白质水平的检测相对较少,大部分局限于转录水平的检测,这种局限性制约了水产动物肌肉发育调控更深入的研究。因此,本研究以黄河鲤白肌为原材料,通过原核表达技术获得重要的含有抗原决定簇的4种肌肉发育的关键因子(Pax7、MyoD、MyoG和MRF4)的融合蛋白,经过纯化之后免疫新西兰大耳兔(Oryctolagus cuniculus),获得相应的鲤多克隆抗体,并以此为工具,检测黄河鲤白肌组织中Pax7、MyoD、MyoG和MRF4在蛋白质水平的表达情况,为探究黄河鲤肌肉发育的调控奠定基础。
1 材料与方法 1.1 试验材料新西兰大耳兔购自河南省新乡市新乡医学院,pMD 19-T Vector(Code No.6013)购自宝生物工程(大连)有限公司,pET21a(+) Vector、DH5α和BL211(DE3)受体菌为本实验室保存。
1.2 鲤肌肉总RNA的提取及反转录无菌条件下取300~500 mg黄河鲤肌肉组织,Trizol法提取样品总RNA,总RNA质量及浓度用Nanodrop 2000(Thermo Fisher Scientific,美国)测定,以206和280 nm处吸光度值的比值为1.80~2.10作为RNA质量和纯度的标准,用1.2%的琼脂糖凝胶电泳对RNA质量进行定性检验。用PrimeScriptTM RT reagent Kit with gDNA Eraser进行反转录,按照试剂盒说明书获得第1链cDNA。
1.3 含抗原决定簇基因片段的工程菌的构建 1.3.1 目的基因引物设计经NCBI数据库查阅黄河鲤肌肉发育关键基因Pax7、MyoD、MyoG和MRF4的序列全长,将开放阅读框(ORF)翻译成为蛋白质序列,利用DNAstar软件的Lasergene程序中protean子程序进行蛋白质序列的抗原决定簇预测分析。采用Primer 5.0分别设计上述基因的特异性引物,分析并添加特定的酶切位点。表达载体为pET21a(+),感受态细胞为BL21(DE3),基因的引物序列及相关信息如表 1所示。
|
|
表 1 原核表达相关基因的引物序列及相关信息 Table 1 Primer sequences and related information of prokaryotic expression related genes |
使用2×Phanta Max Master Mix (Dye Plus)(南京诺唯赞生物科技股份有限公司)扩增目的基因。反应体系包括2×Phanta Max Master Mix 10 μL,模板DNA 1 μL,上、下游引物各0.5 μL,ddH2O 8 μL,共20 μL。试剂混匀后迅速离心,PCR扩增程序为:95 ℃ 3 min,预变性;95 ℃ 30 s,变性,55 ℃ 15 s,复性,72 ℃ 30 s,延伸,共35个循环;72 ℃ 10 min和12 ℃暂存(暂存时间不超过30 min,PCR扩增程序结束后及时取出反应产物,进行下一步试验)。
1.3.3 目的片段的胶回收采用快速琼脂糖凝胶DNA回收试剂盒(CW2302A,江苏康为世纪生物科技有限公司)回收凝胶中的DNA目的片段。
1.3.4 重组克隆质粒的构建将回收的目的片段连接到pMD19-T克隆载体上。反应体系包括2×Solution I 5 μL,目的基因4.5 μL,pMD19-T Vector 0.5 μL,共10 μL。混匀后迅速离心,置于PCR仪中,16 ℃过夜进行T-A连接。
1.3.5 重组克隆质粒的转化与筛选采用热激法将连接产物转入感受态细胞DH5α内。选取阳性克隆,将其菌液逐级培养,用30%甘油溶液于-80 ℃保存。提取阳性克隆质粒,一部分质粒于-80 ℃保存,一部分质粒则送至苏州金唯智生物科技有限公司进行测序验证。
1.3.6 重组质粒DNA的提取采用质粒抽提试剂盒(D6943-02,OMEGA,美国)按照说明书提取质粒DNA。
1.3.7 重组表达质粒的构建、转化及筛选 1.3.7.1 重组克隆质粒的双酶切将阳性重组克隆质粒pMD-19T-Pax7、pMD-19T-MyoD、pMD-19T-MyoG和pMD-19T-MRF4进行双酶切。反应体系为重组质粒(recombinant plasmid) 5 μL,10×Buffer 5 μL,BamH Ⅰ 2 μL,Hind Ⅲ 2 μL,ddH2O 36 μL,共50 μL。37 ℃水浴孵育过夜,1.0%琼脂糖凝胶电泳检测,纯化含有BamH Ⅰ和Hind Ⅲ双酶切位点的黄河鲤Pax7、MyoD、MyoG和MRF4片段并回收。利用上述步骤进行表达载体pET21a(+)的双酶切及产物纯化回收。
1.3.7.2 目的片段与表达载体的连接将含有BamH Ⅰ和Hind Ⅲ双酶切位点的黄河鲤Pax7、MyoD、MyoG和MRF4片段与表达载体pET21a(+)的双酶切产物进行连接。反应体系为2×T4 Buffer 5 μL,双酶切基因片段3 μL,pET21a(+) 1 μL,T4 Ligase 1 μL,共10 μL。混匀后迅速离心,置于PCR仪,16 ℃过夜进行T4连接。
1.3.7.3 T4连接产物的转化、筛选及阳性重组表达质粒的提取将T4连接产物转入pGEM-T感受态中,随后进行筛选和阳性重组表达质粒的提取。
1.3.8 重组表达质粒的双酶切验证用BamH Ⅰ和Hind Ⅲ对阳性重组表达质粒pET-21a-Pax7、pET-21a-MyoD、pET-21a-MyoG和pET-21a-MRF4进行双单酶切验证,方法与重组克隆质粒双酶切相同。酶切产物经电泳检测,采集并分析电泳图像。将一部分筛选得到的阳性克隆质粒于-20 ℃保存备用,一部分送至苏州金唯智生物科技有限公司进行测序验证。
1.4 重组蛋白的原核表达 1.4.1 表达菌株的制备将1.3中构建好的重组表达质粒pET-21a-Pax7、pET-21a-MyoD、pET-21a-MyoG和pET-21a-MRF4通过热激转化到表达感受态大肠杆菌BL21中,并筛选阳性克隆。将获得的阳性克隆接种于LB培养液(含氨苄青霉素100 μg/mL),37 ℃下200 r/min振荡过夜培养。
1.4.2 目的重组蛋白的诱导表达无菌条件下,取培养过夜的菌液5 mL加入到250 mL LB培养液中,37 ℃下200 r/min振荡扩大培养,至菌液600 nm处吸光度值达到0.5~0.6时(2.5~3.0 h),加入异丙基硫代半乳糖苷(IPTG,终浓度1 mmol/L)诱导剂,37 ℃下200 r/min振荡诱导培养6 h,期间每小时分别取菌液1 mL,用于后续蛋白表达的验证。
1.4.3 目的重组蛋白的检测采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)的方法检测原核表达的融合蛋白,以未经IPTG诱导的菌体作为对照。
1.4.4 重组蛋白的纯化经SDS-PAGE检测到目的蛋白表达后,采用1 mL镍离子预装柱(HisTrapTM excel)对表达的重组蛋白进行纯化。室温条件下8 000×g离心2 min,收集菌体,将收集到的菌体用平衡缓冲液[equilibration buffer,20 mmol/L磷酸(PB)缓冲液,500 mmol/L NaCl溶液,pH 7.4]重悬浮,重悬浮的菌体在冰浴中进行超声波裂解(6 mm变幅杆,35%功率,3.5 s工作,7 s休息,裂解60~120 min,至溶液由浑浊变清透,由黏稠变不黏稠表明裂解完成)。裂解后获得目的重组蛋白,借助清洗缓冲液(wash buffer,20 mmol/L PB缓冲液,500 mmol/L NaCl溶液,20 mmol/L咪唑,pH 7.4)和洗脱缓冲液(elution buffer,20 mmol/L PB缓冲液,500 mmol/L NaCl溶液,250 mmol/L咪唑,pH 7.4)对重组蛋白进行纯化。将收集到的目的蛋白进行SDS-PAGE检测分析,于-80 ℃超低温冰箱中保存备用。用透析方法最大限度去除纯化后重组蛋白溶液中的尿素和咪唑等离子。
1.5 多克隆抗体的制备 1.5.1 重组蛋白免疫动物将分装的1 mL重组蛋白(约300 μg/mL)+1 mL完全弗氏佐剂/不完全弗氏佐剂,用破碎仪充分混匀,检查乳化程度(将乳化好的重组蛋白溶液滴在水面上,如果液滴不扩散,表明重组蛋白和佐剂已达到“油包水”的完全乳化状态)。采用耳缘静脉注射和多点皮下注射的方法免疫新西兰大耳兔[8],每周免疫1次,共计免疫5次,初次免疫用的乳化剂为完全弗氏佐剂,后续的乳化剂为不完全弗氏佐剂。
1.5.2 兔源多克隆抗体效价的检测采用酶联免疫吸附试验(ELISA)的方法检测新西兰大耳兔血清中抗体的效价。重组蛋白最后1次免疫新西兰大耳兔前1周进行耳缘静脉采血,将纯化的重组蛋白用包被液稀释至10 μg/mL,向酶标板中加入抗原100 μL/孔,4 ℃过夜包被。使用封闭液[10 g脱脂奶粉溶于100 mL磷酸盐(PBS)缓冲液]37 ℃孵育2 h后用抗体稀释液对兔源血清进行倍比稀释(稀释倍数:100、1 000、10 000、30 000、90 000、270 000、810 000、2 430 000),向酶标板中依次加入100 μL/孔的稀释血清,37 ℃孵育2 h,以未免疫的兔源血清为对照组。用抗体稀释液按1 ∶ 20 000的比例稀释羊抗兔二抗辣根过氧化物酶标记羊抗兔免疫球蛋白G(H+L)[HRP-Goat-Anti-Rabbit IgG (H+L)],向酶标板中依次加入100 μL/孔的稀释二抗,37 ℃孵育1 h。加入100 μL/孔的显色液,37 ℃孵育30 min,终止液为2 mol/L H2SO4溶液,每孔加入50 μL,在酶标仪中读取450 nm处的吸光度值,统计结果。
抗体效价判定标准:试验组与阴性对照组的吸光度值比值应≥2,血清的最大稀释倍数为待测抗体的效价。抗体效价检测达标后,通过颈动脉插管取血,以获得免疫血清,分装后于-80 ℃保存备用。
1.6 黄河鲤肌肉组织免疫荧光验证随机选取3尾黄河鲤(n=3),从其背鳍前下方侧线以上区域取5 mm×5 mm×5 mm大小的肌肉组织块,放入4%多聚甲醛固定液中固定,然后经过梯度酒精脱水后使用石蜡包埋,对包埋好的肌肉组织块进行切片,每个多克隆抗体在3尾黄河鲤肌肉组织块的6个平行切片样品上进行验证,经二甲苯脱蜡、梯度酒精复水后,使用H2O2(8 mL甲醇+1 mL PBS缓冲液+1 mL 30 % H2O2)封闭内源性过氧化氢酶,再使用山羊血清(北京索莱宝科技有限公司)封闭后,分别使用抗Pax7、MyoD、MyoG和MRF4血清4 ℃孵育过夜,第2天使用荧光二抗HRP-Goat-Anti-Rabbit IgG (H+L)孵育,再使用4′, 6-二脒基-2-苯基吲哚(DAPI)染色,最后用抗荧光淬灭剂封片,透明指甲油封边。使用荧光显微镜对切片进行拍照,使用Image J对图片荧光面积进行分析。
1.7 数据统计分析试验数据采用SPSS 22.0软件的单因素方差分析(one-way ANOVA)程序进行统计分析,并采用Duncan氏法进行多重比较检验,结果以平均值±标准差表示,P < 0.05表示存在显著差异。
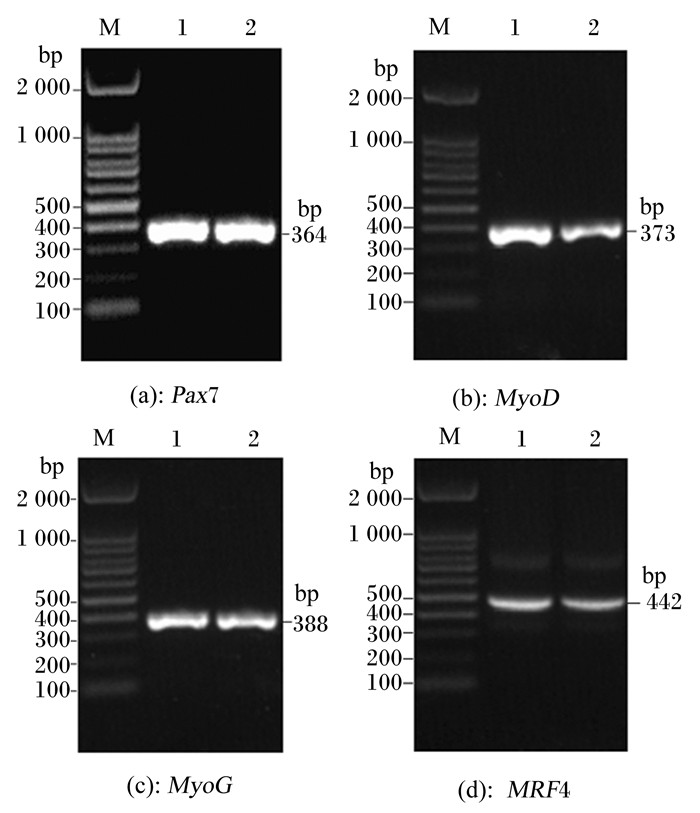
2 结果与分析 2.1 黄河鲤肌肉发育关键基因抗原决定簇片段的克隆以黄河鲤肌肉的cDNA为模板,以1.3.1中的引物进行PCR扩增Pax7、MyoD、MyoG和MRF4基因的全长序列。琼脂糖凝胶电泳分析显示,分别在360、370、390和440 bp附近获得1条特异性的条带(图 1),实际大小为364、373、388和442 bp,大小与预期一致。
|
Pax7:配对盒转录因子7 paired box 7;MyoD:肌肉转录调节因子myogenic differentiation antigen;MyoG:肌细胞生成素myogenin;MRF4:生肌调节因子4 myogenic regulatory factor 4。下图同the same as below。 M:D2000 bp DNA ladder;1、2:PCR产物。 M: D2000 bp DNA ladder; 1, 2: PCR product. 图 1 黄河鲤肌肉发育关键基因抗原决定簇片段PCR产物的电泳分析 Fig. 1 Electrophoresis analysis of PCR product of antigenic determinant fragment of key genes for muscle development of Yellow River carp (Cyprinus carpio haematopterus) |
将Pax7、MyoD、MyoG和MRF4片段琼脂糖凝胶纯化后的酶切片段与pET-21a(+)质粒琼脂糖凝胶纯化后的酶切产物进行T4链接,得到重组表达质粒pET-21a(+)-Pax7 (354 bp)、pET-21a(+)-MyoD (363 bp)、pET-21a(+)-MyoG (378 bp)和pET-21a(+)-MRF4 (432 bp)。
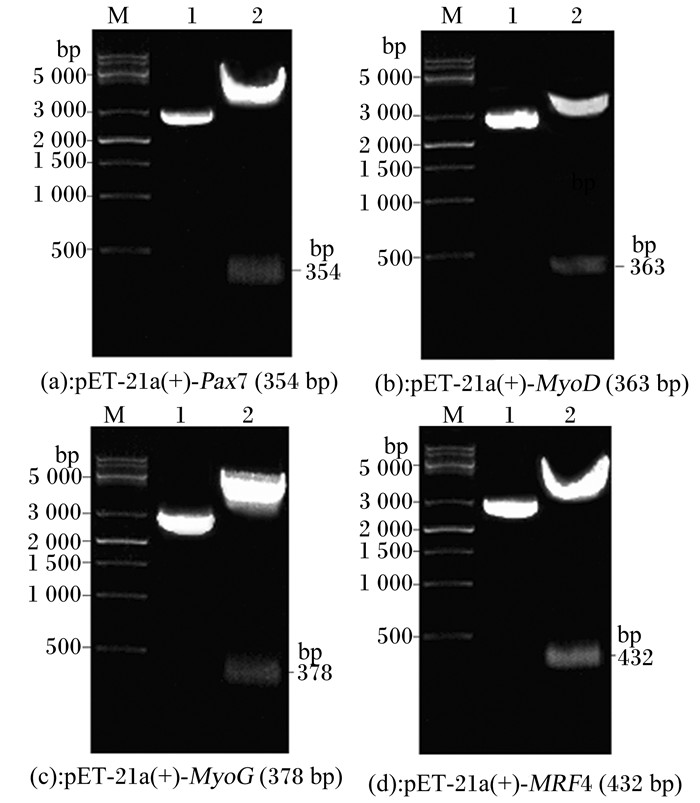
对筛选获得的阳性重组表达质粒pET-21a(+)-Pax7 (354 bp)、pET-21a(+)-MyoD (363 bp)、pET-21a(+)-MyoG (378 bp)和pET-21a(+)-MRF4 (432 bp)双酶切(BamH Ⅰ和Hind Ⅲ)处理(图 2),检测Pax7、MyoD、MyoG和MRF4目的片段是否连接到表达载体pET-21a(+)上。酶切反应结束后,经1.0%琼脂糖凝胶电泳分析酶切结果(图 2)。1号和2号泳道分别为重组质粒和双酶切片段。根据酶切结果可知pET-21a(+)-Pax7 (354 bp)、pET-21a(+)-MyoD (363 bp)、pET-21a(+)-MyoG (378 bp)和pET-21a(+)-MRF4 (432 bp)均为阳性重组表达质粒。
|
M: D2000 bp DNA ladder;1:重组质粒;2:重组质粒双酶切片段。 M: D2000 bp DNA ladder; 1: recombinant plasmid; 2: double enzyme digestion of recombinant plasmid. 图 2 重组表达质粒双酶切产物琼脂糖凝胶电泳验证 Fig. 2 Gel electrophoresis analysis of product of double enzyme digestion of recombinant expression plasmid |
初步的阳性重组表达质粒经测序检测,与NCBI数据库中已提交的基因进行序列比对,序列同源性均在99 %以上,说明表达质粒pET-21a(+)中所插入的基因片段均为目的片段。
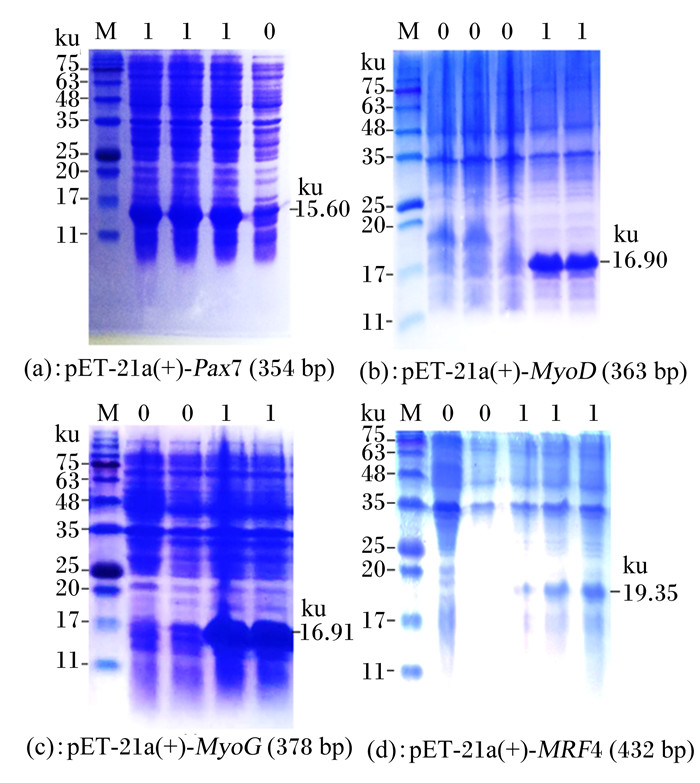
2.4 重组蛋白的诱导表达、纯化与鉴定 2.4.1 重组蛋白的诱导表达重组表达质粒pET-21a(+)-Pax7 (354 bp)、pET-21a(+)-MyoD (363 bp)、pET-21a(+)-MyoG (378 bp)和pET-21a(+)-MRF4 (432 bp)在大肠杆菌BL21中经IPTG诱导表达,并选用无IPTG诱导的含有重组表达质粒的菌液做阴性对照。重组蛋白电泳结果显示:IPTG诱导后,重组表达质粒的菌液所在泳道均具有特异性蛋白条带,大小分别约16、17、17和19 ku(图 3)(实际大小分别为15.60、16.90、16.91和19.35 ku),而阴性对照在此位置没有特异性蛋白条带。
|
M: 蛋白质marker (11~245 ku);0:重组质粒无IPTG诱导组;1:重组质粒经IPTG诱导组。 M: protein marker (11 to 245 ku); 0: the group of recombinant plasmid inducement without IPTG; 1: the group of recombinant plasmid inducement by IPTG. 图 3 重组蛋白原核表达SDS-PAGE分析 Fig. 3 SDS-PAGE analysis of recombinant protein prokaryotic expression |
收集表达重组目的蛋白菌体,超声破碎后经镍离子柱纯化、半透膜透析和超滤等技术得到纯化后的重组目的蛋白。PBS或未诱导的含有重组表达质粒的菌体做阴性对照(0号泳道)和纯化的目的蛋白溶液(1号泳道)经SDS-PAGE检测,结果如图 4所示。

|
M: 蛋白质marker (11~245 ku);0:阴性对照组;1:重组蛋白纯化组; M: protein marker (11 to 245 ku); 0: negative control group; 1: recombinant protein purification group. 图 4 原核表达重组蛋白纯化后SDS-PAGE分析 Fig. 4 SDS-PAGE analysis after purification of prokaryotic expression recombinant protein |
采用ELISA的方法检测收集的血清中多克隆抗体的效价,结果如表 2、表 3、表 4、表 5所示。Ⅰ、Ⅱ、Ⅲ列为试验组的3个平行数据,Ⅳ、Ⅴ、Ⅵ列为对照组(未免疫兔血清)的3个平行数据。从表中可以看出,当兔源血清稀释至2.43×106时,4种多克隆抗体的试验组与对照组的效价比值均大于2,故判定制备的4种多克隆抗体的效价均达到2.4×106。
|
|
表 2 ELISA方法测定多克隆抗体Pax7效价 Table 2 Pax7 polyclonal antibody titer detected by ELISA method |
|
|
表 3 ELISA方法测定多克隆抗体MyoD效价 Table 3 MyoD polyclonal antibody titer detected by ELISA method |
|
|
表 4 ELISA测定多克隆抗体MyoG效价 Table 4 MyoG polyclonal antibody titer detected by ELISA method |
|
|
表 5 ELISA方法测定多克隆抗体MRF4效价 Table 5 MRF4 polyclonal antibody titer detected by ELISA method |
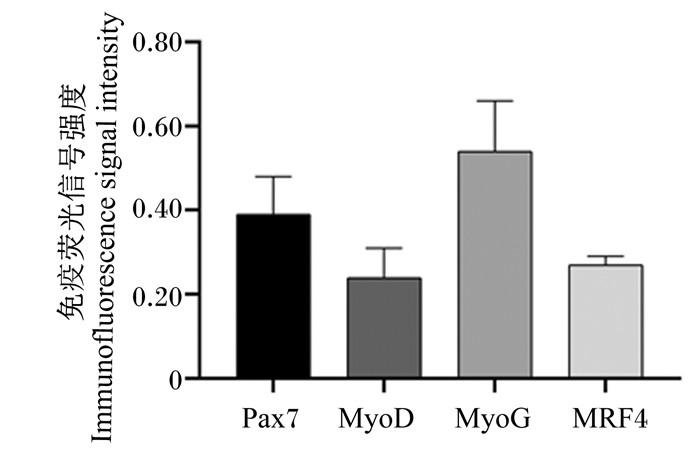
鲤肌肉中肌肉发育关键因子的蛋白免疫荧光检测及对比如图 5、图 6所示。数据分析显示,黄河鲤白肌中Pax7、MyoD、MyoG和MRF4蛋白免疫荧光信号强度无显著差异(n=3, P>0.05)。

|
FITC: 经异硫氰酸荧光素染色后的肌纤维横截面;DAPI: 经4′, 6-二脒基-2-苯基吲哚染色细胞核的肌纤维横截面;Merge: 将2个图进行合并后的肌纤维横截面。 FITC: cross section of myofiber of target proteins incubated only with antibodies; DAPI: cross section of myofiber of nucleus stained with 4′, 6-diamidino-2-phenylindole; Merge: cross section of myofiber of merge FITC and DAPI. 图 5 黄河鲤白肌中肌肉发育关键因子的蛋白免疫荧光检测 Fig. 5 Protein immunofluorescence assay of key factors for muscle development in white muscle of Yellow River carp |
|
图 6 黄河鲤白肌中肌肉发育关键因子的免疫荧光信号强度 Fig. 6 Protein immunofluorescence signal intensity of key factors for muscle development in white muscle of Yellow River carp |
本试验采用常规的多克隆抗体的制备方法,利用生物信息学方法从NCBI数据库和国家生物信息中心(China National Center for Bioinformation,CNCB)搜集鲤的相关蛋白分子信息,经过分析Pax7、MyoD、Myogenin和MRF4 4个蛋白因子的分子序列特征,采用Protean、Primer 5.0、DNAMAN等软件分析各个蛋白的抗原决定簇序列,经过基因克隆和蛋白表达试验,获得相应的融合蛋白,经过镍离子亲和层析柱的纯化,透析和超滤富集,获得高浓度的融合蛋白。在融合蛋白诱导表达的过程中,由于使用大肠杆菌的原核表达系统,个别融合蛋白以包涵体的形式出现,需要用高浓度的尿素溶液溶解,在后续的纯化过程中,增加了融合蛋白变性的风险,尽管有些融合蛋白发生变性而沉淀,在后续的免疫过程中并不影响多克隆抗体的制备。但是,相关蛋白的细胞孵育试验的功能验证无法进行,因此需要优化纯化和透析的试验步骤或使用真核表达系统进行蛋白的表达,减小融合蛋白以包涵体形式出现的几率。
本研究中,黄河鲤白肌中Pax7、MyoD、MyoG和MRF4蛋白免疫荧光信号强度无显著差异,黄河鲤白肌中肌卫星细胞的维持、激活和复制过程与成肌细胞转化为肌细胞、单核成肌细胞融合为多核成肌细胞、成肌细胞分化融合为肌管过程同步进行,肌纤维正常形成,即白肌中肌纤维的增生与增粗同时存在。本试验所选用的4个蛋白因子是肌肉发育的不同阶段的关键标志性蛋白,具有不同的时空表达特性。在哺乳动物中,出生后的肌纤维数目几乎是固定的,生长主要依靠肌纤维的增粗[9],增生对其生长的作用极小,仅发现在肌肉损伤后的生长中有新的肌纤维产生[10],导致其存在有限的生长和固定的体型,属于限定增长。鱼类骨骼肌的生长调控是多样的,大多数鱼类骨骼肌的生长是非限定增长,出膜后的肌纤维数量不是固定的,在生命周期中涉及肌纤维的增生与增粗[11],2种肌纤维的生长模式共同作用促进骨骼肌的持续生长。Pax7作为肌卫星细胞的特异性标志[12-13],用来鉴定肌卫星细胞是否成功分离纯化。用cRNA探针进行原位杂交试验,证实了Pax7在单核肌卫星细胞中表达[14]。在胚后的生长发育中,肌卫星细胞的维持、激活、复制过程都呈现出Pax7的高表达[15]。Pax7的表达缺失时,机体会阻滞细胞周期和早熟分化,从而导致肌肉分化的缺陷[16-17]。MyoD可促使非成肌细胞向肌细胞转化,并进一步促进肌细胞融合、分化为成熟的肌纤维;当MyoD表达缺失时,肌细胞的增殖和分化将无法进行。MyoG可以终止肌细胞的增殖,同时促使单核成肌细胞向多核肌细胞融合;当MyoG表达缺失时,成肌细胞则停止分裂与增殖,致使肌肉发育受阻[18]。MRF4可诱导成肌细胞分化融合成为肌管,并促进肌纤维的形成,同时也可维持肌细胞的稳定[19],与MyoG共同控制肌肉的分化过程;当MRF4表达缺失时,小鼠的骨骼肌虽然形成,但却因为肋骨存在生长缺陷,在出生后即死亡[20]。
本试验成功制备了兔源性黄河鲤4个肌肉发育不同阶段的关键标志性蛋白(Pax7、MyoD、Myogenin和MRF4)的多克隆抗体,经ELISA检测,4种抗体的效价均达到2.4×106以上,这与本实验室制备的鲤的营养素转运载体和细胞因子的多克隆抗体的效价相似[8, 21-22],该结果初步表明所得的抗体可以满足后续的分析。以本研究制备的多克隆抗体为一抗,用组织免疫荧光的方法检测并验证其在黄河鲤白肌组织石蜡切片的应用效果及稳定性,结果表明4种抗体可以用于黄河鲤白肌组织的相应的蛋白定量表达检测,且特异性、稳定性和亲和性均较高。
4 结论综上所述,本试验制备的稳定性及特异性较高的黄河鲤肌肉发育关键因子的多克隆抗体可以满足鲤肌肉发育过程中相关蛋白表达的检测和验证,可为水产动物骨骼肌发育的调控机制研究提供有力的工具。
| [1] |
JOHNSTON I A, BOWER N I, MACQUEEN D J. Growth and the regulation of myotomal muscle mass in teleost fish[J]. Journal of Experimental Biology, 2011, 214(Pt 10): 1617-1628. |
| [2] |
RESCAN P Y. Development of myofibres and associated connective tissues in fish axial muscle: recent insights and future perspectives[J]. Differentiation, 2019, 106: 35-41. DOI:10.1016/j.diff.2019.02.007 |
| [3] |
JOHNSTON I A. Environment and plasticity of myogenesis in teleost fish[J]. The Journal of Experimental Biology, 2006, 209(Pt 12): 2249-2264. |
| [4] |
JOHNSTON I A, ALDERSON R, SANDHAM C, et al. Muscle fibre density in relation to the colour and texture of smoked Atlantic salmon (Salmo salar L.)[J]. Aquaculture, 2000, 189(3/4): 335-249. |
| [5] |
LIU Z J, WANG C, LIU X Q, et al. Shisa2 regulates the fusion of muscle progenitors[J]. Stem Cell Research, 2018, 31: 31-41. DOI:10.1016/j.scr.2018.07.004 |
| [6] |
RELAIX F, ROCANCOURT D, MANSOURI A, et al. A Pax3/Pax7-dependent population of skeletal muscle progenitor cells[J]. Nature, 2005, 435(7044): 948-953. DOI:10.1038/nature03594 |
| [7] |
RELAIX F, MONTARRAS D, ZAFFRAN S, et al. Pax3 and Pax7 have distinct and overlapping functions in adult muscle progenitor cells[J]. Journal of Cell Biology, 2006, 172(1): 91-102. DOI:10.1083/jcb.200508044 |
| [8] |
冯军厂, 常绪路, 朱振祥, 等. 鲤细胞因子多克隆抗体的制备及检测[J]. 水产学报, 2018, 42(10): 1615-1625. FENG J C, CHANG X L, ZHU Z X, et al. Preparation and detection of cytokines polyclonal antibodies of Cyprinus carpio[J]. Journal of Fisheries of China, 2018, 42(10): 1615-1625 (in Chinese). |
| [9] |
ROWE R W, GOLDSPINK G. Muscle fibre growth in five different muscles in both sexes of mice[J]. Journal of Anatomy, 1969, 104(Pt 3): 519-530. |
| [10] |
DHAWAN J, RANDO T A. Stem cells in postnatal myogenesis: molecular mechanisms of satellite cell quiescence, activation and replenishment[J]. Trends in Cell Biology, 2005, 15(12): 666-673. DOI:10.1016/j.tcb.2005.10.007 |
| [11] |
JOHNSTON I A. Muscle development and growth: potential implications for flesh quality in fish[J]. Aquaculture, 1999, 177(1/2/3/4): 99-115. |
| [12] |
赵新艳, 郭妍婷, 陈俊贞, 等. 牛骨骼肌卫星细胞的分离鉴定和诱导分化[J]. 中国畜牧兽医, 2020, 47(10): 3249-3258. ZHAO X Y, GUO Y T, CHEN J Z, et al. Isolation, identification and differentiation of bovine skeletal muscle satellite cells[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(10): 3249-3258 (in Chinese). |
| [13] |
刘志坚, 方翊, 王云龙, 等. 原代咬肌肌卫星细胞的提取及鉴定[J]. 口腔医学研究, 2014, 30(1): 30-33. LIU Z J, FANG X, WANG Y L, et al. Isolation and differentiation of primary muscle satellite cell from rat masseter[J]. Journal of Oral Science Research, 2014, 30(1): 30-33 (in Chinese). |
| [14] |
GOTENSPARRE S M, ANDERSSON E, WARGELIUS A, et al. Insight into the complex genetic network of tetraploid Atlantic salmon (Salmo salar L.): description of multiple novel Pax-7 splice variants[J]. Gene, 2006, 373: 8-15. DOI:10.1016/j.gene.2005.12.026 |
| [15] |
BENTZINGER C F, WANG Y X, RUDNICKI M A. Building muscle: molecular regulation of myogenesis[J]. Cold Spring Harbor Perspectives in Biology, 2012, 4(2): a008342. |
| [16] |
GVNTHER S, KIM J, KOSTIN S, et al. Myf5-positive satellite cells contribute to Pax7-dependent long-term maintenance of adult muscle stem cells[J]. Cell Stem Cell, 2013, 13(5): 590-601. DOI:10.1016/j.stem.2013.07.016 |
| [17] |
VON MALTZAHN J, JONES A E, PARKS R J, et al. Pax7 is critical for the normal function of satellite cells in adult skeletal muscle[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(41): 16474-16479. DOI:10.1073/pnas.1307680110 |
| [18] |
单立莉. Myostatin、MyoD、Myogenin基因对金华猪和长白猪肉质影响的比较研究[D]. 硕士学位论文. 延吉: 延边大学, 2009. SHAN L L. Study on expressions of Myostatin, MyoD, Myogenin gene in meat quality between Jinhua pig and Landrance[D]. Master's Thesis. Yanji: Yanbian University, 2009. (in Chinese) |
| [19] |
李虹辉, 许友卿, 刘小燕, 等. 鳜鱼生肌调节因子基因(MRF4)的克隆及其在成鱼和胚胎中的表达[J]. 湖南农业大学学报(自然科学版), 2013, 39(6): 631-635. LI H H, XU Y Q, LIU X Y, et al. Molecular cloning of myogenic regulatory factor 4(MRF4) gene and its expression in adult and embryonic mandarin fish (Siniperca chuatsi)[J]. Journal of Hunan Agricultural University (Natural Sciences), 2013, 39(6): 631-635 (in Chinese). |
| [20] |
李虹辉. 翘嘴鳜(Siniperca chuatsi)生肌调节因子MRF4和MYF5的克隆及其表达研究[D]. 硕士学位论文. 南宁: 广西大学, 2014. LI H H. Studies on the expression of MRF4 and MYF5 genes cloned from mandarin fish (Siniperca chuatsi)[D]. Master's Thesis. Nanning: Guangxi University, 2014. (in Chinese) |
| [21] |
闫潇, 杨丽萍, 郑文佳, 等. 鲤肠道小肽转运载体PepT1多克隆抗体的制备及其组织表达分析[J]. 中国水产科学, 2016, 23(3): 513-521. YAN X, YANG L P, ZHENG W J, et al. Preparation of the antibody and tissue distribution of the peptide transporter PepT1 in Cyprinus carpio L.[J]. Journal of Fishery Sciences of China, 2016, 23(3): 513-521 (in Chinese). |
| [22] |
聂国兴, 王贝, 闫潇, 等. 鲤肠道sglt1基因的表达与抗体制备[J]. 水产学报, 2012, 36(3): 329-335. NIE G X, WANG B, YAN X, et al. Expression of sglt1 gene in Cyprinus carpio and preparation of its polyclonal antibody[J]. Journal of Fisheries of China, 2012, 36(3): 329-335 (in Chinese). |




