2. 动物营养调控与健康安徽省重点实验室, 凤阳 233100
2. Anhui Province Key Laboratory of Animal Nutritional Regulation and Health, Fengyang 233100, China
硼是自然界中广泛存在的一种非金属元素,兼有金属元素性质,通常以硼酸或硼酸盐形态存在于土壤、水和岩石中。研究表明,硼是人和动物不可缺少的微量元素之一,可促进矿物质代谢、能量代谢、大脑功能和免疫反应,降低关节炎的风险,并参与降低某些癌症发生率[1-4]。硼摄入不足会导致骨骼发育、大脑反应和免疫功能受损[5]。在培养的动物细胞中,降低硼含量可诱导丝裂原活化蛋白激酶激活,敲除硼离子转运蛋白则导致细胞生长和增殖受到抑制[6]。研究发现,适量补充硼能够改善许多代谢酶活性,调节动物骨骼发育及矿物质和能量代谢,增强抗氧化功能和免疫功能,促进T淋巴细胞分化,降低血清甘油三酯含量[7-9]。添加低剂量(0.01~0.10 mmol/L)硼可促进细胞因子分泌,抑制鸵鸟脾脏淋巴细胞凋亡,而添加高剂量(25~100 mmol/L)硼则产生相反的作用[10]。经口灌胃100 mg/kg硼酸能够显著升高乙醇诱导的肝脏超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性减低,减少肝脏丙二醛(malondialdehyde,MDA)含量和半胱天冬蛋白酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)阳性细胞数量,从而减弱乙醇诱导的肝脏氧化损伤[11]。饮水补充100 mg/L硼对肉鸡免疫器官(脾脏和胸腺)发育和显微结构改善均可产生积极影响[12]。但是,高剂量硼对人和动物机体可产生不良影响,甚至具有一定毒性作用。有研究发现,饮水补充640 mg/L硼导致大鼠抗氧化能力明显下降,机体胆固醇、脂类、糖类及离子代谢发生紊乱[13]。
以上研究表明,不同剂量硼可对动物机体多种生理功能产生不同影响,但其作用机制尚不清楚。肝脏是动物机体最大的消化腺,在维持营养物质消化吸收和代谢、有毒物质降解及免疫调节等方面起着至关重要的作用,肝脏显微结构和生理功能改变可直接影响动物机体消化功能和免疫功能。然而,不同剂量硼对哺乳动物肝脏显微结构、抗氧化功能和细胞增殖和凋亡产生何种影响并不清楚。因此,本研究以大鼠为试验动物,研究不同剂量硼对肝脏显微结构、肝糖原含量、抗氧化功能及细胞增殖和凋亡相关基因表达的影响,为揭示硼影响动物生理功能的作用机制及其在人和动物生活生产中的应用提供科学依据。
1 材料与方法 1.1 试验材料与试验设计 1.1.1 试验材料SD大鼠购自南京市江宁区青龙山动物繁殖场,许可证号:SCXK(苏)2017-001。硼酸(H3BO3)购自国药集团化学试剂有限公司,批号:20120524,分析纯,纯度≥99.5%,硼含量≥17.4%。
1.1.2 试验设计选用清洁级刚断乳的(22±2)日龄健康雄性SD大鼠100只,适应性饲养7 d后,随机分为10组,每组10只。对照组饮用蒸馏水(硼含量为0),试验组(Ⅰ~Ⅸ组)分别饮用硼含量为5、10、20、40、80、160、320、480、640 mg/L的蒸馏水。试验期60 d。所有试验大鼠均饲喂普通大鼠基础饲粮,基础饲粮组成及营养水平见表 1。动物使用由安徽科技学院试验动物伦理委员会审查和批准,所有试验程序均严格按照安徽省《试验动物的护理和使用指南》进行。动物饲养在安徽科技学院试验动物房大鼠独立通气笼盒(individually ventilated cages,IVC)内,室温控制在22~25 ℃,相对湿度控制在50%~60%,给予14 h光照10 h黑暗光照周期,自由采食和饮水。动物饲养前所有笼子、盖子和水瓶均进行消毒处理。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验结束时,大鼠禁食不禁水过夜,称重,右心房采血并放血处死,迅速分离肝脏,一部分固定于4%多聚甲醛磷酸盐缓冲液(pH 7.4)中用于苏木精-伊红(hematoxylin-eosin,HE)染色,一部分固定于卡诺(Carnoy)固定液中用于肝糖原过碘酸希夫反应(periodic acid-Schiff,PAS)染色,另一部分经液氮冷冻后于-80 ℃保存用于抗氧化指标测定及总RNA提取。
1.3 测定指标与方法 1.3.1 肝脏组织学观察大鼠肝脏经4%多聚甲醛磷酸盐缓冲液充分固定后,经梯度乙醇脱水、二甲苯透明、石蜡包埋、石蜡轮转切片机切片(厚6 μm),每10张切片取1片用于HE染色,方法参照Jin等[14]。染色结果使用全自动数字切片扫描与应用系统[VM1,麦克奥迪(厦门)医疗诊断系统有限公司]进行观察并拍照。
1.3.2 PAS染色分析大鼠肝脏经卡诺固定液充分固定后,经梯度乙醇脱水、二甲苯透明、石蜡包埋、石蜡轮转切片机切片(厚6 μm),每10张切片取1片用于PAS染色。肝脏切片脱蜡至水,在1%过碘酸水溶液中氯化5 min,流水冲洗5 min,再用蒸馏水漂洗,加入Schiff试剂中反应15 min,亚硫酸钠溶液洗涤3次(每次2 min),流水冲洗10 min,苏木精对细胞核进行染色后进行脱水透明,中性树胶封片。使用全自动数字切片扫描与应用系统进行观察并拍照。每个肝脏组织取5张肝脏切片进行PAS染色,每张PAS染色切片按照上、下、左、右、中的顺序选取5个视野拍照,然后用Image Pro Plus 6.0测定PAS染色的积分光密度值(integral optical density value)。
1.3.3 抗氧化功能测定采用试剂盒测定肝脏组织匀浆中MDA含量和SOD、谷胱甘肽过氧化物酶(GSH-Px)活性以及总抗氧化能力(T-AOC),试剂盒购自南京建成生物工程研究所,具体操作步骤按照试剂盒说明书进行。
1.3.4 实时荧光定量PCR测定参考屈胜胜[15]报道方法进行大鼠肝脏组织总RNA提取。用NanoDrop One超微量核酸蛋白测定仪(Thermo公司,美国)检测提取的肝脏总RNA的浓度和质量,琼脂糖凝胶电泳检测总RNA完整性。然后按照反转录试剂盒(Thermo公司,美国)操作说明合成第1条cDNA链。实时荧光定量PCR测定方法参考Liu等[16]的报道,并按照实时荧光定量PCR试剂盒(TaKaRa公司,日本)操作说明进行核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)、依赖还原型辅酶Ⅰ(Ⅱ)醌氧化还原酶1[NAD(P)H: quinine oxidoreductase 1,NQO1]、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、Caspase-3、B细胞淋巴瘤/白血病-2相关X蛋白(B-cell lymphoma/leukaemia-2-associated X protein,Bax)和B细胞淋巴瘤/白血病-2(B-cell lymphoma/leukaemia-2,Bcl-2)mRNA相对表达量测定,每个样品测定3次,测定仪器为480Ⅱ实时荧光定量PCR仪(Roche公司,瑞士)。引物序列如表 2所示,以3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参基因,测定结果采用2-ΔΔCt法计算目的基因mRNA相对表达量。
|
|
表 2 引物序列 Table 2 Primer Sequences |
测定数据采用SPSS 26.0统计软件进行单因素方差分析(one-way ANOVA),不同试验组之间差异显著性采用Duncan氏法进行检验。数据以平均值±标准差(mean±SD)表示,P < 0.05为显著差异,P < 0.01为差异极显著。
2 结果 2.1 饮水补充不同剂量硼对大鼠肝脏显微结构的影响由图 1可知,对照组大鼠肝脏显微结构正常,肝小叶轮廓清晰,肝细胞索排列整齐,肝血窦宽窄适当,肝细胞结构清晰,肝枯否氏细胞数量适中(图 1-A)。与对照组相比,试验Ⅰ、Ⅱ和Ⅲ组大鼠肝脏显微结构明显改善,肝细胞索排列更加整齐,肝血窦变窄,肝细胞增大,双核肝细胞数量增多,枯否氏细胞数量有所增多,其中试验Ⅲ组肝脏中靠近中央静脉周围的肝细胞中出现少量的脂滴(图 1-B、图 1-C和图 1-D)。试验Ⅳ组大鼠肝细胞索排列稍显紊乱,肝血窦变窄,肝细胞核染色较深,肝枯否氏细胞增多,中央静脉周围的肝细胞中脂滴增多(图 1-E)。试验Ⅴ、Ⅵ和Ⅶ组大鼠肝脏显微结构有所损伤,肝小叶轮廓不清,肝细胞索排列紊乱,肝血窦增宽,双核肝细胞数量逐渐减少,肝细胞染色逐渐加深,肝枯否氏细胞逐渐增加,含有脂滴的肝细胞数量和分布明显增加(图 1-F、图 1-G和图 1-H)。试验Ⅷ和Ⅸ组大鼠肝脏明显受损,肝小叶轮廓模糊,肝细胞索排列非常紊乱,肝血窦显著增宽,肝细胞核出现固缩,部分肝细胞出现溶解,肝枯否氏细胞显著增加,并在局部出现聚集,肝细胞中脂滴数量显著增加,部分肝细胞中出现较大的空泡样结构(图 1-I和图 1-J)。
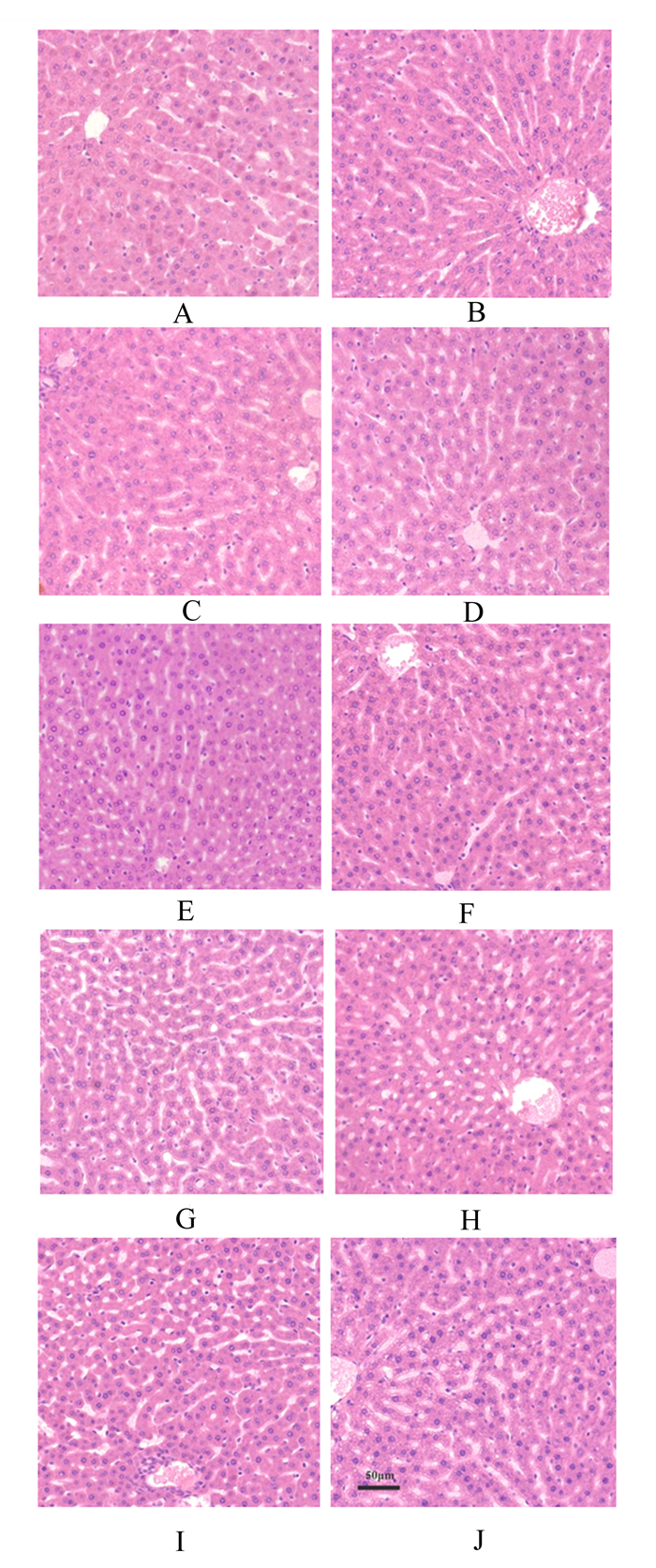
|
A:对照组;B:试验Ⅰ组;C:试验Ⅱ组;D:试验Ⅲ组;E:试验Ⅳ组;F:试验Ⅴ组;G:试验Ⅵ组;H:试验Ⅶ组;I:试验Ⅷ组;J:试验Ⅸ组。图 2同。 A: control group; B: experimental group Ⅰ; C: experimental group Ⅱ; D: experimental group Ⅲ; E: experimental group Ⅳ; F: experimental group Ⅴ; G: experimental group Ⅵ; H: experimental group Ⅶ; I: experimental group Ⅷ; J: experimental group Ⅸ. The same as Fig. 2. 图 1 饮水补充不同剂量硼对大鼠肝脏显微结构的影响 Fig. 1 Effects of drinking water supplemented with different doses of boron on liver microstructure of rats (200×) |
由图 2可知,大鼠肝脏中肝糖原PAS染色阳性细胞中可见粉红色或者淡红色颗粒,主要分布在中央静脉周围。对照组肝脏中可见少量的PAS染色阳性细胞,主要分布在中央静脉周围(图 2-A)。与对照组相比,试验Ⅰ组大鼠肝脏中PAS染色阳性细胞数量增多,分布增加,主要分布在中央静脉周围及部分肝小叶边缘(图 2-B)。试验Ⅱ组大鼠肝脏中PAS染色阳性细胞数量明显增多,PAS阳性反应增强,分布区域明显增大,中央静脉和肝肝小叶边缘均分布有较多的PAS染色阳性细胞(图 2-C)。试验Ⅲ和Ⅳ组大鼠肝脏PAS染色阳性细胞数量和分布无明显差异(图 2-D和2-E)。然而,试验Ⅴ、Ⅵ、Ⅶ、Ⅷ和Ⅸ组大鼠肝脏中PAS染色阳性细胞数量明显减少,阳性染色较淡,几乎看不见PAS染色阳性细胞(图 2-F、图 2-G、图 2-H、图 2-I和图 2-J)。

|
图 2 饮水补充不同剂量硼对大鼠肝脏PAS染色的影响 Fig. 2 Effects of drinking water supplemented with different doses of boron on liver PAS stain of rats (400×) |
由图 3可知,与对照组相比,试验Ⅰ和Ⅱ组大鼠肝脏中肝糖原含量分别极显著增加了20.21%和37.52%(P < 0.01),而试验Ⅴ、Ⅵ、Ⅶ、Ⅷ和Ⅸ组大鼠肝脏中肝糖原含量分别极显著降低了17.99%、22.53%、15.47%、55.42%和64.41%(P < 0.01),但试验Ⅲ和Ⅳ组大鼠肝脏中肝糖原含量无显著变化(P>0.05)。
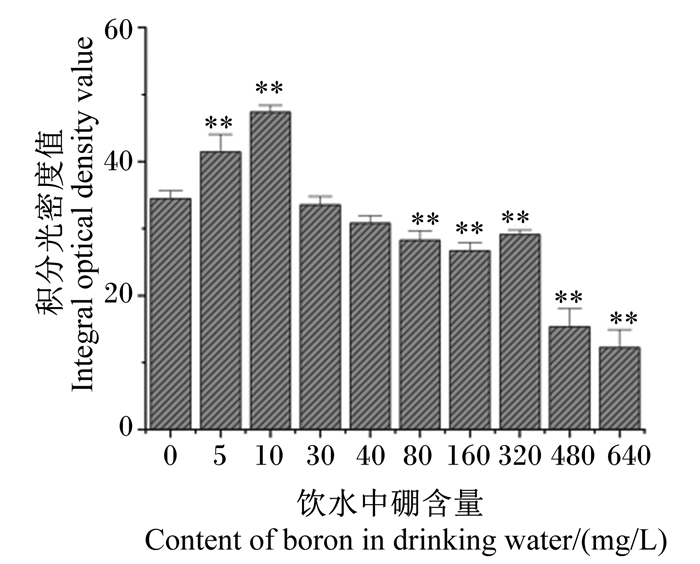
|
与对照组相比,数据柱标*表示差异显著(P < 0.05),数据柱标* *表示差异极显著(P < 0.01)。下图同。 Compared with the control group, value columns with * mean significant difference (P < 0.05), and with * * mean extremely significant difference (P < 0.01). The same as below. 图 3 饮水补充不同剂量硼对大鼠肝脏中肝糖原含量的影响 Fig. 3 Effects of drinking water supplemented with different doses of boron on liver hepatic glycogen content of rats |
由图 4可知,与对照组相比,试验Ⅰ和Ⅱ组大鼠肝脏SOD活性分别显著或极显著提高了48.20%和64.66%(P < 0.05或P < 0.01),其余各组大鼠肝脏SOD活性差异不显著(P>0.05);试验Ⅰ和Ⅱ组大鼠肝脏T-AOC分别显著提高了24.86%和28.03%(P < 0.05),试验Ⅷ和Ⅸ组大鼠肝脏T-AOC分别显著或极显著下降了27.14%和58.08%(P < 0.05或P < 0.01),试验Ⅲ、Ⅳ、Ⅴ、Ⅵ和Ⅶ组大鼠肝脏T-AOC差异不显著(P>0.05);试验Ⅰ组大鼠肝脏GSH-Px活性极显著提高了39.60%(P < 0.01),其余各组大鼠肝脏GSH-Px活性差异不显著(P>0.05);试验Ⅷ和Ⅸ组大鼠肝脏MDA含量显著或极显著提高了49.30%和73.06%(P < 0.05或P < 0.01),试验Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ和Ⅶ组大鼠肝脏MDA含量差异不显著(P>0.05)。
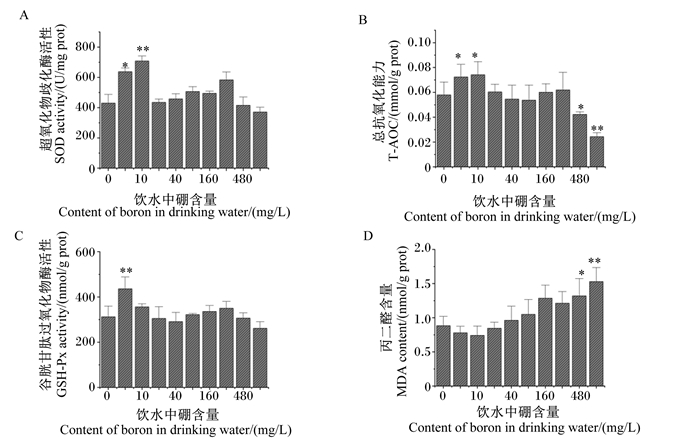
|
图 4 饮水补充不同剂量硼对大鼠肝脏抗氧化功能的影响 Fig. 4 Effects of drinking water supplemented with different doses of boron on liver antioxidant function of rats |
由图 5可知,与对照组相比,试验Ⅰ和Ⅱ组大鼠肝脏Nrf2 mRNA相对表达量分别显著提高了32.00%和26.67%(P < 0.05),而试验Ⅷ和Ⅸ组大鼠肝脏Nrf2 mRNA相对表达量分别显著或极显著降低了34.67%和50.67%(P < 0.05或P < 0.01),其余各组大鼠肝脏Nrf2 mRNA相对表达量差异不显著(P>0.05);试验Ⅰ组大鼠肝脏NQO1 mRNA相对表达量显著提高了26.87%(P < 0.05),而试验Ⅷ和Ⅸ组大鼠肝脏NQO1 mRNA相对表达量分别显著或极显著降低了38.81%和53.73%(P < 0.05或P < 0.01),其余各组大鼠肝脏NQO1 mRNA相对表达量差异不显著(P>0.05)。
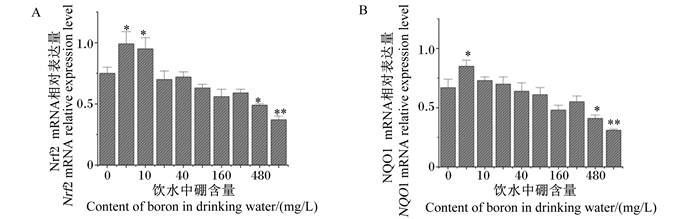
|
图 5 饮水补充不同剂量硼对大鼠肝脏Nrf2(A)和NQO1(B)mRNA相对表达量的影响 Fig. 5 Effects of drinking water supplemented with different doses of boron on mRNA relative expression levels of Nrf2 (A) and NQO1 (B) in liver of rats |
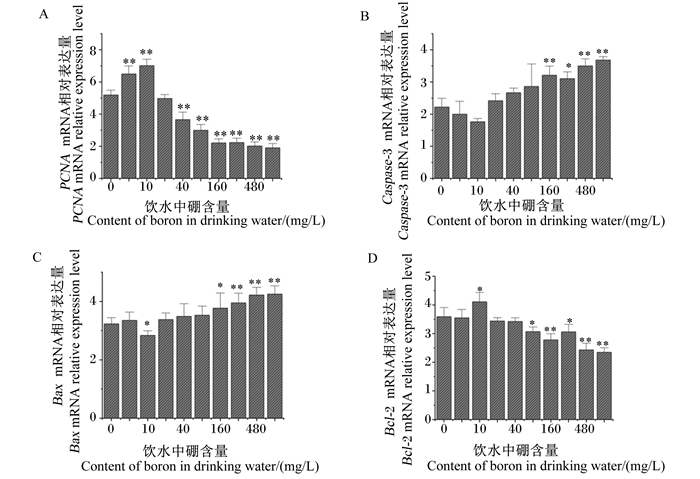
由图 6可知,与对照组相比,试验Ⅰ和Ⅱ组大鼠肝脏PCNA mRNA相对表达量分别极显著提高了25.16%和35.04%(P < 0.01),而试验Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ和Ⅸ组大鼠肝脏PCNA mRNA相对表达量分别极显著降低了29.52%、42.23%、57.45%、57.00%、61.17%和63.29%(P < 0.01),试验Ⅲ组大鼠肝脏PCNA mRNA相对表达量差异不显著(P>0.05);试验Ⅵ、Ⅶ、Ⅷ和Ⅸ组大鼠肝脏Caspase-3 mRNA相对表达量分别显著或极显著提高了44.51%、39.86%、57.57%和65.82%(P < 0.05或P < 0.01),试验Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ组大鼠肝脏Caspase-3 mRNA相对表达量差异不显著(P>0.05);试验Ⅱ组大鼠肝脏Bax mRNA相对表达量显著降低了12.07%(P < 0.05),而试验Ⅵ、Ⅶ、Ⅷ和Ⅸ组大鼠肝脏Bax mRNA相对表达量分别显著或极显著提高了16.72%、22.29%、30.65%和31.58%(P < 0.05或P < 0.01),其余各组大鼠肝脏Bax mRNA相对表达量差异不显著(P>0.05);试验Ⅱ组大鼠肝脏Bcl-2 mRNA相对表达量显著提高了14.48%(P < 0.05),而试验Ⅴ、Ⅵ、Ⅶ、Ⅷ和Ⅸ组大鼠肝脏Bcl-2 mRNA相对表达量分别显著或极显著降低了14.47%、22.56%、14.76%、32.31%和34.54%(P < 0.05或P < 0.01),其余各组大鼠肝脏Bcl-2 mRNA相对表达量差异不显著(P>0.05)。
|
图 6 饮水补充不同剂量硼对大鼠肝脏PCNA(A)、Caspase-3(B)、Bax(C)和Bcl-2(D)mRNA相对表达量的影响 Fig. 6 Effects of drinking water supplemented with different doses of boron on mRNA relative expression levels of PCNA (A), Caspase-3 (B), Bax (C) and Bcl-2 (D) in liver of rats |
肝脏作为动物机体重要的消化器官,具有消化营养物质的功能,还负责营养物质的代谢和利用以及合成机体必需的大分子物质。更重要的是,肝脏还具有解毒、参与免疫及造血作用,是动物机体非常重要的多功能器官之一。肝脏多种功能的发挥与其组织结构密切相关,肝脏组织结构是肝脏功能正常发挥的基础,肝脏显微结构的改变直接影响肝脏的功能状况。研究发现,补充不同剂量硼能够对动物许多器官的显微结构产生影响[17-18]。王为等[19]对非洲鸵鸟研究发现,饮水补充80 mg/L硼有利于肝脏发育,可改善肝脏组织结构,使肝血窦内枯否氏细胞增多,肝血窦增大,而饮水补充320和640 mg/L硼则对非洲雏鸵鸟肝脏发育产生损伤影响,导致肝脏组织出现明显病理学变化,肝板排列混乱,细胞与细胞间分界模糊,细胞核出现碎裂或固缩,肝血窦狭小。诸亚平等[20]研究发现,饮水补充100 mg/L硼对固始鸡发育后期(3~6周龄)肝脏组织结构有明显改善和促进作用,而饮水补充大于200 mg/L硼则对固始鸡肝脏组织结构发育有明显不良影响。本研究也发现,饮水补充5~20 mg/L硼可明显改善大鼠肝脏显微结构,肝小叶轮廓更加清晰,肝细胞索排列更加整齐,肝血窦变窄,双核肝细胞数量增多,肝枯否氏细胞数量增加,表明饮水补充适量硼对哺乳动物肝脏显微结构可产生明显改善作用,进而促进肝脏发育,增强肝脏功能。然而,饮水补充480和640 mg/L硼则导致大鼠肝脏显微结构受损,出现明显的脂肪沉淀、炎性细胞浸润以及肝细胞溶解,进而损伤肝细胞功能。其原因可能是适量的补充硼可以促进肠道组织结构的发育,从而增强胃肠吸收营养物质的能力,为肝细胞生长提供充足的营养需要。然而,补充高剂量的硼则损害肠道显微结构,严重影响肠道消化吸收功能[18],进而影响大鼠肝脏的发育。
糖原是动物机体重要的能量来源,主要分为肝糖原和肌糖原,动物消化器官吸收的糖类营养物质被利用后,多余的分别被肝细胞和肌细胞合成为肝糖原和肌糖原。肝脏是肝糖原的主要储藏库,用于维持动物机体的血糖水平。肝糖原含量的变化可以直接反映肝脏功能,肝糖原含量降低则可能导致动物机体出现低血糖症状[21]。研究表明,补充不同剂量硼可对动物肝糖原含量产生明显影响。哈西卜哈利克[22]研究发现,饮水补充80 mg/L硼能够显著增加非洲鸵鸟肝脏中肝糖原含量,而饮水补充640 mg/L硼则显著降低肝糖原含量。有研究报道,补充20和40 mg/L硼可使肥胖大鼠肝细胞内肝糖原含量明显增多,而补充80 mg/L硼导致肥胖大鼠肝脏PAS染色阳性细胞数量明显减少[23]。本研究发现,饮水补充5和10 mg/L硼可显著增加PAS染色阳性细胞的数量和分布,增强PAS染色,而饮水补充480和640 mg/L硼则导致PAS染色阳性细胞数量显著减少。这表明适量补充硼能够适当促进肝糖原合成储存,而补充高剂量硼则导致肝糖原含量显著减少,分析原因可能包括以下2方面:一方面,高剂量硼导致大鼠肝脏内硼含量增多,造成肝细胞出现硼中毒,进而引起肝细胞结构受损,肝糖原合成储存功能受到抑制;另一方面,高剂量硼引起动物机体发生应激反应,加快了机体对肝脏中肝糖原的利用,进而导致肝糖原含量减少[22]。另外,Javed等[24]研究发现,金属中毒后导致动物糖原储备减少,而硼兼具有金属性质,很可能过多的硼在动物肝脏内积累会产生同样效果。
3.2 饮水补充不同剂量硼对大鼠肝脏抗氧化功能的影响氧自由基是动物机体有氧呼吸过程中产生的物质,当机体处于正常状态时,氧自由基产生与消除呈现一种动态平衡,而当机体健康状况出现异常时,这种平衡被打破,大量氧自由基产生不能被消除,进而损害细胞结构。动物机体清除氧自由基主要由抗氧化系统来完成。机体抗氧化系统主要由抗氧化酶系统和非酶系统组成[25]。其中,SOD和GSH-Px是动物体内2种重要的抗氧化酶[26],SOD和GSH-Px活性高低可以间接反映机体清除自由基能力[27]。T-AOC是反映器官组织整个抗氧化能力的一个重要指标[28],而MDA含量是机体氧化反应中主要代谢产物,对细胞膜可产生损伤作用,其含量间接反映器官组织氧化程度[29]。此外,Nrf2在机体清除氧自由基的复杂系统中起着重要作用,其可通过调控部分抗氧化酶基因表达而发挥抗氧化作用。NQO1是Nrf2基因调控的下游基因之一,NQO1通过维持泛醌和α-生育酚醌的还原形式,在保护内源性抗氧化剂中起关键作用[30]。有研究发现,饮水补充40 mg/L硼可提高脾脏抗氧化能力,改善脾脏组织结构;而饮水补充大于80 mg/L硼可降低脾脏抗氧化能力,破坏脾脏组织结构[17]。也有研究显示,饮水补充10和20 mg/L硼可增加大鼠胸腺GSH-Px活性,显著提高胸腺SOD活性和T-AOC,降低胸腺MDA含量,而饮水补充480和640 mg/L硼则对大鼠胸腺中这4个指标产生了相反影响[31]。Yamada等[32]研究发现,10 μmol/L硼酸处理可以激活DU-145前列腺癌细胞Nrf2基因并增加NQO1基因的表达。本研究发现,与对照组相比,饮水补充5 mg/L硼可增加大鼠肝脏SOD、GSH-Px活性和T-AOC,提高Nrf2和NQO1 mRNA相对表达量;饮水补充10 mg/L硼也能增加大鼠肝脏SOD活性和T-AOC,提高Nrf2 mRNA相对表达量。这表明饮水中添加5和10 mg/L硼可提升大鼠肝脏抗氧化酶活性,提高大鼠肝脏抗氧化功能。然而,饮水补充480和640 mg/L硼则降低大鼠肝脏SOD、GSH-Px活性和T-AOC,并降低Nrf2和NQO1 mRNA相对表达量,从而降低机体清除自由基的能力,使MDA含量增加。分析硼影响抗氧化功能的原因可能是:硼可以通过硼酸核受体介导,刺激转录因子激活,调节活性氧清除相关基因的表达,进而发挥抗氧化作用[33];也可能是硼对机体氧化应激的抑制作用和对酶活性的抑制作用[34]。硼的抗氧化作用与微量元素硒的抗氧化功能有所不同,硒的抗氧化功能主要体现在硒以硒半胱氨酸和硒蛋氨酸2种形式存在于硒蛋白中,而硒蛋白参与动物机体抗氧化体系的组成,调节动物机体的自由基代谢和抗氧化酶活性,进而影响机体抗氧化功能[35]。另外,饮水补充40~320 mg/L硼引起大鼠肝脏SOD和GSH-Px活性增加,这提示机体可能通过代偿机制增强肝脏SOD和GSH-Px活性以清除多余的自由基。
3.3 饮水补充不同剂量硼对大鼠肝脏细胞增殖和凋亡相关基因表达的影响细胞增殖和凋亡是细胞正常生长过程中2个重要的细胞内事件,细胞通过增殖和凋亡的动态平衡实现细胞功能的正常发挥。PCNA是细胞DNA聚合酶δ的辅助蛋白,其表达变化与细胞增殖状态密切相关,可作为评价细胞增殖状态的关键指标之一[36]。在细胞凋亡过程中,调控细胞凋亡的相关基因通过接受细胞凋亡信号,表达和合成细胞凋亡相关的各种酶,诱导产生联级反应进而完成凋亡事件。Caspase-3是执行细胞凋亡最后程序的关键酶,其基因表达变化可以在一定程度上反映细胞凋亡状态[37],Bcl-2蛋白家族是一类在细胞凋亡中起重要作用的蛋白,它们主要参与线粒体介导的内源性凋亡途径,其成员Bax与Bcl-2这一对相互拮抗的基因共同调控细胞凋亡事件,它们的表达变化可以反映细胞的凋亡状态[38]。有研究报道,在培养液中加入0.4 mmol/L的硼可以促进脾淋巴细胞的增殖和Bcl-2 mRNA表达,而加入40 mmol/L的硼则可以促进脾淋巴细胞的凋亡和Bax mRNA表达[39]。另外,也有研究发现,饮水补充80 mg/L硼可使非洲鸵鸟肠细胞凋亡显著减少,而饮水补充320和640 mg/L硼可使非洲鸵鸟肠细胞凋亡显著增加[40]。本研究也发现,饮水补充5和10 mg/L硼可增加大鼠肝脏PCNA和Bcl-2 mRNA相对表达量,降低Caspase-3和Bax mRNA相对表达量;而饮水补充480和640 mg/L硼则降低大鼠肝脏PCNA和Bcl-2 mRNA相对表达量,增加Caspase-3和Bax mRNA相对表达量。这可能是由于适量补充硼可能通过减少含重复凋亡结构杆状病毒抑制剂(BIRC)2/3表达,进而促进受体相互作用蛋白1(RIP1)泛素化,减少琥珀酸脱氢酶形成,从而抑制细胞死亡,而高浓度硼产生了相反作用[10]。另外,本研究发现,饮水补充5和10 mg/L硼就能够明显促进大鼠肝脏PCNA mRNA表达,抑制Caspase-3 mRNA表达,其主要原因可能是不同器官对硼的敏感程度不一致,肝脏对硼生物学作用更加敏感。
4 结论饮水补充5和10 mg/L硼可改善大鼠肝脏显微结构,增加肝糖原含量,提高肝脏SOD、GSH-Px活性和T-AOC,降低肝脏MDA含量,促进肝脏Nrf2和PCNA mRNA表达;而饮水补充480和640 mg/L硼则产生相反作用。
| [1] |
HASEEB K, WANG J, XIAO K, et al. Effects of boron supplementation on expression of Hsp70 in the spleen of African ostrich[J]. Biological Trace Element Research, 2018, 182(2): 317-327. DOI:10.1007/s12011-017-1087-y |
| [2] |
HUNT C D. Dietary boron: progress in establishing essential roles in human physiology[J]. Journal of Trace Elements in Medicine and Biology, 2012, 26(2/3): 157-160. |
| [3] |
NIELSEN F H. Update on human health effects of boron[J]. Journal of Trace Elements in Medicine and Biology, 2014, 28(4): 383-387. DOI:10.1016/j.jtemb.2014.06.023 |
| [4] |
NIELSEN F H, MEACHAM S L. Growing evidence for human health benefits of boron[J]. Journal of Evidence-Based Complementary and Alternative Medicine, 2011, 16(3): 169-180. DOI:10.1177/2156587211407638 |
| [5] |
NIELSEN F H. Is boron nutritionally relevant?[J]. Nutrition Reviews, 2008, 66(4): 183-191. DOI:10.1111/j.1753-4887.2008.00023.x |
| [6] |
ABDELNOUR S A, ABD EL-HACK M E, SWELUM A A, et al. The vital roles of boron in animal health and production: a comprehensive review[J]. Journal of Trace Elements in Medicine and Biology, 2018, 50: 296-304. DOI:10.1016/j.jtemb.2018.07.018 |
| [7] |
ORENAY BOYACIOGLU S, KORKMAZ M, KAHRAMAN E, et al. Biological effects of tolerable level chronic boron intake on transcription factors[J]. Journal of Trace Elements in Medicine and Biology, 2017, 39: 30-35. DOI:10.1016/j.jtemb.2016.06.009 |
| [8] |
HUANG H B, XIAO K, LU S, et al. Increased thymic cell turnover under boron stress may bypass TLR3/4 pathway in African ostrich[J]. PLoS One, 2015, 10(6): e0129596. DOI:10.1371/journal.pone.0129596 |
| [9] |
KHALIQ H, ZHONG J M, PENG K M. The physiological role of boron on health[J]. Biological Trace Element Research, 2018, 186(1): 31-51. DOI:10.1007/s12011-018-1284-3 |
| [10] |
ZHANG X T, XIAO K, QIU W W, et al. The immune regulatory effect of boron on ostrich chick splenic lymphocytes[J]. Biological Trace Element Research, 2021, 199(7): 2695-2706. DOI:10.1007/s12011-020-02392-5 |
| [11] |
SOGUT I, PALTUN S O, TUNCDEMIR M, et al. The antioxidant and antiapoptotic effect of boric acid on hepatoxicity in chronic alcohol-fed rats[J]. Canadian Journal of Physiology and Pharmacology, 2018, 96(4): 404-411. DOI:10.1139/cjpp-2017-0487 |
| [12] |
JIN E H, GU Y F, WANG J, et al. Effect of supplementation of drinking water with different levels of boron on performance and immune organ parameters of broilers[J]. Italian Journal of Animal Science, 2014, 13(2): 3152. DOI:10.4081/ijas.2014.3152 |
| [13] |
李升和, 李文超, 靳二辉, 等. 饮水硼对大鼠生长及血清生化指标与抗氧化能力的影响[J]. 中国兽医学报, 2013, 33(3): 486-492. LI S H, LI W C, JIN E H, et al. Effects of drinking boron on the growth and the biochemical indexes and antioxidant ability in serum of rats[J]. Chinese Journal of Veterinary Science, 2013, 33(3): 486-492 (in Chinese). |
| [14] |
JIN E H, LI S H, REN M, et al. Boron affects immune function through modulation of splenic T lymphocyte subsets, cytokine secretion, and lymphocyte proliferation and apoptosis in rats[J]. Biological Trace Element Research, 2017, 178(2): 261-275. DOI:10.1007/s12011-017-0932-3 |
| [15] |
屈胜胜. 巴西莓对酒精性肝损伤的保护作用及机制研究[D]. 硕士学位论文. 北京: 北京中医药大学, 2014. QU S S. Study on the protective effect and mechanism of Brazilian berry on alcoholic liver injury[D]. Master's Thesis. Beijing: Beijing University of Chinese Medicine, 2014. (in Chinese) |
| [16] |
LIU T, WANG C F, WU X S, et al. Effect of boron on microstructure, immune function, expression of tight junction protein, cell proliferation and apoptosis of duodenum in rats[J]. Biological Trace Element Research, 2021, 199(1): 205-215. DOI:10.1007/s12011-020-02123-w |
| [17] |
HU Q Q, LI S H, QIAO E M, et al. Effects of boron on structure and antioxidative activities of spleen in rats[J]. Biological Trace Element Research, 2014, 158(1): 73-80. DOI:10.1007/s12011-014-9899-5 |
| [18] |
唐娟, 肖珂, 郑昕婷, 等. 硼酸对非洲雏鸵鸟肺组织形态学的影响[J]. 畜牧兽医学报, 2015, 46(12): 2291-2298. TANG J, XIAO K, ZHENG X T, et al. Effect of boric acid on the morphology of African ostrich chicks lung[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(12): 2291-2298 (in Chinese). DOI:10.11843/j.issn.0366-6964.2015.12.022 |
| [19] |
王为, 彭克美, 肖珂, 等. 饮水硼对非洲雏鸵鸟肝脏组织的影响[J]. 中国畜牧兽医, 2014, 41(9): 136-139. WANG W, PENG K M, XIAO K, et al. Effect of drinking boron on liver tissue of Africa ostrich chicks[J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(9): 136-139 (in Chinese). |
| [20] |
诸亚平, 李升和, 顾有方. 微量元素硼对固始鸡肝组织结构的影响[J]. 饲料研究, 2012(5): 39-41. ZHU Y P, LI S H, GU Y F. Effect of trace element boron on liver structure of Gushi chicken[J]. Feed Research, 2012(5): 39-41 (in Chinese). DOI:10.3969/j.issn.1002-2813.2012.05.013 |
| [21] |
PRIYA B P, MARUTHI Y A. Imidacloprid toxicity on biochemical constituents in liver tissue of fresh water teleost Channa punctatus[J]. International Journal of Pharma and Bio Sciences, 2013, 4(4): B50-B54. |
| [22] |
哈西卜哈利克. 补充硼对非洲鸵鸟鸡脾、肾、肝发育的影响[D]. 博士学位论文. 武汉: 华中农业大学, 2018. KHALIQ H. Effects of supplemented boron on the development of spleen, kidney, and liver in the African ostrich chicks[D]. Ph. D. Thesis. Wuhan: Huazhong Agricultural University, 2018. (in Chinese) |
| [23] |
靳二辉, 胡倩倩, 任曼, 等. 补充硼对雄性肥胖大鼠肝脏、睾丸和附睾的影响[J]. 营养学报, 2016, 38(5): 466-472. JIN E H, HU Q Q, REN M, et al. Effects of boron on liver testis and epididymis in male obese rats[J]. Acta Nutrimenta Sinica, 2016, 38(5): 466-472 (in Chinese). |
| [24] |
JAVED M, USMANI N. Impact of heavy metal toxicity on hematology and glycogen status of fish: a review[J]. Proceedings of the National Academy of Sciences, India Section B: Biological Sciences, 2015, 85(4): 889-900. |
| [25] |
孙全贵, 龙子, 张晓迪, 等. 抗氧化系统研究新进展[J]. 现代生物医学进展, 2016, 16(11): 2197-2200, 2190. SUN Q G, LONG Z, ZHANG X D, et al. Novel progress in antioxidant system[J]. Progress in Modern Biomedicine, 2016, 16(11): 2197-2200, 2190 (in Chinese). |
| [26] |
SINHA K, DAS J, PAL P B, et al. Oxidative stress: the mitochondria-dependent and mitochondria-independent pathways of apoptosis[J]. Archives of Toxicology, 2013, 87(7): 1157-1180. |
| [27] |
NALKIRAN I, TURAN S, ARIKAN S, et al. Determination of gene expression and serum levels of MnSOD and GPX1 in colorectal cancer[J]. Anticancer Research, 2015, 35(1): 255-259. |
| [28] |
郭永清, 赵宇飞, 任宏, 等. 硒代蛋氨酸对断奶仔猪生长性能、抗氧化及免疫性能的影响[J]. 中国饲料, 2019(4): 50-54. GUO Y Q, ZHAO Y F, REN H, et al. Growth performance, antioxidation and immunity of weaning pigs fed with diets supplementation selenomethionine[J]. China Feed, 2019(4): 50-54 (in Chinese). |
| [29] |
王铕, 陈浩, 万蒙, 等. 包被纳米氧化锌对断奶仔猪生长性能、抗氧化酶活性及血清生化和免疫指标的影响[J]. 中国畜牧杂志, 2020, 56(2): 117-121, 126. WANG Y, CHEN H, WAN M, et al. Effects of coated nano-zinc oxide on growth performance, activity of antioxidation enzyme and serum biochemical, immune index of weaned piglets[J]. Chinese Journal of Animal Science, 2020, 56(2): 117-121, 126 (in Chinese). |
| [30] |
李慧, 杨林. Nrf2抗氧化的分子调控机制[J]. 生物信息学, 2018, 16(1): 1-6. LI H, YANG L. Molecular regulatory mechanism of Nrf2 antioxidant[J]. China Journal of Bioinformatics, 2018, 16(1): 1-6 (in Chinese). |
| [31] |
JIN E H, REN M, LIU W W, et al. Effect of boron on thymic cytokine expression, hormone secretion, antioxidant functions, cell proliferation, and apoptosis potential via the extracellular signal-regulated kinases 1 and 2 signaling pathway[J]. Journal of Agricultural and Food Chemistry, 2017, 65(51): 11280-11291. DOI:10.1021/acs.jafc.7b04069 |
| [32] |
YAMADA K E, ECKHERT C D. Boric acid activation of eIF2α and Nrf2 is PERK dependent: a mechanism that explains how boron prevents DNA damage and enhances antioxidant status[J]. Biological Trace Element Research, 2019, 188(1): 2-10. DOI:10.1007/s12011-018-1498-4 |
| [33] |
TURKEZ H, GEYIKOGLU F. Boric acid: a potential chemoprotective agent against aflatoxin B1 toxicity in human blood[J]. Cytotechnology, 2010, 62(2): 157-165. DOI:10.1007/s10616-010-9272-2 |
| [34] |
ARSLAN-ACAROZ D, BAYŞU-SOZBILIR N. Ameliorative effect of boric acid against formaldehyde-induced oxidative stress in A549 cell lines[J]. Environmental Science and Pollution Research, 2020, 27(4): 4067-4074. DOI:10.1007/s11356-019-06986-y |
| [35] |
AVERY J C, HOFFMANN P R. Selenium, selenoproteins, and immunity[J]. Nutrients, 2018, 10(9): 1203. |
| [36] |
DENG Y Y, HU Z X, CHAI Z Y, et al. Cloning and comparative studies of proliferating cell nuclear antigen (PCNA) genes for nine dinoflagellates[J]. Journal of Applied Phycology, 2019, 31(5): 2969-2979. |
| [37] |
STURZU A, SHEIKH S, ECHNER H, et al. Chemosensitization of prostate carcinoma cells with a receptor-directed Smac conjugate[J]. Medicinal Chemistry, 2016, 12(5): 412-418. |
| [38] |
WANG C F, JIN E H, DENG J, et al. GPR30 mediated effects of boron on rat spleen lymphocyte proliferation, apoptosis, and immune function[J]. Food and Chemical Toxicology, 2020, 146: 111838. |
| [39] |
JIN E H, PEI Y Q, LIU T, et al. Effects of boron on the proliferation, apoptosis and immune function of splenic lymphocytes through ERα and ERβ[J]. Food and Agricultural Immunology, 2019, 30(1): 743-761. |
| [40] |
SUN P P, LUO Y, WU X T, et al. Effects of supplemental boron on intestinal proliferation and apoptosis in African ostrich chicks[J]. International Journal of Morphology, 2016, 34(3): 830-835. |




