2. 岭南现代农业科学与技术广东省实验室茂名分中心, 茂名 525000
2. Maoming Branch, Guangdong Laboratory for Lingnan Modern Agriculture, Maoming 525000, China
2020年中国柑橘产量为5 121.90万t[1],其中50%~60%作为新鲜水果消费,40%~50%用于加工[2]。柑橘渣是柑橘产业的副产品,约占加工产品的65%[3],年产量为1 331万~1 664万t。目前,柑橘渣是一种未被充分利用的资源,产量较大的柑橘渣对环境造成了较大的压力。在动物养殖中利用柑橘渣资源,可增加饲料原料来源、降低饲养成本以及食品生产对环境的影响,对我国饲料行业和畜牧业的可持续发展具有重要意义。
柑橘渣含有丰富的纤维、果胶、多酚、黄酮、类胡萝卜素等活性化合物,对动物健康具有很高的价值[4]。柑橘渣还含有动物生长所需的碳水化合物、蛋白质和脂肪等。研究显示,青贮柑橘果肉不影响奶牛乳脂、乳蛋白、乳糖产量[5]。肉牛对柑橘渣的干物质、有机物、中性洗涤纤维(NDF)消化率较高[6],饲喂含柑橘渣饲粮的牛肉中总共轭亚油酸、n-3和n-6多不饱和脂肪酸的比例更高[7]。青贮柑橘渣不会影响山羊、猪的采食量和体重[8-9],但能提高猪肉品质[9]。上述研究结果表明柑橘渣是一种有价值的饲料原料。
固态发酵技术在提高产量、降低能耗和减少排放方面非常有效。固态发酵处理农业、加工业废弃物可生产具有额外营养或促进健康的成分,微生物发酵能促进功能成分从基质中释放,或将废弃物中的化合物进行生物转化[10]。青贮柑橘渣的粗蛋白质(CP)和粗脂肪(EE)含量随青贮时间的增加而提高,柠檬苦素含量逐渐下降[11]。真菌发酵柑橘渣提高了CP含量[12-13]。芽孢杆菌、酵母、黑曲霉(Aspergillus niger)可以在木质素和糖类化合物上进行有氧生长。微生物有氧发酵的代谢比厌氧发酵更活跃。酵母、芽孢杆菌、黑曲霉是安全的微生物,能够产生丰富的酶,有助于大分子底物的降解、成分转化以及新化合物的合成,从而改善发酵后底物的营养和功能特性[14]。但是以往的研究均是通过青贮/厌氧发酵实现柑橘渣的保存,且对发酵柑橘渣的研究较少。因此,本研究拟采用不同菌种对柑橘渣进行有氧发酵,检测发酵产物的有机酸、总黄酮、营养成分含量,探讨有氧发酵是否能提高柑橘渣的营养价值,以期为柑橘渣的应用提供科学依据。
1 材料与方法 1.1 试验材料柑橘渣购自重庆某食品有限公司,米糠为市售。
地衣芽孢杆菌(Bacillus licheniformis)、葡萄牙棒孢酵母(Clavispora lusitaniae)、黑曲霉由广东省农业科学院动物科学研究所保存。
1.2 试验方法 1.2.1 种子液的制备取0.1 mL地衣芽孢杆菌保存液于100 mL灭菌营养肉汤培养基中,37 ℃培养24 h。取0.1 mL葡萄牙棒孢酵母保存液于100 mL灭菌马铃薯葡萄糖培养基中,28 ℃培养24 h。用灭菌水调整上述菌液浓度为1.0×105 CFU/mL,备用。将0.2 mL 1×108~2×108个/mL黑曲霉孢子液涂布到马铃薯葡萄糖琼脂培养基的表面,28 ℃培养5~7 d。用无菌水获得黑曲霉孢子悬浮液(浓度为1×107个/mL)。
1.2.2 发酵基质制备及发酵方案将柑橘渣与米糠按8 ∶ 2(质量比)混合均匀(自然状态),含水量60%,每菌接种量为2%,按照表 1的菌种组合添加菌种并搅拌均匀,自然pH,每个发酵瓶200 g发酵基质,松散储存,采用透气膜封口进行有氧发酵,室温(28~30 ℃)发酵7 d。
|
|
表 1 菌种组合及接种活菌数 Table 1 Strain combinations and number of inoculated viable bacteria |
将1 g新鲜样品与9 mL超纯水混匀,4 ℃静置过夜,采用便携式pH计(Testo 205)测定pH。
1.3.2 有机酸含量的测定根据《GB 5009.157—2016食品有机酸的测定》测定乳酸、苹果酸、柠檬酸含量。根据文献[15]测定乙酸、丙酸、丁酸含量。
1.3.3 常规营养成分含量的测定CP含量采用凯氏定氮法通过全自动凯氏定氮仪(FOSS 8400)测定,EE含量采用索氏提取法通过全自动脂肪仪(FOSS)测定,粗纤维(CF)、NDF、酸性洗涤纤维(ADF)含量采用Van Soest等[16]方法通过纤维仪(Ankom 220)测定,粗灰分含量采用550 ℃灼烧法测定,钙、磷含量分别采用乙二胺四乙酸滴定法和钼酸铵分光光度法测定,碳水化合物为计算值,计算公式为:
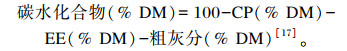
|
根据Wang等[18]的方法测定总黄酮含量。
1.3.5 水解氨基酸含量的测定水解氨基酸含量的测定采用酸水解法,即0.2 g样品加入10 mL 6 mol/L盐酸,110 ℃水解24 h,经定容过滤后,用氨基酸分析仪(Hitachi L8900)测定。参考FAO/WHO模式与鸡蛋蛋白,计算必需氨基酸组成[19]。
1.4 数据处理用SPSS 19.0软件进行单因素方差分析(one- way ANOVA),并用Duncan氏法进行多重比较。结果表示为平均值和均值标准误(SEM),P < 0.05为差异显著。
2 结果 2.1 不同菌种有氧发酵对柑橘渣pH和有机酸含量的影响各发酵柑橘渣均具有浓郁陈皮味,T3、T5、T6、T7组酸香味较浓。由表 2可知,各发酵柑橘渣的pH均在4.20以下,显著低于CON组(P < 0.05)。T3、T5、T6、T7组的柠檬酸、乳酸、总有机酸含量显著高于CON、T1、T2、T4组(P < 0.05)。T7组的柠檬酸含量显著高于T3、T5、T6组(P < 0.05)。T5组的乳酸含量显著高于T3、T6、T7组(P < 0.05)。与柠檬酸和乳酸含量相反,T3、T5、T6、T7组的苹果酸含量显著低于CON、T1、T2、T4组(P < 0.05),以T7组的苹果酸含量最低。T2和T4组的乙酸含量显著高于其他组(P < 0.05)。T3和T7组的丙酸含量显著高于CON、T1、T2、T4、T5组(P < 0.05)。CON、T1、T2组未检出丁酸。
|
|
表 2 不同菌种有氧发酵对柑橘渣pH和有机酸含量的影响 Table 2 Effects of aerobic fermentation with different strains on pH and organic acid contents of citrus pomace |
由表 3可知,与CON组相比,各发酵组的CP和总黄酮含量均显著增加(P < 0.05),分别提高了9.81%~28.89%和180.00%~303.33%。此外,T3、T5、T6、T7组的CP和总黄酮含量显著高于T1、T2、T4组(P < 0.05),以T7组的总黄酮含量最高。与CON组相比,T2、T3、T5、T6、T7组的EE含量均显著增加(P < 0.05),以T7组的EE含量最高,CON组与T1、T4组的EE含量差异不显著(P>0.05)。与CON、T1、T2、T4组相比,T3、T5、T6、T7组的CF、ADF、NDF、钙含量显著增加(P < 0.05),但碳水化合物含量显著减少(P < 0.05)。与CON组相比,T1、T2、T4组的CF、ADF、NDF、钙含量差异不显著(P>0.05)。T7组的磷含量显著高于其他组(P < 0.05)。T5、T6、T7组的粗灰分含量显著高于T1和T2组(P < 0.05)。
|
|
表 3 不同菌种发酵对柑橘渣总黄酮和常规营养成分含量的影响 Table 3 Effects of aerobic fermentation with different strains on total flavonoid and conventional nutrient contents of citrus pomace |
由表 4可知,与CON、T1、T2、T4组相比,T3、T5、T6、T7组的苏氨酸、赖氨酸、组氨酸、丝氨酸、甘氨酸、丙氨酸、酪氨酸含量和必需氨基酸/总氨基酸比值显著增加(P < 0.05),但脯氨酸含量和非必需氨基酸/总氨基酸比值显著降低(P < 0.05)。T3、T5、T6、T7组的苏氨酸、赖氨酸、组氨酸、丝氨酸、甘氨酸、丙氨酸、酪氨酸、必需氨基酸含量较CON组分别提高了35.29%、56.25%~68.75%、25.00%、26.31%~31.57%、17.39%~26.09%、8.00%~12.00%、25.00%~33.33%、12.75%~26.85%。与T1、T2、T4组相比,T3、T6、T7组的亮氨酸、苯丙氨酸、总氨基酸含量显著提高(P < 0.05)。T7组的缬氨酸、异亮氨酸、精氨酸、必需氨基酸含量显著高于其他发酵组(P < 0.05)。T1~T6组的精氨酸含量显著低于T7和CON组(P < 0.05),T7组的精氨酸含量与CON组差异不显著(P>0.05)。
|
|
表 4 不同菌种有氧发酵对柑橘渣水解氨基酸含量的影响 Table 4 Effects of aerobic fermentation with different strains on hydrolyzed amino acid contents of citrus pomace |
由表 5可知,与CON、T1、T2、T4组相比,T3、T5、T6、T7组的赖氨酸、苏氨酸、亮氨酸、赖氨酸+苯丙氨酸、必需氨基酸比例显著提高(P < 0.05)。T3、T5、T6、T7组的赖氨酸、苏氨酸、亮氨酸、赖氨酸+苯丙氨酸比例高于或接近于鸡蛋蛋白,且均高于FAO/WHO模式。T7组的缬氨酸和异亮氨酸比例显著高于其他组(P < 0.05),且高于FAO/WHO模式。
|
|
表 5 不同菌种有氧发酵对柑橘渣必需氨基酸组成的影响 Table 5 Effects of aerobic fermentation with different strains on essential amino acid composition of citrus pomace |
微生物通过在基质中释放有机酸来降解细胞壁[20]。本试验中发酵柑橘渣中各种有机酸含量与以往研究相似[8, 21]。酵母、芽孢杆菌、黑曲霉分泌的酶的协同作用将有助于酸化柑橘渣。本研究结果显示,各发酵柑橘渣的pH均低于4.20。酵母、地衣芽孢杆菌、黑曲霉等微生物利用柑橘渣代谢合成柠檬酸、乳酸及其他有机酸[22],使得柑橘渣pH降低。黑曲霉单独或组合(T3、T5、T6、T7组)发酵柑橘渣较低的pH与其高含量的柠檬酸、乳酸、总有机酸是一致的。乳酸可由多种细菌、酵母和丝状真菌产生[23-24]。微生物对碳水化合物、脂肪和氨基酸代谢产生的乳酸有利于改善发酵的香气[25],表现为发酵柑橘渣具有酸香气味。另外,柠檬酸具有较强的酸香味,使得黑曲霉发酵的柑橘渣酸香味更浓郁。黑曲霉固态发酵橙皮最高能生产193 g/kg柠檬酸[26]。本试验中,发酵柑橘渣中柠檬酸含量最高为22.19 g/kg,与以往研究有所不同,主要是由于上述研究目的在于生产柠檬酸,本研究目的在柑橘渣的饲料化利用。黑曲霉与其他菌种组合发酵柑橘渣的总有机酸含量显著高于黑曲霉单独发酵的柑橘渣,说明微生物的协同作用有利于有机酸的合成。本试验中,黑曲霉单独或组合发酵柑橘渣的苹果酸含量均较发酵柑橘渣显著降低,而其他发酵组苹果酸含量与未发酵柑橘渣相似。这可能是黑曲霉利用了柑橘渣中的苹果酸。黑曲霉单独或组合发酵柑橘渣有机酸含量丰富,对于改善动物肠道健康、促进动物生长有积极效果。
3.2 不同菌种有氧发酵对柑橘渣总黄酮和常规营养成分含量的影响黄酮具有多种生物学功能,对动物健康有益。本研究中各发酵柑橘渣的总黄酮含量均显著高于未发酵柑橘渣,说明微生物利用柑橘渣代谢合成了黄酮类物质。地衣芽孢杆菌、丝状真菌、酵母均在多酚和黄酮类化合物的生物合成中发挥着重要作用,能够降解细胞壁和提高释放酚类化合物[27-28]。酿酒酵母可产生β-葡萄糖苷酶和阿魏酸酯酶以降解细胞壁[29]。葡萄牙棒孢酵母能够合成和转化橙皮素和橙皮苷[30]。芽孢杆菌属细菌在发酵过程中产生的裂解酶有助于降解细胞壁,释放多酚和类黄酮[27]。黑曲霉具有较强的生物转化能力,能产生多种化合物[31],如黄酮、多酚[32]。三菌组合发酵发酵柑橘渣的总黄酮含量最高,这归因于微生物的互作。在3种微生物的作用下,柑橘渣被转化和利用的程度更高。
不同菌种发酵柑橘渣CP含量的提高来源于菌体蛋白和酶的增加。以往研究表明,真菌发酵提高了柑橘渣CP含量[12-13]。地衣芽孢杆菌分泌蛋白质能力强(木聚糖酶、纤维素酶和淀粉酶)[33],酵母菌体蛋白含量高[34]。黑曲霉单独或组合发酵柑橘渣的CP含量显著高于其他组,这是因为在有氧条件下,黑曲霉生长迅速,菌丝体丰富,菌体蛋白含量高于其他组合。菌体增加的同时,黑曲霉细胞壁几丁质含量也增加,这可能导致了发酵柑橘渣CF含量的增加。真菌细胞壁成分(β-葡聚糖、几丁质和壳聚糖)被归类为促进动物健康的膳食纤维[35]。发酵柑橘渣CF含量增加的部分是真菌膳食纤维,对动物健康有益。本试验测得的柑橘渣和发酵柑橘渣的CF、ADF、NDF含量与Wang等[36]的研究结果一致,其报道柑橘渣的CF、ADF、NDF含量分别为15.69%、21.49%、23.37%。也有研究报道,青贮后柑橘渣的CF、ADF、NDF含量无显著变化[11]。这与本研究结果不一致,主要是发酵方式(青贮与有氧发酵)和发酵菌种(不添加菌种与添加芽孢杆菌、酵母、黑曲霉)的不同引起的。
黑曲霉等丝状真菌可以在固体基质的颗粒间空间定植并分泌用于水解固体基质的各种酶[37]。黑曲霉组合发酵柑橘渣的碳水化合物含量减少,说明微生物利用柑橘渣中碳水化合物作为能量来源,生成有机酸、氨基酸,合成蛋白质、脂肪等,促进微生物生长繁殖。本试验中,黑曲霉单独或组合发酵柑橘渣的CP、氨基酸、EE、有机酸含量均较未发酵柑橘渣有不同程度提高,该试验结果与前人研究结果[11]一致。粗灰分被认为是矿物质食物的良好来源[38]。T5、T6、T7组粗灰分含量的增加与钙含量增加一致。发酵柑橘渣中CP、CF、EE、粗灰分、钙、磷含量的增加,可能是底物被消耗导致营养物质含量的相对增加。
3.3 不同菌种有氧发酵对柑橘渣水解氨基酸含量和必需氨基酸组成的影响氨基酸含量的增加提高了柑橘渣的营养价值。除色氨酸未测定外,发酵柑橘渣中测得17种水解氨基酸,其中蛋氨酸含量很低。分析测定结果发现,地衣芽孢杆菌和葡萄牙棒孢酵母未能提高柑橘渣的氨基酸含量,黑曲霉单独或组合发酵使柑橘渣中多种氨基酸及必需氨基酸含量增加,这与CP含量的增加是一致的,侧面说明了黑曲霉单独或组合发酵柑橘渣的真蛋白质含量提高了,尤以三菌组合发酵效果最优,这与发酵朱缨花[39]、发酵橄榄叶渣[40]的氨基酸含量与未发酵原料相比有不同程度的增加的结果相似。黑曲霉单独或组合发酵柑橘渣的苏氨酸、赖氨酸、组氨酸、丝氨酸、甘氨酸、丙氨酸、酪氨酸、必需氨基酸含量较未发酵柑橘渣分别提高了35.29%、56.25%~68.75%、25.00%、26.31%~31.57%、17.39%~26.09%、8.00%~12.00%、25.00%~33.33%、12.75%~26.85%,说明黑曲霉单独或组合发酵改善了柑橘渣的氨基酸谱。
黑曲霉单独或组合发酵柑橘渣后脯氨酸含量减少,主要是由于黑曲霉优先利用脯氨酸。脯氨酸和丙氨酸是黑曲霉孢子发芽的强激活剂[41]。黑曲霉孢子萌发过程中利用了大量的脯氨酸,而产生的脯氨酸含量较低,这导致发酵柑橘渣中脯氨酸含量降低。黑曲霉能产生脯氨酰内切蛋白酶,分解脯氨酸[42]。另外,丙氨酸的生产量大于利用量,使得含黑曲霉的发酵柑橘渣中丙氨酸含量较高。
本试验中发酵或未发酵柑橘渣的必需氨基酸/总氨基酸比值(0.38~0.46)和必需氨基酸/非必需氨基酸比值(0.63~0.84)均接近或高于FAO/WHO理想蛋白质(必需氨基酸/总氨基酸比值>0.4,必需氨基酸/非必需氨基酸比值>0.6)[19]。必需氨基酸比例高于或接近鸡蛋蛋白和FAO/WHO模式。柑橘渣和发酵柑橘渣的必需氨基酸组成较为均衡,黑曲霉单独或组合发酵柑橘渣的必需氨基酸组成比未发酵柑橘渣更优,三菌组合发酵柑橘渣效果最优。
3.4 黑曲霉和多菌种发酵效果柑橘渣含丰富的D-柠檬烯,D-柠檬烯对微生物表现出很高的抗菌活性[43]。Zema等[2]发现,从柑橘渣中筛选的酵母对D-柠檬烯具有天然抗性。本试验中的黑曲霉来源于陈皮,也许对D-柠檬烯具有抗性,使得黑曲霉能充分利用柑橘渣中的成分,改善柑橘渣的营养价值。Velázquez等[31]报道,黑曲霉在补充有柠檬烯和柠檬精油的培养基中表现出最高的耐受性和生长速度。黑曲霉是丝状真菌,菌丝能够遍布基质表面,代谢活性高,能在各种基质中良好生长,生长速度优于单细胞生物(地衣芽孢杆菌和葡萄牙棒孢酵母)。在发酵饲料方面,地衣芽孢杆菌和酵母主要与其他微生物配合使用,而黑曲霉单独使用也能获得较好效果。黑曲霉是一种比酿酒酵母更有效的蛋白质分泌者,能大量分泌酸性蛋白酶、木聚糖酶、纤维素酶等[44]。酸性蛋白酶能在发酵后期低pH环境中发挥作用,木聚糖酶和纤维素酶则能够分解植物组织细胞之间的物质[44-45]。黑曲霉能够耐受低至1.5的pH[46],在低pH环境下生长仍能充分转化代谢柑橘渣的成分。而葡萄牙棒孢酵母与地衣芽孢杆菌在发酵后期的低pH环境下生长受到抑制,代谢减弱。因此,含有黑曲霉的发酵柑橘渣营养价值优于不含黑曲霉的发酵柑橘渣。
本研究结果显示,多菌种发酵改善了柑橘渣的营养价值。这可能是由于菌种在发酵过程中产生的代谢物之间存在相互作用,另外,发酵过程中新微生物群的相互作用和协同作用也可影响活性物质、营养物质的生成。黑曲霉分泌多种酶,增加柑橘渣有机物的水解,可以释放出地衣芽孢杆菌和酵母可利用的底物,菌种间协同作用改善了柑橘渣的营养价值。微生物之间的相互作用影响微生物群落成员的生长、代谢和分化[47],这些相互作用可能通过信号分子、生理化学环境的调节、趋化性、协同代谢、蛋白质分泌甚至基因转移来实现[48]。外源微生物的接种会给柑橘渣微生物群落带来变化,具体机制需要深入研究微生物的相互作用以及菌群变化进行探讨。
4 结论本试验条件下,黑曲霉、地衣芽孢杆菌+黑曲霉、葡萄牙棒孢酵母+黑曲霉、地衣芽孢杆菌+葡萄牙棒孢酵母+黑曲霉有氧发酵均能够改善柑橘渣的常规营养成分、总黄酮、有机酸含量和必需氨基酸组成,提高其营养价值,且地衣芽孢杆菌+葡萄牙棒孢酵母+黑曲霉组合提高作用更明显,效果更优。
| [1] |
国家统计局. 国家数据[DB/OL]. [2021-08-11]. https://data.stats.gov.cn/. National Bureau of Statistics. National data[DB/OL]. [2021-08-11]. https://data.stats.gov.cn/. (in Chinese) |
| [2] |
ZEMA D A, CALABRÒ P S, FOLINO A, et al. Valorisation of citrus processing waste: a review[J]. Waste Management, 2018, 80: 252-273. DOI:10.1016/j.wasman.2018.09.024 |
| [3] |
MAHAN K M, LE R K, WELLS T Jr, et al. Production of single cell protein from agro-waste using Rhodococcus opacus[J]. Journal of Industrial Microbiology and Biotechnology, 2018, 45(9): 795-801. DOI:10.1007/s10295-018-2043-3 |
| [4] |
ANTICONA M, BLESA J, FRIGOLA A, et al. High biological value compounds extraction from citrus waste with non-conventional methods[J]. Foods, 2020, 9(6): 811. DOI:10.3390/foods9060811 |
| [5] |
WILLIAMS S R O, CHAVES A V, DEIGHTON M H, et al. Influence of feeding supplements of almond hulls and ensiled citrus pulp on the milk production, milk composition, and methane emissions of dairy cows[J]. Journal of Dairy Science, 2018, 101(3): 2072-2083. DOI:10.3168/jds.2017-13440 |
| [6] |
TAYENGWA T, CHIKWANHA O C, RAFFRENATO E, et al. Comparative effects of feeding citrus pulp and grape pomace on nutrient digestibility and utilization in steers[J]. Animal, 2021, 15(1): 100020. DOI:10.1016/j.animal.2020.100020 |
| [7] |
TAYENGWA T, CHIKWANHA O C, NEETHLING J, et al. Polyunsaturated fatty acid, volatile and sensory profiles of beef from steers fed citrus pulp or grape pomace[J]. Food Research International, 2021, 139: 109923. DOI:10.1016/j.foodres.2020.109923 |
| [8] |
MALLA B A, RASTOGI A, SHARMA R K, et al. Kinnow madarin (Citrus nobilis lour×Citrus deliciosa tenora) fruit waste silage as potential feed for small ruminants[J]. Veterinary World, 2015, 8(1): 19-23. DOI:10.14202/vetworld.2015.19-23 |
| [9] |
CERISUELO A, CASTELLÓ L, MOSET V, et al. The inclusion of ensiled citrus pulp in diets for growing pigs: effects on voluntary intake, growth performance, gut microbiology and meat quality[J]. Livestock Science, 2010, 134(1/3): 180-182. |
| [10] |
SABATER C, RUIZ L, DELGADO S, et al. Valorization of vegetable food waste and by-products through fermentation processes[J]. Frontiers in Microbiology, 2020, 11: 581997. DOI:10.3389/fmicb.2020.581997 |
| [11] |
姚焰础, 杨飞云, 刘作华, 等. 柑橘渣青贮过程中营养物质和苦味物质含量的动态变化规律研究[J]. 中国饲料, 2012(7): 14-15, 19. YAO Y C, YANG F Y, LIU Z H, et al. Study on the dynamic variation of silage process on the nutrients and bitter compounds of citrus pulp[J]. China Feed, 2012(7): 14-15, 19 (in Chinese). DOI:10.3969/j.issn.1004-3314.2012.07.004 |
| [12] |
程锦. 混合菌种发酵柑橘皮渣生产蛋白饲料的研究[D]. 硕士学位论文. 重庆: 重庆大学, 2016. CHENG J. The research of protein feed production by muti-strains fermentation with citrus peel[D]. Master's Thesis. Chongqing: Chongqing University, 2016. (in Chinese) |
| [13] |
杨柳, 郑华, 张邑帆, 等. 复合菌种协同发酵提高柑橘渣蛋白质含量的研究[C]//中国畜牧兽医学会动物微生态学分会第十一次全国学术研讨会暨第五届会员代表大会论文集, 重庆: 中国畜牧兽医学会动物微生态学分会, 2014: 214. YANG L, ZHENG H, ZHANG Y F, et al. Studying of compatible strains for fermentation citrus pulp and enhancement its protein content[C]//Proceedings of the 11th National Symposium and the 5th Member Congress of Animal Microecology Branch of China Animal Husbandry and Veterinary Society, Chongqing: Animal Microecology Branch of Chinese Society of Animal Husbandry and Veterinary Medicine, 2014: 214. |
| [14] |
DAI C H, HOU Y Z, XU H N, et al. Effect of solid-state fermentation by three different Bacillus species on composition and protein structure of soybean meal[J/OL]. Journal of the Science of Food and Agriculture, 2021. (2021-06-19)[2021-08-11]. https://doi.org/10.1002/jsfa.11384.DOI: 10.1002/jsfa.11384.
|
| [15] |
白杰, 李德芳, 陈安国, 等. HPLC法测定红麻青贮饲料中的有机酸[J]. 中国麻业科学, 2016, 38(3): 105-110. BAI J, LI D F, CHEN A G, et al. Determination of organic acids in kenaf silage by HPLC[J]. Plant Fiber Sciences in China, 2016, 38(3): 105-110 (in Chinese). DOI:10.3969/j.issn.1671-3532.2016.03.002 |
| [16] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [17] |
SNIFFEN C J, O'CONNOR J D, VAN SOEST P J, et al. A net carbohydrate and protein system for evaluating cattle diets: Ⅱ. Carbohydrate and protein availability[J]. Journal of Animal Science, 1992, 70(11): 3562-3577. DOI:10.2527/1992.70113562x |
| [18] |
WANG J H, CAO F L, SU E Z, et al. Improvement of animal feed additives of ginkgo leaves through solid-state fermentation using Aspergillus niger[J]. International Journal of Biological Sciences, 2018, 14(7): 736-747. DOI:10.7150/ijbs.24523 |
| [19] |
FAO/WHO. Energy and protein requirements: FAO nutritional meeting report series No. 52[R]. Rome: FAO, 1973.
|
| [20] |
VILLARREAL-SOTO S A, BEAUFORT S, BOUAJILA J, et al. Understanding Kombucha tea fermentation: a review[J]. Journal of Food Science, 2018, 83(3): 580-588. DOI:10.1111/1750-3841.14068 |
| [21] |
BEYZI S B, ÜLGER Ī, KALIBER M, et al. Determination of chemical, nutritional and fermentation properties of citrus pulp silages[J]. Turkish Journal of Agriculture: Food Science and Technology, 2018, 6(12): 1833-1837. DOI:10.24925/turjaf.v6i12.1833-1837.2229 |
| [22] |
BEHERA B C. Citric acid from Aspergillus niger: a comprehensive overview[J]. Critical Reviews in Microbiology, 2020, 46(6): 727-749. DOI:10.1080/1040841X.2020.1828815 |
| [23] |
KOMESU A, ROCHA DE OLIVEIRA J A, DA SILVA MARTINS L H, et al. Lactic acid production to purification: a review[J]. BioResources, 2017, 12(2): 4364-4383. DOI:10.15376/biores.12.2.4364-4383 |
| [24] |
JUTURU V, WU J C. Microbial production of lactic acid: the latest development[J]. Critical Reviews in Biotechnology, 2016, 36(6): 967-977. DOI:10.3109/07388551.2015.1066305 |
| [25] |
LIU Y X, CHENG H, LIU H Y, et al. Fermentation by multiple bacterial strains improves the production of bioactive compounds and antioxidant activity of goji juice[J]. Molecules, 2019, 24(19): 3519. DOI:10.3390/molecules24193519 |
| [26] |
TORRADO A M, CORTÉS S, MANUEL SALGADO J, et al. Citric acid production from orange peel wastes by solid-state fermentation[J]. Brazilian Journal of Microbiology, 2011, 42(1): 394-409. DOI:10.1590/S1517-83822011000100049 |
| [27] |
KAYATH C A, IBALA ZAMBA A, MOKÉMIABEKA S N, et al. Synergic involvements of microorganisms in the biomedical increase of polyphenols and flavonoids during the fermentation of ginger juice[J]. International Journal of Microbiology, 2020, 2020: 8417693. |
| [28] |
CHO K M, HONG S Y, MATH R K, et al. Biotransformation of phenolics (isoflavones, flavanols and phenolic acids) during the fermentation of cheonggukjang by Bacillus pumilus HY1[J]. Food Chemistry, 2009, 114(2): 413-419. DOI:10.1016/j.foodchem.2008.09.056 |
| [29] |
COGHE S, BENOOT K, DELVAUX F, et al. Ferulic acid release and 4-vinylguaiacol formation during brewing and fermentation: indications for feruloyl esterase activity in Saccharomyces cerevisiae[J]. Journal of Agricultural and Food Chemistry, 2004, 52(3): 602-608. DOI:10.1021/jf0346556 |
| [30] |
傅曼琴, 徐玉娟, 吴继军, 等. 一株葡萄牙棒孢酵母菌株及其应用: CN202010624949.4[P]. 2020-07-01. FU M Q, XU Y J, WU J J, et al. A strain of Clavispora lusitaniae and its application: CN202010624949.4[P]. 2020-07-01. (in Chinese) |
| [31] |
VELÁZQUEZ J E, SADAÑOSKI M A, ZAPATA P D, et al. Bioproduction of α-terpineol and R-(+)-limonene derivatives by terpene-tolerant ascomycete fungus as a potential contribution to the citrus value chain[J]. Journal of Applied Microbiology, 2021, 130(1): 76-89. DOI:10.1111/jam.14777 |
| [32] |
CAO H, CHEN X Q, JASSBI A R, et al. Microbial biotransformation of bioactive flavonoids[J]. Biotechnology Advances, 2015, 33(1): 214-223. DOI:10.1016/j.biotechadv.2014.10.012 |
| [33] |
ASLAM F, ANSARI A, AMAN A, et al. Production of commercially important enzymes from Bacillus licheniformis KIBGE-IB3 using date fruit wastes as substrate[J]. Journal, Genetic Engineering & Biotechnology, 2020, 18(1): 46. |
| [34] |
CHEN M X, LI Q, ZHANG Y, et al. Xylo-oligosaccharides enriched yeast protein feed production from reed sawdust[J]. Bioresource Technology, 2018, 270: 738-741. DOI:10.1016/j.biortech.2018.09.127 |
| [35] |
STARZYŃSKA-JANISZEWSKA A, STODOLAK B, DULIŃSKI R, et al. Fermentation of colored quinoa seeds with Neurospora intermedia to obtain oncom-type products of favorable nutritional and bioactive characteristics[J]. Cereal Chemistry, 2017, 94(3): 619-624. DOI:10.1094/CCHEM-10-16-0264-R |
| [36] |
WANG C, GAO G L, HUANG J X, et al. Nutritive value of dry citrus pulp and its effect on performance in geese from 35 to 70 days of age[J]. Journal of Applied Poultry Research, 2017, 26(2): 253-259. DOI:10.3382/japr/pfw069 |
| [37] |
RICCI A, DIAZ A B, CARO I, et al. Orange peels: from by-product to resource through lactic acid fermentation[J]. Journal of the Science of Food and Agriculture, 2019, 99(15): 6761-6767. DOI:10.1002/jsfa.9958 |
| [38] |
ADEDUNTAN S A, OYERINDE A S. Evaluation of chemical and antinutritional characteristics of obeche (Triplochition scleroxylon) and some mulberry (Morus alba) leaves[J]. International Journal of Biological and Chemical Sciences, 2009, 3(4): 681-687. |
| [39] |
崔艺燕, 邓盾, 田志梅, 等. 不同菌种发酵对朱缨花叶粉营养价值的影响[J]. 中国畜牧兽医, 2020, 47(5): 1436-1443. CUI Y Y, DENG D, TIAN Z M, et al. Effects of fermentation with different strains on the nutritional values of Calliandra calothyrsus leaf powder[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(5): 1436-1443 (in Chinese). |
| [40] |
XIE P J, HUANG L X, ZHANG C H, et al. Nutrient assessment of olive leaf residues processed by solid-state fermentation as an innovative feedstuff additive[J]. Journal of Applied Microbiology, 2016, 121(1): 28-40. DOI:10.1111/jam.13131 |
| [41] |
IJADPANAHSARAVI M, PUNT M, WÖSTEN H A B, et al. Minimal nutrient requirements for induction of germination of Aspergillus niger conidia[J]. Fungal Biology, 2021, 125(3): 231-238. DOI:10.1016/j.funbio.2020.11.004 |
| [42] |
EDENS L, DEKKER P, VAN DER HOEVEN R, et al. Extracellular prolyl endoprotease from Aspergillus niger and its use in the debittering of protein hydrolysates[J]. Journal of Agricultural and Food Chemistry, 2005, 53(20): 7950-7957. DOI:10.1021/jf050652c |
| [43] |
DENKOVA-KOSTOVA R, TENEVA D, TOMOVA T, et al. Chemical composition, antioxidant and antimicrobial activity of essential oils from tangerine (Citrus reticulata L.), grapefruit (Citrus paradisi L.), lemon (Citrus lemon L.) and cinnamon (Cinnamomum zeylanicum Blume)[J]. Zeitschrift für Naturforschung C, 2021, 76(5/6): 175-185. |
| [44] |
PEL H J, DE WINDE J H, ARCHER D B, et al. Genome sequencing and analysis of the versatile cell factory Aspergillus niger CBS 513.88[J]. Nature Biotechnology, 2007, 25(2): 221-231. DOI:10.1038/nbt1282 |
| [45] |
YU R L, LIU J, WANG Y, et al. Aspergillus niger as a secondary metabolite factory[J]. Frontiers in Chemistry, 2021, 9: 701022. DOI:10.3389/fchem.2021.701022 |
| [46] |
PATHAK A, KOTHARI R, VINOBA M, et al. Fungal bioleaching of metals from refinery spent catalysts: a critical review of current research, challenges, and future directions[J]. Journal of Environmental Management, 2021, 280: 111789. DOI:10.1016/j.jenvman.2020.111789 |
| [47] |
WANG P, WU Q, JIANG X J, et al. Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J]. International Journal of Food Microbiology, 2017, 250: 59-67. DOI:10.1016/j.ijfoodmicro.2017.03.010 |
| [48] |
BENOIT I, VAN DEN ESKER M H, PATYSHAKULIYEVA A, et al. Bacillus subtilis attachment to Aspergillus niger hyphae results in mutually altered metabolism[J]. Environmental Microbiology, 2015, 17(6): 2099-2113. DOI:10.1111/1462-2920.12564 |




