2. 中国科学院大学, 北京 100039;
3. 湖南粒丰生物科技有限公司, 长沙 410125
2. University of Chinese Academy of Sciences, Beijing 100039, China;
3. Hunan Lifeng Biological Technology Co., Ltd., Changsha 410125, China
在肉类工业中,畜禽脂肪含量与生产效率和肉品质密切相关[1]。人类摄取脂肪含量高的肉制品将增加患糖尿病和脂肪肝等慢性疾病的风险[2],因此,减少畜禽脂肪沉积已成为动物营养学研究重点和热点。研究表明,高蛋白质膳食可有效降低机体脂肪沉积[3-4],而其代价是损害骨骼健康和肾功能以及降低氮利用效率[5-6]。在畜牧生产中,降低饲粮蛋白质水平可减少饲料成本和氨排放,并提高氮利用效率[7-8],因而低蛋白质饲粮被广泛关注[9-10]。然而,与高蛋白质饲粮相反,低蛋白质饲粮有促进脂肪沉积的趋势[6]。为了减轻由低蛋白质饲粮引起的脂肪沉积,人们在蛋白质限制膳食中添加功能性氨基酸(如精氨酸、谷氨酰胺和亮氨酸)方面进行了广泛的探索[11]。近年来,除功能性氨基酸外,植物饲料资源(如杂交构树)也因其粗蛋白质含量高(18%~22%)和营养均衡而引起了人们极大的兴趣[12-13]。杂交构树含有40多种具有抗菌、抗氧化和抗炎功能的多酚和黄酮类物质[14],且可抑制脂肪酶活性、增加能量消耗和减少体重增加,表明其具有抗脂肪沉积潜力[15]。然而,低蛋白质饲粮中添加构树全株发酵饲料对机体脂肪沉积的影响及调控机制尚不清楚。据报道,肠道微生物可调控机体脂肪代谢[16]。具体来说,肠道微生物可分解膳食纤维以产生短链脂肪酸(short-chain fatty acids,SCFAs)[17],SCFAs可作为宿主和信号分子的能量来源,从而将肠道微生物的代谢活动与宿主体内的能量稳态联系起来[18]。此外,膳食蛋白质水平会影响肠道微生物组成[19],且低蛋白质膳食(蛋白质水平降低不超过3%)比高蛋白质膳食更有效[20-21]。基于此,本试验拟对低蛋白质饲粮中添加构树全株发酵饲料对育肥猪脂肪重量、脂肪代谢和肠道微生物组成的影响进行研究,以期为构树全株发酵饲料在育肥猪生产中的应用提供参考。
1 材料与方法 1.1 试验设计选择初始体重[(63.53±0.40) kg]相近的健康三元杂交(杜洛克×长白×大白)阉公猪18头,随机分为3组(每组6头猪):正常蛋白质饲粮组(A组,作为对照组,饲粮粗蛋白质含量为16%)、低蛋白质饲粮组(B组,饲粮粗蛋白质含量为13%)和构树全株发酵饲料组(C组,饲粮含10%构树全株发酵饲料,饲粮粗蛋白质含量为13%)。试验期45 d。构树全株发酵饲料由湘潭某构树产业发展有限公司提供,其发酵工艺以及主要营养成分含量见张兴等[22]的报道。各组饲粮组成及营养水平见本课题组前期研究[23]。
1.2 饲养管理与样品采集试验期间,所有猪只在漏粪地板式猪床上单栏饲养,自由饮水,自由采食,每天饲喂3次。试验结束时,禁食12 h,颈静脉采血后将所有猪只屠宰,称取体脂重量并记录,采集背脂和结肠食糜。
1.3 指标测定 1.3.1 血清生化指标血液样品于4 ℃、3 500 r/min条件下离心10 min以获得血清,接着使用CX-4全自动生化分析仪(Beckman,美国)和相应试剂盒(北京利德曼生物科技有限公司)检测血清中高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)、甘油三酯(triacylglycerol,TG)和胆固醇(cholesterol,CHOL)浓度。
1.3.2 背脂中脂肪代谢相关基因mRNA表达量参照郑昌炳等[24]的方法,以β-肌动蛋白(β-actin)为内参基因,检测背脂中脂质摄取相关基因[脂肪酸转运蛋白1(fatty acid transport protein 1,FATP1)、脂肪酸转位酶(fatty acid translocase,FAT/CD36)、脂肪生成相关基因[乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)]、脂肪分解相关基因[激素敏感性脂肪酶(hormone-sensitive lipase,HSL)、肉碱棕榈酰转移酶1B(carnitine palmitoyl transferase 1B,CPT1B)]、脂质代谢相关转录因子[过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)、CCAAT/增强子结合蛋白α(CCAAT/enhancer-binding protein α,C/EBPα)、甾醇调节元件结合蛋白-1c(sterol regulatory element binding protein-1c,SREBP-1c)]的mRNA表达量[25],实时荧光定量PCR引物序列见表 1。
|
|
表 1 实时荧光定量PCR引物序列 Table 1 Primer sequences used for quantitative real-time PCR |
参照前人研究方法[24],称取0.5~0.6 g冷冻干燥后的结肠食糜,使用Agilent 6890气相色谱仪(Agilent Technologies公司, 美国)进行结肠SCFAs(乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸)浓度测定。
1.3.4 肠道微生物组成取适量结肠食糜,参照前人研究方法[16, 26],采用16S DNA测序分析微生物组成。DNA样品到最终数据获得包括样品检测、PCR、纯化、建库、测序、数据分析等,均由上海美吉生物医药科技有限公司完成。Alpha多样性指数(Shannon、Simpson、Chao1和ACE指数)用于分析肠道微生物群落的多样性和丰富度。
1.3.5 结肠中生物胺浓度将约1 g冷冻干燥后的结肠食糜与8 mL 0.4 mol/L高氯酸溶液混合,然后在-20 ℃下储存过夜。将混合物以8 000 r/min离心10 min(2次),得到上清液。将1 mL上清液与1 mL NaOH/NaHCO3缓冲液(pH=10.6)和1 mL溶于丙酮的丹磺酰氯(10 mg/mL)混合。将混合物在40 ℃避光水浴30 min,每5 min适度摇晃1次。在混合物冷却之前,将1 mL 5%氢氧化铵加入混合物中并涡旋混合。待混合物完全冷却后,加入1 mL无水醚提取生物胺,包括腐胺、尸胺、亚精胺和精胺。10 min后,移取无水乙醚层以3 000 r/min离心浓缩。然后,将沉淀物溶解在1 mL甲醇中并通过0.22 μm聚砜膜过滤。最后用Agilent 1260高效液相色谱仪(Agilent Technologies公司, 美国)检测生物胺浓度。
色谱参数如下:分析柱为agilent zorbax SB-C18(4.6 mm×150 mm,内径3.5 μm);保护柱为agilent zorbax SB-C18(2.1 mm×12.5 mm,内径5 μm);柱温为35 ℃;流速为1.0 mL/min;进样量为10 μL;紫外检测器,波长254 nm;流动相A为乙腈;流动相B为0.02 mol/L醋酸铵水溶液。梯度洗脱程序如下:时间=0 min,间隔=0 min,60% A,40% B;时间=3 min,间隔=3 min,70% A,30% B;时间=6 min,间隔=3 min,78% A,22% B;时间=10 min,间隔=4 min,78% A,22% B;时间=15 min,间隔=5 min,98% A,2% B;时间=17 min,间隔=2 min,98% A,2% B;时间=18 min,间隔=1 min,60% A,40% B;时间=23 min,间隔=5 min,60% A,40% B。
1.3.6 结肠中吲哚和粪臭素浓度称取约0.4 g冷冻干燥后的结肠食糜,加入10 mL甲醇,混合均匀。将混合物在30 ℃水浴10 min,在-20 ℃下静置10 min后将混合物以8 000 r/min离心10 min,得到上清液。上清液用0.22 μm滤膜进行过滤后,使用Agilent 1290高效液相色谱仪(Agilent Technologies公司,美国)进行结肠食糜吲哚和粪臭素浓度测定。
色谱参数如下:柱子为zorbax SB-C18(4.6 mm×150 mm,内径5 μm);柱温为35 ℃;流速为1.0 mL/min;进样量为10 μL;流动相为60%甲醇水溶液。
1.4 数据分析试验数据使用Excel 2019进行初步处理,然后用SAS 8.2软件进行单因素方差分析(one-way ANOVA),并用Duncan氏法进行多重比较检验。使用SPSS 18.0软件进行体脂重量和结肠SCFAs浓度之间的相关性分析。所有试验数据均以平均值和均值标准误(SEM)表示,以P < 0.05作为差异显著性判断标准。
2 结果与分析 2.1 体脂重量和血清生化指标如表 2所示,与正常蛋白质饲粮相比,低蛋白质饲粮使育肥猪的体脂重量显著增加(+20.69%,P < 0.05),而在低蛋白质饲粮中添加构树全株发酵饲料则使育肥猪的体脂重量恢复到与对照组相似的水平(P>0.05)。与正常蛋白质饲粮相比,低蛋白质饲粮显著增加了育肥猪血清CHOL浓度(+16.80%,P < 0.05)。与低蛋白质饲粮相比,在低蛋白质饲粮中添加构树全株发酵饲料显著降低了育肥猪血清CHOL浓度(-7.60%,P < 0.05)。与正常蛋白质饲粮相比,低蛋白质饲粮以及在低蛋白质饲粮中添加构树全株发酵饲料均显著增加了育肥猪血清HDL浓度(分别增加27.40%和28.77%,P < 0.05),但低蛋白质饲粮组和构树全株发酵饲料组之间没有显著差异(P>0.05)。不同饲粮处理对育肥猪血清TG和LDL浓度无显著影响(P>0.05)。
|
|
表 2 饲喂不同饲粮育肥猪的体脂重量和血清生化指标 Table 2 Body fat weight and serum biochemical indexes of finishing pigs fed different diets(n=6) |
如图 1所示,与正常蛋白质饲粮相比,低蛋白质饲粮趋向于上调背脂中ACC的mRNA表达量,显著上调了背脂中SREBP-1c的mRNA表达量(P < 0.05),并显著下调了背脂中CPT-1B的mRNA表达量(P < 0.05);与低蛋白质饲粮相比,在低蛋白质饲粮中添加构树全株发酵饲料显著下调了背脂中ACC的mRNA表达量(P < 0.05),趋向于下调背脂中SREBP-1c的mRNA表达量(P>0.05)。背脂中HSL、FAT/CD36、FATP1、C/EBPα和PPARγ的mRNA表达量不受饲粮处理的显著影响(P>0.05)。
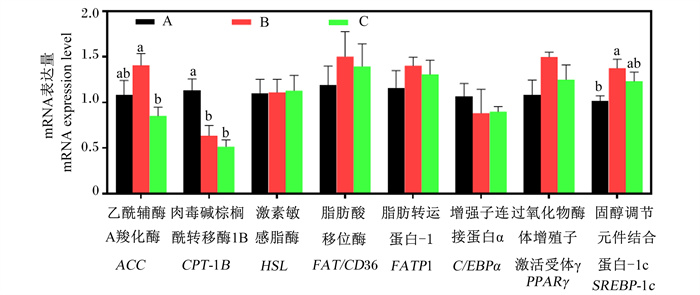
|
A:A组group A;B: B组group B;C:C组group C。下图同the same as below。 图 1 饲喂不同饲粮育肥猪背脂中脂肪代谢相关基因的mRNA表达量 Fig. 1 mRNA expression levels of lipid metabolism-related genes in dorsal subcutaneous adipose of finishing pigs fed different diets |
育肥猪结肠中SCFAs(乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸)浓度如图 2所示。与正常蛋白质饲粮相比,低蛋白质饲粮显著降低了育肥猪结肠中乙酸、丙酸、丁酸和戊酸浓度(P < 0.05),而在低蛋白质饲粮中添加构树全株发酵饲料则有增加结肠中乙酸和丙酸浓度的趋势(P>0.05)。不同饲粮处理对结肠中异丁酸和异戊酸浓度没有显著影响(P>0.05)。此外,体脂重量与结肠中乙酸、丙酸和丁酸浓度呈显著负相关(P < 0.05,表 3)。
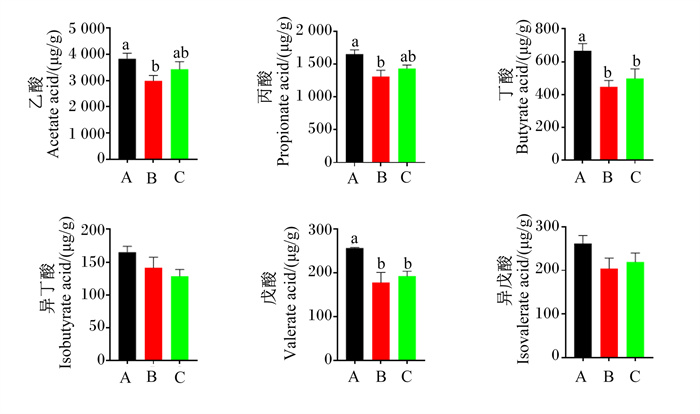
|
图 2 饲喂不同饲粮育肥猪结肠中SCFAs浓度的影响 Fig. 2 SCFAs concentrations in colon of finishing pigs fed different diets |
|
|
表 3 体脂重量与结肠中SCFAs浓度相关性分析 Table 3 Correlation analysis between body fat weight and colonic SCFAs concentrations |
饲粮处理对育肥猪肠道微生物多样性的影响见图 3。与正常蛋白质饲粮相比,低蛋白质饲粮具有降低Shannon和ACE指数的趋势,但是差异不显著(P>0.05,图 3-A);与低蛋白质饲粮相比,在低蛋白质饲粮中添加构树全株发酵饲料显著提高了Shannon和ACE指数(P < 0.05,图 3-A)。不同饲粮处理对Simpson和Chao1指数没有显著影响(P>0.05,图 3-A)。此外,对照组和构树全株发酵饲料组之间具有截然不同的菌群结构,而低蛋白质饲粮组的菌群结构与对照组相似(图 3-B)。如图 3-C所示,各组育肥猪结肠中优势菌门均为厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)。在门水平上(图-3D),与正常蛋白质饲粮相比,低蛋白质饲粮具有增加厚壁菌门相对丰度的趋势(P>0.05),显著增加了放线菌门(Actinobacteria)的相对丰度(P < 0.05),并显著降低了拟杆菌门和柔膜菌门(Tenericutes)的相对丰度(P < 0.05);与低蛋白质饲粮相比,在低蛋白质饲粮中添加构树全株发酵饲料显著降低了厚壁菌门和放线菌门的相对丰度(P < 0.05),并显著增加了拟杆菌门和变形菌门(Proteobacteria)的相对丰度(P < 0.05)。
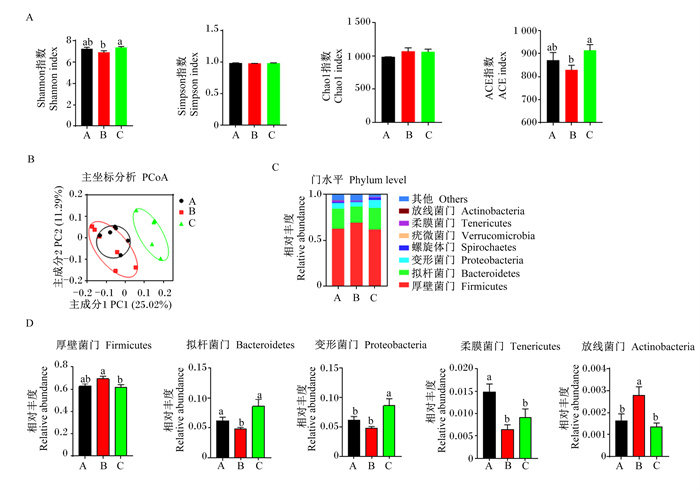
|
图 3 饲喂不同饲粮育肥猪的肠道微生物组成 Fig. 3 Gut microbiota composition of finishing pigs fed different diets |
如图 4所示,不同饲粮处理对结肠中腐胺、亚精胺、精胺和吲哚浓度无显著影响(P>0.05)。与正常蛋白质饲粮相比,在低蛋白质饲粮中添加构树全株发酵饲料显著降低了结肠中尸胺和粪臭素浓度(P < 0.05)。
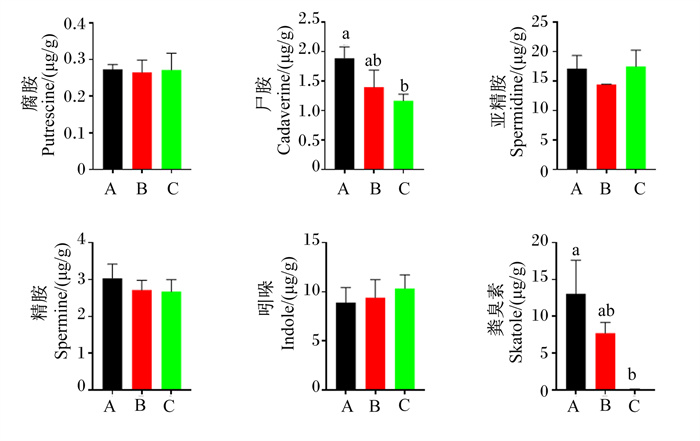
|
图 4 饲喂不同饲粮育肥猪结肠中生物胺、吲哚和粪臭素浓度 Fig. 4 Biogenic amine, indole and skatole concentrations in colon of finishing pigs fed different diets |
构树全株发酵饲料营养成分丰富,然而目前有关其对育肥猪脂肪代谢调控的研究较少。本试验发现,低蛋白质饲粮可显著提高育肥猪体脂重量和血清CHOL浓度,而在低蛋白质饲粮中添加构树全株发酵饲料可逆转低蛋白质饲粮引起的体脂重量和血清CHOL浓度,提示构树全株发酵饲料可抑制低蛋白质饲粮引起的脂肪沉积。为进一步探究构树全株发酵饲料的作用机制,我们首先检测了背脂中与脂肪合成及分解相关基因的mRNA表达量,结果显示,构树全株发酵饲料对脂肪分解(HSL和CPT-1B)和脂质摄取相关基因(FAT/CD36和FATP1)mRNA表达量的影响不显著,但显著降低了脂肪合成相关基因(ACC)的mRNA表达量。Lee等[27]研究表明,杂交构树的根皮提取物可通过激活磷酸腺苷活化蛋白激酶(AMPK)信号通路来抑制肝脏和脂肪组织中脂肪合成,与本试验研究结果类似。因此,我们推测低蛋白质饲粮中添加构树全株发酵饲料后育肥猪体脂重量降低的原因可能与构树全株发酵饲料抑制机体脂肪合成有关。
机体表型与肠道微生物组成息息相关[16, 28]。厚壁菌门和拟杆菌门是育肥猪结肠食糜中主要的2个细菌门类[29]。在猪上的研究表明,机体脂肪沉积状况显著影响猪的肠道微生物组成,体现为脂肪型猪种肠道微生物多样性较低,厚壁菌门的相对丰度较高,拟杆菌门的相对丰度较低[30-31]。在人和小鼠上的研究同样发现脂肪沉积的增加显著影响了肠道菌群结构[16, 32]。另外,营养素,如蛋白质,作为饲粮中最主要的营养成分之一,可改善机体代谢与健康可能源于其对肠道微生物的调节。Lubbs等[33]研究表明,低蛋白质饲粮可降低仔猪粪便中梭菌属和大肠杆菌的数量,从而改善肠道功能,促进肠道健康。本试验发现,育肥猪结肠中优势菌门为厚壁菌门和拟杆菌门,与上述结果一致。低蛋白质饲粮增加了育肥猪肠道中厚壁菌门的相对丰度并降低了拟杆菌门的相对丰度,这与前面得出的低蛋白质饲粮增加育肥猪体脂重量和血清CHOL含量的结果相呼应。在大鼠上的研究表明,拟杆菌门的相对丰度与体脂重量呈负相关[34]。拟杆菌门的主要代谢产物是乙酸和丙酸[35-37],这2种SCFAs浓度与脂肪沉积亦呈负相关[16, 28]。据此推测,采食低蛋白质饲粮的育肥猪脂肪沉积增加,促使机体肠道菌群结构发生改变,拟杆菌门相对丰度降低,乙酸和丙酸浓度减少。
有趣的是,在低蛋白质饲粮中添加构树全株发酵饲料显著增加了结肠中拟杆菌门的相对丰度,并有提高乙酸和丙酸浓度的趋势,这与前面提到的构树全株发酵饲料抑制脂肪沉积的结果相呼应,提示在低蛋白质饲粮中添加构树全株发酵饲料有利于降低体脂沉积,从而改善育肥猪结肠微生物组成与功能,提高有益菌的相对丰度,并可提高结肠中乙酸和丙酸浓度。与本研究结果相似,前人研究亦发现饲喂复合菌发酵饲料可显著改善生长育肥猪结肠微生物结构和SCFAs组成[29]。研究表明,生物饲料对动物后肠微生物结构的改善可直接影响后肠微生物的发酵方式,进而影响粪便中的恶臭化合物(如吲哚、粪臭素)组成[38-39]。粪臭素是色氨酸发酵的产物,会受到肠道微生物群变化的影响[40]。粪臭素是公猪肉中异味的来源,会影响肉的风味[41]。本试验发现,与正常蛋白质饲粮相比,低蛋白质饲粮有降低结肠中粪臭素的趋势,而在低蛋白质饲粮中添加构树全株发酵饲料则可显著降低育肥猪结肠中粪臭素的浓度。前人研究亦表明,低蛋白质饲粮可降低肠道内容物或粪便中粪臭素的浓度[42-44]。因此,我们推测杂交构树经生物发酵后可显著增强低蛋白质饲粮降低粪臭素的能力。
4 结论在低蛋白质饲粮中添加10%构树全株发酵饲料可抑制育肥猪背脂合成,降低体脂重量和血清CHOL含量,改善肠道微生物组成。
| [1] |
LEBRET B, MOUROT J. Caractéristiques et qualité des tissus adipeux chez le porc. Facteurs de variation non génétiques[J]. INRAE Productions Animales, 1998, 11(2): 131-143. |
| [2] |
SUNG H, SIEGEL R L, TORRE L A, et al. Global patterns in excess body weight and the associated cancer burden[J]. CA: A Cancer Journal for Clinicians, 2019, 69(2): 88-112. |
| [3] |
ASTRUP A, RABEN A, GEIKER N. The role of higher protein diets in weight control and obesity-related comorbidities[J]. International Journal of Obesity, 2015, 39(5): 721-726. DOI:10.1038/ijo.2014.216 |
| [4] |
GARCIA CARABALLO S C, COMHAIR T M, DEJONG C H C, et al. Dietary treatment of fatty liver: high dietary protein content has an antisteatotic and antiobesogenic effect in mice[J]. Biochimica et Biophysica Acta: Molecular Basis of Disease, 2017, 1863(7): 1789-1804. DOI:10.1016/j.bbadis.2017.04.022 |
| [5] |
CUENCA-SÁNCHEZ M, NAVAS-CARRILLO D, ORENES-PIÑERO E. Controversies surrounding high-protein diet intake: satiating effect and kidney and bone health[J]. Advances in Nutrition, 2015, 6(3): 260-266. DOI:10.3945/an.114.007716 |
| [6] |
WANG Y M, ZHOU J Y, WANG G, et al. Advances in low-protein diets for swine[J]. Journal of Animal Science and Biotechnology, 2018, 9: 60. DOI:10.1186/s40104-018-0276-7 |
| [7] |
KITADA M, OGURA Y, SUZUKI T, et al. A very-low-protein diet ameliorates advanced diabetic nephropathy through autophagy induction by suppression of the mTORC1 pathway in Wistar fatty rats, an animal model of type 2 diabetes and obesity[J]. Diabetologia, 2016, 59(6): 1307-1317. DOI:10.1007/s00125-016-3925-4 |
| [8] |
ZHANG S, QIAO M, TROTTIER N L. Feeding a reduced protein diet with a near ideal amino acid profile improves amino acid efficiency and nitrogen utilization for milk production in sows[J]. Journal of Animal Science, 2019, 97(9): 3882-3897. DOI:10.1093/jas/skz220 |
| [9] |
LEI X J, CHEONG J Y, PARK J H, et al. Supplementation of protease, alone and in combination with fructooligosaccharide to low protein diet for finishing pigs[J]. Animal Science Journal, 2017, 88(12): 1987-1993. DOI:10.1111/asj.12849 |
| [10] |
PÉREZ-MARTÍ A, GARCIA-GUASCH M, TRESSERRA-RIMBAU A, et al. A low-protein diet induces body weight loss and browning of subcutaneous white adipose tissue through enhanced expression of hepatic fibroblast growth factor 21 (FGF21)[J]. Molecular Nutrition & Food Research, 2017, 61(8): 1600725. |
| [11] |
WU G Y. Functional amino acids in nutrition and health[J]. Amino Acids, 2013, 45(3): 407-411. DOI:10.1007/s00726-013-1500-6 |
| [12] |
PENG X J, LIU H, CHEN P L, et al. A chromosome-scale genome assembly of paper mulberry (Broussonetia papyrifera) provides new insights into its forage and papermaking usage[J]. Molecular Plant, 2019, 12(5): 661-677. DOI:10.1016/j.molp.2019.01.021 |
| [13] |
DONG L F, ZHANG H S, GAO Y H, et al. Dynamic profiles of fermentation characteristics and bacterial community composition of Broussonetia papyrifera ensiled with perennial ryegrass[J]. Bioresource Technology, 2020, 310: 123396. DOI:10.1016/j.biortech.2020.123396 |
| [14] |
HAN Q H, WU Z L, HUANG B, et al. Extraction, antioxidant and antibacterial activities of Broussonetia papyrifera fruits polysaccharides[J]. International Journal of Biological Macromolecules, 2016, 92: 116-124. DOI:10.1016/j.ijbiomac.2016.06.087 |
| [15] |
李勇. 构树叶对营养性肥胖小鼠脂肪代谢的影响[D]. 硕士学位论文. 湛江: 广东海洋大学, 2011. LI Y. Effects of Broussonetia papyrifera leaf on lipid metabolism of nutritive obese mice[D]. Master's Thesis. Zhanjiang: Guangdong Ocean University, 2011. (in Chinese) |
| [16] |
DUAN Y H, ZHONG Y Z, XIAO H, et al. Gut microbiota mediates the protective effects of dietary β-hydroxy-β-methylbutyrate (HMB) against obesity induced by high-fat diets[J]. FASEB Journal, 2019, 33(9): 10019-10033. DOI:10.1096/fj.201900665RR |
| [17] |
TOPPING D L, CLIFTON P M. Short-chain fatty acids and human colonic function: roles of resistant starch and nonstarch polysaccharides[J]. Physiological Reviews, 2001, 81(3): 1031-1064. DOI:10.1152/physrev.2001.81.3.1031 |
| [18] |
KIMURA I, OZAWA K, INOUE D, et al. The gut microbiota suppresses insulin-mediated fat accumulation via the short-chain fatty acid receptor GPR43[J]. Nature Communications, 2013, 4: 1829. DOI:10.1038/ncomms2852 |
| [19] |
RIST V T S, WEISS E, EKLUND M, et al. Impact of dietary protein on microbiota composition and activity in the gastrointestinal tract of piglets in relation to gut health: a review[J]. Animal, 2013, 7(7): 1067-1078. DOI:10.1017/S1751731113000062 |
| [20] |
ZHOU L P, FANG L D, SUN Y, et al. Effects of the dietary protein level on the microbial composition and metabolomic profile in the hindgut of the pig[J]. Anaerobe, 2016, 38: 61-69. DOI:10.1016/j.anaerobe.2015.12.009 |
| [21] |
FAN P X, LIU P, SONG P X, et al. Moderate dietary protein restriction alters the composition of gut microbiota and improves ileal barrier function in adult pig model[J]. Scientific Reports, 2017, 7: 43412. DOI:10.1038/srep43412 |
| [22] |
张兴, 朱少中, 杨旗, 等. 构树发酵饲料对湘沙猪配套系商品猪生长性能、胴体品质和肌肉品质的影响[J]. 动物营养学报, 2019, 31(12): 5760-5771. ZHANG X, ZHU S Z, YANG Q, et al. Effects of Broussonetia papyrifera fermented diet on growth performance, carcass quality and meat quality of Xiangsha pigs commercial line of commercial pigs[J]. Chinese Journal of Animal Nutrition, 2019, 31(12): 5760-5771 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.12.042 |
| [23] |
宋博, 郑昌炳, 仲银召, 等. 低蛋白质饲粮中添加构树全株发酵饲料对育肥猪生长性能、胴体性状和肉品质的影响[J]. 动物营养学报, 2020, 32(10): 4841-4851. SONG B, ZHENG C B, ZHONG Y Z, et al. Effects of low-protein diet supplemented with fermented Broussonetia papyrifera on growth performance, carcass traits and meat quality of finishing pigs[J]. Chinese Journal of Animal Nutrition, 2020, 32(10): 4841-4851 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.10.035 |
| [24] |
郑昌炳, 宋博, 郑界, 等. 饲粮中添加β-羟基-β-甲基丁酸对巴马香猪生长性能和肝脏脂肪代谢的影响[J]. 动物营养学报, 2021, 33(6): 3176-3184. ZHENG C B, SONG B, ZHENG J, et al. Effects of dietary supplementation of beta-hydroxy-beta-methylbutyrate on growth performance and liver lipid metabolism of Bama Xiang pigs[J]. Chinese Journal of Animal Nutrition, 2021, 33(6): 3176-3184 (in Chinese). |
| [25] |
WANG M, YANG C, WANG Q Y, et al. The growth performance, intestinal digestive and absorptive capabilities in piglets with different lengths of small intestines[J]. Animal, 2020, 14(6): 1196-1203. DOI:10.1017/S175173111900288X |
| [26] |
KONG X F, JI Y J, LI H W, et al. Colonic luminal microbiota and bacterial metabolite composition in pregnant Huanjiang mini-pigs: effects of food composition at different times of pregnancy[J]. Scientific Reports, 2016, 6: 37224. DOI:10.1038/srep37224 |
| [27] |
LEE J M, CHOI S S, PARK M H, et al. Broussonetia papyrifera root bark extract exhibits anti-inflammatory effects on adipose tissue and improves insulin sensitivity potentially via AMPK activation[J]. Nutrients, 2020, 12(3): 773. DOI:10.3390/nu12030773 |
| [28] |
YIN J, LI Y Y, HAN H, et al. Melatonin reprogramming of gut microbiota improves lipid dysmetabolism in high-fat diet-fed mice[J]. Journal of Pineal Research, 2018, 65(4): e12524. DOI:10.1111/jpi.12524 |
| [29] |
张铮, 朱坤, 朱伟云, 等. 发酵饲料对生长育肥猪结肠微生物发酵及菌群组成的影响[J]. 微生物学报, 2019, 59(1): 93-102. ZHANG Z, ZHU K, ZHU W Y, et al. Effect of a fermented feed on colonic fermentation and microbial composition in finishing pig[J]. Acta Microbiologica Sinica, 2019, 59(1): 93-102 (in Chinese). |
| [30] |
GUO X, XIA X, TANG R, et al. Development of a real-time PCR method for Firmicutes and Bacteroidetes in faeces and its application to quantify intestinal population of obese and lean pigs[J]. Letters in Applied Microbiology, 2008, 47(5): 367-373. DOI:10.1111/j.1472-765X.2008.02408.x |
| [31] |
GUO X L, XIA X J, TANG R Y, et al. Real-time PCR quantification of the predominant bacterial divisions in the distal gut of Meishan and Landrace pigs[J]. Anaerobe, 2008, 14(4): 224-228. DOI:10.1016/j.anaerobe.2008.04.001 |
| [32] |
CANI P D. Human gut microbiome: hopes, threats and promises[J]. Gut, 2018, 67(9): 1716-1725. DOI:10.1136/gutjnl-2018-316723 |
| [33] |
LUBBS D C, VESTER B M, FASTINGER N D, et al. Dietary protein concentration affects intestinal microbiota of adult cats: a study using DGGE and qPCR to evaluate differences in microbial populations in the feline gastrointestinal tract[J]. Journal of Animal Physiology and Animal Nutrition, 2009, 93(1): 113-121. DOI:10.1111/j.1439-0396.2007.00788.x |
| [34] |
PARNELL J A, REIMER R A. Prebiotic fibres dose-dependently increase satiety hormones and alter Bacteroidetes and Firmicutes in lean and obese JCR: LA-cp rats[J]. British Journal of Nutrition, 2012, 107(4): 601-613. DOI:10.1017/S0007114511003163 |
| [35] |
MILLER T L. The pathway of formation of acetate and succinate from pyruvate by Bacteroides succinogenes[J]. Archives of Microbiology, 1978, 117(2): 145-152. DOI:10.1007/BF00402302 |
| [36] |
LOUIS P, FLINT H J. Formation of propionate and butyrate by the human colonic microbiota[J]. Environmental Microbiology, 2017, 19(1): 29-41. DOI:10.1111/1462-2920.13589 |
| [37] |
SALONEN A, LAHTI L, SALOJÄRVI J, et al. Impact of diet and individual variation on intestinal microbiota composition and fermentation products in obese men[J]. ISME Journal, 2014, 8(11): 2218-2230. DOI:10.1038/ismej.2014.63 |
| [38] |
NEISH A S. Microbes in gastrointestinal health and disease[J]. Gastroenterology, 2009, 136(1): 65-80. DOI:10.1053/j.gastro.2008.10.080 |
| [39] |
ITO T, MIYAMOTO H, KUMAGAI Y, et al. Thermophile-fermented compost extract as a possible feed additive to enhance fecundity in the laying hen and pig: modulation of gut metabolism[J]. Journal of Bioscience and Bioengineering, 2016, 121(6): 659-664. DOI:10.1016/j.jbiosc.2015.10.014 |
| [40] |
BLACHIER F, MARIOTTI F, HUNEAU J F, et al. Effects of amino acid-derived luminal metabolites on the colonic epithelium and physiopathological consequences[J]. Amino Acids, 2007, 33(4): 547-562. DOI:10.1007/s00726-006-0477-9 |
| [41] |
JENSEN M T, COX R P, JENSEN B B. Microbial production of skatole in the hind gut of pigs given different diets and its relation to skatole deposition in backfat[J]. Animal Science, 1995, 61(2): 293-304. DOI:10.1017/S1357729800013837 |
| [42] |
LUO Z, LI C B, CHENG Y F, et al. Effects of low dietary protein on the metabolites and microbial communities in the caecal digesta of piglets[J]. Archives of Animal Nutrition, 2015, 69(3): 212-226. DOI:10.1080/1745039X.2015.1034521 |
| [43] |
MU C L, YANG Y X, LUO Z, et al. The colonic microbiome and epithelial transcriptome are altered in rats fed a high-protein diet compared with a normal-protein diet[J]. The Journal of Nutrition, 2016, 146(3): 474-483. DOI:10.3945/jn.115.223990 |
| [44] |
YU M, ZHANG C J, YANG Y X, et al. Long-term effects of early antibiotic intervention on blood parameters, apparent nutrient digestibility, and fecal microbial fermentation profile in pigs with different dietary protein levels[J]. Journal of Animal Science and Biotechnology, 2017, 8: 60. DOI:10.1186/s40104-017-0192-2 |




