2. 吉林睿圣科技有限公司,松原 138000
2. Jilin Risen Technology Co., Ltd., Songyuan 138000, China
随着畜牧业生产的不断发展,改善动物健康、提高动物产品质量以及控制动物生产成本已成为企业追求养殖效益最大化的目标。发酵豆粕和鱼粉的营养价值不言而喻,但其成本昂贵导致许多企业望而却步。因此,许多企业开始关注一些价格低廉的饲用蛋白质产品,其中以酵母类产品为主,目前以酵母水解物应用较为广泛。酵母水解物主要是指以酿酒酵母为菌种,经液体发酵、自溶或外源酶催化水解后获得的浓缩或干燥类产品,酵母水解物因其较高的消化利用率在畜牧养殖中被广泛应用,但酵母水解物水解工艺成本较高,还需要进一步优化。而酵母蛋白饲料则以其独特的价格和生产优势越来越受到业界关注。酵母蛋白饲料主要由菌体蛋白及其酵母代谢产物组成,随着研究的不断深入,学者们观察到酵母蛋白饲料区别于鱼粉和血浆酵母蛋白的优势,主要有以下几个方面:1)含有丰富的B族维生素[1];2)酵母蛋白饲料中富含肌糖、谷氨酸酯以及水解蛋白质等容易消化吸收的成分,并且酵母在发酵过程中会产生许多消化酶类,从而提高动物对养分的消化吸收能力,改善动物生产性能[2];3)酵母细胞壁可作为一种免疫促进剂,激发和增强动物机体免疫力[3];4)酵母蛋白饲料不易受到沙门氏菌等有害菌的污染;5)开发成本低廉。因此,酵母蛋白饲料被视为一种理想的蛋白质资源,并具有替代如血浆蛋白粉、鱼粉和发酵豆粕等易消化原料的潜力。
邢新建等[4]研究表明,仔猪饲粮中添加酵母蛋白饲料替代血浆蛋白后,仔猪平均日增重(ADG)、平均日采食量(ADFI)以及料重比(F/G)均无显著差异,血清中的免疫球蛋白[免疫球蛋白A(IgA)、免疫球蛋白G(IgG)和免疫球蛋白M(IgM)]含量也无显著变化,但酵母蛋白能够改善断奶仔猪的腹泻率。该研究结果与王学兵等[5]、车炼强等[6]和石秋锋等[7]的研究结果相似。此外,孙亚楠等[8]和石学刚等[9]在肉鸡中的研究表明,在营养水平相当时,酵母蛋白完全替代鱼粉对肉鸡生长性能无负面影响。Moehn等[10]探究仔猪饲粮中添加3%、6%和9%的酵母蛋白饲料对仔猪生长性能和消化率的影响,结果表明,与含有乳清蛋白和酪蛋白的对照组相比,仔猪生长性能方面无显著差异,但是酵母蛋白线性提高了断奶仔猪对氨基酸的消化率。
产朊假丝酵母(又叫产朊圆酵母)能够以硝酸作为氮源,在培养基中不需要添加生长因子即可生长,并且可以利用糖蜜等产出人类可食用的蛋白质,因此是一种优质的酵母产品。然而,关于产朊假丝酵母作为蛋白质原料在断奶仔猪中的应用效果鲜见报道,且有必要开发一种新型廉价的蛋白质饲料产品来缓解国内工艺成本(酵母水解物)及蛋白质饲料成本(发酵豆粕与鱼粉)较高的问题。因此,本试验旨在探究2种由产朊假丝酵母发酵而成酵母蛋白原料替代酵母水解物、鱼粉(动物蛋白质)以及发酵豆粕(植物蛋白质)对断奶仔猪生长性能、血清免疫和抗氧化指标以及养分表观消化率的影响,并对产朊假丝酵母分别替代酵母水解物、鱼粉以及发酵豆粕的可能性进行分析。
1 材料与方法本试验在中国农业大学农业农村部饲料工业中心动物试验基地(河北省承德市丰宁县)进行,已获得中国农业大学伦理委员会的批准(No.AW10601202-1-2)。
1.1 试验样品本试验所用酵母蛋白Ⅰ和酵母蛋白Ⅱ由吉林某科技有限公司提供,该产品主要是由产朊假丝酵母发酵而成的优质蛋白质饲料,富含大量的酵母代谢产物,包括丰富的蛋白质、脂质、糖和各种维生素等,以及发酵过程中会产生酶、辅酶、核糖核酸、甾醇等和一些新陈代谢的中间产物;蛋白质原料发酵豆粕和酵母水解物由北京某农业科技有限公司提供。各蛋白质原料主要成分见表 1。
|
|
表 1 各蛋白质原料主要成分 Table 1 Main components of protein raw materials |
本试验选用96头28日龄初始体重为(7.90±1.65) kg的健康“杜×长×大”断奶仔猪,采用性别和体重完全随机区组的方式分为4个组,每组6个重复,每个重复4头猪(公母各占1/2)。对照组饲喂由含发酵豆粕、酵母水解物和鱼粉组成的基础饲粮,试验组分别饲喂用酵母蛋白Ⅰ替代基础饲粮中3%酵母水解物(试验Ⅰ组)、酵母蛋白Ⅰ替代基础饲粮中3%鱼粉(试验Ⅱ组)以及酵母蛋白Ⅱ替代基础饲粮中5%发酵豆粕(试验Ⅲ组)的饲粮。所有饲粮营养水平均满足NRC(2012)仔猪营养需求标准,试验期间以粉料形式进行投喂。饲粮组成及营养水平见表 2。试验期21 d。
|
|
表 2 饲粮组成及营养水平(风干基础) Table 2 Composition and nutrient levels of diets (air-dry basis) |
试验开始前对猪舍进行彻底消毒,并清洁料槽和饮水器。试验期间每天08:00和16:00各饲喂1次,仔猪自由采食和饮水。采用自动控制系统对猪舍中空气的温度、湿度、二氧化碳(CO2)和氨浓度进行调控。猪舍温度保持在24~28 ℃,相对湿度控制在65%~75%。试验期间按照正常仔猪管理方案对试验猪进行常规免疫和驱虫,随时观察并记录仔猪采食及健康状况。
1.4 样品采集 1.4.1 血清样品采集与处理在试验第21天早上,每个重复各选取1头接近平均体重的仔猪进行采血(前腔静脉10 mL)。静止3 h后,在4 ℃下以3 000×g离心10 min,收集血清并于-20 ℃保存待检。
1.4.2 粪便样品采集与处理试验第18天时,彻底清理仔猪粪便。从第19天到第21天,以每个重复为单位进行粪样的收集(1 kg),采集过程中应避免粪样被污染,早晚各1次,并置于-20 ℃保存待检。
1.5 指标检测及方法 1.5.1 生长性能分别在第1和21天对仔猪进行称重,每天记录采食量,并计算ADG、ADFI和F/G。
1.5.2 腹泻率试验期间每天09:00和17:00检查每圈仔猪肛门,观察并记录,于试验结束后统计各组仔猪腹泻头数并计算腹泻率,公式如下:
腹泻率(%)=100×腹泻仔猪总头数/(试验
仔猪总头数×试验期天数)。
1.5.3 血清免疫和抗氧化指标分析前,将血清置于4 ℃下解冻并混合均匀。血清中超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性、总抗氧化能力(T-AOC)以及丙二醛(MDA)含量严格按照商用试剂盒操作步骤进行。采用酶联免疫吸附试验(ELISA)法测定血清中IgA、IgG、IgM、白细胞介素-1β(IL-1β)、白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)、D-乳酸(DLA)含量以及二胺氧化酶(DAO)活性。试验所用商用试剂盒均购自南京建成生物工程研究所。试验仪器:生化分析仪(日立7160,日本),Multiskan Ascent酶标仪(Thermo,美国)。
1.5.4 原料营养成分含量粪便样品在4 ℃解冻后置于烘箱,并在65 ℃下干燥72 h。饲粮和粪便中的干物质(DM)、粗蛋白质(CP)、粗脂肪(EE)、粗灰分(Ash)以及铬含量的测定分别参照GB/T 6435—2006[11]、GB/T 6432—1994[12]、GB/T 6433—2006[13]、GB/T 6438—2007[14]以及GB/T 13088—2006[15]方法进行测定;采用纤维分析仪(ANKOM,NY,美国)按照Van Soest等[16]推荐的方法测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量。总能(GE)参照国际标准ISO 9831:1998使用氧弹式测热仪(6400型,Parr,美国)进行测定。有机物(OM)含量以及养分表观消化率计算公式如下:
OM(%)=100-Ash含量(%,干物质基础);
养分表观消化率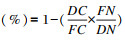
式中:DC为饲粮中的铬含量;FN为粪便中目标养分的含量;FC为粪便中的铬含量;DN为饲粮中目标养分的含量。
1.5.5 粪便短链脂肪酸含量将粪便于4 ℃下解冻并混合均匀,称取样品0.5 g左右于10 mL离心管中,加入8 mL超纯水,冰水浴超声振荡30 min(每超声10 min混匀1次),在4 ℃下12 000×g离心10 min,取上清液用超纯水稀释50倍,使用0.22 mm滤膜过滤后加入到进样小瓶,使用ICS-3000离子色谱仪分析(Dionex,美国)进行测定,多种有机酸经AS11分析柱(250 mm×4 mm)及AG11保护柱分离,流动相洗脱条件:氢氧化钾梯度,0~5 min,0.8~1.5 mmol/L;5~10 min,1.5~2.5 mmol/L;10~15 min,2.5 mmol/L,流速为1 mL/min。短链脂肪酸含量单位为mg/g粪便样品。
1.6 数据统计分析所有数据通过SAS 9.2中的GLM模型进行统计分析。饲粮为固定效应,试验猪为随机效应。以每个重复为单位分析仔猪生长性能和养分表观消化率数据,采用卡方检验统计仔猪腹泻率数据,以猪个体为单位分析血清免疫和抗氧化指标数据。采用t检验进行2组间比较,使用LSMEANS计算处理的平均值,试验结果以平均值和均值标准误(SEM)表示,以P≤0.05为差异显著,0.05 < P≤0.10为差异趋于显著。
2 结果 2.1 产朊假丝酵母对断奶仔猪生长性能和腹泻率的影响由表 3可知,与对照组相比,各试验组断奶仔猪ADG、ADFI和F/G均无显著差异(P>0.05);同样,各组断奶仔猪腹泻率之间也无显著差异(P>0.05)。
|
|
表 3 产朊假丝酵母对断奶仔猪生长性能和腹泻率的影响 Table 3 Effects of Candida utilis on growth performance and diarrhea rate of weaned piglets |
由表 4可知,与对照组相比,试验Ⅱ组断奶仔猪血清IL-10含量显著降低(P < 0.05),血清GSH-Px和SOD活性显著提高(P < 0.05);试验Ⅰ组、试验Ⅱ组和试验Ⅲ组血清TNF-α含量均显著提高(P < 0.05);各组其他血清免疫和抗氧化指标之间均无显著差异(P>0.05)。
|
|
表 4 产朊假丝酵母对断奶仔猪血清免疫和抗氧化指标的影响 Table 4 Effects of Candida utilis on serum immune and antioxidant indices of weaned piglets |
由表 5可知,与对照组相比,试验Ⅱ组断奶仔猪DM、OM、CP、EE和NDF表观消化率显著降低(P≤0.05);此外,试验Ⅰ组、试验Ⅱ组和试验Ⅲ组GE表观消化率均显著降低(P≤0.05)。
|
|
表 5 产朊假丝酵母对断奶仔猪养分表观消化率的影响 Table 5 Effects of Candida utilis on nutrient apparent digestibility of weaned piglets |
由表 6可知,与对照组相比,试验Ⅱ组断奶仔猪粪便中丁酸含量显著提高(P < 0.05),粪便中异丁酸和异戊酸含量显著降低(P < 0.05);此外,试验Ⅲ组断奶仔猪粪便中异丁酸含量显著降低(P < 0.05),粪便中丁酸和总挥发性脂肪酸含量显著提高(P < 0.05)。
|
|
表 6 产朊假丝酵母对断奶仔猪粪便挥发性脂肪酸含量的影响 Table 6 Effects of Candida utilis on volatile fatty acid contents in feces of weaned piglets |
由于国内饲料企业对进口优质蛋白质原料(豆粕、鱼粉)的过度依赖,这激发了学者们开发和研究一些国内生产并具有竞争力的蛋白质原料以降低饲料成本。断奶期是仔猪最为重要的阶段,因为它们很容易暴露于多重应激原下(环境应激、生理应激和饲粮应激等),而这些应激常会导致仔猪腹泻率提高,生长性能下降[17]。因此,近年来许多学者也在寻找一种合适的蛋白质原料产品,使其既能够替代国外进口蛋白质原料,又可以保证仔猪生长不受影响。其中,酶解大豆蛋白以及酵母蛋白产品因其在仔猪上良好的试验效果而备受企业青睐[18-20]。本试验研究结果表明,产朊假丝酵母产品在维持断奶仔猪ADG和F/G的同时,可以分别替代3%的酵母水解物或鱼粉以及5%的发酵豆粕,这与Hu等[21]在断奶仔猪上的研究结果(8%面包酵母替代)以及Øverland等[22]在大西洋鲑鱼中的研究结果(40%产朊假丝酵母替代)一致,即与对照组相比,酵母蛋白替代组未观察到ADG、ADFI和F/G的显著改变。然而,也有研究表明,酵母替代能够改善肉鸡生长性能[23],这可能与酵母蛋白产品中丰富的酵母代谢产物能提高动物对饲粮的适口性有关。此外,养分的消化吸收与断奶仔猪的生长性能也密切相关。本试验也进一步证实,酵母蛋白Ⅱ替代发酵豆粕组(试验Ⅲ组)在生长性能和养分表观消化率上与对照组相比基本无显著差异,这表明酵母蛋白Ⅱ大比例(5%)替代发酵豆粕(植物蛋白质)在仔猪生产应用上是可行的;而酵母蛋白Ⅰ替代鱼粉组(试验Ⅱ组)断奶仔猪对饲粮DM、OM、CP、EE和NDF的表观消化率显著低于对照组,这也解释了试验中试验Ⅱ组仔猪个别生产指标低于对照组的原因。但这与前人的研究结果不同,李莹[24]研究发现,发酵豆粕组仔猪对CP的消化率显著高于鱼粉组,且发酵豆粕+鱼粉组的CP消化率最低,而鱼粉组仔猪EE的消化率最高,发酵豆粕+鱼粉组的EE消化率最低。这表明不同蛋白质源会造成仔猪对不同养分消化能力的差异。研究表明,产朊假丝酵母富含丰富的酶类(蛋白酶、纤维素酶和植酸酶等),能够将淀粉和纤维素转化为小分子易消化和吸收的物质[25]。丁洪涛等[26]通过体外发酵技术探究产朊假丝酵母添加水平对奶牛养分消化率的影响,结果表明,产朊假丝酵母对NDF和ADF消化率无显著差异,但提高了DM消化率。庞德公[27]的体外发酵试验结果表明,在全混合日粮中添加4×109 CFU/g产朊假丝酵母能够提高ADF和NDF消化率。仇武松等[28]和Cruz等[29]研究结果也表明,添加产朊假丝酵母能够分别提高湖羊和仔猪对CP的消化率,这可能与产朊假丝酵母能够刺激蛋白质分解菌生长有关[30]。因此,本试验仔猪消化率结果与前人研究结果不一致的原因可能与发酵方式(体外发酵或体内发酵)、作用方式(添加剂方式或替代)、动物类型(单胃或反刍)以及添加水平相关,也有可能是由于酵母产品中所富含大量的微生物蛋白导致仔猪消化率降低(微生物蛋白中的蛋白质含量或氨基酸含量平衡性差于植物蛋白质和动物蛋白质),这有待进一步探究。此外,本试验也进一步证实了动物蛋白质(鱼粉)和植物蛋白质(发酵豆粕)对仔猪养分消化率的重要作用。
3.2 产朊假丝酵母对断奶仔猪血清免疫指标的影响仔猪由于自身免疫系统发育不成熟,且通过母体获得的有益免疫因子消失,饲粮中蛋白质的抗原刺激等易导致其产生免疫应激[31],引发免疫细胞合成的促炎性细胞因子(TNF-α和IL-1β等)水平上升,从而将用于维持生长的养分转变为维持免疫应答,影响仔猪的生长和健康[31]。IL-10是一种抗炎细胞因子,对机体免疫调控发挥至关重要的作用。本试验研究结果表明,与对照组相比,酵母蛋白Ⅰ替代鱼粉组(试验Ⅱ组)断奶仔猪血清TNF-α和IL-10含量显著降低,这也与李莹[24]的研究结果不尽相似,该研究发现发酵豆粕组仔猪血清促炎性因子IL-1β和TNF-α的含量显著高于鱼粉组,且发酵豆粕+鱼粉组仔猪的免疫性能最好。这表明不同的饲料蛋白质原料对断奶仔猪的免疫应答不同。目前尚不清楚产朊假丝酵母对仔猪血清的作用机制,这可能与产朊假丝酵母中某些蛋白质特异性的抗原刺激有关,也可能是由于微生物蛋白替代动物蛋白质导致所供应养分不足,从而无法维持相应的免疫应答程序,这有待进一步验证。
3.3 产朊假丝酵母对断奶仔猪血清抗氧化指标的影响仔猪断奶应激往往会引起氧自由基的过度产生,自身酶活系统无法中和过量的氧自由基,从而引发脂质过氧化,损害生物膜的结构与功能。SOD和GSH-Px可以中和氧自由基,保护细胞免受损害。本试验研究结果表明,酵母蛋白Ⅰ替代鱼粉组(试验Ⅱ组)断奶仔猪血清SOD和GSH-Px活性显著高于对照组,这可能与产朊假丝酵母富硒及其具有合成谷胱甘肽的能力有关[32]。Yang等[33]的研究结果表明,产朊假丝酵母能够改善仔猪血清SOD和过氧化氢酶活性以及T-AOC,并降低血清MDA含量。这与本试验研究结果一致,表明产朊假丝酵母能够改善抗氧化酶活性,提高仔猪抗氧化能力。然而,对于酵母蛋白Ⅰ替代酵母水解物组(试验Ⅰ组)和酵母蛋白Ⅱ替代发酵豆粕组(试验Ⅲ组)断奶仔猪抗氧化能力未改善的原因尚不明晰,有待进一步研究。
3.4 产朊假丝酵母对断奶仔猪粪便挥发性脂肪酸含量的影响短链脂肪酸主要由结肠微生物通过厌氧发酵不易消化的碳水化合物和蛋白质产生,短链脂肪酸的生成有利于抑制病原微生物的生长,对动物肠道健康发挥着至关重要的作用[34-35]。研究发现,乙酸含量的升高有利于抑制大肠杆菌的增殖[36],丁酸是结肠上皮细胞主要的供能物质[37],支链脂肪酸(异丁酸、异戊酸)能够反映蛋白质的发酵程度[38-39]。然而,前人关于酵母对猪后肠道中挥发性脂肪酸影响的报道却不尽相同,Lascano等[40]研究表明,在奶牛饲粮中添加酵母菌能够提高瘤胃总挥发性脂肪酸含量;Lila等[41]研究表明,酵母对体外发酵瘤胃总挥发性脂肪酸含量的影响不显著,但瘤胃中丙酸含量显著升高。这些差异可能与试验动物、酵母培养物类型及浓度有关。研究表明,随着产朊假丝酵母添加水平的提高,奶牛产气量逐渐增加,且产朊假丝酵母含量为3.3×107 CFU/mL时能够显著提高瘤胃总挥发性脂肪酸含量,这是产朊假丝酵母刺激瘤胃微生物的结果[29]。本试验中,与对照组相比,酵母蛋白Ⅰ替代鱼粉组(试验Ⅱ组)断奶仔猪粪便中丁酸含量显著提高,且酵母蛋白Ⅱ替代发酵豆粕组(试验Ⅲ组)粪便中丁酸和总挥发性脂肪酸含量显著提高,这表明产朊假丝酵母能够刺激后肠道微生物(如产丁酸菌)提高细菌代谢产物含量。
4 结论本试验用由产朊假丝酵母发酵而成的酵母蛋白Ⅰ替代3%酵母水解物或3%鱼粉,以及用酵母蛋白Ⅱ替代5%发酵豆粕,对断奶仔猪生长性能和腹泻率无负面影响;其中,酵母蛋白Ⅰ替代3%鱼粉可显著提高断奶仔猪血清抗氧化能力,酵母蛋白Ⅰ替代3%鱼粉和酵母蛋白Ⅱ替代5%发酵豆粕可显著提高断奶仔猪粪便中丁酸含量。这表明产朊假丝酵母具备开发成为非常规蛋白质饲料原料的潜力。
| [1] |
谢建坤, 张弢, 李忠娴. 酵母饲料的开发势在必行[J]. 江西农业科技, 1993(1): 33-34. XIE J K, ZHANG T, LI Z X. The development of yeast feed is imperative[J]. Jiangxi Agricultural Science & Technology, 1993(1): 33-34 (in Chinese). |
| [2] |
黄瑞华. 寡糖、大蒜素与酵母提取物对猪生长与健康的影响[D]. 博士学位论文. 南京: 南京农业大学, 2009. HUANG R H. Effects of oligosaccharides, allicin and yeast extract on growth and health of pigs[D]. Ph. D. Thesis. Nanjing: Nanjing Agricultural University, 2009. (in Chinese) |
| [3] |
SHEN Y B, PIAO X S, KIM S W, et al. Effects of yeast culture supplementation on growth performance, intestinal health, and immune response of nursery pigs[J]. Journal of Animal Science, 2009, 87(8): 2614-2624. DOI:10.2527/jas.2008-1512 |
| [4] |
邢新建, 王永杰, 孙丽红, 等. 酵母蛋白粉与血浆蛋白粉在乳仔猪日粮中应用效果的研究[J]. 中国畜牧杂志, 2012, 48(17): 45-47. XING X J, WANG Y J, SUN L H, et al. Study on the effect of yeast protein powder and plasma protein powder in the diet of suckling piglets[J]. Chinese Journal of Animal Science, 2012, 48(17): 45-47 (in Chinese). DOI:10.3969/j.issn.0258-7033.2012.17.012 |
| [5] |
王学兵, 崔保安, 魏战勇, 等. 酵母蛋白替代进口鱼粉对断奶仔猪生产性能的影响[J]. 中国农学通报, 2008, 24(9): 18-21. WANG X B, CUI B A, WEI Z Y, et al. Yeast protein to replace imported fish meal weaned piglets performance of the test report[J]. Chinese Agricultural Science Bulletin, 2008, 24(9): 18-21 (in Chinese). |
| [6] |
车炼强, 苏国旗, 胡亮, 等. 酵母抽提物替代血浆蛋白粉对断奶仔猪生产性能的影响[J]. 饲料工业, 2012, 33(14): 7-10. CHE L Q, SU G Q, HU L, et al. Effect of replacing spray dried plasma protein with yeast extract on growth performance of weaned piglets[J]. Feed Industry, 2012, 33(14): 7-10 (in Chinese). DOI:10.3969/j.issn.1001-991X.2012.14.002 |
| [7] |
石秋锋, 桑静超, 辛小召, 等. 不同蛋白质源组合饲粮对断奶仔猪生长性能和血清生化指标的影响[J]. 动物营养学报, 2013, 25(6): 1199-1206. SHI Q F, SANG J C, XIN X Z, et al. Effects of diets with different protein source combinations on growth performance and serum biochemical indices of weaner piglets[J]. Chinese Journal of Animal Nutrition, 2013, 25(6): 1199-1206 (in Chinese). DOI:10.3969/j.issn.1006-267x.2013.06.011 |
| [8] |
石学刚, 郭福存, 李发弟. 酵母蛋白替代鱼粉对肉仔鸡饲喂效果的研究[J]. 甘肃农业大学学报, 2010, 45(4): 33-37. SHI X G, GUO F C, LI F D. Feeding effect of yeast protein instead of fish meal in broilers[J]. Journal of Gansu Agricultural University, 2010, 45(4): 33-37 (in Chinese). DOI:10.3969/j.issn.1003-4315.2010.04.007 |
| [9] |
孙亚楠, 李维, 周岩民, 等. 酵母蛋白粉替代肉鸡日粮中鱼粉的效果研究[J]. 畜牧与兽医, 2008, 40(12): 40-44. SUN Y N, LI W, ZHOU Y M, et al. Investigation on replacement of fish meal with yeast protein meal in the diet of broilers[J]. Animal Husbandry & Veterinary Medicine, 2008, 40(12): 40-44 (in Chinese). |
| [10] |
MOEHN S, GROENEWEGEN P, BALL R O. Amino acid digestibility of a yeast-derived protein source and gut endogenous losses in newly weaned pigs[J]. Livestock Science, 2010, 134(1/3): 221-224. |
| [11] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中水分和其他挥发性物质含量的测定: GB/T 6435—2006[S]. 北京: 中国标准出版社, 2006. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. Determination of moisture and other volatile mater content in feeds: GB/T 6435—2006[S]. Beijing: Standards Press of China, 2006. (in Chinese) |
| [12] |
国家技术监督局. 饲料中粗蛋白测定方法: GB/T 6432—1994[S]. 北京: 中国标准出版社, 1994. The State Bureau of Quality and Technical Supervision. Method for the determination of crude protein in feedstuffs: GB/T 6432—1994[S]. Beijing: Standards Press of China, 1994. (in Chinese) |
| [13] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中粗脂肪的测定: GB/T 6433—2006[S]. 北京: 中国标准出版社, 2006. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. Determinaiion of crude fat in feeds: GB/T 6433—2006[S]. Beijing: Standards Press of China, 2006. (in Chinese) |
| [14] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中粗灰分的测定: GB/T 6438—2007[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. Animal feeding stuffs-determination of crude ash: GB/T 6438—2007[S]. Beijing: Standards Press of China, 2007. (in Chinese) |
| [15] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中铬的测定方法: GB/T 13088—2006[S]. 北京: 中国标准出版社, 2006. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. Determination of chromium in feeds: GB/T 13088—2006[S]. Beijing: Standards Press of China, 2006. (in Chinese) |
| [16] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [17] |
UPADHAYA S D, KIM I H. The impact of weaning stress on gut health and the mechanistic aspects of several feed additives contributing to improved gut health function in weanling piglets-a review[J]. Animals, 2021, 11(8): 2418. DOI:10.3390/ani11082418 |
| [18] |
马晓康. 酶解大豆蛋白(HP300) 猪有效能和回肠末端氨基酸消化率及其在仔猪上的高效应用研究[D]. 博士学位论文. 北京: 中国农业大学, 2019. MA X K. Available energy, SID of amino acids and efficient application of enzyme-treated soybean meal (HP300) to piglets[D]. Ph. D. Thesis. Beijing: China Agricultural University, 2019. (in Chinese) |
| [19] |
LONG S F, MA J Y, PIAO X S, et al. Enzyme-treated soybean meal enhanced performance via improving immune response, intestinal morphology and barrier function of nursery pigs in antibiotic free diets[J]. Animals, 2021, 11(9): 2600. DOI:10.3390/ani11092600 |
| [20] |
王瑶. 丝兰提取物和产朊假丝酵母对断奶仔猪生长性能与肠道健康的影响研究[D]. 硕士学位论文. 重庆: 西南大学, 2018. WANG Y. Study on the effect of Yucca shidigero extract and Candida utilis on growth performance and intestinal health in weaned piglets[D]. Master's Thesis. Chongqing: Southwest University, 2018. (in Chinese) |
| [21] |
HU L, CHE L, SU G, et al. Inclusion of yeast-derived protein in weanling diet improves growth performance, intestinal health, and anti-oxidative capability of piglets[J]. Czech Journal of Animal Science, 2014, 59(7): 327-336. DOI:10.17221/7531-CJAS |
| [22] |
ØVERLAND M, KARLSSON A, MYDLAND L T, et al. Evaluation of Candida utilis, Kluyveromyces marxianus and Saccharomyces cerevisiae yeasts as protein sources in diets for Atlantic salmon (Salmo salar)[J]. Aquaculture, 2013, 402/403: 1-7. DOI:10.1016/j.aquaculture.2013.03.016 |
| [23] |
LEZCANO P, HERRERA M, RODRIGUEZ B, et al. Evaluation of torula yeast (Candida utilis) grown on distillery vinasse for broilers[J]. Cuban Journal of Agricultural Science, 2013, 47: 183-188. |
| [24] |
李莹. 不同来源蛋白质饲料品质评价及其对断奶仔猪肠道菌群结构的影响[D]. 硕士学位论文. 北京: 中国农业科学院, 2020. LI Y. Evaluation of protein feed quality from different sources and its effects on intestinal microflora structure of weaned piglets[D]. Master's Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2020. (in Chinese) |
| [25] |
郭照宙, 许灵敏, 宋建楼, 等. 产朊假丝酵母功能的探究及应用[J]. 饲料博览, 2016(3): 33-35, 39. GUO Z Z, XU L M, SONG J L, et al. Functional exploration and application of Candida utilis[J]. Feed Review, 2016(3): 33-35, 39 (in Chinese). DOI:10.3969/j.issn.1001-0084.2016.03.010 |
| [26] |
丁洪涛, 刘星, 夏冬华, 等. 产朊假丝酵母对奶牛体外瘤胃发酵参数及日粮营养物质消化率的影响[J]. 中国畜牧杂志, 2012, 48(9): 56-59. DING H T, LIU X, XIA D H, et al. Effects of Candida utilis on in vitro rumen fermentation parameters and dietary nutrient digestibility of dairy cows[J]. Chinese Journal of Animal Science, 2012, 48(9): 56-59 (in Chinese). DOI:10.3969/j.issn.0258-7033.2012.09.014 |
| [27] |
庞德公. 枯草芽孢杆菌、产朊假丝酵母与屎肠球菌对奶牛瘤胃微生物消化代谢和甲烷排放的影响[D]. 硕士学位论文. 乌鲁木齐: 新疆农业大学, 2014. PANG D G. Effects of Bacillus subtilis, Candida utilis and Enterococcus faecium on in vitro rumen microbial digestion and metabolism and methane emission of dairy cows[D]. Master's Thesis. Urumqi: Xinjiang Agricultural University, 2014. (in Chinese) |
| [28] |
仇武松, 王彦芦, 张振威, 等. 日粮添加产朊假丝酵母与枯草芽孢杆菌对湖羊生长性能及养分消化率的影响[J]. 中国畜牧杂志, 2017, 53(2): 106-109. CHOU W S, WANG Y L, ZHANG Z W, et al. Effects of dietary Candida utilis and Bacillus subtilis addition on growth performance and nutrient digestibility of Hu sheep[J]. Chinese Journal of Animal Science, 2017, 53(2): 106-109 (in Chinese). |
| [29] |
CRUZ A, HÅKENÅSEN I M, SKUGOR A, et al. Candida utilis yeast as a protein source for weaned piglets: effects on growth performance and digestive function[J]. Livestock Science, 2019, 226: 31-39. DOI:10.1016/j.livsci.2019.06.003 |
| [30] |
YOON I K, STERN M D. Effects of Saccharomyces cerevisiae and Aspergillus oryzae cultures on ruminal fermentation in dairy cows[J]. Journal of Dairy Science, 1996, 79(3): 411-417. DOI:10.3168/jds.S0022-0302(96)76380-4 |
| [31] |
KICK A R, TOMPKINS M B, FLOWERS W L, et al. Effects of stress associated with weaning on the adaptive immune system in pigs[J]. Journal of Animal Science, 2012, 90(2): 649-656. DOI:10.2527/jas.2010-3470 |
| [32] |
项驷文, 郑蕾, 朱龙宝, 等. 产朊假丝酵母富硒及产谷胱甘肽的培养工艺[J]. 食品工业科技, 2017, 38(1): 165-168, 174. XIANG S W, ZHENG L, ZHU L B, et al. Fermentation process of Candida utilis for selenium-enriched and production of glutathione[J]. Science and Technology of Food Industry, 2017, 38(1): 165-168, 174 (in Chinese). |
| [33] |
YANG Z G, WANG Y, HE T L, et al. Effects of dietary Yucca schidigera extract and oral Candida utilis on growth performance and intestinal health of weaned piglets[J]. Frontiers in Nutrition, 2021, 8: 685540. DOI:10.3389/fnut.2021.685540 |
| [34] |
DEN BESTEN G, VAN EUNEN K, GROEN A K, et al. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism[J]. Journal of Lipid Research, 2013, 54(9): 2325-2340. DOI:10.1194/jlr.R036012 |
| [35] |
TAN J, MCKENZIE C, POTAMITIS M, et al. The role of short-chain fatty acids in health and disease[J]. Advances in Immunology, 2014, 121: 91-119. |
| [36] |
WELLS J E, YEN J T, MILLER D N. Impact of dried skim milk in production diets on Lactobacillus and pathogenic bacterial shedding in growing-finishing swine[J]. Journal of Applied Microbiology, 2005, 99(2): 400-407. DOI:10.1111/j.1365-2672.2005.02629.x |
| [37] |
TREMAROLI V, BÄCKHED F. Functional interactions between the gut microbiota and host metabolism[J]. Nature, 2012, 489(7415): 242-249. DOI:10.1038/nature11552 |
| [38] |
NORDGAARD I, MORTENSEN P B, LANGKILDE A M. Small intestinal malabsorption and colonic fermentation of resistant starch and resistant peptides to short-chain fatty acids[J]. Nutrition, 1995, 11(2): 129-137. |
| [39] |
RASMUSSEN H S, HOLTUG K, MORTENSEN P B. Degradation of amino acids to short-chain fatty acids in humans.An in vitro study[J]. Scandinavian Journal of Gastroenterology, 1988, 23(2): 178-182. DOI:10.3109/00365528809103964 |
| [40] |
LASCANO G J, HEINRICHS A J. Rumen fermentation pattern of dairy heifers fed restricted amounts of low, medium, and high concentrate diets without and with yeast culture[J]. Livestock Science, 2009, 124(1/3): 48-57. |
| [41] |
LILA Z A, MOHAMMED N, YASUI T, et al. Effects of a twin strain of Saccharomyces cerevisiae live cells on mixed ruminal microorganism fermentation in vitro[J]. Journal of Animal Science, 2004, 82(6): 1847-1854. DOI:10.2527/2004.8261847x |




