2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
妊娠期和泌乳期母猪的饲养管理水平直接决定了种猪场的生产水平和经济效益。妊娠和泌乳是2个极其复杂的生理过程,在上述过程中机体营养代谢会发生显著变化,而肠道微生物对宿主的营养代谢发挥着重要作用[1]。因此,了解不同妊娠和泌乳期母猪肠道菌群结构组成和多样性的变化规律,对提高母猪机体健康和繁殖性能具有重要意义。妊娠过程中动物肠道菌群组成会发生显著变化,这有助于宿主妊娠期间的营养代谢调节和免疫适应[2]。Wu等[3]研究发现,宿主的饮食组成会影响其肠道菌群的结构组成,其中富含蛋白质和动物脂肪的饮食可显著增加肠道拟杆菌属相对丰度,而富含碳水化合物的饮食可显著增加肠道普氏菌属相对丰度。Koren等[4]和Cheng等[5]均报道,妊娠期肠道菌群的改变与母体妊娠引起的代谢变化密切相关,这对预测孕妇早产及其机体健康具有重要意义。笔者前期研究也发现,长白猪的妊娠进程与脂质代谢和肠道菌群变化有关,尤其是与普式菌属、琥珀弧菌属、拟杆菌属等碳水化合物降解菌密切相关[6]。由此可见,肠道菌群可能是改善母体代谢与机体健康的重要调控靶点。而巴马香猪作为我国优良地方小型猪品种之一,其基因纯合、耐粗饲、肉质优良。但目前巴马香猪的饲养管理较为粗放,多饲喂营养价值低且不易被消化的青粗饲料,导致母猪繁殖性能低下,继而影响养殖场的生产效率[7]。了解妊娠-泌乳期巴马香猪肠道菌群的结构组成变化,能为提高其繁殖性能提供依据。因此,本试验研究了不同妊娠-泌乳期巴马香猪肠道菌群结构组成与多样性的变化规律,对提高母猪的机体健康水平、繁殖性能及子代生长发育具有重要现实意义。
1 材料与方法 1.1 试验设计与饲养管理动物饲养试验于2018年8月至2019年2月在湖南省常德市石门县汉唐农业有限公司香猪养殖基地开展。试验选取3~7胎次刚配种的巴马香猪20头(其中多为3~5胎次,仅有4头母猪为6~7胎次),单栏饲养,分娩前1周转至产房。母猪配种后至妊娠第105天饲喂妊娠母猪饲粮,妊娠第105天至断奶后第21天饲喂泌乳母猪饲粮。试验期间不使用抗生素或益生菌,每天08:00和17:00饲喂,自由饮水。参照我国《猪饲养标准》(NY/T 65—2004)和NRC(2012)母猪营养需要量,基础饲粮组成及其营养水平见表 1。试验期为母猪配种后第3天至分娩后第21天。试验期间,有4头母猪返情(为6~7胎次母猪),16头母猪正常妊娠和分娩。其他饲养管理均按商业养猪场规范操作。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
分别于母猪妊娠第30、60和90天以及泌乳第14天(由于分娩栏舍的限制仅收集到了其中7头母猪粪便样品),每天09:00—11:00采集母猪新鲜粪便,置于10 mL无菌离心管中,-20 ℃保存。将粪便样品解冻后均匀混合,取0.2 g左右样品,利用快速DNA旋转提取试剂盒(MP Biomedicals公司,美国)抽提总DNA,利用NanoDrop 1000分光光度计(Thermo Fisher Scientific公司,美国)检测DNA的浓度和纯度;利用338F(5’-GCACCTAAYT GGGYDTAAAGNG-3’)和806R(5’-TACNVGGGTATCTAATCC-3’)引物对V3~V4可变区进行PCR扩增,扩增程序为:98 ℃预变性2 min,25个循环(98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸5 min。扩增体系为25 μL:包括5 μL 5×缓冲液,5 μL 5×High-Fidelity GC缓冲液,2 μL dNTPs(2.5 mmol/L),1 μL上、下游引物(10 μmol/L),0.25 μL High-Fidelity DNA聚合酶(5 U/μL);2 μL DNA模板,8.75 μL ddH2O。PCR扩增产物用Agencourt AMPure Beads(Beckman Coulter公司,美国)纯化和PicoGreen dsDNA试剂盒(Invitrogen公司,美国)定量,PCR扩增结果利用1.2%琼脂糖凝胶电泳检验,于Illumina MiSeq平台进行双端测序(2×300 bp,上海派森诺生物科技有限公司)。
1.3 生物信息学与差异显著性分析对测序得到的PE reads进行去引物、质量过滤和拼接。利用QIIME软件调用UCLUS序列比对工具对质控后得到的有效序列在97%序列相似度下聚类,得到可操作分类单元(operational taxonomic unit,OTU)代表序列,并将其与GreenGene数据库(http://greengenes.lbl.gov/cgi-bin/nph-index.cgi)[8]的模板序列进行比对,获取每个OTU对应的分类学信息。基于获得的OTU信息,调用QIIME软件alpha_diversity.py命令分析样品的ACE、Chao1、Shannon和Simpson指数等Alpha多样性指数;在门和属水平上聚类分析样品的物种组成和相对丰度。利用PICRUSt软件对粪便菌群进行功能预测,通过KEGG Pathway分析菌群丰度,筛选代谢功能具有显著差异的粪便菌群。
试验数据用Excel 2010初步整理后,肠道菌群相对丰度变化利用Metastats软件(http://metastats.cbcb.umd.edu/)分析,利用R软件ggplot2程序以及GraphPad Prism V.7.0软件绘图。P < 0.05表示差异显著。
2 结果 2.1 母猪粪便菌群多样性的变化高通量测序下机序列经质量控制筛选后,55个粪便菌群样品测序共产生2 247 367条高质量序列,平均每个样本40 861条。基于97%相似性水平对非重复序列进行OTU聚类,共获得77 356个OTU,平均每个样本获得1 406个OTU。
由表 2可见,与妊娠第30天相比,妊娠第60天母猪粪便菌群Simpson和Shannon指数显著降低(P < 0.05);与妊娠第90天相比,泌乳第14天母猪粪便菌群Chao1和ACE指数显著降低(P < 0.05)。
|
|
表 2 妊娠-泌乳期母猪粪便菌群的Alpha多样性 Table 2 Alpha diversity of fecal microbiota of sows during pregnancy and lactation stage |
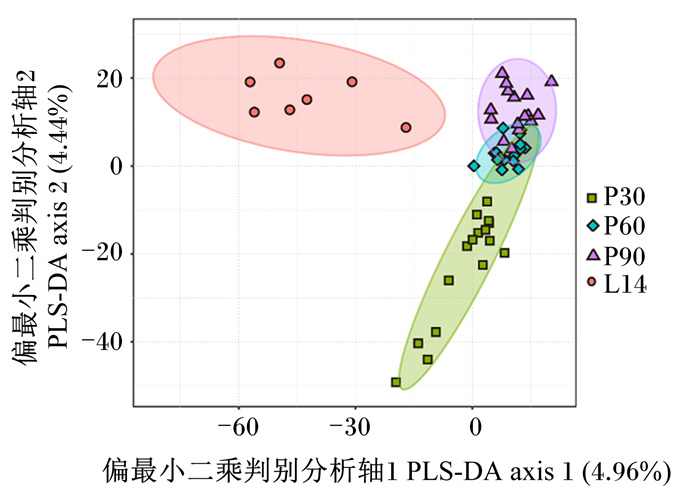
由图 1可见,基于偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)的分析结果表明,妊娠第30、60、90天与泌乳第14天之间粪便菌群结构均有明显区分并趋向聚成2个类群,说明妊娠期与泌乳期母猪粪便菌群结构组成明显差异。
|
P30、P60、P90、L14分别表示妊娠第30、60和90天以及泌乳第14天。下图同。 P30, P60, P90 and L14 represent days 30, 60, and 90 of pregnancy and day 14 of lactation, respectively. The same as below. 图 1 妊娠-泌乳期母猪粪便菌群的Beta多样性 Fig. 1 Beta diversity of fecal microbiota of sows during pregnancy and lactation stage |
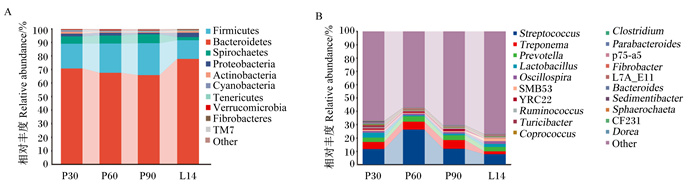
由图 2可见,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、螺旋体门(Spirochaetes)和变形菌门(Proteobacteria)为母猪粪便菌群的主要优势菌门(图 2-A);链球菌属(Streptococcus)、密螺旋体属(Treponema)、普式菌属(Prevotella)、乳酸菌属(Lactobacillus)为母猪粪便菌群的主要优势菌属(图 2-B)。
|
Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Spirochaetes:螺旋体门;Proteobacteria:变形菌门;Actinobacteria:放线菌门;Cyanobacteria:蓝藻菌门;Tenericutes:柔膜菌门;Verrucomicrobia:疣微菌门;Fibrobacteres:纤维杆菌门;Streptococcus:链球菌属;Treponema:密螺旋体属;Prevotella:普式菌属;Lactobacillus:乳酸菌属;Oscillospira:颤螺菌属;Ruminococcus:瘤胃球菌属;Turicibacter:苏黎世杆菌属;Coprococcus:粪球菌属;Clostridium:梭杆菌属;Parabacteroides:副杆菌属;Fibrobacter:纤维杆菌属;Bacteroides:拟杆菌属;Dorea:多尔氏菌属;Other:其他。 图 2 妊娠-泌乳期母猪粪便菌群门(A)和属(B)水平的组成 Fig. 2 Composition at phylum (A) and genus (B) levels of fecal microbiota of sows during pregnancy and lactation stage |
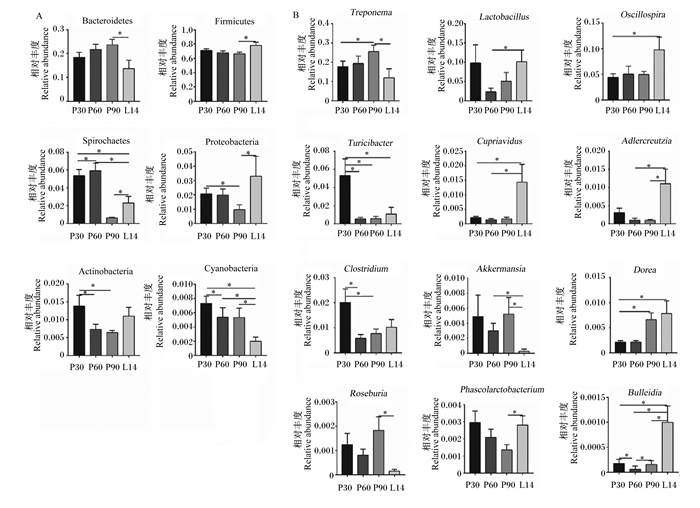
由图 3-A可见,与妊娠第30和60天相比,泌乳第14天粪便菌群螺旋体门相对丰度显著降低(P < 0.05)。与妊娠第90天相比,泌乳第14天粪便菌群厚壁菌门、螺旋体门和变形菌门相对丰度显著增加(P < 0.05),拟杆菌门相对丰度显著降低(P < 0.05)。与妊娠第30、60和90天相比,泌乳第14天粪便菌群蓝藻菌门(Cyanobacteria)相对丰度显著降低(P < 0.05)。
|
Bacteroidetes:拟杆菌门;Firmicutes:厚壁菌门;Spirochaetes:螺旋体门;Proteobacteria:变形菌门;Actinobacteria:放线菌门;Cyanobacteria:蓝藻菌门;Treponema:密螺旋体属;Lactobacillus:乳酸菌属;Oscillospira:颤螺菌属;Turicibacter:苏黎世杆菌属;Cupriavidus:贪铜菌属;Adlercreutzia:阿德勒克鲁特菌属;Clostridium:梭杆属;Akkermansia:阿克曼菌属;Dorea:多尔氏菌属;Roseburia:罗斯氏菌属;Phascolarctobacterium:考拉杆菌属;Bulleidia:布雷德菌属。 图 3 妊娠-泌乳期母猪粪便差异菌群的相对丰度 Fig. 3 Relative abundance of fecal differential microbiota of sows during pregnancy and lactation stage |
由图 3-B可见,与妊娠第30天相比,妊娠第60和90天粪便菌群梭杆菌属(Clostridium)相对丰度显著降低(P < 0.05),妊娠第60和90天以及泌乳第14天粪便菌群苏黎世杆菌属(Turicibacter)相对丰度显著降低(P < 0.05),泌乳第14天颤螺菌属(Oscillospira)和多尔氏菌属(Dorea)相对丰度显著增(P < 0.05)。与妊娠第60天相比,泌乳第14天粪便菌群乳酸菌属相对丰度显著增加(P < 0.05)。与妊娠第90天相比,泌乳第14天粪便菌群考拉杆菌属(Phascolarctobacterium)相对丰度显著增加(P < 0.05),密螺旋体属和罗斯氏菌属(Roseburia)相对丰度显著降低(P < 0.05)。与妊娠第30和60天相比,泌乳第14天粪便菌群贪铜菌属(Cupriavidus)相对丰度显著增加(P < 0.05)。与妊娠第60和90天相比,泌乳第14天粪便菌群阿克曼菌属(Akkermansia)相对丰度显著降低(P < 0.05)。与妊娠第30、60和60天相比,泌乳第14天粪便菌群布雷德菌属(Bulleidia)相对丰度显著增加(P < 0.05)。
2.4 母猪粪便菌群代谢功能的变化如表 3所示,与妊娠第30天相比,妊娠60第天粪便菌群碳水化合物代谢通路、聚糖生物合成与代谢通路相对丰度显著增加(P < 0.05)。与妊娠第60天相比,泌乳第14天粪便菌群碳水化合物代谢通路、聚糖生物合成和代谢通路、核苷酸代谢通路相对丰度显著降低(P < 0.05)。与妊娠第30和60天相比,泌乳第14天粪便菌群脂代谢通路相对丰度显著增加(P < 0.05),其他氨基酸代谢通路相对丰度显著降低(P < 0.05)。与妊娠第90天相比,泌乳第14天粪便菌群氨基酸代谢通路相对丰度显著降低(P < 0.05)。
|
|
表 3 妊娠-泌乳期母猪粪便菌群的代谢功能 Table 3 Metabolism function of fecal microbiota of sow during pregnancy and lactation stage |
肠道菌群结构组成受宿主遗传背景、生理状态、年龄、饮食、饲养环境[9]等因素的影响[4]。为了满足母体自身及胎儿生长发育的营养需要,妊娠期间宿主的激素分泌、营养代谢、免疫功能和肠道菌群均会发生变化[10]。有研究表明,较低的肠道菌群丰富度与机体胰岛素抵抗、炎症反应之间存在相关性[11];肥胖孕妇的肠道菌群丰富度降低,其肠道通透性增加[12]。本研究发现,与妊娠后期相比,泌乳期母猪粪便菌群丰富度降低,提示泌乳期母猪可能存在轻度的机体炎症反应。
厚壁菌门和拟杆菌门是妊娠-泌乳期母猪肠道中最丰富的菌门。在本研究中,妊娠期巴马香猪粪便菌群优势菌属为链球菌属、密螺旋体属、普氏菌属和乳酸菌属。另有研究表明,妊娠期环江香猪粪便菌群优势菌属为乳酸菌属、密螺旋体属、瘤胃球菌属和梭杆菌属[13],妊娠长白猪粪便菌群优势菌属为密螺旋体属、梭杆菌属、瘤胃球菌属和普氏菌属[14]。这说明遗传背景是影响母猪肠道菌群组成的重要因素。近期研究表明,富集的变形菌门是肠道菌群失调和肠上皮功能障碍的潜在指示菌群[15]。螺旋体门相对丰度的减少可以缓解妊娠小型猪的便秘[16]。在本研究中,与妊娠第90天相比,泌乳第14天粪便菌群厚壁菌门、螺旋体门和变形菌门相对丰度显著增加,提示泌乳中期变形菌门富集会导致肠道黏膜的低度炎症,这种炎症可能促使菌群失调进入一个正反馈反应,有益于宿主机体健康[4]。早期研究表明,肥胖与厚壁菌门相对丰度的增加有关[17],拟杆菌门因含有大量碳水化合物活性酶,可降解碳水化合物和蛋白质等大分子有机化合物[18]。厚壁菌门相对丰度增加被认为是增强宿主从饮食中获取能量的一种手段[19],这有利于母体为其泌乳做好能量储备。Jumpertz等[20]研究表明,厚壁菌门相对丰度的增加和拟杆菌门相对丰度的减少与能量增加有关。本研究发现,与妊娠期相比,泌乳期巴马香猪粪便菌群厚壁菌门相对丰度增加,拟杆菌门相对丰度降低,与妊娠长白猪上的研究结果[5]不同,该差异可能与试验猪的遗传背景不同有关。与妊娠第60天相比,泌乳第14天母猪粪便菌群乳酸菌属和阿克曼菌属相对丰度显著增加。乳酸菌属可促进宿主脂质代谢[21];阿克曼菌属与改善机体代谢有关,阿克曼菌属相对丰度低的宿主易患肥胖和发生炎症[22]。上述研究表明,泌乳期母猪肠道菌群的变化有利于其泌乳过程。由此可知,不同妊娠-泌乳期母猪的肠道菌群组成不同,可能与其不同生理状态下的代谢差异有关。
肠道菌群的代谢产物可调控宿主的生长发育。其中,多胺可参与调节胎盘和胎儿生长发育、血管生成以及DNA和蛋白质的合成[23]。本研究PICRUSt预测分析发现,与妊娠第30天相比,妊娠第60天母猪粪便菌群聚糖生物合成和代谢通路、碳水化合物代谢通路相对丰度显著增加,表明不同生理状态下宿主肠道菌群有利于满足其营养需要。另外,与妊娠第30和60天相比,泌乳第14天粪便菌群脂代谢通路相对丰度显著增加,可能是因为泌乳期母猪饲粮粗蛋白质水平(16.30%)高于妊娠母猪饲粮粗蛋白质水平(12.82%)。有研究发现,膳食脂类可在肠腔中被水解,进而通过蛋白质介导的转运机制被宿主肠上皮细胞吸收利用[24]。阿克曼菌属(为产丁酸菌)具有缓解机体炎症和改善肠道功能的作用[25]。多数来源于细菌的氨基酸均可参与机体免疫功能的调控[26]。本研究发现,与妊娠第30天相比,妊娠90第天母猪粪便菌群的氨基酸代谢通路相对丰度显著增加,提示妊娠后期母猪肠道菌群的变化可能有利于其机体健康的维持,防止机体炎症的发生。
4 结论不同妊娠-泌乳期巴马香猪粪便菌群结构组成发生不同变化,妊娠中期母猪粪便拟杆菌门和密螺旋体属相对丰度较高,菌群碳水化合物和核苷酸代谢通路上调,以满足妊娠母猪自身营养需要和胎儿生长发育需要。
| [1] |
MULLIGAN C, FRIEDMAN J. Maternal modifiers of the infant gut microbiota: metabolic consequences[J]. Journal of Endocrinology, 2017, 235(1): R1-R12. DOI:10.1530/JOE-17-0303 |
| [2] |
COLLADO M C, ISOLAURI E, LAITINEN K, et al. Distinct composition of gut microbiota during pregnancy in overweight and normal-weight women[J]. American Journal of Clinical Nutrition, 2008, 88(4): 894-899. DOI:10.1093/ajcn/88.4.894 |
| [3] |
WU G D, CHEN J, HOFFMANN C, et al. Linking long-term dietary patterns with gut microbial enterotypes[J]. Science, 2011, 334(6052): 105-108. DOI:10.1126/science.1208344 |
| [4] |
KOREN O, GOODRICH J K, CULLENDER T C, et al. Host remodeling of the gut microbiome and metabolic changes during pregnancy[J]. Cell, 2012, 150(3): 470-480. DOI:10.1016/j.cell.2012.07.008 |
| [5] |
CHENG C S, WEI H K, YU H C, et al. Metabolic syndrome during perinatal period in sows and the link with gut microbiota and metabolites[J]. Frontiers in Microbiology, 2018, 9: 1989. DOI:10.3389/fmicb.2018.01989 |
| [6] |
JI Y J, LI H, XIE P F, et al. Stages of pregnancy and weaning influence the gut microbiota diversity and function in sows[J]. Journal of Applied Microbiology, 2019, 127(3): 867-879. DOI:10.1111/jam.14344 |
| [7] |
PAN J S, LIN Z S, WEN J C, et al. Application of the modified cytosine base-editing in the cultured cells of Bama-mini pig[J]. Biotechnology Letters, 2021, 43(9): 1699-1714. DOI:10.1007/s10529-021-03159-1 |
| [8] |
DESANTIS T Z, HUGENHOLTZ P, LARSEN N, et al. Greengenes, a chimera-checked 16S rRNA gene database and workbench compatible with ARB[J]. Applied and Environmental Microbiology, 2006, 72(7): 5069-5072. DOI:10.1128/AEM.03006-05 |
| [9] |
LYNCH S V, PEDERSEN O. The human intestinal microbiome in health and disease[J]. New England Journal of Medicine, 2016, 375(24): 2369-2379. DOI:10.1056/NEJMra1600266 |
| [10] |
NEWBERN D, FREEMARK M. Placental hormones and the control of maternal metabolism and fetal growth[J]. Current Opinion in Endocrinology, Diabetes, and Obesity, 2011, 18(6): 409-416. DOI:10.1097/MED.0b013e32834c800d |
| [11] |
LE CHATELIER E, NIELSEN T, QIN J J, et al. Richness of human gut microbiome correlates with metabolic markers[J]. Nature, 2013, 500(7464): 541-546. DOI:10.1038/nature12506 |
| [12] |
MOKKALA K, RÖYTIÖ H, MUNUKKA E, et al. Gut microbiota richness and composition and dietary intake of overweight pregnant women are related to serum zonulin concentration, a marker for intestinal permeability[J]. The Journal of Nutrition, 2016, 146(9): 1694-1700. DOI:10.3945/jn.116.235358 |
| [13] |
KONG X F, JI Y J, LI H W, et al. Colonic luminal microbiota and bacterial metabolite composition in pregnant Huanjiang mini-pigs: effects of food composition at different times of pregnancy[J]. Scientific Reports, 2016, 6: 37224. DOI:10.1038/srep37224 |
| [14] |
LIU H B, HOU C L, LI N, et al. Microbial and metabolic alterations in gut microbiota of sows during pregnancy and lactation[J]. FASEB Journal, 2019, 33(3): 4490-4501. DOI:10.1096/fj.201801221RR |
| [15] |
LITVAK Y, BYNDLOSS M X, TSOLIS R M, et al. Dysbiotic Proteobacteria expansion: a microbial signature of epithelial dysfunction[J]. Current Opinion in Microbiology, 2017, 39: 1-6. DOI:10.1016/j.mib.2017.07.003 |
| [16] |
ZHANG Y Y, LU T F, HAN L X, et al. L-glutamine supplementation alleviates constipation during late gestation of mini sows by modifying the microbiota composition in feces[J]. BioMed Research International, 2017, 2017: 4862861. |
| [17] |
TSAI F, COYLE W J. The microbiome and obesity: is obesity linked to our gut flora?[J]. Current Gastroenterology Reports, 2009, 11(4): 307-313. DOI:10.1007/s11894-009-0045-z |
| [18] |
THOMAS F, HEHEMANN J H, REBUFFET E, et al. Environmental and gut bacteroidetes: the food connection[J]. Frontiers in Microbiology, 2011, 2: 93. |
| [19] |
TURNBAUGH P J, LEY R E, MAHOWALD M A, et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444(7122): 1027-1031. DOI:10.1038/nature05414 |
| [20] |
JUMPERTZ R, LE D S, TURNBAUGH P J, et al. Energy-balance studies reveal associations between gut microbes, caloric load, and nutrient absorption in humans[J]. The American Journal of Clinical Nutrition, 2011, 94(1): 58-65. DOI:10.3945/ajcn.110.010132 |
| [21] |
HUANG X C, GAO J, ZHAO Y Z, et al. Dramatic remodeling of the gut microbiome around parturition and its relationship with host serum metabolic changes in sows[J]. Frontiers in Microbiology, 2019, 10: 2123. DOI:10.3389/fmicb.2019.02123 |
| [22] |
PLOVIER H, EVERARD A, DRUART C, et al. A purified membrane protein from Akkermansia muciniphila or the pasteurized bacterium improves metabolism in obese and diabetic mice[J]. Nature Medicine, 2017, 23(1): 107-113. DOI:10.1038/nm.4236 |
| [23] |
PEREIRA R D, DE LONG N E, WANG R C, et al. Angiogenesis in the placenta: the role of reactive oxygen species signaling[J]. BioMed Research International, 2015, 2015: 814543. |
| [24] |
HUSSAIN M M. Intestinal lipid absorption and lipoprotein formation[J]. Current Opinion in Lipidology, 2014, 25(3): 200-206. DOI:10.1097/MOL.0000000000000084 |
| [25] |
THOMAS L V, SUZUKI K, ZHAO J. Probiotics: a proactive approach to health.A symposium report[J]. British Journal of Nutrition, 2015, 114(Suppl 1): S1-S15. |
| [26] |
GAO J, XU K, LIU H N, et al. Impact of the gut microbiota on intestinal immunity mediated by tryptophan metabolism[J]. Frontiers in Cellular and Infection Microbiology, 2018, 8: 13. DOI:10.3389/fcimb.2018.00013 |




