2. 浙江师范大学化学与生命科学学院, 金华 321004;
3. 浙江省宁波市农机畜牧中心, 宁波 315000;
4. 浙江省余姚市陆埠镇农业农村办, 余姚 315402
2. College of Chemistry and Life Science, Zhejiang Normal University, Jinhua 321004, China;
3. Ningbo Agricultural Machinery and Animal Husbandry Center, Ningbo 315000, China;
4. Agricultural and Rural Affairs Office of Lubu Town, Yuyao 315402, China
奶牛瘤胃可以为众多微生物提供生存环境,这些微生物之间的相互作用对维持瘤胃内环境稳定和饲料降解至关重要[1]。动物的健康状况、年龄、饲粮结构和饲料添加剂等均会影响奶牛瘤胃发酵参数和微生物区系多样性,其中饲料添加剂对奶牛瘤胃内环境的影响尤为显著[2-3]。有报道表明,乳化剂吐温80能显著提高瘤胃中的总挥发性脂肪酸(TVFA)浓度[4]。王晓霞等[5]研究表明,茶皂素可以显著降低瘤胃液pH、氨态氮(NH3-N)浓度和瘤胃液原虫含量。许晓莉等[6]研究表明,乳化剂大豆磷脂能改变绵羊瘤胃微生物种群结构及多样性。由此可见,乳化剂可以调控反刍动物瘤胃发酵。
乳化剂又称去污剂或表面活性剂,由亲水基和疏水基2部分组成,是一类具有促使2种或2种以上互不相溶的液体均匀分散的具有典型表面活性作用的物质。聚乙二醇甘油蓖麻酸酯(PEGA)与吐温80、大豆磷脂、茶皂素等均属于乳化剂,受益于化工技术进步,其生产成本显著降低。有关反刍动物应用PEGA的文献报道很少,笔者前期采用体外产气试验发现,吐温80、大豆磷脂和PEGA均具有提高产气量、促进瘤胃发酵的作用,且PEGA的添加成本最低。因此,本试验选用安装永久瘤胃瘘管的奶牛作为试验动物,研究PEGA对其瘤胃发酵和微生物区系的影响,以期为PEGA在荷斯坦奶牛饲粮中的应用提供一定的理论依据。
1 材料与方法 1.1 试验材料PEGA由浙江省某生物技术有限公司提供,粉剂,纯度为48%,其余部分为载体二氧化硅。
1.2 试验设计试验在浙江省杭州市临安区板桥镇正兴牧业有限公司进行,选用3头年龄(5.5岁左右)、日产奶量与体重相近、处于泌乳末期的安装永久性瘤胃瘘管的健康荷斯坦奶牛作为试验动物,拴系式饲养。试验设3个组,对照组(Ⅰ组)定量饲喂基础饲粮(半干混合饲粮)同时自由采食羊草,试验组(Ⅱ组和Ⅲ组)在基础饲粮中每头牛每天分别添加25和50 g PEGA。采用3×3拉丁方试验设计,每期试验15 d,预试期12 d,正试期3 d。
1.3 饲养管理与样品采集试验牛每天饲喂2次(08:00和15:00),自由饮水,人工单独添加PEGA到半干混合饲粮中,搅拌均匀。半干混合饲粮组成、半干混合饲粮和羊草营养水平分别见表 1和表 2。于每期正试期第1~2天连续测定记录每头牛采食量,结果发现每头牛每天干物质采食量为(15.2±0.88) kg半干混合饲粮和(1.66±0.58) kg羊草。每期正试期第3天06:00、10:00、13:00、17:00共4个时间点通过瘘管人工采集瘤胃食糜2 kg左右,人工混合均匀后采样。一部分食糜约200 g经4层纱布过滤后立即用S40 Mutimin型pH计测定滤液pH,结果取4个时间点的平均值;另一部分食糜迅速分装于5 mL冻存管内,保存在液氮中,用于后续指标测定。
|
|
表 1 半干混合饲粮组成(干物质基础) Table 1 Composition of half dry mixed diet (DM basis) |
|
|
表 2 半干混合饲粮和羊草营养水平(干物质基础) Table 2 Nutrient levels of half dry mixed diet and leymus chinensis (DM basis) |
将同1期每头试验牛4个不同时间点的食糜样品解冻后等量混匀,取样本50 mg,加50 μL 15%磷酸,再加125 μg/mL的内标(异己酸)溶液100 μL和乙醚400 μL匀浆1 min,于4 ℃、12 000 r/min离心10 min,取上清采用气相色谱串联质谱法测定VFA浓度。气-质联用仪(Thermo TRACE 1310-ISQ LT)色谱条件:色谱柱Agilent HP-INNOWAX毛细管柱(30 m×0.25 mm×0.25 μm);分流进样,进样量1 μL,分流比10 ∶ 1。进样口温度250 ℃;离子源温度230 ℃;传输线温度250 ℃,四极杆温度150 ℃。程序升温起始温度90 ℃;然后以10 ℃/min升温至120 ℃;再以5 ℃/min升温至150 ℃;最后以25 ℃/min升温至250 ℃维持2 min。载气为氦气,载气流速1.0 mL/min。MS条件:电子轰击电离(EI)源,SIM扫描方式,电子能量70 eV。
其余食糜样用4层纱布过滤得到瘤胃液,NH3-N浓度的测定参照Broderick等[10]的方法。α-淀粉酶(α-AMS)、脂肪酶(LPS)、纤维素酶(CL)和胃蛋白酶(PP)活性的测定使用南京建成生物工程研究所生产的试剂盒。以上指标采用超微量微孔板分光光度计(德国BioTek Epoch),选用推荐波长读数,根据标准曲线计算测定值。
α-AMS单位定义:100 mL瘤胃液在37 ℃与底物作用30 min,水解10 mg淀粉定义为1个酶活力单位。LPS单位定义:在37 ℃条件下,每克蛋白在本反应体系中与底物反应1 min,每消耗1 μmol底物为1个酶活性单位。CL单位定义:每毫克蛋白质每分钟催化产生1 μg葡萄糖定义为1个酶活性单位。PP单位定义:每毫克组织蛋白37 ℃每分钟分解蛋白生成1 μg氨基酸相当于1个酶活力单位。
1.4.2 细菌DNA提取和实时荧光定量PCR参考Wei等[8]的方法进行瘤胃细菌DNA提取和荧光定量PCR,上、下游引物分别为: 5’-CCT ACG GGA GGC AGC AG-3’和5’-ATT ACC GCG GCT GCT GG-3’。构建20 μL反应体系,使用PCR仪(ABI 7500,英国)对瘤胃液中的总菌进行定量分析。
1.4.3 瘤胃微生物DNA提取、PCR扩增及高通量测序取1.4.1混匀冻存的食糜,采用前人描述的方法提取和纯化瘤胃食糜微生物总DNA[11],采用细菌通用引物对: 515F (5’-GTGCCAGCMGCCGCGGTAA-3’,此处的M是简并碱基)和806R(5’-GGACTACVSGGGTATCTAAT-3’,此处的V、S是简并碱基),针对细菌16S rRNA基因的V3~V4区进行PCR扩增。PCR产物用2%琼脂糖凝胶电泳鉴定并用AxyPrepDNA凝胶回收试剂盒切胶回收PCR产物,Tris-HCl洗脱,2%琼脂糖电泳检测。回收的PCR产物用QuantiFluorTM-ST fluorometer定量,送北京奥维森基因科技有限公司构建文库,利用Illumina MiSeq测序平台上机测序。
1.5 高通量测序数据生物信息学分析测序结果使用QIIME1.8.0软件质控、Mothur软件拼接,并进行Tags过滤和剔除嵌合体。然后使用uparse算法将序列聚类为操作分类单元(OTU),并使用RDP Classifier算法分类器对OTU的代表序列从门到属进行物种注释。基于OTU table和rep_set.tree文件及抽样的最大深度,计算α多样性指数。根据注释的细菌结构和组成,对其门和属水平上相对丰度进行组间差异性分析。
1.6 数据处理和分析试验数据采用SPSS 21.0进行单因素方差分析,用Duncan氏法进行组间多重比较。对于所有统计分析,以P < 0.05作为差异显著依据,P < 0.01作为差异极显著依据,结果用平均值和标准误(SE)表示。
2 结果 2.1 PEGA对奶牛瘤胃发酵的影响由表 3可知,与Ⅰ组相比,Ⅱ组和Ⅲ组的瘤胃液pH均略有降低(P>0.05),Ⅱ组和Ⅲ组的NH3-N浓度均有所提高(P>0.05);Ⅱ组和Ⅲ组的异丁酸比例显著低于Ⅰ组(P < 0.05);Ⅱ组的戊酸比例显著高于Ⅰ组和Ⅲ组(P < 0.05);其余各VFA的比例在组间无显著差异(P>0.05)。
|
|
表 3 PEGA对荷斯坦奶牛瘤胃发酵的影响 Table 3 Effects of PEGA on rumen fermentation of Holstein cows |
由表 4可知,Ⅰ组和Ⅲ组的α-AMS、LPS、CL和PP活性均高于Ⅱ组,但是差异不显著(P>0.05);Ⅲ组的α-AMS和CL活性高于Ⅰ组,Ⅰ组的LPS和PP活性高于Ⅲ组,差异均不显著(P>0.05)。
|
|
表 4 PEGA对荷斯坦奶牛瘤胃中4种酶活性的影响 Table 4 Effects of PEGA on 4 kinds of rumen enzyme activities of Holstein cows |
由表 5可知,各组瘤胃内容物细菌基因组拷贝数非常接近,差异不显著(P>0.05)。本次测序经去除嵌合体和短序列后共得到122 461条有效序列,平均长度分布在400~440 bp。将有效序列以97%的序列相似度进行OTU划分,Ⅰ组、Ⅱ组和Ⅲ组OTU分别有2 212、2 253和2 293个。其中Ⅰ组和Ⅱ组共享的OTU有1 677个,Ⅰ组和Ⅲ组共享的OTU有1 723个,Ⅱ组和Ⅲ组共享的OTU有1 808个,3组共享的OTU有1 484个。
|
|
表 5 PEGA对荷斯坦牛瘤胃内容物细菌总量的影响 Table 5 Effects of PEGA on total amount of bacteria in rumen contents of Holstein cows |
Alpha多样性指数主要用于评价样品中微生物的丰富性和均匀性。由表 6可知,所有样本的覆盖度达98%以上,反映本次测序结果代表了样本中微生物的真实情况。随着测序深度增加,Ⅱ组和Ⅲ组观测物种个数较Ⅰ组少23~72个,菌种丰富度Chao指数低于Ⅰ组,但不同组间差异不显著(P>0.05)。各组Shannon指数接近,差异不显著(P>0.05)。
|
|
表 6 PEGA对荷斯坦奶牛瘤胃中微生物Alpha多样性的影响 Table 6 Effects of PEGA on rumen microbial Alpha diversity of Holstein cows |
偏最小二乘法判别分析(partial least squares discriminant analysis, PLS-DA)是一种常见的检验样本组间差异的方法,该方法根据分组方案,弱化组内样本差异,突出组间样本差异, 从而易于发现组间样本的差异性。由图 1可知,Ⅰ组、Ⅱ组和Ⅲ组各样本点均按照各自组别分组聚集,说明3组奶牛瘤胃微生物间存在明显差异。Ⅱ组和Ⅲ组被主成分1所分开;Ⅰ组和Ⅲ组被主成分2所分开。
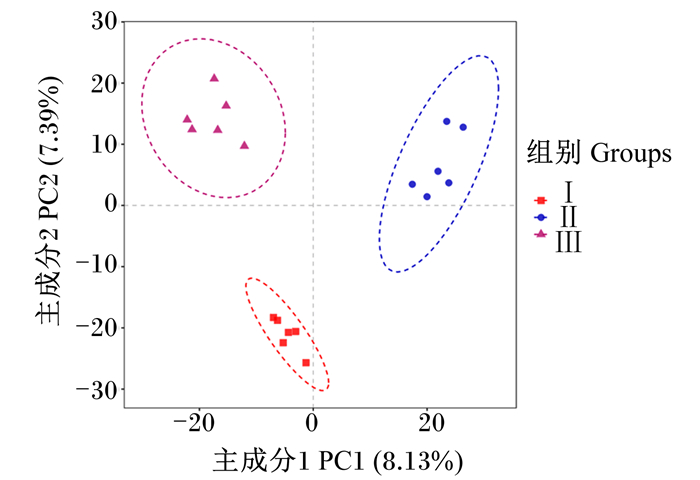
|
图 1 基于OTU水平的偏最小二乘法判别分析 Fig. 1 PLS-DA analysis based on OTU level |
本试验共鉴定出19个细菌门分类物种,本次仅对相对丰度≥0.5%的6个菌门进行组间差异分析,结果表明(表 7),3组奶牛瘤胃微生物在门水平的优势菌群主要由厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)组成,两者占整个菌群的92%以上,但不同组间差异不显著(P>0.05);次级优势菌门是螺旋体菌门(Spirochaetae)和Saccharibacteria,Ⅲ组的Saccharibacteria相对丰度显著低于Ⅰ组和Ⅱ组(P<0.05);Ⅱ组和Ⅲ组的变形菌门(Proteobacteria)相对丰度比Ⅰ组有提高(P>0.05);不同组间软壁菌门(Tenericutes)相对丰度差异不显著(P>0.05)。
|
|
表 7 PEGA对荷斯坦奶牛瘤胃微生物区系组成的影响 Table 7 Effects of PEGA on rumen microflora composition of Holstein cows |
在属水平上共鉴定出208种菌,31种菌属相对丰度≥0.5%。未鉴定菌属(unidentified)相对丰度在30%左右,主要来自拟杆菌目S24-7群(Bacteroidales_S24-7_group)和拟杆菌目BS11肠道群(Bacteroidales_BS11_gut_group)。基于菌属种类多且部分菌属的相对丰度较低,本次仅对其中11个相对丰度≥1.0%的菌属进行组间差异分析。结果表明(表 7),Ⅱ组的unidentified、理研菌科RC9肠道群(Rikenellaceaee_RC9_gut_group)和克里斯滕森菌科R7群(Christensenellaceae_R-7_group)相对丰度显著低于Ⅰ组和Ⅲ组(P<0.05);Ⅱ组和Ⅲ组的普雷沃氏菌科UCG-001(Prevotellaceae_UCG-001)相对丰度显著高于Ⅰ组(P<0.05);各组间其他菌属相对丰度差异不显著(P>0.05)。
2.7 瘤胃pH、NH3-N、VFA浓度与属水平微生物相对丰度的相关关系对瘤胃发酵参数与属水平微生物相对丰度进行Pearson相关分析,因未鉴定菌属主要来自Bacteroidales_S24-7_group和Bacteroidales_BS11_gut_group,该菌科代谢功能多样,故未进行关联分析。由图 2可知,瘤胃液pH与瘤胃球菌科UCG-005(Ruminococcaceae_UCG-005)相对丰度呈极显著负相关(P<0.01),与其余菌属相对丰度无显著相关关系(P>0.05);NH3-N浓度与毛螺菌科AC2044群(Lachnospiraceae_AC2044_group)相对丰度呈显著负相关(P<0.05),与其余菌属相对丰度无显著相关关系(P>0.05);乙酸比例与Ruminococcaceae_UCG-005相对丰度呈显著负相关(P<0.05);丙酸比例与普雷沃氏菌科UCG-003(Prevotellaceae_UCG-003)相对丰度呈极显著正相关(P<0.01),与Lachnospiraceae_AC2044_group和毛螺菌科NK3A20群(Lachnospiraceae_NK3A20_group)相对丰度呈显著正相关(P<0.05),与瘤胃球菌科UCG-014(Ruminococcaceae_UCG-014)相对丰度呈极显著负相关(P<0.01);丁酸比例与瘤胃球菌属2(Ruminococcus_2)相对丰度呈显著正相关(P<0.05),与瘤胃球菌属1(Ruminococcus_1)相对丰度呈显著负相关(P<0.05);戊酸浓度与Prevotellaceae_UCG-003、Prevotellaceae_UCG-001和Lachnospiraceae_NK3A20_group相对丰度呈显著正相关(P<0.05);TVFA浓度与Prevotellaceae_UCG-003和Lachnospiraceae_AC2044_group相对丰度呈显著正相关(P<0.05),与Ruminococcaceae_UCG-014和Ruminococcaceae_UCG-005相对丰度呈显著负相关(P<0.05)。
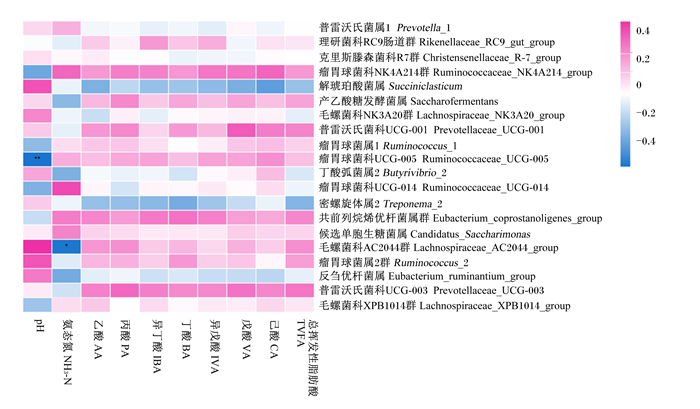
|
图 2 瘤胃pH、NH3-N、VFA浓度与属水平微生物相对丰度的相关关系 Fig. 2 Relationship between rumen pH, NH3-N, VFA concentration and microbial relative abundance at genus level |
瘤胃pH是瘤胃生理状况的最直接表现,是食糜中VFA与唾液中缓冲盐相互作用、瘤胃上皮对VFA吸收及随食糜流出等因素综合作用的结果。pH受饲粮精粗比、唾液分泌量和有机酸积累的影响,精料比例增加则有机酸增多、pH下降,唾液富含碳酸氢盐和磷酸氢盐,对瘤胃发酵产酸具有中和作用[12]。pH过高或过低均不利于瘤胃内微生物的正常生长。本试验中测得的奶牛瘤胃液pH在5.78~5.99,属于正常范围。王宏勇等[13]研究表明,在绵羊饲粮中添加吐温40和吐温60不会显著影响其瘤胃液pH,但添加吐温80可显著降低瘤胃液pH。许晓莉等[6]研究表明,在绵羊饲粮中添加大豆磷脂(每只羊10、20和40 g/d)对其瘤胃液pH无显著影响。
瘤胃NH3-N浓度反映了蛋白质合成与降解之间的平衡状况,一方面奶牛采食的饲粮在瘤胃中不断发酵产生氨气(NH3),另一方面瘤胃微生物不断利用NH3合成微生物蛋白[14]。研究表明,适宜奶牛瘤胃微生物生长所需的NH3-N浓度为6.3~27.5 mg/dL[15-16]。约有80%的瘤胃细菌以NH3-N作为唯一生长氮源,瘤胃原虫可以产生NH3-N,但不能利用NH3-N合成所需要的蛋白质[17]。本试验中测得的奶牛瘤胃液NH3-N浓度在11.64~14.22 mg/dL,属于正常范围。
瘤胃微生物种类繁多,数量庞大,主要包括细菌、原虫、真菌和酵母。瘤胃微生物每天消化大量的碳水化合物生成VFA,其过程可分为2个阶段:一是将复杂的碳水化合物消化生成各种单糖;二是糖的无氧酵解,单糖被瘤胃微生物摄取,在酶的作用下通过不同代谢途径生成VFA[18]。VFA浓度和比例可以作为衡量瘤胃代谢活动的指标[19]。Kim等[20]研究发现,和对照组相比,添加吐温80可增加体外培养瘤胃液中的丙酸浓度。王晓霞等[5]研究发现,茶皂素可提高体外培养瘤胃液中丙酸浓度。本试验发现,添加PEGA可降低瘤胃液异丁酸比例,增加戊酸比例,略提高丙酸比例。由此可见,乳化剂可以微调奶牛瘤胃发酵模式。
3.2 PEGA对奶牛瘤胃中4种酶活性的影响反刍动物瘤胃液中酶的活性与瘤胃微生物的数量和代谢密切相关,α-AMS、LPS、CL和PP的活性分别反映瘤胃中淀粉分解菌、脂肪分解菌、纤维素分解菌和蛋白质分解菌的数量和活力[21]。关于乳化剂对瘤胃液酶活性影响的结果报道并不一致。Kamande等[22]研究发现每天在绵羊饲粮中分别添加10 g吐温60和吐温80,可提高其羧甲基纤维素酶、PP和CL的活性,可提高其干物质与半纤维素在瘤胃内的降解率。Horistov等[23]报道在大麦和苜蓿基础饲粮中添加吐温80,对娟姗牛干物质采食量、瘤胃羧甲基纤维素酶、木聚糖酶和淀粉酶没有显著影响。本研究发现,PEGA对以上4种酶活性均无显著影响,具体原因有待进一步研究。
3.3 PEGA对奶牛瘤胃微生物区系组成的影响经过长期适应和选择,微生物和宿主之间、微生物和微生物之间处于一种相互依赖、相互制约的动态平衡系统中。本研究中OTU数目和Shannon指数分析结果表明,荷斯坦奶牛瘤胃内微生物数量和种类均较多。Beta多样性分析结果表明,3组奶牛瘤胃菌群组成结构具有明显组间差异,提示PEGA可影响奶牛瘤胃微生物组成。
本研究发现,基于门分类水平,奶牛瘤胃优势菌群主要包括Firmicutes和Bacteroidetes,这与前人报道结果[24-25]基本一致。Evans等[26]研究表明,Firmicutes主要参与纤维物质的分解,而Bacteroidetes在非纤维物质的降解中发挥重要作用。Saccharibacteria能够降解果胶、半纤维素和纤维素等,对纤维物质转化为VFA有重要影响[27]。本研究还发现,3组奶牛瘤胃中Saccharibacteria和Proteobacteria相对丰度存在显著差异,Ⅲ组的Saccharibacteria相对丰度显著低于Ⅰ组和Ⅱ组;Ⅱ组和Ⅲ组的Proteobacteria相对丰度比Ⅰ组有显著提高。
在属水平上,除去unidentified,3组奶牛瘤胃中前3优势菌属分别是Prevotella_1、Rikenellaceae_RC9_gut_group和Christensenellaceae_R-7_group。这与高雨飞[28]、曾钰等[29]研究结果基本一致。本研究发现,Ⅱ组和Ⅲ组的Prevotellaceae_UCG-001相对丰度显著高于Ⅰ组;Ⅱ组的Rikenellaceaee_RC9_gut_group和Christensenellaceae_R-7_group相对丰度显著低于Ⅰ组和Ⅲ组,表明瘤胃中Firmicutes与Bacteroidetes此消彼长。Lee等[30]在体外瘤胃发酵培养中发现吐温80可以显著提高4种非纤维分解菌(埃氏巨球形菌、嗜淀粉瘤胃杆菌、新月单胞菌和普雷沃氏菌)的生长速度,但是对4种纤维分解菌(黄化瘤胃球菌、产琥珀酸杆菌、白色瘤胃球菌和溶纤维丁酸弧菌)的生长无显著影响,该发现与本研究结果类似。
3.4 瘤胃pH、NH3-N、VFA浓度与属水平微生物相对丰度的相关分析Prevotellaceae是瘤胃中数量最多的一类Bacteroidetes菌科,包括半纤维素分解菌和蛋白分解菌,如栖瘤胃普雷沃菌、布氏普雷沃氏菌和短普雷沃氏菌等,其可降解植物性半纤维素、蛋白质、非纤维多糖,参与多种微生物代谢[31]。Ruminococcus是瘤胃中主要的纤维降解菌,其在瘤胃中可分泌大量纤维素酶、半纤维素酶和寡糖酶[32]。本研究发现丁酸比例与Ruminococcus_2相对丰度呈显著正相关,与Ruminococcus_1相对丰度呈显著负相关,表明疣微菌科不同属的代谢能力不同。Christensenellaceae属于Firmicutes,饲粮中添加富马酸、苹果酸可促进其数量增加,该菌科可利用富马酸、苹果酸生成琥珀酸和丙酸[33],Prevotellaceae也可以生成琥珀酸[34]。Prevotellaceae_UCG-003和Lachnospiraceae_NK3A20_group相对丰度均与丙酸和戊酸比例呈显著正相关,表明这2种菌属在多糖降解过程中存在协同作用[35]。据报道,毛螺菌在消化纤维过程中与产琥珀酸丝状杆菌具有协同作用,并且对病原菌具有拮抗作用[36]。瘤胃内支链VFA是产氨菌和原虫介导支链氨基酸脱氨基的产物,大部分纤维降解菌生长需要支链VFA[37]。本研究发现添加PEGA导致瘤胃内异丁酸比例降低,推测PEGA抑制部分产氨微生物生长;添加25 g PEGA提高瘤胃液戊酸比例,可能与普雷沃氏菌属相对丰度增加有关。
4 结论奶牛饲粮中添加PEGA可微调瘤胃微生物区系,增加瘤胃Prevotellaceae_UCG-001相对丰度;对pH、NH3-N浓度等常规发酵参数没有显著影响,VFA组成略有变化。
| [1] |
RUSSELL J B, RYCHLIK J L. Factors that alter rumen microbial ecology[J]. Science, 2001, 292(5519): 1119-1122. DOI:10.1126/science.1058830 |
| [2] |
邱凌, 曾东, 倪学勤, 等. 微生态制剂对奶牛产奶量和乳品质与肠道菌群的影响[J]. 中国畜牧杂志, 2011, 47(3): 64-67. QIU L, ZENG D, NI X Q, et al. Effects of microecological preparations on the milk yield, milk quality and intestinal flora of dairy cow[J]. Chinese Journal of Animal Science, 2011, 47(3): 64-67 (in Chinese). |
| [3] |
陈沫, 臧长江, 陈晖, 等. 不同离子型表面活性剂对反刍动物瘤胃发酵调控的研究进展[J]. 中国畜牧兽医, 2018, 45(5): 1203-1210. CHEN M, ZANG C J, CHEN H, et al. Research progress on the regulation of rumen fermentation by different surfactants in ruminants[J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(5): 1203-1210 (in Chinese). |
| [4] |
KIM H J, KIM S B, KIM C J. The effects of nonionic surfactants on the pretreatment and enzymatic hydrolysis of recycled newspaper[J]. Biotechnology and Bioprocess Engineering, 2007, 12(2): 147-151. DOI:10.1007/BF03028641 |
| [5] |
王晓霞, 王侃, 吴晨晖, 等. 无患子皂甙对瘤胃发酵及甲烷产量的影响[J]. 中国畜牧杂志, 2012, 48(17): 55-58. WANG X X, WANG K, WU C H, et al. The Effects of sapindoside on rumen fermentation and methane production in vitro[J]. Chinese Journal of Animal Science, 2012, 48(17): 55-58 (in Chinese). DOI:10.3969/j.issn.0258-7033.2012.17.015 |
| [6] |
许晓莉. 添加大豆磷脂对绵羊瘤胃消化代谢及微生物区系的影响[D]. 硕士学位论文. 乌鲁木齐: 新疆农业大学, 2013. XU X L. Effects of dietary addition of soybean lecithin on ruminal metabolism and microbial diversity in sheep[D]. Master's Thesis. Urumqi: Xinjiang Agricultural University, 2013. (in Chinese) |
| [7] |
张丽英. 饲料分析及饲料质量检测技术[M]. 4版. 北京: 中国农业大学出版社, 2003. ZHANG L Y. Feed analysis and feed quality testing technology[M]. Beijing: China Agricultural University Press, 2003 (in Chinese). |
| [8] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74: 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [9] |
NRC. Nutrient requirements of dairy cattle[S]. Washington, D.C. : National Academy Press, 2001.
|
| [10] |
BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. Journal of Dairy Science, 1980, 63(1): 64-75. DOI:10.3168/jds.S0022-0302(80)82888-8 |
| [11] |
GUO W, LI Y, WANG L Z, et al. Evaluation of composition and individual variability of rumen microbiota in yaks by 16S rRNA high-throughput sequencing technology[J]. Anaerobe, 2015, 34: 74-79. DOI:10.1016/j.anaerobe.2015.04.010 |
| [12] |
汪水平, 王加启, 龚月生, 等. 日粮精粗比对泌乳奶牛瘤胃及小肠pH值的影响[J]. 中国奶牛, 2007(S1): 37-40. WANG S P, WANG J Q, GONG Y S, et al. The effect of dietary concentrate to forage ratio on the pH value of rumen and small intestine of lactating dairy cows[J]. China Dairy Cattle, 2007(S1): 37-40 (in Chinese). |
| [13] |
王宏勇, 孙浩, 陈勇. 吐温对绵羊采食、瘤胃代谢、CMCase活力和原虫数量的影响[J]. 饲料工业, 2008, 29(3): 38-41. WANG H Y, SUN H, CHEN Y. Effects of tween on intake, rumen fermentation characteristics, cmcase activity and protozoa counts of sheep[J]. Feed Intustry, 2008, 29(3): 38-41 (in Chinese). |
| [14] |
王洪荣, 秦韬, 王超. 青蒿素对山羊瘤胃发酵和微生物氮素微循环的影响[J]. 中国农业科学, 2014, 47(24): 4904-4914. WANG H R, QIN T, WANG C. Effects of artemisinine on the rumen fermentation and microbial nitrogen recycling rate in goats[J]. Scientia Agricultura Sinica, 2014, 47(24): 4904-4914 (in Chinese). DOI:10.3864/j.issn.0578-1752.2014.24.014 |
| [15] |
MURPHY J J, KENNELLY J J. Effect of protein concentration and protein source on the degradability of dry matter and protein in situ[J]. Journal of Dairy Science, 1987, 70(9): 1841-1849. DOI:10.3168/jds.S0022-0302(87)80223-0 |
| [16] |
HRISTOV A N, MCALLISTER T A. Effect of inoculants on whole-crop barley silage fermentation and dry matter disappearance in situ[J]. Journal of Animal Science, 2002, 80(2): 510-516. DOI:10.2527/2002.802510x |
| [17] |
王欢莉. 山羊瘤胃原虫与细菌之间氮周转规律与机制的研究[D]. 博士学位论文. 扬州: 扬州大学, 2014. WANG H L. Mechanism of nitrogen turnover between protozoa and bacteria in the rumen of goats[D]. Ph. D. Thesis. Yangzhou: Yangzhou University, 2014. (in Chinese) |
| [18] |
张洁, 陈旭伟, 徐爱秋, 等. 瘤胃微生物对饲料碳水化合物的消化代谢[J]. 中国奶牛, 2008(2): 17-20. ZHANG J, CHEN X W, XU A Q, et al. Digestion and metabolism of feed carbohydrates by rumen microorganisms[J]. China Dairy Cattle, 2008(2): 17-20 (in Chinese). DOI:10.3969/j.issn.1004-4264.2008.02.007 |
| [19] |
王洪荣, 陈旭伟, 王梦芝. 茶皂素和丝兰皂苷对山羊人工瘤胃发酵和瘤胃微生物的影响[J]. 中国农业科学, 2011, 44(8): 1710-1719. WANG H R, CHEN X W, WANG M Z. Effect of Yucca schidigera saponin and tea saponin mixture on the rumen fermentation and its fibrolytic bacterial activity in the rusitec substrates with different concentrate to forage ratio[J]. Scientia Agricultura Sinica, 2011, 44(8): 1710-1719 (in Chinese). |
| [20] |
KIM W, GAMO Y, YAHAYA M S, et al. Pretreatment of surfactant Tween 80 and fibrolytic enzyme influencing volatile fatty acid and methane production of a total mixed ration by mixed rumen microorganisms at in vitro[J]. Grassland Science, 2005, 51(2): 145-152. DOI:10.1111/j.1744-697X.2005.00020.x |
| [21] |
李鹤琼, 刘强, 王聪, 等. 2-甲基丁酸对断奶前后犊牛瘤胃发酵、酶活及纤维分解菌菌群的影响[J]. 畜牧兽医学报, 2015, 46(12): 2218-2226. LI H Q, LIU Q, WANG C, et al. Effects of 2-methylbutyrate supplementation on rumen fermentation, enzyme activities and cellulolytic bacteria in pre-and post-weaning dairy calves[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(12): 2218-2226 (in Chinese). DOI:10.11843/j.issn.0366-6964.2015.12.013 |
| [22] |
KAMANDE G M, BAAH J, CHENG K J, et al. Effects of Tween 60 and Tween 80 on protease activity, thiol group reactivity, protein adsorption, and cellulose degradation by rumen microbial enzymes[J]. Journal of Dairy Science, 2000, 83(3): 536-542. DOI:10.3168/jds.S0022-0302(00)74913-7 |
| [23] |
HRISTOV A N, MCALLISTER T A, OLSON M E, et al. Effect of Tween 80 and salinomycin on ruminal fermentation and nutrient digestion in steers fed a diet containing 70% barley[J]. Canadian Journal of Animal Science, 2000, 80(2): 363-372. DOI:10.4141/A99-067 |
| [24] |
JAMI E, ISRAEL A, KOTSER A, et al. Exploring the bovine rumen bacterial community from birth to adulthood[J]. ISME Journal, 2013, 7(6): 1069-1079. DOI:10.1038/ismej.2013.2 |
| [25] |
JAMI E, MIZRAHI I. Composition and similarity of bovine rumen microbiota across individual animals[J]. PLoS One, 2012, 7(3): e33306. DOI:10.1371/journal.pone.0033306 |
| [26] |
EVANS N J, BROWN J M, MURRAY R D, et al. Characterization of novel bovine gastrointestinal tract Treponema isolates and comparison with bovine digital dermatitis treponemes[J]. Applied and Environmental Microbiology, 2011, 77(1): 138-147. DOI:10.1128/AEM.00993-10 |
| [27] |
张红涛. 不同玉米青贮水平对荷斯坦后备牛瘤胃液微生物组及其代谢组的影响[D]. 博士学位论文. 北京: 中国农业大学, 2017. ZHANG H T. Effects of corn silage levels on rumen fluid microbiota and its metabolome in Holstein heifers[D]. Ph. D. Thesis. Beijing: China Agricultural University, 2017. (in Chinese) |
| [28] |
高雨飞. 高精料日粮条件下烟酸对牛瘤胃微生物区系的影响[D]. 硕士学位论文. 南昌: 江西农业大学, 2016. GAO Y F. Effects of niacin on microorganism system in the rumen of cattle under high-concentrate diet[D]. Master's Thesis. Nanchang: Jiangxi Agricultural University, 2016. (in Chinese) |
| [29] |
曾钰, 高彦华, 彭忠利, 等. 饲粮中添加酵母培养物对舍饲牦牛瘤胃发酵参数及微生物区系的影响[J]. 动物营养学报, 2020, 32(4): 1721-1733. ZENG Y, GAO Y H, PENG Z L, et al. Effects of yeast culture supplementation in diets on rumen fermentation parameters and microflora of house-feeding yak[J]. Chinese Journal of Animal Nutrition, 2020, 32(4): 1721-1733 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.04.031 |
| [30] |
LEE S S, AHN B H, KIM H S, et al. Effects of non-ionic surfactants on enzyme distributions of rumen contents, anaerobic growth of rumen microbes, rumen fermentation characteristics and performances of lactating cows[J]. Asian-Australasian Journal of Animal Sciences, 2003, 16(1): 104-115. DOI:10.5713/ajas.2003.104 |
| [31] |
张洁, 张力莉, 徐晓锋. 反刍动物瘤胃内普雷沃氏菌的研究进展[J]. 中国饲料, 2020(7): 17-21. ZHANG J, ZHANG L L, XU X F. Research progress of Prevotella in the rumen of ruminants[J]. China Feed, 2020(7): 17-21 (in Chinese). |
| [32] |
DAI X, TIAN Y, LI J T, et al. Metatranscriptomic analyses of plant cell wall polysaccharide degradation by microorganisms in the cow rumen[J]. Applied and Environmental Microbiology, 2015, 81(4): 1375-1386. DOI:10.1128/AEM.03682-14 |
| [33] |
DE NARDI R, MARCHESINI G, LI S C, et al. Metagenomic analysis of rumen microbial population in dairy heifers fed a high grain diet supplemented with dicarboxylic acids or polyphenols[J]. BMC Veterinary Research, 2016, 12: 29. DOI:10.1186/s12917-016-0653-4 |
| [34] |
HOBSON P N, STEWART C S. The rumen microbial ecosystem[M]. Dordrecht: Springer, 1997.
|
| [35] |
FLINT H J, BAYER E A, RINCON M T, et al. Polysaccharide utilization by gut bacteria: potential for new insights from genomic analysis[J]. Nature Reviews Microbiology, 2008, 6(2): 121-131. DOI:10.1038/nrmicro1817 |
| [36] |
SURANA N K, KASPER D L. Moving beyond microbiome-wide associations to causal microbe identification[J]. Nature, 2017, 552(7684): 244-247. DOI:10.1038/nature25019 |
| [37] |
张慧玲, 李林, 陈勇, 等. 添加支链氨基酸或支链脂肪酸对玉米秸秆体外瘤胃发酵和细菌多样性的影响[J]. 新疆农业大学学报, 2012, 35(4): 265-269. ZHANG H L, LI L, CHEN Y, et al. Effects of branched chain amino acids or fatty acid supplementation on in vitro fermentation of corn straw and bacterial diversity[J]. Journal of Xinjiang Agricultural University, 2012, 35(4): 265-269 (in Chinese). DOI:10.3969/j.issn.1007-8614.2012.04.002 |




