2. 山西农业大学动物科学学院, 太谷 030801
2. College of Animal Science, Shanxi Agricultural University, Taigu 030801, China
饲粮中添加复合益生菌制剂(complex probiotic preparation,CPP)和菊粉(inulin,IN)能提高育肥肉牛生长性能、抗氧化性能和免疫功能,推动养殖业的安全快速发展[1-2]。反刍动物中应用较多的益生菌有酵母菌、芽孢杆菌和乳酸菌等。Malik等[3]研究发现,饲粮中添加CPP(酿酒酵母∶嗜酸乳杆菌=1 ∶ 3)提高了13月龄雄性水牛平均日增重(ADG)和饲料效率;彭涛等[4]研究发现,饲粮中添加0.4%的CPP(植物乳杆菌和酵母菌)提高了舍饲山羊血清免疫球蛋白含量,改善了机体抗氧化性能,并有提高ADG的趋势;高堂亮[5]研究发现,饲粮中添加5×1010 CFU/d微生态制剂(枯草芽孢杆菌∶地衣芽孢杆菌∶植物乳酸菌=2 ∶ 2 ∶ 1)提高了肉牛生长性能和干物质(DM)表观消化率,降低了后肠大肠杆菌数量。目前,IN在鸡、猪和大鼠上的研究主要集中于肠道[6-9],在反刍动物上的研究主要针对幼龄动物。Ārne等[10]研究发现,饲粮中添加6 g/d的IN提高了23日龄犊牛ADG,并改善了胃肠道和形态学指标;Samanta等[11]研究发现,饲粮中添加IN提高了肠道双歧杆菌数量,抑制了大肠杆菌繁殖,促进了养分消化吸收,提高了犊牛ADG。由于犊牛瘤胃尚未发育完全,IN在反刍动物上的研究仅局限于高精料饲粮背景下IN对育肥牛瘤胃酸中毒调节的探索[12]。
鉴于CPP和IN在提高动物生长性能和调节瘤胃环境等方面的共同点,当前高精料饲粮背景下如何激发饲喂CPP育肥牛的生长性能具有重要的意义。因此,本试验以西门塔尔杂交肉牛为研究对象,探讨饲粮中添加CPP和IN对育肥期肉牛生长性能、养分消化、瘤胃发酵和血液代谢的影响,以期为CPP和IN的应用提供依据。
1 材料与方法 1.1 试验材料CPP购自江苏某生物技术有限公司,活菌数为1.5×1010 CFU/g,其中,酵母菌∶枯草芽孢杆菌∶乳酸杆菌=2 ∶ 2 ∶ 1。IN购自重庆某股份有限公司,纯度为90%。
1.2 试验设计采用2×2双因子完全随机设计,主因子分别为CPP(饲粮中不添加或添加20 g/d的CPP)和IN(饲粮中不添加或添加2%的IN),CPP和IN添加量分别参照汤志宏等[13]和田可[12]。选取约1周岁、体重(403±12) kg、体况良好、体型一致的西门塔尔杂交肉牛20头,随机分为4组,每组5头牛。各组分别饲喂基础饲粮、基础饲粮+CPP、基础饲粮+IN以及基础饲粮+CPP+IN。基础饲粮参照NRC(2016)[14]配制,精粗比为62 ∶ 38,其组成及营养水平见表 1。试验前分别将CPP和IN混入饲粮中,保证全部食用。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验于2021年4—6月在山西省方山县宏康牧业有限责任公司养殖场进行,预试期10 d,正试期60 d。试验牛均为单栏舍饲,自然通风,统一管理,饲养开始前对所有试验牛进行驱虫和耳号标记。每天07:00和17:00各饲喂1次,自由饮水,定期清理牛舍,保持卫生清洁。喂食采用精粗混合的方式,保证一定的剩料量。
1.4 样品采集与指标检测 1.4.1 生长性能正试期每天记录采食量,晨饲前准确称量试验牛的饲粮饲喂量和前1天的剩料量,计算干物质采食量(DMI)。于试验开始和结束时分别连续2 d记录试验牛空腹体重,计算ADG和料重比(F/G)。DMI、ADG和F/G计算公式如下:

|
正试期开始每隔5 d采集1次饲粮样品,通过直肠取样法收集新鲜粪样后加入粪重1/4的10%酒石酸。将收集到的饲粮样品和粪样65 ℃烘干,回潮24 h,粉碎,制备成分析试样,测定常规营养成分含量。DM含量采用直接烘干法测定;粗灰分(CA)和酸不溶灰分(AIA)含量采用灼烧法测定[15];粗蛋白质(CP)含量采用凯氏定氮法测定;中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量采用Van Soest等[16]纤维素分析法测定;粗脂肪(EE)含量采用乙醚浸提法测定。通过内源性指示剂法计算养分表观消化率,计算公式如下:
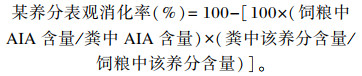
|
利用瘤胃管经口腔抽取瘤胃液,使用UB-7型酸度计现场测定pH。4层无菌棉纱布过滤,分装于10 mL离心管,-20 ℃保存待测。采用比色法测定瘤胃氨态氮(NH3-N)浓度。采用气相色谱法测定瘤胃挥发性脂肪酸(VFA)浓度,以巴豆酸作为内标物,色谱柱类型为SH-Rtx-WAX(30.00 m×0.25 mm×0.25 μm),火焰氢离子检测器、气化室温度分别为220和200 ℃,柱温140 ℃,上样量1 μL。
1.4.4 瘤胃菌群采用十六烷基三甲基溴化铵(CTAB)法提取瘤胃微生物总DNA[17],用核酸蛋白测定仪检测DNA的质量和数量。通过10倍连续稀释建立目标微生物的标准曲线[18],实时定量PCR检测瘤胃微生物菌群数量。瘤胃微生物及实时定量PCR引物序列如表 2所示。总反应体系为20 μL,包括10 μL SYBR Green Premix Ex TaqTM Ⅱ,2 μL模板DNA,上、下游引物各0.8 μL(10 μmol/L),0.4 μL ROX Reference Dye Ⅱ,6.0 μL超纯水。两步法PCR反应程序:95 ℃预变性60 s,95 ℃变性15 s,60 ℃延伸30 s,40个循环,通过PCR产物解离曲线检测扩增特异性。
|
|
表 2 瘤胃微生物及实时定量PCR引物序列 Table 2 Primers sequences of rumen microbes and real-time PCR |
通过全自动生化检测仪测定血清葡萄糖(GLU)、总蛋白(TP)、白蛋白(ALB)、甘油三酯(TG)和尿素氮(UN)含量,采用试剂盒(南京建成生物工程研究所)测定血清总抗氧化能力(T-AOC)和超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性及丙二醛(MDA)含量。
1.5 统计分析应用SAS 9.2统计软件进行一般线性模型下多因素交互方差分析,分析模型如下:
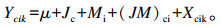
|
式中:μ为群体均数;Jc为CPP因素的效应;Mi为IN因素的效应;(JM)ci为CPP因素与IN因素的互作效应;Xcik为随机误差。不同时间采集的样品按重复测量处理,各组间平均值的多重比较采用Duncan氏法。试验数据以平均值±标准差表示,P<0.05为差异显著,0.05<P<0.10为差异有显著趋势。
2 结果 2.1 CPP和IN对育肥牛生长性能的影响如表 3所示,CPP和IN互作显著提高了育肥牛ADG(P<0.05),对DMI和F/G无显著影响(P>0.05)。饲粮中添加CPP或IN显著提高了育肥牛末重和ADG(P<0.05),显著降低了F/G(P<0.05),对DMI无显著影响(P>0.05)。
|
|
表 3 CPP和IN对育肥牛生长性能的影响 Table 3 Effects of CPP and IN on growth performance of finishing bulls |
如表 4所示,CPP和IN互作有提高育肥牛CP表观消化率的趋势(P=0.063)。饲粮中添加CPP显著提高了育肥牛DM、NDF和CP表观消化率(P<0.05),有提高ADF表观消化率的趋势(P= 0.077),对EE和NFC表观消化率无显著影响(P>0.05)。饲粮中添加IN显著提高了育肥牛CP表观消化率(P<0.05),对DM、EE、NDF、ADF和NFC表观消化率无显著影响(P>0.05)。
|
|
表 4 CPP和IN对育肥牛养分表观消化率的影响 Table 4 Effects of CPP and IN on nutrient apparent digestibilities of finishing bulls |
如表 5和表 6所示,CPP和IN互作有提高瘤胃溶纤维丁酸弧菌数量的趋势(P=0.069)。饲粮中添加CPP显著提高了瘤胃丙酸和NH3-N浓度(P<0.05),显著提高了瘤胃白色瘤胃球菌、产琥珀酸丝状杆菌、溶纤维丁酸弧菌和栖瘤胃普雷沃氏菌数量(P<0.05),显著降低了瘤胃原虫数量(P<0.05)。饲粮中添加IN显著降低了瘤胃pH(P<0.05),显著提高了瘤胃丙酸浓度及产琥珀酸丝状杆菌、溶纤维丁酸弧菌数量(P<0.05),有提高瘤胃总挥发性脂肪酸(TVFA)、异丁酸浓度和降低栖瘤胃普雷沃氏菌数量的趋势(P=0.083、P=0.096和P=0.058)。
|
|
表 5 CPP和IN对育肥牛瘤胃发酵参数的影响 Table 5 Effects of CPP and IN on rumen fermentation parameters of finishing bulls |
|
|
表 6 CPP和IN对育肥牛瘤胃菌群的影响 Table 6 Effects of CPP and IN on rumen microflora of finishing bulls |
如表 7所示,CPP和IN互作有提高血清TP含量的趋势(P=0.089)。饲粮中添加CPP显著提高了血清GLU、TP含量和T-AOC(P<0.05),显著降低了血清UN和MDA含量(P<0.05)。饲粮中添加IN显著提高了血清GLU和TP含量(P<0.05),显著降低了血清UN含量(P<0.05),有提高血清T-AOC的趋势(P=0.076)。
|
|
表 7 CPP和IN对育肥牛血清生化和抗氧化指标的影响 Table 7 Effects of CPP and IN on serum biochemical and antioxidant indices of finishing bulls |
本研究中,饲粮中添加CPP对肉牛DMI没有显著影响,与Li等[19]、Geng等[20]研究结果一致。ADG是反映肉牛生长性能最重要的指标之一,提高ADG可以缩短育成时间,降低F/G,节约饲养成本。酵母菌及其发酵产物中含有丰富的氨基酸、维生素和有机酸等养分,可促进胃肠有益菌生长和微生物蛋白合成[21]。枯草芽孢杆菌可迅速消耗肠道中的游离氧,促进乳酸杆菌等有益菌的生长[22]。乳酸杆菌可为胃肠微生物提供防御屏障,阻止过路菌等病原微生物附着胃肠壁,调节微生物区系平衡,提高饲料利用率[23]。本试验中,饲粮中添加20 g/d的CPP显著提高了育肥牛末重和ADG,显著降低了F/G,与郑玮才等[24]、张娟利等[25]研究结果一致。
IN能改善胃肠道微生态坏境,提高养分消化利用率,从而提高动物生长性能,降低F/G。本试验中,饲粮中添加IN对育肥牛DMI无显著影响,但显著提高了ADG,显著降低了F/G。田可[12]研究表明,饲粮中添加2%的IN显著提高了肉牛末重和ADG,显著降低了F/G,与本研究结果一致。本试验饲粮精粗比较高,IN调节微生物区系效果明显,在稳定瘤胃发酵环境的同时抑制有害菌黏附胃肠道壁,为有益菌繁殖提供底物,促进饲料营养消化吸收,从而提高生长性能。
CPP和IN都有调节胃肠微生物区系平衡和提高养分消化利用的效果,同时IN可刺激CPP的微生物区系调控功能,增强有益微生物的促生长作用[26-27]。本试验中,CPP和IN互作显著提高了育肥牛ADG,可能与高精料饲粮下蛋白质利用效率增加有关。
3.2 CPP和IN对育肥牛养分表观消化率的影响益生菌及其分泌的多种消化酶可将不易消化的大分子物质降解为易消化的小分子物质,提高饲料消化利用率;益生菌代谢物中包含的维生素、氨基酸及短链脂肪酸等物质促进饲料在体内的消化吸收;乳酸杆菌、枯草芽孢杆菌等有益菌可以为机体提供多种利于其生长发育的物质,产生有机酸并增强胃肠蠕动,增强机体对养分的吸收。杨朋飞等[28]、高堂亮[5]研究发现,饲粮中添加微生态制剂可提高奶牛DM和CP表观消化率;Qiao等[29]研究发现,饲粮中添加100 g/d活地衣芽孢杆菌培养物显著增加了荷斯坦奶牛有机物(OM)、NDF和ADF表观消化率。本试验中,饲粮中添加20 g/d的CPP显著提高了育肥牛DM、CP和NDF表观消化率,得益于酵母菌的营养活性、芽孢杆菌的纤维分解活性和生物夺氧特性、乳酸杆菌的抑菌活性,与上述研究结果一致。
田可[12]研究发现,高精料饲粮中添加IN显著提高了肉牛CP和NDF表观消化率,可能因为IN作为底物支持部分微生物的生长,以及代谢产物调控胃肠道代谢功能,促进养分的消化吸收。本试验中,饲粮中添加2%的IN只显著增加了育肥牛CP表观消化率,对NDF表观消化率影响不显著,可能原因为饲粮成分差异。Brambillasca等[30]研究发现,饲粮中添加IN对仔猪DM、OM、CP、EE、NDF和ADF表观消化率均无显著影响,可能与动物种类和发育阶段有关。
梁金逢等[31]研究发现,饲粮中添加甘露寡糖和CPP提高了CP和EE表观消化率,使得饲料中含氮物质更多地向蛋白质转化。本试验中,CPP和IN互作有提高CP表观消化率的趋势,可能与IN刺激CPP调控胃肠道营养消化吸收有关。
3.3 CPP和IN对育肥牛瘤胃发酵参数和菌群的影响汤志宏等[13]研究报道,饲粮中添加CPP提高了奶牛瘤胃NH3-N和微生物蛋白浓度;彭华[32]研究报道,饲粮中添加纳豆枯草芽孢杆菌提高了奶牛瘤胃丙酸浓度,降低了瘤胃乙酸浓度。本试验中,饲粮中添加CPP显著提高了肉牛瘤胃丙酸和NH3-N浓度,与上述研究结果一致。而张志军[33]研究发现,饲粮中添加CPP显著提高了绵羊瘤胃TVFA、乙酸浓度及乙酸/丙酸,可能与饲粮成分、益生菌种类及活性有关。谢明欣等[34]研究发现,饲粮精粗比为7 ∶ 3时添加CPP(枯草芽孢杆菌和酿酒酵母)导致乳酸利用菌(溶纤维丁酸弧菌)和纤维降解菌(白色瘤胃球菌、产琥珀酸丝状杆菌)数量先减少后增加,可能因为纤维降解菌降解纤维素时产生大量氢气(H2),抑制纤维菌的降解速度,导致乳酸利用菌和纤维降解菌数量减少;CPP保证纤维降解速率不降低,有利于饲粮中纤维素的利用和降低乳酸的积累。杨东吉等[35]研究发现,饲粮中添加酿酒酵母培养物改变了断奶仔猪盲肠微生物相对丰度,有提高蛋白质水解菌(栖瘤胃普雷沃氏菌)相对丰度的趋势,提高了CP表观消化率,促进了养分的吸收。本试验中,饲粮中添加CPP显著增加了肉牛瘤胃白色瘤胃球菌、产琥珀酸丝状杆菌、溶纤维丁酸弧菌和栖瘤胃普雷沃氏菌数量,显著降低了瘤胃原虫数量,使得饲料降解更充分,减少能量的损失,导致瘤胃丙酸和NH3-N浓度显著上升,提高微生物蛋白的合成。
IN被胃肠道部分有益菌群发酵产生短链脂肪酸,具有调节胃肠道pH、抑制有害菌繁殖、调节机体能量代谢、促进矿质元素吸收等生理功能,对于不能直接利用IN的微生物亦产生影响。Pablack等[8]研究发现,饲粮中添加3%的IN显著增加了分娩母猪粪便中肠球菌数量,显著降低了粪便pH。田可[12]研究发现,高精料饲粮中添加2%的IN显著降低了瘤胃pH,显著增加了瘤胃丙酸、丁酸和异丁酸浓度。低pH有利于发挥IN的特性,有助于高精料饲粮下肉牛对养分的利用,同时饲粮的精料占比决定了瘤胃的发酵类型。本试验中,饲粮中添加IN显著降低了瘤胃pH,显著增加了瘤胃丙酸浓度和产琥珀酸丝状杆菌、溶纤维丁酸弧菌数量,与上述研究结果一致。高精料饲粮中添加IN可提高瘤胃菌群的相对丰度和多样性,是导致肉牛高ADG和低F/G的原因之一。IN在抑制有害菌的同时壮大部分有益菌群,产琥珀酸丝状杆菌和溶纤维丁酸弧菌数量的增加表明IN可优化高精料饲粮下的瘤胃菌群,增加降解纤维和利用乳酸的能力[36]。
CPP中酵母菌、枯草芽孢杆菌和乳酸杆菌通过生物夺氧、竞争抑制等手段抑制病原菌繁殖,促进有益菌生长;IN通过与病原菌外源凝集素特异结合,减少其在胃肠壁的黏附;IN刺激下的CPP可发酵生成更多的生理活性物质,两者共同促进有益菌的繁殖[37]。本试验中,CPP和IN互作有提高瘤胃溶纤维丁酸弧菌数量的趋势,提高了乳酸利用的能力。
3.4 CPP和IN对育肥牛血清生化和抗氧化指标的影响本试验中,饲粮中添加CPP显著提高了血清GLU、TP含量和T-AOC,降低了血清UN和MDA含量。血清GLU含量是反映动物生理状态的重要指标,饲粮中添加CPP使瘤胃丙酸含量升高,为肉牛肝脏糖异生提供了能量,可能是血清GLU含量上升的原因。血清TP含量是衡量动物饲粮蛋白质利用效率的重要指标,血清UN含量反映瘤胃中氮的利用程度,本试验中,饲粮中添加CPP提高了动物对饲粮蛋白质的消化利用,使得瘤胃微生物蛋白合成增加,蛋白质的瘤胃外流速度提高,机体蛋白质分解减弱,氮利用率增加。张翔飞[38]研究发现,饲粮中添加0.1%的活性干酵母可显著提高肉牛血清TP、ALB、球蛋白和GLU含量,降低血清UN含量。血清T-AOC反映机体抗氧化能力的大小,MDA是膜质过氧化作用的产物,反映组织过氧化损伤程度。彭涛等[4]研究发现,饲粮中添加0.4%的CPP显著提高了舍饲山羊血清TP、球蛋白含量,显著提高了血清T-AOC和SOD活性,显著降低了血清MDA含量,与本研究结果一致。
Attia等[39]研究发现,饲粮中添加35 mg/kg的IN可提高母兔血清TP、ALB、球蛋白和GLU含量,降低血清UN、胆固醇含量和谷丙转氨酶、谷草转氨酶活性。IN可降低动物和人的血液脂肪和胆固醇含量,可能与IN通过改善胃肠道菌群失调和利用肠道菌群代谢产物调节能量代谢有关。IN代谢产物为短链脂肪酸,其中丙酸盐可抑制脂类合成、促进糖异生和蛋白质合成[40]。同时,IN本身能促进益生菌繁殖,抑制病原菌增殖,增加胃肠菌群相对丰度,提高蛋白质合成效率。本试验中,饲粮中添加2%的IN显著提高了血清GLU和TP含量,显著降低了血清UN含量,提高了氮利用率。
本试验中,CPP和IN互作有提高肉牛血清TP含量的趋势。IN对CPP生长有促进作用,提高益生菌对饲粮蛋白质的消化利用,促进瘤胃微生物蛋白的合成,同时降低UN生成,提高机体氮的利用率。
4 结论① 饲粮中添加CPP提高了瘤胃白色瘤胃球菌、琥珀酸丝状杆菌、溶纤维丁酸弧菌和栖瘤胃普雷沃氏菌数量,增加了瘤胃丙酸和NH3-N浓度,提高了DM、CP和NDF表观消化率,从而提高了育肥牛生长性能和饲料效率。
② 饲粮中添加IN提高了瘤胃琥珀酸丝状杆菌和溶纤维丁酸弧菌数量,增加了瘤胃丙酸浓度,提高了CP表观消化率,从而提高了育肥牛生长性能和饲料效率。
③ CPP与IN互作有提高瘤胃溶纤维丁酸弧菌数量和CP表观消化率的趋势,从而提高了育肥牛生长性能。
| [1] |
COLOMBO E A, COOKE R F, BRANDÃO A P, et al. Performance, health, and physiological responses of newly received feedlot cattle supplemented with pre- and probiotic ingredients[J]. Animal, 2021, 15(5): 100214. DOI:10.1016/j.animal.2021.100214 |
| [2] |
奚文博, 严昌国, 崔莲花. 益生元菊粉在动物营养中的研究进展[J]. 饲料研究, 2017(21): 8-12, 21. XI W B, YAN G C, CUI L H. Progress of prebiotics of inulin in animal nutrient[J]. Feed Research, 2017(21): 8-12, 21 (in Chinese). |
| [3] |
MALIK R, BANDLA S. Effect of source and dose of probiotics and exogenous fibrolytic enzymes (EFE) on intake, feed efficiency, and growth of male buffalo (Bubalus bubalis) calves[J]. Tropical Animal Health and Production, 2010, 42(6): 1263-1269. DOI:10.1007/s11250-010-9559-5 |
| [4] |
彭涛, 郭贝贝, 张水印, 等. 复合益生菌制剂对舍饲山羊育肥性能和血清生化指标的影响[J]. 动物营养学报, 2020, 32(1): 440-446. PENG T, GUO B B, ZHANG S Y, et al. Effects of complex-probiotic-preparation on fattening performance and serum biochemical indexes of captive goats[J]. Chinese Journal of Animal Nutrition, 2020, 32(1): 440-446 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.01.051 |
| [5] |
高堂亮. 微生态制剂的制备及其在肉牛上的应用[D]. 硕士学位论文. 石河子: 石河子大学, 2018. GAO T L. Preparation of probiotics and its application in beef cattle[D]. Master's Thesis. Shihezi: Shihezi University, 2018. (in Chinese) |
| [6] |
魏轶男. 菊粉对肉仔鸡生长性能、免疫功能及抗氧化性能的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2013. WEI Y N. Effects of inulin on growth performance, immune organs indices and antioxidantion of broilers[D]. Master's Thesis. Yangling: Northwest A&F University, 2013. (in Chinese) |
| [7] |
LI K, ZHANG L, XUE J, et al. Dietary inulin alleviates diverse stages of type 2 diabetes mellitus via anti-inflammation and modulating gut microbiota in db/db mice[J]. Food & Function, 2019, 10(4): 1915-1927. |
| [8] |
PABLACK N, VAHJEN W, ZENTEK J. Dietary inulin affects the intestinal microbiota in sows and their suckling piglets[J]. BMC Veterinary Research, 2015, 11: 51. DOI:10.1186/s12917-015-0351-7 |
| [9] |
SCHROEDER B O, BIRCHENOUGH G M H, STÅHLMAN M, et al. Bifidobacteria or fiber protects against diet-induced microbiota-mediated colonic mucus deterioration[J]. Cell Host & Microbe, 2018, 23(1): 27-40. |
| [10] |
ĀRNE A, ILGAŽA A. Jerusalem artichoke flour feeding effects on calf development in the first months of life[J]. Research For Rural Development, 2014, 1: 169-175. |
| [11] |
SAMANTA A K, JAYAPAL N, SENANI S, et al. Prebiotic inulin: useful dietary adjuncts to manipulate the livestock gut microflora[J]. Brazilian Journal of Microbiology, 2013, 44(1): 1-14. DOI:10.1590/S1517-83822013005000023 |
| [12] |
田可. 日粮添加菊粉对育肥肉牛生长性能、瘤胃发酵和菌群、炎症反应的影响[D]. 硕士学位论文. 重庆: 西南大学, 2020. TIAN K. Effects of dietary supplementation of inulin on growth performance, rumen fermentation and bacterial microbiota, inflammatory response in finishing beef steers[D]. Master's Thesis. Chongqing: Southwest University, 2020. (in Chinese) |
| [13] |
汤志宏, 徐宁宁, 叶均安. 复合益生菌和酵母培养物对热应激奶牛生产性能、瘤胃发酵和血清抗应激指标的影响[J]. 浙江大学学报(农业与生命科学版), 2019, 45(5): 611-618. TANG Z H, XU N N, YE J A. Effect of compound probiotics and yeast culture on milk production, rumen fermentation and serum anti-stress parameters of heat-stressed dairy cows[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2019, 45(5): 611-618 (in Chinese). |
| [14] |
National Academies of Sciences, Engineering, and Medicine. Nutrient requirements of beef cattle[M]. 8th ed. Washington D.C. : The National Academies Press, 2016.
|
| [15] |
VAN KEULEN J, YOUNG B A. Evaluation of acid-insoluble ash as a natural marker in ruminant digestibility studies[J]. Journal of Animal Science, 1977, 44(2): 282-287. DOI:10.2527/jas1977.442282x |
| [16] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [17] |
YU Z T, MORRISON M. Improved extraction of PCR-quality community DNA from digesta and fecal samples[J]. BioTechniques, 2004, 36(5): 808-812. DOI:10.2144/04365ST04 |
| [18] |
KONGMUN P, WANAPAT M, PAKDEE P, et al. Effect of coconut oil and garlic powder on in vitro fermentation using gas production technique[J]. Livestock Science, 2010, 127(1): 38-44. DOI:10.1016/j.livsci.2009.08.008 |
| [19] |
LI S, YOON I, SCOTT M, et al. Impact of Saccharomyces cerevisiae fermentation product and subacute ruminal acidosis on production, inflammation, and fermentation in the rumen and hindgut of dairy cows[J]. Animal Feed Science and Technology, 2016, 211: 50-60. DOI:10.1016/j.anifeedsci.2015.10.010 |
| [20] |
GENG C Y, REN L P, ZHOU Z M, et al. Comparison of active dry yeast (Saccharomyces cerevisiae) and yeast culture for growth performance, carcass traits, meat quality and blood indexes in finishing bulls[J]. Animal Science Journal, 2016, 87(8): 982-988. DOI:10.1111/asj.12522 |
| [21] |
DIAS A L G, FREITAS J A, MICAI B, et al. Effects of supplementing yeast culture to diets differing in starch content on performance and feeding behavior of dairy cows[J]. Journal of Dairy Science, 2018, 101(1): 186-200. DOI:10.3168/jds.2017-13240 |
| [22] |
贾鹏, 马涛, 万凡, 等. 益生菌在反刍动物饲粮中的应用[J]. 饲料工业, 2019, 40(1): 54-59. JIA P, MA T, WAN F, et al. Application of probiotics in diet of ruminants[J]. Feed Industry, 2019, 40(1): 54-59 (in Chinese). |
| [23] |
黄雪泉. 添加枯草芽孢杆菌制剂对仔猪生产性能的影响[J]. 中国畜牧兽医, 2010, 37(7): 212-214. HUANG X Q. The effect of Bacillus subtilis formulations on performance in piglets[J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(7): 212-214 (in Chinese). |
| [24] |
郑玮才, 郝小燕, 张宏祥, 等. 酿酒酵母和地衣芽孢杆菌对绵羊生长性能和营养物质消化代谢的影响[J]. 动物营养学报, 2020, 32(11): 5314-5321. ZHENG W C, HAO X Y, ZHANG H X, et al. Effects of Saccharomyces cerevisiae and Bacillus licheniformis on growth performance and nutrient digestion and metabolism in sheep[J]. Chinese Journal of Animal Nutrition, 2020, 32(11): 5314-5321 (in Chinese). |
| [25] |
张娟利, 莫放, 姚刚, 等. 日粮添加枯草芽孢杆菌对13月龄新疆褐牛育肥增重性能和消化率的影响[J]. 中国畜牧杂志, 2020, 56(12): 153-157. ZHANG J L, MO F, YAO G, et al. Effect of dietary Bacillus subtilis supplementation on feedlotting performance and nutrient digestibility of Xinjiang brown beef cattle at initial age of thirteen month[J]. Chinese Journal of Animal Science, 2020, 56(12): 153-157 (in Chinese). |
| [26] |
RAI V, YADAV B, LAKHANI G P. Application of probiotic and prebiotic in animals production: a review[J]. Environment & Ecology, 2013, 31(2B): 873-876. |
| [27] |
SAKR E A E, MASSOUD M I. Impact of prebiotic potential of stevia sweeteners-sugar used as synbiotic preparation on antimicrobial, antibiofilm, and antioxidant activities[J]. LWT, 2021, 144: 111260. DOI:10.1016/j.lwt.2021.111260 |
| [28] |
杨朋飞, 闫素梅, 王鹏宇, 等. 饲喂微生态制剂对奶牛后肠道微生物数量及日粮营养物质消化率的影响[J]. 畜牧与饲料科学, 2011, 32(9): 174-175, 186. YANG P F, YAN S M, WANG P Y, et al. Effects of feeding probiotics on intestinal microbe quantity and dietary nutrient digestibility of dairy cows[J]. Animal Husbandry and Feed Science, 2011, 32(9): 174-175, 186 (in Chinese). DOI:10.3969/j.issn.1672-5190.2011.09.065 |
| [29] |
QIAO G H, SHAN A S, MA N, et al. Effect of supplemental Bacillus cultures on rumen fermentation and milk yield in Chinese Holstein cows[J]. Journal of Animal Physiology and Animal Nutrition, 2010, 94(4): 429-436. |
| [30] |
BRAMBILLASCA S, ZUNINO P, CAJARVILLE C. Addition of inulin, alfalfa and citrus pulp in diets for piglets: influence on nutritional and faecal parameters, intestinal organs, and colonic fermentation and bacterial populations[J]. Livestock Science, 2015, 178: 243-250. DOI:10.1016/j.livsci.2015.06.003 |
| [31] |
梁金逢, 文信旺, 周晓情, 等. TMR日粮添加寡糖和复合益生菌对育成牛生长性能、免疫功能及抗氧化功能的影响[J]. 饲料工业, 2019, 40(15): 41-44. LIANG J F, WEN X W, ZHOU X Q, et al. Effects of TMR diets added oligosaccharide and compound probiotics on the growth performance, immune function and antioxidant function of breeding cattle[J]. Feed Industry, 2019, 40(15): 41-44 (in Chinese). |
| [32] |
彭华. 纳豆枯草芽孢杆菌对奶牛生产性能、瘤胃发酵和血液指标的影响[D]. 博士学位论文. 北京: 中国农业科学院, 2011. PENG H. Effects of Bacillus subtilis natto on performance, rumen fermentation and blood metabolites in early lactation[D]. Ph. D. Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2011. (in Chinese) |
| [33] |
张志军. 复合益生菌制剂对绵羊瘤胃发酵、血清生化和奶牛生产性能的影响[D]. 硕士学位论文. 乌鲁木齐: 新疆农业大学, 2012. ZHANG Z J. Effect of dietary compound probiotics on rumen fermentation, serum bilchemistry of sheep and productive performance of dairy cow[D]. Master's Thesis. Urumqi: Xinjiang Agricultural University, 2012. (in Chinese) |
| [34] |
谢明欣, 李常瑞, 杨晓东, 等. 不同精粗比饲粮条件下复合益生菌对绵羊瘤胃微生物种群的影响[J]. 动物营养学报, 2020, 32(9): 4418-4428. XIE M X, LI C R, YANG X D, et al. Effects of compound probiotics on rumen microbial population in sheep fed different concentrate to roughage ratio diets[J]. Chinese Journal of Animal Nutrition, 2020, 32(9): 4418-4428 (in Chinese). |
| [35] |
杨东吉, 张静静, 朱随亮, 等. 酿酒酵母培养物替代抗生素对断奶仔猪生长性能、养分消化率及盲肠微生物区系的影响[J]. 动物营养学报, 2020, 32(1): 138-147. YANG D J, ZHANG J J, ZHU S L, et al. Effects of Saccharomyces cerevisiae culture instead of antibiotics on growth performance, nutrient digestibility and cecal microflora of weaned piglets[J]. Chinese Journal of Animal Nutrition, 2020, 32(1): 138-147 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.01.019 |
| [36] |
KHAFIPOUR E, LI S, TUN H M, et al. Effects of grain feeding on microbiota in the digestive tract of cattle[J]. Animal Frontiers, 2016, 6(2): 13-19. DOI:10.2527/af.2016-0018 |
| [37] |
DA SILVA SABO S, CONVERTI A, TODOROV S D, et al. Effect of inulin on growth and bacteriocin production by Lactobacillus plantarum in stationary and shaken cultures[J]. International Journal of Food Science & Technology, 2015, 50(4): 864-870. |
| [38] |
张翔飞. 活性干酵母对肉牛瘤胃发酵、纤维降解及微生物菌群的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2014. ZHANG X F. Effect of active dried yeast on rumen fermentation, fiber degradation and microbial community of beef cattle[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2014. (in Chinese) |
| [39] |
ATTIA Y A, BOVERA F, EL-TAHAWY W S, et al. Productive and reproductive performance of rabbits does as affected by bee pollen and/or propolis, inulin and/or mannan-oligosaccharides[J]. World Rabbit Science, 2015, 23(4): 273-282. DOI:10.4995/wrs.2015.3644 |
| [40] |
胡婷, 李键, 张玉, 等. 菊粉调节能量代谢紊乱机制的研究进展[J]. 食品科学, 2019, 40(17): 325-330. HU T, LI J, ZHANG Y, et al. Progress in the understanding of the mechanism by which inulin regulates energy metabolism disorders[J]. Food Science, 2019, 40(17): 325-330 (in Chinese). DOI:10.7506/spkx1002-6630-20180904-032 |




