去势通常是指摘除家畜睾丸和副性腺或使睾丸萎缩被机体吸收而失去正常生殖能力的外科手术。而半去势是去掉公畜单侧睾丸和副性腺的一种重要的研究睾丸发育的方法。已有研究表明,去势会导致公畜体内激素浓度发生改变,其中主要是性激素的变化[1],从而使其攻击性[2]、生长性能[3]大幅降低,并且还能显著提高其肉品质[4-5],因此是生产管理中产出高档雪花肉的方法之一。此外,前人研究还发现内源性激素的改变能够显著影响瘤胃代谢水平,例如雌二醇(E2)抑制瘤胃代谢,而孕酮(PROG)和睾酮(T)则提高瘤胃代谢。雄性水牛去势后发现,其瘤胃微生物蛋白、总挥发性脂肪酸浓度降低,而氨态氮(NH3-N)浓度升高[6]。蔡天权等[7]经过体内和体外试验发现,无论是肌肉注射0.1 mg/kg BW的17β-雌二醇还是体外发酵添加0.1 mg/mL 17β-雌二醇都能够使瘤胃液微生物总脱氢酶活性和总挥发性脂肪酸浓度显著降低,抑制瘤胃代谢。小鼠半去势研究表明,与半去势组相比,双去势组单位体积去睾丸胴体和肌肉重量均无显著差异,但双去势组平均日增重(ADG)较低[8]。同时Wang等[9]对半去势和未去势的小鼠进行研究发现,半去势后的小鼠普遍具有代偿性增长现象,即半去势后生长情况与未去势无显著差异。此外,半去势小鼠还会出现代偿性雄激素生成,从而具有正常的生殖能力[10]。虽然目前对去势的研究较为成熟,但集中于探究不同去势时间、不同去势方法和双去势与未去势之间的影响,对反刍动物半去势的研究至今未见报道。因此,本研究主要探究不同去势程度(双去势、半去势和未去势)对筠连黄牛生长性能、血液指标和瘤胃发酵的影响,旨在为不同程度去势对地方肉牛品种的影响提供一定的理论依据,并对半去势在肉牛上的运用提供参考。
1 材料与方法 1.1 试验动物试验选用年龄一致(9月龄)、体重[(184.46±17.37) kg]相近、健康的筠连黄牛公牛18头。
1.2 试验设计将18头筠连黄牛随机分成3组,即假手术组(未去势,仅在阴囊左侧划一刀)、双去势组(去掉全部睾丸及副性腺)和半去势组(去掉左侧睾丸及副性腺),每组6头牛。去势后观察14 d,无不良反应后开始饲养试验,预试期7 d,正试期240 d。
1.3 试验饲粮试验饲粮营养水平达到《肉牛饲养标准》(NY/T 815—2004)对体重250 kg增重800 g/d肉牛的推荐标准,精粗比为4 ∶ 6。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the experimental diet (DM basis) |
试验于2019年11月至2020年7月在四川农业大学试验场进行。试验前筠连黄牛统一打耳标,接种疫苗,驱虫,并定时打扫牛舍卫生和消毒。所有试验牛分栏饲养,每天饲喂2次(09:00和17:00),并保证自由采食和饮水。
1.5 样品采集与指标测定 1.5.1 生长性能测定正试期第1天和第240天08:00,对肉牛进行空腹称重,计算各组筠连黄牛平均日增重;试验期每天记录各试验牛精料、粗料实际饲喂量,并换算成干物质采食量(DMI);按照如下公式计算营养物质摄入量:
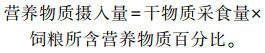
|
在正试期第240天晨饲前颈静脉采集血液,静置30 min后以3 000 r/min离心10 min制备血清,置于-20 ℃冰箱保存,用于血清激素及生化指标的测定。
血清激素浓度测定:采用酶联免疫吸附测定(ELISA)法测定血清中睾酮、雌二醇、孕酮、促肾上腺皮质激素(ACTH)、胰高血糖素(GC)、胰岛素(INS)、生长激素(GH)和生长抑素(SS)的浓度。上述指标测定所用试剂盒均购于南京建成生物工程研究所。
血清生化指标测定:血清中尿素氮(UN)、白蛋白(ALB)、总蛋白(TP)、甘油三酯(TG)、游离脂肪酸(NEFA)、葡萄糖(GLU)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、总胆固醇(TC)、β-羟基丁酸(β-HB)含量与碱性磷酸酶(ALP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)活性使用全自动生化分析仪(3100,日立,日本)测定,并计算球蛋白(GLO)含量和白球比(A/G),其中球蛋白含量为总蛋白与白蛋白含量的差值,白球比为白蛋白与球蛋白含量的比值。
1.5.3 瘤胃液采集与指标测定于正试期第240天晨饲前1 h采用口腔瘤胃导管取样法,通过连接有聚氯乙烯(PVC)管的真空泵抽取筠连黄牛的瘤胃液。丢弃前150 mL的瘤胃内容物以避免唾液的污染[11]。然后抽取60 mL瘤胃液,测定完pH后将瘤胃液经4层纱布过滤分装在15 mL离心管中,放入-20 ℃冰箱保存。
瘤胃发酵参数测定:瘤胃液pH采用25型高精度pH酸度计进行测定;氨态氮浓度采用碱性次氯酸钠-苯酚分光光度法进行测定[12];使用差速离心法和二喹啉甲酸(BCA)法测定微生物蛋白(MCP)浓度,具体操作步骤参照庄二林[13]的方法和试剂盒说明书(蛋白定量试剂盒,南京建成生物工程研究所);乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸6种挥发性脂肪酸(VFA)浓度是以巴豆酸为内标物采用气相色谱仪(瓦里安CP-3800,美国)测定;总挥发性脂肪酸(TVFA)浓度为乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸浓度之和。
1.6 数据处理与分析用Excel 2016对数据进行初步处理,以SPSS 22.0统计软件对数据进行单因素方差分析(one-way ANOVA),并用Duncan氏法进行多重比较,结果以平均值和均值标准误(SEM)表示,P≤0.05为差异显著。
2 结果与分析 2.1 不同去势程度对筠连黄牛生长性能的影响由表 2可知,去势后240 d时,双去势组筠连黄牛体重相比假手术组显著增高(P≤0.05);此外,双去势组的平均日增重显著高于假手术组(P≤0.05)。
|
|
表 2 不同去势程度对筠连黄牛生长性能的影响 Table 2 Effects of different castration degrees on growth performance of Junlian cattle |
由表 3可知,不同去势程度对筠连黄牛饲粮、粗料和精料干物质采食量及各营养物质摄入量均无显著影响(P>0.05)。
|
|
表 3 不同去势程度对筠连黄牛干物质采食量和营养物质摄入量的影响 Table 3 Effects of different castration degrees on DMI and nutrient intake of Junlian cattle |
由表 4可知,双去势组血清睾酮浓度比半去势组和假手术组分别降低了46.59%和51.99%,差异显著(P≤0.05),而双去势组血清雌二醇浓度比半去势组和假手术组分别升高了15.82%和27.55%,差异显著(P≤0.05);与假手术组相比,双去势组血清胰岛素和生长抑素浓度显著升高(P≤0.05),而血清生长激素浓度则显著降低(P≤0.05);3组之间血清孕酮、促肾上腺皮质激素和胰高血糖素浓度无显著差异(P>0.05)。
|
|
表 4 不同去势程度对筠连黄牛血清激素浓度的影响 Table 4 Effects of different castration degrees on serum hormone concentrations of Junlian cattle |
由表 5可知,不同去势程度对筠连黄牛血清总胆固醇、甘油三酯、高密度脂蛋白、葡萄糖、β-羟基丁酸、白蛋白、尿素氮浓度与谷丙转氨酶活性均未造成显著影响(P>0.05);双去势组血清游离脂肪酸浓度比假手术组降低看53.85%,差异显著(P≤0.05);而与双去势组相比,无论是假手术组还是半去势组,血清低密度脂蛋白浓度、谷草转氨酶和碱性磷酸酶活性均显著降低(P≤0.05);此外,与假手术组相比,双去势组血清总蛋白和球蛋白浓度分别降低了13.22%和26.30%,差异显著(P≤0.05);同时,双去势组白球比显著高于假手术组(P≤0.05)。
|
|
表 5 不同去势程度对筠连黄牛血清生化指标的影响 Table 5 Effects of different castration degrees on serum biochemical indexes of Junlian cattle |
由表 6可知,双去势组筠连黄牛瘤胃液pH显著高于假手术组(P≤0.05);与假手术组相比,双去势组瘤胃液氨态氮、微生物蛋白、总挥发性脂肪酸、乙酸、丙酸、异戊酸和异丁酸浓度均显著降低(P≤0.05);此外,双去势组瘤胃液丁酸浓度较假手术组降低了39.40%,有显著降低的趋势(0.05<P≤0.10)。
|
|
表 6 不同去势程度对筠连黄牛瘤胃发酵参数的影响 Table 6 Effects of different castration degrees on rumen fermentation parameters of Junlian cattle |
研究表明,动物生长与体内雄性激素浓度密切相关,睾酮影响动物生长激素的分泌,促进蛋白质合成、骨骼生长和钙磷沉积,体内雄性激素浓度高的动物生长速度更快[14-16]。由本试验结果可以看出,与未去势相比,双去势能够显著降低筠连黄牛的体重和平均日增重,这一点与郭同军等[17]的研究相一致。Bretschneider[18]指出,对于不同品种肉牛,不同去势方式及不同去势月龄对增重效果的影响较一致,即去势降低了肉牛增重效果。Mach等[19]对8月龄荷斯坦牛阉割后的生长性能的研究表明,未去势组终末体重和平均日增重均显著高于去势组;Álvarez-Rodríguez等[20]对10月龄野牛去势后发现,在19月龄后未去势野牛体重显著高于去势野牛,同时在21月龄时去势野牛平均日增重也显著低于未去势野牛。李宇等[21]对3月龄小尾寒羊去势后发现,去势并不会导致干物质采食量出现显著性改变,这与本试验结果一致。
本试验中双去势组终末体重和平均日增重相比假手术组分别显著降低了13.89%和33.33%,然而李旭等[3]对去势后安草杂交公牛生长性能的研究显示,通过育肥试验后,去势组的终末体重和平均日增重比未去势组分别显著降低了4.52%和14.91%,对于这种结果的差异可能是因为牛的品种不同所导致。虽然本试验中半去势组终末体重和平均日增重与假手术组没有显著差异,但是存在普遍降低的现象。对于类似研究,Wang等[9]探究半去势对小鼠生长发育影响的研究发现,与未去势组相比,半去势组小鼠体重、去睾丸体重和体增重均无显著变化。该现象的合理解释可能是半去势后的动物可能存在代偿性机制,使得自身体重和增重与假手术组之间差异不显著。
3.2 不同去势程度对筠连黄牛血清激素浓度的影响众所周知,无论是雄性还是雌性动物,体内都含有一定浓度的雄激素和雌激素,但是两者浓度却各不相同。雄性动物雄激素较多而雌激素较少,雌性动物恰好相反。前人研究发现,公畜去势后体内睾酮浓度显著降低[22],而半去势却因保留了一侧睾丸出现代偿性雄激素生成现象[10],这与本试验结果相一致。雌激素中活性最强的是雌二醇,雌二醇主要作用是促进脂肪的合成,使血液中高密度脂蛋白浓度增加,从而降低胆固醇浓度。吕强[23]对22~26月龄青年新疆褐去势后血清激素浓度的研究发现,去势组新疆褐牛血清雌二醇浓度显著高于未去势组。He等[24]对雄性田鼠去势后发现,去势后1~4周,血清雌二醇浓度逐渐升高,并且第3、4周与之前几周呈现出显著改变。促肾上腺皮质激素和胰高血糖素是促进脂肪分解的激素,而胰岛素则是通过增加葡萄糖的氧化分解,促进葡萄糖合成糖原、脂肪、蛋白质等非糖物质,从而降低血糖浓度。本试验发现,血清胰岛素浓度从高到底依次是双去势组、半去势组和假手术组,且双去势组与假手术组差异显著;同时,促肾上腺皮质激素和胰高血糖素浓度变化虽然不显著,但是其变化趋势与胰岛素几乎相反。这可能说明不同去势程度对动物机体脂肪代谢具有一定的影响,其中双去势组筠连黄牛机体脂肪合成代谢最强,其次是半去势组,最后是假手术组。生长激素是垂体前叶分泌的一种肽类激素,对机体生长发育起着重要的作用,能够促进骨骼的生长。与之相反的是生长抑素,它能抑制生长激素的分泌。本试验发现,随着去势程度的增加,血清生长激素浓度逐渐降低,生长抑素浓度逐渐升高,抑制机体的生长发育,这与去势240 d时双去势组体重显著降低的结果相一致。
3.3 不同去势程度对筠连黄牛血清生化指标的影响血清生化指标能够较为粗略地反映动物机体的新陈代谢和健康状况[25]。低密度脂蛋白和高密度脂蛋白在血清中常与胆固醇结合,是2种重要的载脂蛋白,低密度脂蛋白主要将胆固醇从肝脏运送到全身组织,而高密度脂蛋白将各组织的胆固醇送回肝脏进行分解[26]。游离脂肪酸是甘油三酯分解后的产物,其浓度可以用来衡量脂肪动员的程度[16]。本试验结果表明,双去势组血清低密度脂蛋白和高密度脂蛋白浓度均高于其他2组,而游离脂肪酸浓度显著低于假手术组,这说明双去势能够改变筠连黄牛血清脂质代谢水平,并且脂肪合成代谢较假手术组强。Shah等[27]对筠连黄牛进行不同程度去势后发现,在去势后60~120 d,双去势筠连黄牛血清甘油三酯、高密度脂蛋白和低密度脂蛋白浓度高于半去势组和未去势组,与本研究结果一致。碱性磷酸酶是体内代谢的关键酶,其活性与体内糖类、脂肪和蛋白质的吸收有着密切的关联。本试验中双去势组血清碱性磷酸酶活性高于其他2组,说明去势能够提高该酶的活性,促进脂肪的合成。血清白蛋白与球蛋白之和即为总蛋白,其浓度升高有利于机体的生长发育;其中血清球蛋白浓度的高低与动物机体免疫能力和蛋白质代谢能力相关,球蛋白浓度高,说明免疫力相对较高,蛋白质代谢能力强;同时白球比也与机体免疫系统状态相关[28],该比值降低代表机体内用于提高自身免疫力的球蛋白相对更多,则抵抗力更强,反之抵抗力较弱。通过本试验研究发现,双去势组血清球蛋白和总蛋白含量显著低于假手术组,这可能说明双去势能够对机体的免疫能力造成损伤,并且使蛋白质合成能力下降,不利于机体的生长发育。
3.4 不同去势程度对筠连黄牛瘤胃发酵参数的影响反刍动物的瘤胃是一个巨大的“发酵罐”,在发酵过程中会产生酸性和碱性物质,瘤胃液pH作为重要测定指标,在评价瘤胃内环境稳态中具有重要作用。本试验发现,双去势组瘤胃液pH显著高于假手术组,这可能与双去势组瘤胃液总挥发性脂肪酸浓度降低有关。瘤胃液微生物蛋白浓度一方面可以反映瘤胃微生物种群数量的高低,另一方面也与瘤胃液氨态氮浓度有关。通常在一定范围内,随着瘤胃液氨态氮浓度的增加,微生物蛋白的合成也增加。杨国宇[29]向装有胃肠道瘘管的雄性水牛经十二指肠瘘管注入大豆黄酮后,发现睾酮浓度升高增加了瘤胃的消化代谢,进而提高了瘤胃液微生物蛋白浓度。本试验中双去势组瘤胃液氨态氮浓度显著低于其他2组,而微生物蛋白浓度呈现相反的结果,因此可以推测随着去势程度的增加导致睾酮浓度不断降低,从而影响瘤胃液氨态氮和微生物蛋白的浓度。瘤胃代谢能产生大量的短链脂肪酸,这些短链脂肪酸为反刍动物提供70%~80%的能量[30]。研究发现,瘤胃代谢与机体内源性激素有关,雌二醇抑制瘤胃代谢[7],而睾酮则增强瘤胃代谢[31]。对不同性别24月龄荷斯坦牛瘤胃液的研究发现,与母牛相比,公牛对饲粮中总固体物和酸性洗涤纤维的降解率较高,瘤胃液中总挥发性脂肪酸浓度较高,并且不同性别间瘤胃细菌群落存在显著差异[32]。本试验发现,与假手术组相比,双去势组的筠连黄牛瘤胃液挥发性脂肪酸(除戊酸和丁酸)浓度均显著降低,而半去势组却无显著变化,其原因可能是双去势后睾酮浓度降低,雌二醇浓度升高导致瘤胃代谢降低。瘤胃发酵能顺利进行依赖于瘤胃微生物,反刍动物摄入的饲粮在其作用下被分解成能被机体消化吸收的营养物质,并且营养物质摄入量又影响着瘤胃微生物,由此可见其营养物质摄入量影响着瘤胃发酵。本研究发现,双去势组虽然瘤胃代谢显著降低,但其干物质采食量和各营养物质摄入量与其他2组相比无显著差异,因此认为这可能是因为内分泌激素改变所导致。前人研究发现,在瘤胃细菌、原虫和纤毛虫表面发现了激素受体[7, 33],此外,在单胃动物中发现性激素可以改变微生物区系[34]。对于本试验中双去势组瘤胃挥发性脂肪酸浓度较低的另一种解释是双去势导致激素浓度改变,从而影响了瘤胃微生物表面激素受体的结合而影响了微生物区系。
4 结论综上可知,双去势后的筠连黄牛生长性能较差,抑制了瘤胃代谢,但能一定程度促进脂肪合成;半去势后的筠连黄牛由于睾丸激素的代偿性分泌,能弥补单侧睾丸缺失所产生的不利影响,使其与假手术组无显著差异。
| [1] |
郭同军, 臧长江, 王连群, 等. 去势对17~21月龄西门塔尔牛激素分泌的影响[J]. 西北农业学报, 2017, 26(8): 1111-1117. GUO T J, ZANG C J, WANG L Q, et al. Effects of castration on hormone concentration in serum of Simmental cattle aged from 17 to 21 months[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2017, 26(8): 1111-1117 (in Chinese). |
| [2] |
刘应进, 朱晓芳, 郭同军, 等. 去势对西门塔尔牛散栏饲养行为的影响[J]. 草食家畜, 2020(2): 31-35. LIU Y J, ZHU X F, GUO T J, et al. Effects of castration on feeding behaviors of Simmental cattle in free stall[J]. Grass-Feeding Livestock, 2020(2): 31-35 (in Chinese). |
| [3] |
李旭, 刘基伟, 翟博, 等. 去势对安草杂交公牛生长性能和肌肉营养成分的影响[J]. 黑龙江畜牧兽医, 2020(3): 48-51. LI X, LIU J W, ZHAI B, et al. Effects of castration on growth performance and muscle nutritional components of male Angus-Steppe red cattle of crosses[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020(3): 48-51 (in Chinese). |
| [4] |
LI J, TANG C H, ZHAO Q Y, et al. Integrated lipidomics and targeted metabolomics analyses reveal changes in flavor precursors in psoas major muscle of castrated lambs[J]. Food Chemistry, 2020, 333: 127451. DOI:10.1016/j.foodchem.2020.127451 |
| [5] |
GKARANE V, BRUNTON N P, HARRISON S M, et al. Volatile profile of grilled lamb as affected by castration and age at slaughter in two breeds[J]. Journal of Food Science, 2018, 83(10): 2466-2477. DOI:10.1111/1750-3841.14337 |
| [6] |
杨国宇, 胡清林, 陈杰. 雄性水牛去势对瘤胃消化代谢的影响[J]. 河南农业大学学报, 1997(3): 97-101. YANG G Y, HU Q L, CHEN J. Effect of castration on the rumen digestion and metabolism in male buffaloes[J]. Journal of Henan Agricultural University, 1997(3): 97-101 (in Chinese). |
| [7] |
蔡天权, 韩正康, 陈伟华, 等. 17β-雌二醇对瘤胃消化代谢调节的研究[J]. 南京农业大学学报, 1990(S1): 131-136. CAI T Q, HAN Z K, CHEN W H, et al. Studies on the control of rumen digestion and metabolism by 17β-estradiol[J]. Journal of Nanjing Agricultural University, 1990(S1): 131-136 (in Chinese). |
| [8] |
奉永友. 早期去势对小鼠生长发育及各功能器官组织学结构的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2016. FENG Y Y. The effect of early castration on the growing development and histological structure of organs in male mice[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2016. (in Chinese) |
| [9] |
WANG Y X, JIN L, MA J D, et al. Hemicastration induced spermatogenesis-related DNA methylation and gene expression changes in mice testis[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(2): 189-197. DOI:10.5713/ajas.17.0518 |
| [10] |
DUTTA S, JOSHI K R, SENGUPTA P, et al. Unilateral and bilateral cryptorchidism and its effect on the testicular morphology, histology, accessory sex organs, and sperm count in laboratory mice[J]. Journal of Human Reproductive Sciences, 2013, 6(2): 106-110. DOI:10.4103/0974-1208.117172 |
| [11] |
SHEN J S, CHAI Z, SONG L J, et al. Insertion depth of oral stomach tubes may affect the fermentation parameters of ruminal fluid collected in dairy cows[J]. Journal of Dairy Science, 2012, 95(10): 5978-5984. DOI:10.3168/jds.2012-5499 |
| [12] |
BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. Journal of Dairy Science, 1980, 63(1): 64-75. DOI:10.3168/jds.S0022-0302(80)82888-8 |
| [13] |
庄二林. 苜蓿与谷草组合效应的评定研究[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2017. ZHUANG E L. Evaluate of associate effects between alfalfa hay and millet stalk[D]. Master's Thesis. Yangling: Northwest A & F University, 2017. (in Chinese) |
| [14] |
TAKEDA H, CHODAK G, MUTCHNIK S, et al. Immunohistochemical localization of androgen receptors with mono- and polyclonal antibodies to androgen receptor[J]. The Journal of Endocrinology, 1990, 126(1): 17-25. DOI:10.1677/joe.0.1260017 |
| [15] |
LUBRITZ D, JOHNSON B, ROBISON O W. Genetic parameters for testosterone production in boars[J]. Journal of Animal Science, 1991, 69(8): 3220-3224. DOI:10.2527/1991.6983220x |
| [16] |
WONG W C, BOYLAN W J, STOTHERS S C. Effects of dietary protein level and sex on swine performance and carcass traits[J]. Canadian Journal of Animal Science, 1968, 48(3): 383-388. DOI:10.4141/cjas68-050 |
| [17] |
郭同军, 臧长江, 王连群, 等. 去势对17~21月龄西门塔尔牛生长性能的影响[J]. 中国畜牧兽医, 2015, 42(5): 1173-1179. GUO T J, ZANG C J, WANG L Q, et al. The influence of castration on growth performance of Simmental cattle aged from 17 to 21 months[J]. China Animal Husbandry & Veterinary Medicine, 2015, 42(5): 1173-1179 (in Chinese). |
| [18] |
BRETSCHNEIDER G. Effects of age and method of castration on performance and stress response of beef male cattle: a review[J]. Livestock Production Science, 2005, 97(2/3): 89-100. |
| [19] |
MACH N, BACH A, REALINI C E, et al. Burdizzo pre-pubertal castration effects on performance, behaviour, carcass characteristics, and meat quality of Holstein bulls fed high-concentrate diets[J]. Meat Science, 2009, 81(2): 329-334. DOI:10.1016/j.meatsci.2008.08.007 |
| [20] |
ÅLVAREZ-RODRÍGUEZ J, ALBERTÍ P, RIPOLL G, 等. Effect of castration at 10 months of age on growth physiology and behavior of male feral beef cattle[J]. Animal Science Journal, 2017, 88(7): 991-998. |
| [21] |
李宇, 赵张晗, 段春辉, 等. 去势对小尾寒羊公羔育肥及肉品质的影响[J]. 中国畜牧杂志, 2018, 54(12): 103-108. LI Y, ZHAO Z H, DUAN C H, et al. Effect of castration on fattening and meat quality of male small-tail Han lambs[J]. Chinese Journal of Animal Science, 2018, 54(12): 103-108 (in Chinese). |
| [22] |
郭珍珍, 何丽华, 辛杭书, 等. 初生去势对荷斯坦公犊体重和血液生化、激素指标的影响[J]. 黑龙江畜牧兽医, 2020(17): 1-5. GUO Z Z, HE L H, XIN H S, et al. Effect of castration at birth on body weight, blood biochemical and hor mone indexes of Holstein bull calves[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020(17): 1-5 (in Chinese). |
| [23] |
吕强. 去势对青年新疆褐牛生长发育及血清生化指标的影响[D]. 硕士学位论文. 乌鲁木齐: 新疆农业大学, 2014. LV Q. Effect of castration on growth and development and serum biochemical indicators of the young Xinjiang brown cattle[D]. Master's Thesis. Urumqi: Xinjiang Agricultural University, 2014. (in Chinese) |
| [24] |
HE F Q, TAI F D, ZHANG Y H, et al. Effects of castration on aggression and levels of serum sex hormones and their central receptors in mandarin voles (Microtus mandarinus)[J]. Journal of Comparative Physiology A, 2012, 198(5): 347-362. DOI:10.1007/s00359-012-0713-6 |
| [25] |
LIU Q W, WANG F, WEI L M, et al. Effect of pelleted total mixed ration on production performance and serum biochemical index of growing Hainan black goats[J]. Animal Husbandry and Feed Science, 2019, 11(1): 19-22, 31. |
| [26] |
周顺伍. 动物生物化学[M]. 3版. 北京: 中国农业出版社, 1999. ZHOU S W. Animal biochemistry[M]. 3rd ed. Beijing: China Agriculture Press, 1999 (in Chinese). |
| [27] |
SHAH A M, WANG Z S, MA J, et al. Effects of uni and bilateral castration on growth performance and lipid metabolism in yellow cattle[J/OL]. Animal Biotechnology, 2021. (2021-06-17). https://doi.org/10.1080/10495398.2021.1936540. DOI: 10.1080/10495398.2021.1936540.
|
| [28] |
王喜明, 许丽, 袁玲, 等. 低聚木糖对犊牛生长性能和血液生化指标的影响[J]. 东北农业大学学报, 2008, 39(7): 61-65. WANG X M, XU L, YUAN L, et al. Effects of xylo-oligosaccharide (XOS) on performance and serum indexes in dairy calf[J]. Journal of Northeast Agricultural University, 2008, 39(7): 61-65 (in Chinese). DOI:10.3969/j.issn.1005-9369.2008.07.015 |
| [29] |
杨国宇. 睾酮调节瘤胃消化代谢的研究[D]. 博士学位论文. 南京: 南京农业大学, 1994. YANG G Y. Study on regulation of rumen digestion and metabolism by testosterone[D]. Ph. D. Thesis. Nanjing: Nanjing Agricultural University, 1994. (in Chinese) |
| [30] |
ABUELFATAH K, ZUKI A B, GOH Y M, et al. Effects of feeding whole linseed on ruminal fatty acid composition and microbial population in goats[J]. Animal Nutrition, 2016, 2(4): 323-328. DOI:10.1016/j.aninu.2016.10.004 |
| [31] |
杨国宇, 陈伟华, 陈杰, 等. 雄性水牛瘤胃内睾酮的检测及变化规律的研究[J]. 南京农业大学学报, 1998(1): 85-89. YANG G Y, CHEN W H, CHEN J, et al. Detection and regulation of rumen fluid testosterone in buffalo bulls[J]. Journal of Nanjing Agricultural University, 1998(1): 85-89 (in Chinese). |
| [32] |
HE Y, WANG H B, YU Z T, et al. Effects of the gender differences in cattle rumen fermentation on anaerobic fermentation of wheat straw[J]. Journal of Cleaner Production, 2018, 205: 845-853. DOI:10.1016/j.jclepro.2018.09.156 |
| [33] |
王金洛, 韩正康, 陈杰. 孕酮调节瘤胃消化代谢的研究[J]. 南京农业大学学报, 1991(2): 74-78. WANG J L, HAN Z K, CHEN J. Studies on the regulation of the ruminal digestion and metabolism by progesterone[J]. Journal of Nanjing Agricultural University, 1991(2): 74-78 (in Chinese). |
| [34] |
DE LA CUESTA-ZULUAGA J, KELLEY S T, CHEN Y F, et al. Age- and sex-dependent patterns of gut microbial diversity in human adults[J]. mSystems, 2019, 4(4): e00261-19. DOI:10.1128/mSystems.00261-19 |




