2. 海南 浙江大学研究院, 三亚 572000;
3. 杭州望妙生物科技有限责任公司, 杭州 310000
2. Hainan Institute, Zhejiang University, Sanya 572000, China;
3. Hangzhou Wangmiao Biological Technology Co., Ltd., Hangzhou 310000, China
随着经济的快速发展和生活水平显著提高,未来人们在宠物猫上的消费增长态势强劲[1]。在宠物猫饲养过程中,经常由于季节和温度的更替、饲养环境的变化以及更换不同的猫粮等产生应激反应,从而影响宠物猫的机体健康,并可能会导致其腹泻、食欲不振、抵抗力下降以及精神萎靡等情况发生。此外,宠物猫比传统畜禽的饲养环境更多样化,加上猫有舔毛的习性,容易使病原菌进入体内造成肠道菌群紊乱甚至疾病的发生[2]。
益生菌被定义为“当给予一定剂量时,有益于宿主健康的活微生物”[3]。目前研究表明,益生菌能与病原菌竞争营养物质和黏附位点[4],改善肠道菌群结构和功能[5];促进消化酶合成和分泌,提高机体对营养物质消化吸收和利用[6-7];此外还能加强肝脏对营养物质代谢的功能[8];促进肠道蠕动,缓解便秘[9];改善肠黏膜结构,增强物理屏障功能[10];提高机体免疫功能,预防动物患病死亡[11];提高抗应激能力[12-13],降低细胞凋亡促进肠黏膜修复[14]。解淀粉芽孢杆菌和枯草芽孢杆菌均属于芽孢杆菌属,在传统的畜禽饲粮上已有广泛的研究应用,研究表明在猪饲粮中添加1×108 CFU/kg解淀粉芽孢杆菌可以改善仔猪消化和吸收酶活性、增强肠道完整性和调节肠道菌群数量,从而提高其生长性能[6];在肉鸡饲粮中加入1×109 CFU/kg枯草芽孢杆菌可以提高鸡的生长性能,改善其免疫功能和抗病能力[15]。在宠物猫上已有研究表明,饲粮中添加5×109 CFU/kg嗜酸乳杆菌D2/CSL可以增加宠物猫粪便中乳杆菌数量以及减少大肠杆菌数量[16],添加2.1×109 CFU/g粪肠球菌SF68可以减少猫的腹泻发生[17],但复合芽孢杆菌在宠物猫上的研究鲜有报道。因此,本试验以促进宠物猫机体健康为出发点,研究饲粮中添加复合芽孢杆菌对成年布偶猫生长、养分表观消化率、血清生化指标及抗氧化功能的影响,为其在饲粮中的应用提供理论依据,也为后续在伴侣动物上的研究奠定基础。
1 材料与方法 1.1 试验材料复合益生芽孢杆菌制剂[含解淀粉芽孢杆菌SC06(BaSC06)和枯草芽孢杆菌B10,均由本实验室分离保存]由本实验室制备提供,其中BaSC06菌液浓度约为1×1010 CFU/mL,枯草芽孢杆菌B10菌液浓度约为1.1×1010 CFU/mL,2种菌按1∶1比例混合。试验中基础饲粮和添加复合益生芽孢杆菌制剂的试验饲粮均由杭州某生物科技有限责任公司制备。
1.2 试验设计及饲养管理试验按照以下标准选取20只成年布偶猫:年龄1~2岁,平均体重为(3.91±0.92) kg,随机分为2组,每组10个重复,每个重复1只猫,其中雄性布偶猫∶雌性布偶猫=4∶6。对照组饲喂基础饲粮,试验组饲喂含有3×109 CFU/kg复合益生芽孢杆菌的试验饲粮,基础饲粮满足AAFCO(2017)的营养需求,其组成及营养水平见表 1。试验期共33 d,其中预试期为5 d,正试期为28 d。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验前已进行必要的免疫、驱虫处理,并且在试验开始前1个月内没有接受任何会改变肠道微生物区系的药物(例如抗生素)。每天早、晚各铲屎1次,每周更换猫砂1次,每天打扫卫生和消毒猫舍,保持宠物圈舍内的清洁,每天逗猫30 min以上。每天08:30给每只猫称取定量的饲粮,早上称量前先把食碗擦洗干净,每天准确记录每只猫的饲喂量和第2天剩余量,下午铲屎时观察粪便状态并记录。在整个试验期间保证猫自由饮水和进食。
1.3 饲粮样品收集在试验第1、28天分别采集每组各200 g饲粮样品,置于干燥器中保存,用于检测常规养分。
1.4 粪便样品收集在试验第1、28天分别采集各组每只猫排便15 min内的新鲜粪便,然后装入样品袋放入-20 ℃保存,用于后续试验。
1.5 生长性能及腹泻率指标测定分别于试验第1、28天对猫进行空腹称重。整个试验阶段每天08:00记录采食量,并按表 2标准进行粪便评分(fecal score,FS)以及记录腹泻次数,计算各组的腹泻率和软便率,计算公式如下:

|
|
|
表 2 粪便评分标准 Table 2 Scoring standard of fecal score |
本试验中养分表观消化率以盐酸不溶灰分(AIA)为内源指示剂测定,计算公式如下:
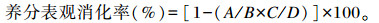
|
式中:A代表粪中某养分含量(%);B代表饲粮中相应养分含量(%);C代表饲粮中AIA的含量;D代表粪便中AIA的含量。
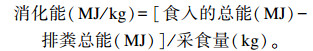
|
试验结束时,每组选取8只猫前肢静脉采血。将一部分血液收集在含乙二胺四乙酸二钾(EDTA-K2)的乙二胺四乙酸(EDTA)管中用于全血血常规指标检测,另一部分血液置于促凝管中进行血清生化指标分析。
全血血常规指标检测采用Sysmex microcell counter CL-180全自动血液学分析仪(Sysmex Corporation, 美国)测量,包括白细胞数目(WBC)、淋巴细胞数目(LY)、单核细胞数目(MON)、中性粒细胞数目(NC)、红细胞数目(RBC)、血红蛋白(HGB)、红细胞比容(HCT)、平均红细胞体积(MCV)、平均红细胞血红蛋白(MCH)、平均红细胞血红蛋白浓度(MCHC)、红细胞分布宽度(RDW)、血小板数目(PLT)、血小板平均体积(MPV)、血小板体积分布宽度(PDW)和血小板压积(PCT)。
将血样收集在促凝管中,4 ℃,3 500 r/min离心10 min,将上清分装于离心管中,置于-80 ℃冰箱中保存待用。全自动生化分析仪(HITACHI7160,HITACHI,日本)测定血清生化指标,包括白蛋白(ALB)、总蛋白(TPRO)、球蛋白(GLB)、肌酐(CRE)、尿素氮(UN)、葡萄糖(GLU)、钙(Ca)和无机磷(PHOS)含量及天冬氨酸氨基转移酶(AST)、丙氨酸转氨酶(ALT)、淀粉酶(AMY)、肌酸激酶(CK)活性。
1.8 血清抗氧化指标测定血清丙二醛(MDA)含量、总抗氧化能力(T-AOC)及过氧化氢酶(CAT)、总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性的测定均采用南京建成生物工程研究所的试剂盒,测定方法按照说明书操作。
1.9 数据处理与统计方法采用SPSS 25.0软件中采用独立样本t检验,统计结果用“平均值±标准差”来表示,P<0.05为差异显著,P>0.05表示差异不显著。
2 结果与分析 2.1 复合芽孢杆菌对宠物猫体重及腹泻率的影响如表 3所示,复合芽孢杆菌能提高宠物猫采食量和体重,并降低腹泻率。对照组和试验组试验期间的采食量分别为50.08和54.16 g,粪便评分分别为2.77和2.60,软便率分别为5.69%和1.33%,腹泻率分别为4.17%和1.52%,对照组体重下降0.01 g,试验组体重上升0.13 g。
|
|
表 3 复合芽孢杆菌对宠物猫体重及腹泻率的影响 Table 3 Effects of compound Bacillus on body weight and diarrhea rate of pet cats |
由表 4可知,试验组宠物猫对干物质和粗蛋白质表观消化率以及消化能显著高于对照组(P<0.05),而粗灰分、粗脂肪和粗纤维表观消化率无显著变化(P>0.05)。
|
|
表 4 复合芽孢杆菌对宠物猫养分表观消化率和消化能的影响 Table 4 Effects of compound Bacillus on apparent digestibility of nutrients and digestive energy of pet cats |
如表 5所示,与对照组相比,试验组血液中单核细胞数目显著降低(P<0.05),白细胞数目和淋巴细胞数目有降低趋势,其余指标均无显著差异(P>0.05)。
|
|
表 5 复合芽孢杆菌对宠物猫全血血常规指标的影响 Table 5 Effects of compound Bacillus on whole blood routine indexes of pet cats |
如表 6所示,与对照组相比,试验组血清总蛋白、球蛋白和葡萄糖含量显著下降(P<0.05),而白球比有显著上升的趋势,其余指标均无显著差异(P>0.05)。
|
|
表 6 复合芽孢杆菌对宠物猫血清生化指标的影响 Table 6 Effects of compound Bacillus on serum biochemical indices of pet cats |
由表 7可知,与对照组相比,试验组血清总抗氧化能力和谷胱甘肽过氧化物酶活性显著提高(P<0.05),而总超氧化物歧化酶活性有上升的趋势,过氧化氢酶活性和丙二醛含量无显著变化(P>0.05)。
|
|
表 7 复合芽孢杆菌对宠物猫血清抗氧化指标的影响 Table 7 Effects of compound Bacillus on serum antioxidant indices of pet cats |
芽孢杆菌属于芽孢杆菌属,可产生多种胞外酶,如α-淀粉酶、纤维素酶及蛋白酶等[18],增强肠道对养分消化吸收和免疫功能[19]。根据我们实验室先前对其他动物的研究表明,在猪饲粮中添加1×108 CFU/kg BaSC06可以显著提高育肥猪平均日增重(ADG)、十二指肠中胰蛋白酶和淀粉酶活性以及肠道中葡萄糖转运蛋白1(SGLT1)和小肽转运蛋白1(PEPT1)的表达[20],而在鸡饲粮中添加1×108 CFU/kg BaSC06,对其生长性能没有显著影响[21],但改善了小肠绒毛的形态和密度[22]。在本试验中,复合芽孢杆菌可在一定程度上增加宠物猫采食量和其体增重,这与其在畜禽上的效果较一致。
猫的消化系统由消化道和消化腺组成,其中猫的小肠较短,仅为体长的3倍左右,盲肠不发达,但肠壁较厚,猫肠管短、宽、厚的特点使其具有明显的食肉动物特征,此外猫的唾液腺和胃腺很发达,在猫的整个胃壁上都有胃腺分布,但由于猫缺乏淀粉酶,不能大量消化淀粉类食物。另外,猫肠道内优势菌门包括厚壁菌门、变形菌门、拟杆菌门和放线菌门,与其他哺乳动物相似[23]。宠物猫在日常饲养过程中,容易受到外界因素的影响导致机体遭受病原菌侵袭,使得肠道菌群失衡,最终导致腹泻和体重下降[24]。因此,有效地防控腹泻在宠物猫饲养过程中是非常重要。研究表明,益生菌能提高紧密连接相关基因和蛋白的表达,增强肠上皮紧密连接的完整性[25],还能抑制大肠杆菌和沙门氏菌在肠道中的定植,提高有益菌的丰度,维持肠道菌群平衡[26]。陆江等[27]研究表明,补充复合益生菌制剂可以减少幼犬腹泻率和便秘率,增强胃肠动力,降低肠黏膜损伤,保护肠黏膜屏障功能。本研究发现,在饲粮中添加复合芽孢杆菌有效地降低腹泻率和软便率,并提高粪便评分,这可能与其提高宠物猫肠道屏障功能、抑制病原菌定植以及维持正常的肠道菌群平衡有关。
3.2 复合芽孢杆菌对宠物猫养分表观消化率的影响养分表观消化率可以衡量饲粮的可消化性和动物的消化能力,而益生菌能提高表观消化率。Fu等[28]研究表明,在仔猪饲粮中添加1×108 CFU/kg丁酸梭菌ZJU-F1显著提高了干物质、粗蛋白质、钙和磷表观消化率。Mountzouris等[29]研究发现,在肉鸡饲粮中添加枯草芽孢杆菌显著提高了粗脂肪、粗蛋白质、干物质和粗灰分表观消化率。益生菌能与宿主原肠道菌群产生协同作用,影响宿主消化道的淀粉酶、脂肪酶、蛋白酶等消化吸收酶的分泌和活性,促进营养物质在动物肠道内的消化吸收利用[30],还可以通过发酵作用来降解一些难以消化利用的物质,产生寡糖、维生素等直接供机体利用[31]。同时,益生菌还能通过提高肠上皮细胞的吸收和转运能力,促进小肽和氨基酸的吸收[7],从而提高饲粮利用率。本试验中,试验组各养分表观消化率均高于对照组,其中干物质、粗蛋白质表观消化率以及消化能差异显著。此外,在饲粮配制过程中需注意各营养物质的平衡,可促进猫对营养物质的吸收,从而提高饲粮的利用率。
3.3 复合芽孢杆菌对宠物猫全血血常规的影响通过血常规检验可以观察血细胞数量变化及形态分布,从而更好地了解动物身体状况进行疾病的早期检测与预防。白细胞分为中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、单核细胞和淋巴细胞,前3种因其细胞质中含有嗜色颗粒被称为粒细胞[32]。单核细胞是体积最大的白细胞,来源于骨髓中的造血干细胞,在骨髓中发育然后在其尚未成熟时进入血液中,具有很强的吞噬作用,能吞噬受伤和衰老的细胞及其残片,此外,它还与淋巴细胞协同作用参与机体特异性免疫反应[33]。当机体发生炎症或其他疾病时都可以引起单核细胞和淋巴细胞数目发生变化[34]。本试验中,试验组宠物猫血液中的单核细胞数目与对照组相比显著降低,淋巴细胞数目也有降低的趋势,可能是由于宠物猫受某些因素影响导致机体发生炎症反应,而益生菌缓解了这种情况,改善了宠物猫机体健康。
3.4 复合芽孢杆菌对宠物猫血清生化指标的影响血清生化组分是动物机体新陈代谢的物质基础,其含量的变化可以直接反映动物机体的生理功能、营养代谢水平和健康程度,受品种、年龄、营养、运动、疾病和内分泌等多种因素的影响[35]。血清总蛋白包含球蛋白和白蛋白,球蛋白由浆细胞分泌,其含量反映动物机体的免疫水平,而血清白蛋白有运输营养物质、维持胶体渗透压和修复受损组织等方面生理功能,其含量可以反映动物机体对蛋白质的消化率和利用程度[36]。Abdel-Moneim等[37]研究表明,枯草芽孢杆菌可以提高鹌鹑血清中总蛋白和白蛋白含量。Dong等[38]研究发现,枯草芽孢杆菌BYS2能提高肉鸡血清中免疫球蛋白的含量。本试验中,试验组宠物猫的血清总蛋白和球蛋白含量低于对照组,白蛋白含量无显著差异,与前人结果不一致的原因可能为宠物猫机体处于健康状态,所需的免疫球蛋白较少,从而使机体球蛋白含量处于正常范围的偏低水平。
3.5 复合芽孢杆菌对宠物猫血清抗氧化指标的影响氧化应激是活性氧(ROS)自由基的产生和清除不平衡,其水平超过了机体的内源性保护机制[39],过量的ROS攻击细胞成分如脂质、蛋白质和DNA,导致细胞膜脂质过氧化、线粒体功能障碍和DNA断裂,最终以细胞死亡终止[40]。总抗氧化能力反映机体抗氧化系统对氧自由基的清除能力。谷胱甘肽过氧化物酶可以特异的催化还原型谷胱甘肽(GSH)对过氧化氢的还原反应,起到保护细胞膜结构和功能完整的作用。超氧化物歧化酶能清除超氧阴离子自由基(O2-·)保护细胞免受损伤[41]。Long等[42]研究表明,丁酸梭菌和唾液乳杆菌可以提高小鼠血清中超氧化物歧化酶、谷胱甘肽过氧化物酶的活性,降低丙二醛的含量。Li等[43]研究表明,芽孢杆菌可以提高鱼血清中总抗氧化能力、超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶的活性。本试验中,复合芽孢杆菌能显著提高宠物猫血清中总抗氧化能力、谷胱甘肽过氧化物酶,超氧化物歧化酶活性也有显著提高趋势,但对血清过氧化物酶活性和丙二醛含量无显著影响,与前人结果一致,表明复合芽孢杆菌有助于提高宠物猫机体的抗氧化功能。
4 结论① 复合芽孢杆菌可显著提高成年布偶猫对干物质、粗蛋白质表观消化率以及消化能,在一定程度上降低腹泻率和软便率并改善粪便评分。
② 复合芽孢杆菌可显著提高成年布偶猫血清总抗氧化能力和谷胱甘肽过氧化物酶活性,对过氧化氢酶活性和丙二醛含量无显著影响,可在一定程度上改善其机体健康。
| [1] |
艾瑞咨询. 2021年中国宠物消费趋势白皮书[R/OL]. [2021-09-23]. https://www.docin.com/p-2720577911.html. I Research. 2021 white paper on pet consumption trend in China[R/OL]. [2021-09-23]. https://www.docin.com/p-2720577911.html. (in Chinese) |
| [2] |
侯静. 猫的几种常见异常症状[J]. 农家参谋, 2012(12): 30. HOU J. Several common abnormal symptoms of cats[J]. The Farmers Consultant, 2012(12): 30 (in Chinese). |
| [3] |
FAO, WHO. Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria[R]. Córdoba, Argentina: Amerian Córdoba Park Hotel, 2001: 30.
|
| [4] |
YANG J J, WANG C L, HUANG K H, et al. Compound Lactobacillus sp. administration ameliorates stress and body growth through gut microbiota optimization on weaning piglets[J]. Applied Microbiology and Biotechnology, 2020, 104(15): 6749-6765. DOI:10.1007/s00253-020-10727-4 |
| [5] |
CHANG J, WANG T, WANG P, et al. Compound probiotics alleviating aflatoxin B1 and zearalenone toxic effects on broiler production performance and gut microbiota[J]. Ecotoxicology and Environmental Safety, 2020, 194: 110420. DOI:10.1016/j.ecoenv.2020.110420 |
| [6] |
HU S L, CAO X F, WU Y P, et al. Effects of probiotic Bacillus as an alternative of antibiotics on digestive enzymes activity and intestinal integrity of piglets[J]. Frontiers in Microbiology, 2018, 9: 2427. DOI:10.3389/fmicb.2018.02427 |
| [7] |
WANG J, JI H F. Influence of probiotics on dietary protein digestion and utilization in the gastrointestinal tract[J]. Current Protein & Peptide Science, 2019, 20(2): 125-131. |
| [8] |
LEE E, JUNG S R, LEE S Y, et al. Lactobacillus plantarum strain Ln4 attenuates diet-induced obesity, insulin resistance, and changes in hepatic mRNA levels associated with glucose and lipid metabolism[J]. Nutrients, 2018, 10(5): 643. DOI:10.3390/nu10050643 |
| [9] |
DIMIDI E, CHRISTODOULIDES S, SCOTT S M, et al. Mechanisms of action of probiotics and the gastrointestinal microbiota on gut motility and constipation[J]. Advances in Nutrition, 2017, 8(3): 484-494. DOI:10.3945/an.116.014407 |
| [10] |
MEYER M M, FRIES-CRAFT K A, BOBECK E A. Composition and inclusion of probiotics in broiler diets alter intestinal permeability and spleen immune cell profiles without negatively affecting performance[J]. Journal of Animal Science, 2020, 98(1): skz383. DOI:10.1093/jas/skz383 |
| [11] |
MOJGANI N, SHAHALI Y, DADAR M. Immune modulatory capacity of probiotic lactic acid bacteria and applications in vaccine development[J]. Beneficial Microbes, 2020, 11(3): 213-226. DOI:10.3920/BM2019.0121 |
| [12] |
WANG Y, WU Y P, WANG Y Y, et al. Antioxidant properties of probiotic bacteria[J]. Nutrients, 2017, 9(5): 521. DOI:10.3390/nu9050521 |
| [13] |
HU T, SONG J J, ZENG W Y, et al. Lactobacillus plantarum LP33 attenuates Pb-induced hepatic injury in rats by reducing oxidative stress and inflammation and promoting Pb excretion[J]. Food and Chemical Toxicology, 2020, 143: 111533. DOI:10.1016/j.fct.2020.111533 |
| [14] |
WU Y Y, ZHEN W R, GENG Y Q, et al. Pretreatment with probiotic Enterococcus faecium NCIMB 11181 ameliorates necrotic enteritis-induced intestinal barrier injury in broiler chickens[J]. Scientific Reports, 2019, 9(1): 10256. DOI:10.1038/s41598-019-46578-x |
| [15] |
GUO M J, LI M T, ZHANG C C, et al. Dietary administration of the Bacillus subtilis enhances immune responses and disease resistance in chickens[J]. Frontiers in Microbiology, 2020, 11: 1768. DOI:10.3389/fmicb.2020.01768 |
| [16] |
FUSI E, RIZZI R, POLLI M, et al. Effects of Lactobacillus acidophilus D2/CSL (CECT 4529) supplementation on healthy cat performance[J]. Veterinary Record Open, 2019, 6(1): e000368. |
| [17] |
BYBEE S N, SCORZA A V, LAPPIN M R. Effect of the probiotic Enterococcus faecium SF68 on presence of diarrhea in cats and dogs housed in an animal shelter[J]. Journal of Veterinary Internal Medicine, 2011, 25(4): 856-860. DOI:10.1111/j.1939-1676.2011.0738.x |
| [18] |
WOLDEMARIAMYOHANNES K, WAN Z, YU Q L, et al. Prebiotic, probiotic, antimicrobial, and functional food applications of Bacillus amyloliquefaciens[J]. Journal of Agricultural and Food Chemistry, 2020, 68(50): 14709-14727. DOI:10.1021/acs.jafc.0c06396 |
| [19] |
AMERAH A M, ROMERO L F, AWATI A, et al. Effect of exogenous xylanase, amylase, and protease as single or combined activities on nutrient digestibility and growth performance of broilers fed corn/soy diets[J]. Poultry Science, 2017, 96(4): 807-816. DOI:10.3382/ps/pew297 |
| [20] |
CAO X F, TANG L, ZENG Z H, et al. Effects of probiotics BaSC06 on intestinal digestion and absorption, antioxidant capacity, microbiota composition, and macrophage polarization in pigs for fattening[J]. Frontiers in Veterinary Science, 2020, 7: 570593. DOI:10.3389/fvets.2020.570593 |
| [21] |
WANG B K, ZHOU Y H, TANG L, et al. Effects of Bacillus amyloliquefaciens instead of antibiotics on growth performance, intestinal health, and intestinal microbiota of broilers[J]. Frontiers in Veterinary Science, 2021, 8: 679368. DOI:10.3389/fvets.2021.679368 |
| [22] |
WANG Y Y, WANG Y B, XU H, et al. Direct-fed glucose oxidase and its combination with B. amyloliquefaciens SC06 on growth performance, meat quality, intestinal barrier, antioxidative status, and immunity of yellow-feathered broilers[J]. Poultry Science, 2018, 97(10): 3540-3549. DOI:10.3382/ps/pey216 |
| [23] |
BARKO P C, MCMICHAEL M A, SWANSON K S, et al. The gastrointestinal microbiome: a review[J]. Journal of Veterinary Internal Medicine, 2018, 32(1): 9-25. DOI:10.1111/jvim.14875 |
| [24] |
PILLA R, SUCHODOLSKI J S. The role of the canine gut microbiome and metabolome in health and gastrointestinal disease[J]. Frontiers in Veterinary Science, 2019, 6: 498. |
| [25] |
ANDERSON R C, COOKSON A L, MCNABB W C, et al. Lactobacillus plantarum MB452 enhances the function of the intestinal barrier by increasing the expression levels of genes involved in tight junction formation[J]. BMC Microbiology, 2010, 10: 316. DOI:10.1186/1471-2180-10-316 |
| [26] |
CHEN C C, LI J Y, ZHANG H X, et al. Effects of a probiotic on the growth performance, intestinal flora, and immune function of chicks infected with Salmonella pullorum[J]. Poultry Science, 2020, 99(11): 5316-5323. DOI:10.1016/j.psj.2020.07.017 |
| [27] |
陆江, 朱道仙, 卢鹏飞, 等. 补喂复合益生菌制剂对幼犬生长性能、肠道动力及肠道屏障功能的影响[J]. 动物营养学报, 2019, 31(9): 4242-4250. LU J, ZHU D X, LU P F, et al. Effects of supplementary feeding complex-probiotic-preparation on growth performance, intestinal motility and intestinal barrier function of puppies[J]. Chinese Journal of Animal Nutrition, 2019, 31(9): 4242-4250 (in Chinese). |
| [28] |
FU J, WANG T, XIAO X, et al. Clostridium butyricum ZJU-F1 benefits the intestinal barrier function and immune response associated with its modulation of gut microbiota in weaned piglets[J]. Cells, 2021, 10(3): 527. DOI:10.3390/cells10030527 |
| [29] |
MOUNTZOURIS K C, TSITRSIKOS P, PALAMIDI I, et al. Effects of probiotic inclusion levels in broiler nutrition on growth performance, nutrient digestibility, plasma immunoglobulins, and cecal microflora composition[J]. Poultry Science, 2010, 89(1): 58-67. DOI:10.3382/ps.2009-00308 |
| [30] |
YUN J H, LEE K B, SUNG Y K, et al. Isolation and characterization of potential probiotic lactobacilli from pig feces[J]. Journal of Basic Microbiology, 2009, 49(2): 220-226. DOI:10.1002/jobm.200800119 |
| [31] |
XU Y, HLAING M M, GLAGOVSKAIA O, et al. Fermentation by probiotic Lactobacillus gasseri strains enhances the carotenoid and fibre contents of carrot juice[J]. Foods, 2020, 9(12): 1803. DOI:10.3390/foods9121803 |
| [32] |
BARKUR S, BANKAPUR A, CHIDANGIL S, et al. Effect of infrared light on live blood cells: role of β-carotene[J]. Journal of Photochemistry and Photobiology B: Biology, 2017, 171: 104-116. DOI:10.1016/j.jphotobiol.2017.04.034 |
| [33] |
OLINGY C E, DINH H Q, HEDRICK C C. Monocyte heterogeneity and functions in cancer[J]. Journal of Leukocyte Biology, 2019, 106(2): 309-322. DOI:10.1002/JLB.4RI0818-311R |
| [34] |
KRATOFIL R M, KUBES P, DENISET J F. Monocyte conversion during inflammation and injury[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2017, 37(1): 35-42. DOI:10.1161/ATVBAHA.116.308198 |
| [35] |
WANG J P, YOO J S, KIM H J, et al. Nutrient digestibility, blood profiles and fecal microbiota are influenced by chitooligosaccharide supplementation of growing pigs[J]. Livestock Science, 2009, 125(2/3): 298-303. |
| [36] |
肖轲, 毛雨竹, 赵旭民, 等. 生物发酵饲料在生长育肥猪上的应用[J]. 饲料工业, 2013, 34(17): 28-31. XIAO K, MAO Y Z, ZHAO X M, et al. Application of biological fermentation feed in growing-finishing pigs[J]. Feed Industry, 2013, 34(17): 28-31 (in Chinese). |
| [37] |
ABDEL-MONEIM A E, SELIM D A, BASUONY H A, et al. Effect of dietary supplementation of Bacillus subtilis spores on growth performance, oxidative status, and digestive enzyme activities in Japanese quail birds[J]. Tropical Animal Health and Production, 2020, 52(2): 671-680. DOI:10.1007/s11250-019-02055-1 |
| [38] |
DONG Y, LI R, LIU Y, et al. Benefit of dietary supplementation with Bacillus subtilis BYS2 on growth performance, immune response, and disease resistance of broilers[J]. Probiotics and Antimicrobial Proteins, 2020, 12(4): 1385-1397. DOI:10.1007/s12602-020-09643-w |
| [39] |
APEL K, HIRT H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction[J]. Annual Review of Plant Biology, 2004, 55: 373-399. DOI:10.1146/annurev.arplant.55.031903.141701 |
| [40] |
UPASANI C D, BALARAMAN R. Protective effect of Spirulina on lead induced deleterious changes in the lipid peroxidation and endogenous antioxidants in rats[J]. Phytotherapy Research, 2003, 17(4): 330-334. DOI:10.1002/ptr.1135 |
| [41] |
羊秀美, 陈炳旭, 吕静, 等. 乳酸链球菌素对肉鸡生长性能、抗氧化和免疫性能及肠道形态的影响[J]. 动物营养学报, 2021, 33(8): 4415-4423. YANG X M, CHEN B X, LV J, et al. Effects of nisin on growth performance, antioxidant and immune performance and intestinal morphology of broilers[J]. Chinese Journal of Animal Nutrition, 2021, 33(8): 4415-4423 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.08.022 |
| [42] |
LONG M, YANG S H, LI P, et al. Combined use of C. butyricum Sx-01 and L. salivarius C-1-3 improves intestinal health and reduces the amount of lipids in serum via modulation of gut microbiota in mice[J]. Nutrients, 2018, 10(7): 810. DOI:10.3390/nu10070810 |
| [43] |
LI W F, ZHANG X P, SONG W H, et al. Effects of Bacillus preparations on immunity and antioxidant activities in grass carp (Ctenopharyngodon idellus)[J]. Fish Physiology and Biochemistry, 2012, 38(6): 1585-1592. DOI:10.1007/s10695-012-9652-y |




