植物雌激素是植物中发现的类似雌激素的非类固醇物质,可以有效预防癌症、动脉硬化、骨质疏松症、更年期症状和肥胖等多种疾病[1]。到目前为止,已发现包括木脂类、异黄酮类[染料木素、大豆黄酮(daidzein, DZ)]和丙烯基黄酮类化合物等20多种植物雌激素类,其作用涉及了许多方面,是目前开发研究较多的一大类物质[2]。DZ是具有酚类结构的异黄酮类植物雌激素。DZ与雌二醇(estradiol, E2)结构类似,具有雌激素样活性,所不同的是,与E2相比,其生物学效应较弱,仅为E2的10-5~10-3[3];另外,DZ的作用具有双向效应,既能发挥雌激素样作用,也可发挥抗雌激素的作用,而这主要取决于DZ的生理剂量和化学结构[4]。李艳等[5]添加不同浓度的DZ作用于山羊乳腺细胞,结果发现,10~100 ng/mL的DZ可显著促进山羊乳腺上皮增殖,但1 000 ng/mL DZ会使细胞增殖能力有所下降;Yu等[6]研究发现,DZ对牛乳腺细胞具有同样的效应,并发现高浓度DZ(20~80 μmol/L)还可抑制乳脂和乳蛋白的合成。由此可见,DZ可促进乳腺细胞增殖,但有剂量依赖性。
乳腺是由乳腺上皮细胞、基质细胞和脂肪细胞等多种细胞构成的动态器官,是哺乳动物区别其他动物的标志。哺乳动物的乳腺发育受到雌激素的调节作用[7]。雌激素是多种靶组织生长和分化的重要调节因子,主要包括E2、雌酮和雌三醇等,其中E2是哺乳动物自身合成的雌激素中活性最高的。有研究发现,E2可通过其雌激素受体(estrogen receptor, ER)调控乳腺发育、泌乳及促进生殖器官发育等[8]。人医方面的研究发现,随着青春期卵巢E2的分泌,可出现乳腺导管的快速延伸和分支,认为是因为E2增加了青春期乳腺组织的ER含量,从而促进了乳腺的发育[9]。另有研究发现,E2也可通过ER促进小鼠乳腺导管末端芽、导管分支和腺泡的形成,从而促进泌乳[10]。这提示E2依赖ER影响乳腺发育。
已有研究证实,植物雌激素DZ与乳腺发育有关。1946年,Bennetts等[11]首次发现给奶牛饲喂三叶草可促进乳腺发育,提高奶产量,提示异黄酮植物雌激素可促进乳腺发育。随后在动物试验中证实,饲喂一定剂量的DZ可促进泌乳,增加奶产量。2008年,刘春龙等[12]首次证实了DZ可通过提高细胞活力促进牛乳腺上皮细胞增殖。最近,Tsugami等[13]研究发现,DZ对体外小鼠乳腺细胞诱导成导管、腺泡形成也有一定的促进作用。以上研究提示,植物雌激素DZ可促进乳腺上皮细胞增殖,促进导管、分泌小泡等结构的形成,可能与乳腺发育和泌乳有关,但其作用途径及机制尚没有相关报道。因此,本文采用DZ处理牛乳腺上皮MAC-T细胞,并以E2处理作为阳性对照,通过检测细胞增殖相关指标、细胞周期的变化及ERβ表达量等指标,研究DZ对MAC-T细胞增殖的影响,并探讨其相关机制,为DZ及其他植物雌激素类物质在泌乳动物生产中的开发应用提供理论依据。
1 材料与方法 1.1 试验细胞牛乳腺上皮细胞系(MAC-T):美国伊利诺伊大学Loor教授馈赠,由本实验室冻存。
1.2 主要试剂及仪器DZ由南京农业大学韩正康教授赠送;二甲基噻唑二苯基四唑嗅盐(MTT,5 mg/mL)、二甲基亚砜(DMSO)和DNA含量测定试剂盒均购自Solarbio公司;E2(纯度≥99%)购自Alfa Aesar公司;DMEM高糖培养基、胎牛血清等购自美国Hyclone公司。
增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)一抗(货号:10205-2)购自Proteintech公司;细胞周期蛋白D1(CyclinD1)一抗(货号:BS1741)购自Bioworld公司;细胞周期蛋白D3(CyclinD3)(货号:DF6229)和ERβ(货号:AF4649)一抗均购自Affinity公司;兔源β-肌动蛋白(β-actin)一抗(货号:AC026)、羊抗鼠免疫球蛋白G(IgG)(货号:AS003)和羊抗兔IgG(货号:AS014)二抗均购自ABclonal公司。
主要仪器:BioPhotometer-D30核酸蛋白测定仪(德国)、TECAN多功能酶标仪(瑞士)、电泳/电转仪(美国)、发光图像分析系统(美国)、贝克曼-Cytoflex流式细胞仪和Countess自动细胞计数仪等。
1.3 试验方法 1.3.1 细胞培养参照Yu等[6]的方法,按照常规法培养。将MAC-T细胞解冻,置于含10%胎牛血清的DMED高糖完全培养液中,5%CO2、37 ℃传代培养。所有细胞处理前均用未加胎牛血清的DMED高糖培养液(不完全培养液)饥饿4 h。
1.3.2 DZ作用条件的确定1) DZ浓度确定:采用MTT法[14]进行。取长至90%左右的细胞正常消化,制成细胞悬液,均匀铺至96孔细胞培养板,待细胞长至80%左右,分别加入终浓度为0、2.5、5.0、10.0、20.0、40.0、80.0和160.0 μmol/L的DZ处理细胞24 h。每孔加入10 μL MTT试剂并置于细胞培养箱中继续培养4 h。弃去培养液,每孔加入150 μL DMSO,低速振荡充分溶解,在酶联免疫检测仪上测定各孔490 nm的吸光度(OD)值,按如下公式计算细胞活力:
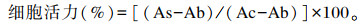
|
式中:As表示试验孔吸光度(含有细胞、培养基、MTT和待测化合物的孔的吸光度);Ab表示空白孔吸光度(含有培养基和MTT的孔的吸光度);Ac表示对照孔吸光度(含有细胞、培养基和MTT的孔的吸光度)。
本试验筛选2.5、5.0和10.0 μmol/L DZ浓度分别作为低、中和高浓度用于后续试验。
2) DZ作用时间的确定:细胞同上处理,96孔板上分别加入DZ,使终浓度为2.5、5.0和10 μmol/L,分别处理12、24、36和48 h后,采用MTT法测定各孔490 nm的吸光度值,计算细胞活力。结果显示:DZ作用时间为12 h时,能显著提高MAC-T细胞活力。
根据以上结果,本试验确定的处理条件是:DZ低、中和高浓度分别为2.5、5.0和10.0 μmol/L,处理时间为12 h。
1.3.3 试验分组和细胞处理根据以上试验所确定的浓度和最佳作用时间,试验共分为3组。1)对照组(CON),等体积不完全培养液。2)试验组,分3个处理:低浓度处理(LDZ),等体积不完全培养液+2.5 μmol/L DZ;中浓度处理(MDZ),等体积不完全培养液+5.0 μmol/L DZ;高浓度处理(HDZ),等体积不完全培养液+10.0 μmol/L DZ。3)阳性对照组(E2):等体积不完全培养液+5×10-4 μmol/L E2。
细胞正常消化制成悬液,均匀接种于6孔细胞培养板中,待细胞长至80%左右,按如上分组处理,37 ℃、5% CO2培养箱中培养12 h。每组均设3个重复。
1.3.4 指标检测 1.3.4.1 细胞数量的检测6孔板细胞处理12 h后终止培养,胰酶消化,加入完全培养液获得细胞悬液,并使其终体积为1 mL。取每孔细胞悬液各10 μL滴在Countess®细胞计数腔室载玻片上,立即用Countess自动细胞计数仪计数,记录细胞数量。每个处理设3个重复。
1.3.4.2 细胞周期相关蛋白Western blot检测参照Li等[15]的方法检测各处理细胞中细胞周期蛋白CyclinD3、CyclinD1、PCNA和ERβ的表达变化,具体如下。
1) 样品制备:将6孔板中处理好的细胞培养液弃去,用冰浴的磷酸盐缓冲液(PBS)洗去多余的培养液。加入蛋白裂解液,并用细胞刮刀刮取细胞。4 ℃、2 580×g,10 min,收集细胞上清,采用二喹啉甲酸(BCA)法测定蛋白浓度,统一浓度为2.68 μg/μL,加入蛋白上样缓冲液,使终浓度为1 mg/mL,100 ℃煮沸10 min,备用。
2) 十二烷基硫酸-钠聚丙烯酰胺凝胶电泳(SDS-PAGE):选用10%分离胶、5%浓缩胶,先使用90 V恒压,待目的条带到达浓缩胶与分离胶界面时,改用110 V恒压,待溴酚蓝条带到达指示前沿停止电泳。
3) 转印:取目的蛋白区域进行湿法转印。聚偏二氟乙烯(PVDF)膜先用甲醛激活约30 s,将凝胶、PVDF膜和转印滤纸依次摆放至转印夹中,配制转膜电泳液并提前冰浴,恒压100 V,转印90 min。
4) 抗体孵育及显色:完成转印后,取出PVDF膜在5%的脱脂奶粉中封闭2 h,TBST洗涤,一抗用TBST稀释,CyclinD3、CyclinD1、ERβ一抗均按照1 ∶ 1 000稀释,PCNA抗体为1 ∶ 2 000稀释。4 ℃摇床过夜孵育一抗。次日用TBST漂洗,CyclinD1加入稀释比例为1 ∶ 10 000的山羊抗鼠IgG二抗,其余3种抗体加入1 ∶ 10 000稀释的山羊抗兔IgG二抗,室温孵育2 h,TBST漂洗,用ECL化学发光液处理,并在凝胶成像系统中曝光拍照。采用Image J软件检测各蛋白条带灰度值,以β-肌动蛋白作内参,目的条带与其相比得到目的蛋白的相对表达量,然后对数值进行归一化处理。
1.3.4.3 细胞中DNA含量(细胞周期)的检测参照Guo等[16]的方法,采用流式细胞仪检测各处理细胞中DNA含量的变化,具体如下。
1) 细胞收集:取生长状态良好且密度达到90%的MAC-T细胞,以1×106个/mL密度接种于6孔细胞培养板,培养24 h待细胞贴壁后,改为含有2.5、5.0和10.0 μmol/L DZ及5×10-4 μmol/L E2的培养液(不含血清)继续培养。12 h后弃去培养液,PBS清洗,胰酶消化,离心,收集细胞。
2) 细胞处理及上机检测:将离心收集的细胞,按照细胞周期检测试剂盒说明书,先用70%预冷乙醇4 ℃固定过夜;然后加入100 μL RNase A溶液重悬细胞,37 ℃水浴30 min。加入碘化丙啶(PI)工作液避光孵育30 min。在激发波长为488 nm下,用流式细胞仪中的PE-A荧光通道检测细胞各周期分布情况。用Modfit 5.0软件分析细胞中G0/G1期、S期、G2期分布情况。以G2-M期细胞所占百分比表示细胞增殖情况。
1.4 数据统计分析试验数据均采用SPSS 21.0软件进行统计分析,采用单因素方差分析(one way ANOVA)和LSD法进行差异显著性检验,P < 0.05表示差异显著,P < 0.01表示差异极显著,采用Graphpad Prism 8.0.1软件作图。
2 结果与分析 2.1 DZ最佳作用条件的筛选结果 2.1.1 DZ浓度的确定由图 1可知,与对照组相比,终浓度为2.5和5.0 μmol/L DZ处理细胞均能提高MAC-T细胞活力,其中5.0 μmol/L DZ处理显著提高细胞活力(P < 0.05);而在终浓度高于10.0 μmol/L后,细胞活力均有下降,在10.0~40.0 μmol/L,细胞活力均低于对照组。故本试验选取终浓度为2.5、5.0和10.0 μmol/L作为DZ低、中和高处理浓度。
|
与对照组相比,数据柱标记* *表示差异极显著(P < 0.01),标记*表示差异显著(P < 0.05)。下图同。 Compare with the control group, value columns with * * mean extremely significant difference (P < 0.01), and with * mean significant difference (P < 0.05). The same as below. 图 1 不同浓度DZ对MAC-T细胞活力的影响 Fig. 1 Effects of different concentrations of DZ on MAC-T cell viability (n=5) |
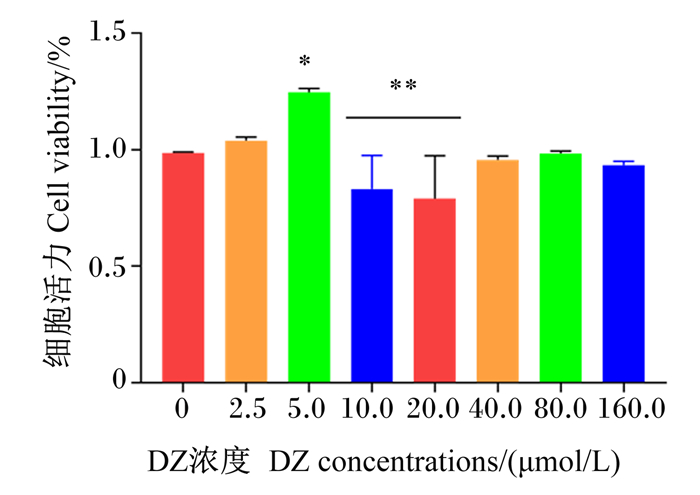
以确定的DZ低、中和高3个浓度分别处理细胞12、24、36和48 h确定最适作用时间。由图 2可知,与对照组相比,处理12 h后,5.0 μmol/L DZ处理使得细胞活力显著提高(P < 0.05),其他2个浓度处理对细胞活力无显著影响(P>0.05);处理24 h后,2.5和5.0 μmol/L DZ处理使得细胞活力显著降低(P < 0.05);而处理36 h后,除2.5 μmol/L DZ处理对细胞活力无显著影响(P>0.05)外,其他浓度处理显著抑制细胞活力(P < 0.05);处理48 h后,3个浓度的DZ处理均极显著降低细胞活力(P < 0.01)。故本试验确定DZ的处理时间为12 h。
|
图 2 不同浓度DZ作用不同时间对MAC-T细胞活力的影响 Fig. 2 Effects of different concentrations and time of daidzein on MAC-T cell viability (n=5) |
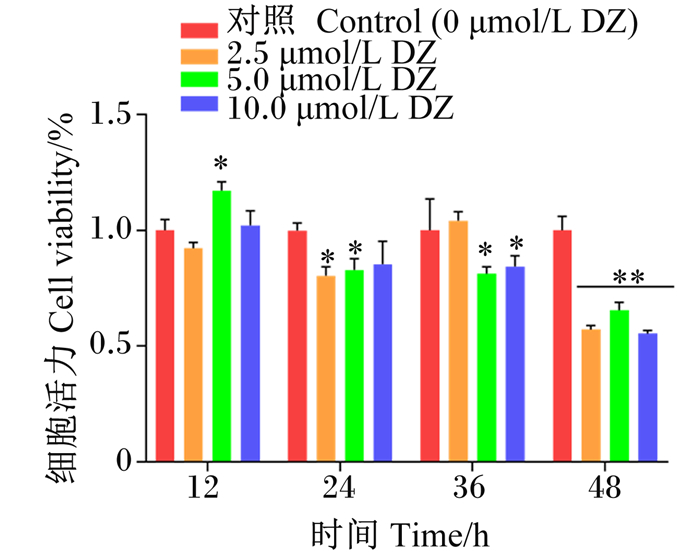
由图 3可知,与对照组相比,5.0 μmol/L DZ处理使得细胞数量显著增加(P < 0.05),约为对照组的1.20倍;2.5 μmol/L DZ处理使得细胞数量有所增加,但差异不显著(P>0.05);阳性对照组(E2处理)细胞数量略低于各DZ处理,但差异不显著(P>0.05)。
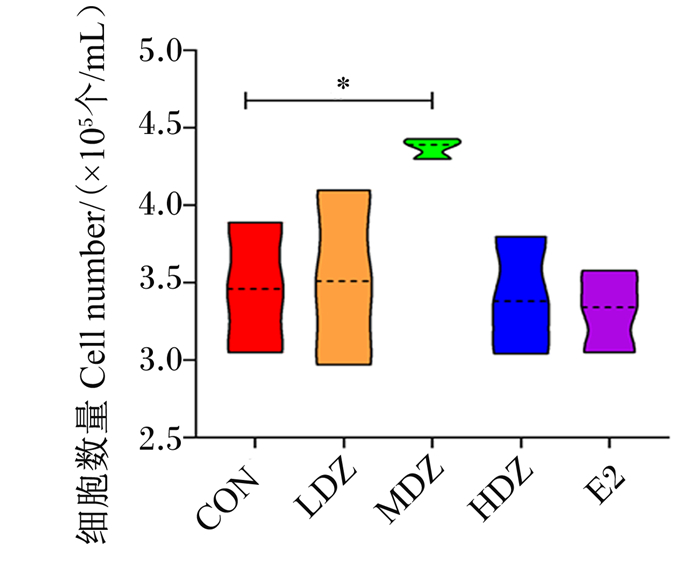
|
CON:对照组control group;LDZ:试验组低浓度处理low concentration treatment in experimental group;MDZ:试验组中浓度处理medium concentration treatment in experimental group;HDZ:试验组高浓度处理high concentration treatment in experimental group;E2:阳性对照组positive control group。下图同the same as below。 图 3 DZ处理对MAC-T细胞数量的影响 Fig. 3 Effects of DZ treatment on MAC- T cell number (n=3) |
由图 4-b可知,与对照组相比,3种浓度的DZ处理均可上调PCNA蛋白相对表达量,其中,中浓度DZ处理差异显著(P < 0.05);E2处理下调了PCNA蛋白相对表达量,但差异不显著(P>0.05)。
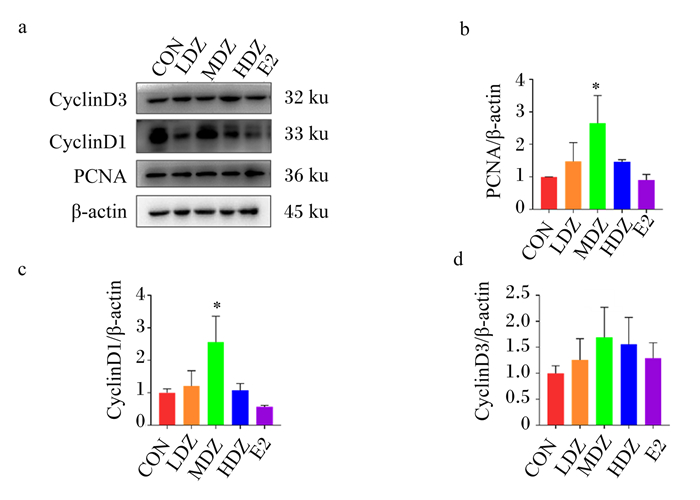
|
CyclinD3:细胞周期蛋白D3;CyclinD1:细胞周期蛋白D1;PCNA:增殖细胞核抗原proliferating cell nuclear antigen;β-actin:β-肌动蛋白。 图 4 DZ处理对MAC-T细胞中增殖蛋白相对表达量的影响 Fig. 4 Effects of DZ treatment on proliferative protein relative expression levels in MAC-T cells (n=3) |
由图 4-c可知,与对照组相比,3种浓度的DZ处理均可上调CyclinD1蛋白相对表达量,其中,中浓度DZ处理差异显著(P < 0.05);E2处理对CyclinD1蛋白相对表达量无显著影响(P>0.05),结果与PCNA有同样趋势。
由图 4-d可知,与对照组相比,3种浓度的DZ处理均可上调CyclinD3蛋白相对表达量,但均无显著差异(P>0.05);E2处理与DZ处理一样,也能上调CyclinD3蛋白相对表达量,但也无显著差异(P>0.05)。
2.3.2 DZ处理对ERβ蛋白相对表达量的影响由图 5可知,与对照组相比,3种浓度的DZ处理和E2处理均可上调ERβ蛋白相对表达量,其中,中浓度DZ处理差异显著(P < 0.05),这提示DZ可能通过ERβ发挥作用。
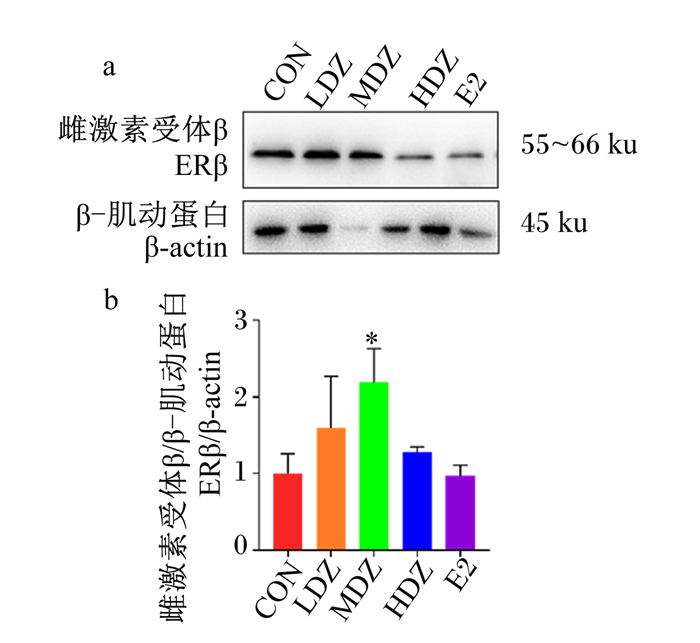
|
图 5 DZ处理对MAC-T细胞中ERβ蛋白相对表达量的影响 Fig. 5 Effects of DZ on ERβ protein relative expression level in MAC-T cells (n=3) |
本试验通过流式细胞仪检测判定细胞周期分布情况,比较流式细胞图中细胞周期G0/G1期、S期、G2-M期细胞比例,主要通过G2-M期细胞所占比例揭示细胞的增殖与否,并结合S期细胞占比分析细胞周期变化。
由图 6可知,与对照组相比,低浓度DZ处理略提高了G2-M期细胞占比(P>0.05);中浓度DZ处理极显著提高了G2-M期细胞占比(P < 0.01),同时极显著提高了S期细胞占比(P < 0.01);高浓度DZ处理降低了G2-M期细胞占比(P>0.05),略有提高S期细胞占比的趋势(P>0.05);E2处理与中浓度DZ处理具有同样趋势,均极显著提高了G2-M期细胞占比(P < 0.01),同时提高了S期细胞占比,但未达到显著水平(P>0.05)。
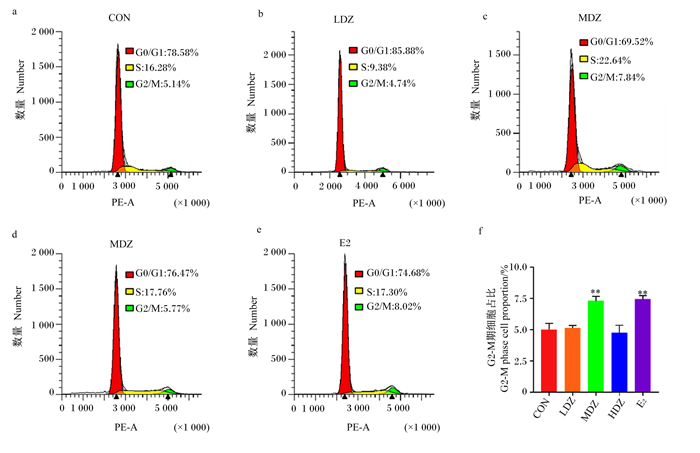
|
图 6 DZ处理对MAC-T细胞中G2-M期细胞占比的影响 Fig. 6 Effect of DZ treatment on G2-M phase cell proportion in MAC-T cells (n=3) |
已经知道,E2在哺乳动物乳腺发育过程中具有重要作用。陈静等[17]研究了添加不同浓度的E2对MAC-T细胞增殖的影响,发现低浓度(0.5、1.0和5.0 nmol/L)E2能够促进奶牛乳腺上皮细胞的增殖,长期处于高浓度(100 nmol/L)E2环境下,乳腺细胞增殖则被抑制并引发细胞损伤,提示E2对细胞增殖作用具有一定的浓度依赖性。曹艳红等[18]研究发现,E2对于奶山羊乳腺上皮细胞增殖具有同样的效应,仅在一定浓度(25 μmol/L)下可以促进乳腺上皮细胞的增殖,增强细胞的代谢活动,且对细胞的损伤较小。武开乐等[19]将不同浓度的E2(0、50、100和200 μmol/L)孵育MAC-T细胞不同时间,仅在12 h时乳腺上皮细胞的增殖效果最好。刘春龙等[12]研究发现,DZ在100~1 000 ng/mL(3.9 μmol/L)时对牛乳腺上皮细胞具有增殖作用。本研究发现,5.0和10.0 μmol/L DZ处理MAC-T细胞12 h能使细胞活力提高,2.5和5.0 μmol/L DZ处理MAC-T细胞12 h能使细胞数量增加,其中,5.0 μmol/L DZ处理差异显著;本试验结果与刘春龙等[12]的研究结果基本一致,即DZ也具有类似E2的作用,能够促进乳腺上皮细胞增殖。
3.2 DZ处理对MAC-T细胞周期的影响细胞周期、细胞的增殖和分化是由细胞周期蛋白和周期蛋白所依赖的激酶所驱动。细胞周期蛋白作为有丝分裂传感器,能够整合细胞外有丝分裂信号和细胞周期进程,阻滞G1期的进展,促进G1到S转变,从而启动DNA复制。其中,D型细胞周期蛋白可在正常细胞中表达和激活,并严格调控细胞有丝分裂进程[20],主要包括CyclinD1、CyclinD3、细胞周期蛋白D4(CyclinD4),其中CyclinD1和CyclinD3是在细胞周期进程表达相对稳定的2种蛋白[15]。研究发现,E2可通过影响CyclinD1的表达调控细胞周期,从而调控正常细胞或癌细胞的增殖;在转基因雌激素敏感小鼠的研究中发现,E2可促进CyclinD1的表达,提示E2可能与细胞周期有关[21]。还有研究发现,E2在0.001、0.010、0.100、1.000和10.000 μmol/L时均可促进人乳腺细胞系的增殖,S期细胞比例减少,G2-M期细胞比例增多[22]。Guo等[16]发现异黄酮类植物雌激素可通过影响细胞周期进展相关蛋白信号通路影响乳腺发育。本试验结果表明,DZ处理可以提高G2-M期细胞占比,触发MAC-T细胞中S期细胞周期阻滞,同时上调CyclinD1和CyclinD3蛋白相对表达量,这与以往研究结论相符,即DZ与E2具有同样的作用,DZ可促进MAC-T细胞的增殖。
3.3 DZ处理对MAC-T细胞ERβ蛋白相对表达量的影响ER是E2发挥多向效应的媒介,有ERα和Erβ 2种亚型。ERα和ERβ同为类固醇受体超级家族的成员,分别由不同基因编码,分布也存在差异性[23]。在乳腺组织中,ERα主要分布在导管上皮细胞和间质细胞,小叶上皮细胞不表达;ERβ主要分布在导管上皮细胞、小叶上皮细胞和间质细胞,在脂肪间质细胞内也可检测到ERβ表达。正常的乳腺组织主要表达ERβ,但在大多数乳腺癌组织中ERβ的表达水平显著降低,而ERα却高表达[24]。Zhou等[25]研究表明,在子宫内膜癌发展中,雌激素通过ERβ促进子宫内膜癌细胞(UCEC)增殖,促进子宫内膜癌的发展,当使用雌激素抑制剂后减弱了ERβ对UCEC的增殖作用;刘丽军[22]等研究表明,E2具有促进人乳腺细胞增殖的作用,免疫组化检测到ERβ的表达。本研究结果表明,DZ处理可提高MAC-T细胞ERβ蛋白相对表达量,这与前人研究结果一致,初步推断DZ可能是通过ERβ介导促进了MAC-T细胞增殖。
4 结论本研究表明,植物雌激素DZ可通过上调MAC-T细胞中ERβ蛋白表达,提高G2-M期细胞占比,并将细胞周期阻滞在S期,从而促进乳腺细胞的增殖,发挥着类似雌激素样的作用。
| [1] |
SIRTORI C R. Risks and benefits of soy phytoestrogens in cardiovascular diseases, cancer, climacteric symptoms and osteoporosis[J]. Drug Safety, 2001, 24(9): 665-682. DOI:10.2165/00002018-200124090-00003 |
| [2] |
PETRINE J C P, DEL BIANCO-BORGES B. The influence of phytoestrogens on different physiological and pathological processes: an overview[J]. Phytotherapy Research, 2021, 35(1): 180-197. DOI:10.1002/ptr.6816 |
| [3] |
EWIES A A A. Phytoestrogens in the management of the menopause: up-to-date[J]. Obstetrical & Gynecological Survey, 2002, 57(5): 306-313. |
| [4] |
刘春龙, 任延铭, 姜文博, 等. 大豆异黄酮类植物雌激素对奶牛内分泌水平的影响[J]. 中国兽医学报, 2010, 30(9): 1261-1264, 1268. LIU C L, REN Y M, JIANG W B, et al. Effects of soybean isoflavone on incretion parameters of dairy cow[J]. Chinese Journal of Veterinary Science, 2010, 30(9): 1261-1264, 1268 (in Chinese). |
| [5] |
李艳, 陈凤, 吕晓峰, 等. 大豆苷和染料木苷对山羊乳腺上皮细胞增殖的影响[J]. 中国畜牧兽医, 2014, 41(3): 170-173. LI Y, CHEN F, LV X F, et al. Effects of daidzin and genistin on proliferation of goat mammary gland epithelial cells[J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(3): 170-173 (in Chinese). |
| [6] |
YU M M, QI H, GAO X J.Daidzein promotes milk synthesis and proliferation of mammary epithelial cells via the estrogen receptor α-dependent NFκB1 activation[J/OL].Animal Biotechnology: 1-10.(2020-05-13)[2021-08-25].https://doi.org/10.1080/10495398.2020.1763376.DOI: 10.1080/10495398.2020.1763376.
|
| [7] |
ZWICK R K, RUDOLPH M C, SHOOK B A, et al. Adipocyte hypertrophy and lipid dynamics underlie mammary gland remodeling after lactation[J]. Nature Communications, 2018, 9(1): 3592. DOI:10.1038/s41467-018-05911-0 |
| [8] |
ITOU J, TAKAHASHI R, SASANUMA H, et al. Estrogen induces mammary ductal dysplasia via the upregulation of Myc expression in a DNA-repair-deficient condition[J]. iScience, 2020, 23(2): 100821. DOI:10.1016/j.isci.2020.100821 |
| [9] |
ARENDT L M, KUPERWASSER C. Form and function: how estrogen and progesterone regulate the mammary epithelial hierarchy[J]. Journal of Mammary Gland Biology and Neoplasia, 2015, 20(1/2): 9-25. |
| [10] |
MANAVATHI B, SAMANTHAPUDI V S K, GAJULAPALLI V N R. Estrogen receptor coregulators and pioneer factors: the orchestrators of mammary gland cell fate and development[J]. Frontiers in Cell and Developmental Biology, 2014, 2: 34. |
| [11] |
BENNETTS H W, UNDERWOOD E J, SHIER P L. A specific breeding problem of sheep on subterranean clover pastures in Western Australia[J]. The Veterinary Journal, 1946, 102(11): 348-352. |
| [12] |
刘春龙, 李忠秋, 张帆, 等. 大豆黄酮和染料木素对体外培养奶牛乳腺上皮细胞增殖及抗氧化水平的影响[J]. 畜牧兽医学报, 2008, 39(11): 1517-1522. LIU C L, LI Z Q, ZHANG F, et al. Effect of daidzein and genistein on proliferation and antioxidation of mammary epithelial cell of dairy cow in vitro[J]. Acta Veterinaria et Zootechnica Sinica, 2008, 39(11): 1517-1522 (in Chinese). DOI:10.3321/j.issn:0366-6964.2008.11.011 |
| [13] |
TSUGAMI Y, SUZUKI N, SUZUKI T, et al. Regulatory effects of soy isoflavones and their metabolites in milk production via different ways in mice[J]. Journal of Agricultural and Food Chemistry, 2020, 68(21): 5847-5853. DOI:10.1021/acs.jafc.0c01288 |
| [14] |
YAO J M, WANG Z, WANG R, et al. Anti-proliferative and anti-inflammatory prenylated isoflavones and coumaronochromones from the fruits of Ficus altissima[J]. Bioorganic Chemistry, 2021, 113: 104996. DOI:10.1016/j.bioorg.2021.104996 |
| [15] |
LI Y W, CAO Y, WANG J X, et al. Kp-10 promotes bovine mammary epithelial cell proliferation by activating GPR54 and its downstream signaling pathways[J]. Journal of Cellular Physiology, 2020, 235(5): 4481-4493. DOI:10.1002/jcp.29325 |
| [16] |
GUO J L, WANG Q L, ZHANG Y, et al. Functional daidzein enhances the anticancer effect of topotecan and reverses BCRP-mediated drug resistance in breast cancer[J]. Pharmacological Research, 2019, 147: 104387. DOI:10.1016/j.phrs.2019.104387 |
| [17] |
陈静, 王根林, 李莲, 等. 雌激素对奶牛乳腺上皮细胞增殖及抗氧化性的影响[J]. 农业生物技术学报, 2013, 21(2): 216-222. CHEN J, WANG G L, LI L, et al. Effects of estrogen on proliferation and antioxidation in bovine (Bos taurus) mammary epithelial cells[J]. Journal of Agricultural Biotechnology, 2013, 21(2): 216-222 (in Chinese). DOI:10.3969/j.issn.1674-7968.2013.02.012 |
| [18] |
曹艳红, 周恒, 滕少花, 等. 雌激素对奶山羊乳腺上皮细胞增殖及超微结构的影响[J]. 黑龙江畜牧兽医, 2015(9): 1-5. CAO Y H, ZHOU H, TENG S H, et al. Effect of estrogen on the proliferation and ultrastructure in the mammary epithelial cells of dairy goat[J]. Heilongjiang Animal Science and Veterinary Medicine, 2015(9): 1-5 (in Chinese). |
| [19] |
武开乐, 库西塔别克·买买提依不拉音, 马静, 等. 雌激素对奶牛乳腺上皮细胞增殖及细胞周期变化规律的影响[J]. 新疆农业科学, 2019, 56(3): 570-579. WU K L, MAIMAITIYIBULAYIN K X T B K, MA J, et al. Effects of estrogen on the proliferation and cell cycle of mammary gland epithelial cells in dairy cows[J]. Xinjiang Agricultural Sciences, 2019, 56(3): 570-579 (in Chinese). |
| [20] |
TCHAKARSKA G, SOLA B. The double dealing of cyclin D1[J]. Cell Cycle, 2020, 19(2): 163-178. DOI:10.1080/15384101.2019.1706903 |
| [21] |
PENTTINEN P, JAEHRLING J, DAMDIMOPOULOS A E, et al. Diet-derived polyphenol metabolite enterolactone is a tissue-specific estrogen receptor activator[J]. Endocrinology, 2007, 148(10): 4875-4886. DOI:10.1210/en.2007-0289 |
| [22] |
刘丽军, 杜惠兰, 修贺明, 等. 雌二醇促人乳腺细胞株增殖及其ERβ表达[J]. 中国病理生理杂志, 2007, 23(1): 193-194. LIU L J, DU H L, XIU H M, et al. Estradiol promotes the proliferation of human breast cell line and ERβ expression[J]. Chinese Journal of Pathophysiology, 2007, 23(1): 193-194 (in Chinese). DOI:10.3321/j.issn:1000-4718.2007.01.045 |
| [23] |
MENUET A, PELLEGRINI E, ANGLADE I, et al. Molecular characterization of three estrogen receptor forms in zebrafish: binding characteristics, transactivation properties, and tissue distributions[J]. Biology of Reproduction, 2002, 66(6): 1881-1892. DOI:10.1095/biolreprod66.6.1881 |
| [24] |
ZHANG W H, ANDERSSON S, CHENG G J, et al. Update on estrogen signaling[J]. FEBS Letters, 2003, 546(1): 17-24. DOI:10.1016/S0014-5793(03)00436-8 |
| [25] |
ZHOU W J, ZHANG J, XIE F, et al. CD45RO-CD8+ T cell-derived exosomes restrict estrogen-driven endometrial cancer development via the ERβ/miR-765/PLP2/Notch axis[J]. Theranostics, 2021, 11(11): 5330-5345. DOI:10.7150/thno.58337 |




