免疫抑制是指动物机体免疫系统受到损伤而导致的暂时性或持久性的免疫机能障碍,使机体对各种病原易感性显著增加的一种状态。近年来,有关畜禽免疫抑制性疾病的报道不断增多,其发病率与感染率也不断增高和日趋严重,已成为制约我国畜牧业生产发展的重大问题。因此,随着中医药免疫学的发展,利用中药材来调节动物机体免疫功能已成为研究的热门话题。芒柄花素(formonetin, FMN)为异黄酮类化合物,又称刺芒柄花素,广泛存在于植物中。研究表明,FMN也是沙冬青种子中总黄酮的主要组成成分[1],具有调节脂质代谢、抗肿瘤、抗炎、抗菌、抗氧化、降血脂等作用[2-3]。由于FMN具有较低的副作用和毒性[4],因此近年来成为研究热点,但主要研究方向还在于其抗肿瘤作用。Wu等[5]研究证明FMN通过调控miR-21和抑癌基因PTEN抑制人膀胱癌细胞的增殖和侵袭性。张彦平等[6]研究证明FMN对动物机体免疫功能具有调节作用并对免疫器官及功能具有修复作用。但肠道黏膜免疫系统作为机体整个免疫网络中的重要组成部分,有关FMN对其影响等报道鲜见。因此,本研究旨在深入探索FMN对小鼠小肠黏膜免疫功能的影响,为进一步研发沙冬青种子总黄酮新型免疫增强剂奠定重要基础。
1 材料与方法 1.1 主要试剂FMN(上海某生化科技有限公司);环磷酰胺(美国Sigam公司);白细胞介素-2(IL-2)、白细胞介素-6(IL-6)检测试剂盒(上海酶联生物科技有限公司);分泌型免疫球蛋白A(sIgA)检测试剂盒(南京建成生物工程研究所),其余试剂均为国产分析纯。
1.2 试验动物分组与试验设计50只清洁级昆明种小鼠,购自中国农业科学院兰州兽医研究所实验动物中心,许可证号:SCXK(甘)2020—0002,20日龄、体重18~20 g,常规饲养管理,适应1周后分组。随机分为5组:空白对照组、免疫抑制模型组以及FMN低、中、高剂量组,每组10只(雌雄各占1/2)。
全部动物试验共28 d。前7 d,空白对照组小鼠灌胃0.6 mL/d生理盐水,免疫抑制模型组与FMN低、中、高剂量组小鼠均灌胃40 mg/(kg·d)环磷酰胺(cyclophosphamide, CTX)0.6 mL;后21 d,空白对照组与免疫抑制模型组小鼠每天灌胃0.6 mL生理盐水,FMN低、中、高剂量组小鼠分别灌胃50、150、250 mg/(kg·d) FMN 0.6 mL。常规饲养管理,每日称取小鼠体重。末次给药24 h后,脱臼处死,分别进行脏器指数、肠黏膜细胞因子及sIgA含量测定。同时,采集小鼠各段肠道黏膜,分别进行显微与超微结构观察。
1.3 胸腺和脾脏指数测定取小鼠胸腺和脾脏,磷酸盐缓冲液(PBS)冲洗,用滤纸吸去多余水分称重,并计算胸腺和脾脏指数。

|
取靠近十二指肠段空肠约2 cm,PBS冲洗后刮取肠黏膜,称重,加入9倍生理盐水制成10%的组织匀浆,3 500 r/min离心10 min,取上清液,-20 ℃保存。采用酶联免疫吸附试验(ELISA)法检测小肠黏膜IL-2、IL-6及sIgA含量。
1.5 小肠黏膜显微与超微结构观察取十二指肠、空肠、回肠各3段(每段1.5 cm),PBS冲洗后,4%多聚甲醛磷酸缓冲液固定。常规石蜡包埋,连续切片(厚度4 μm),每隔5张切片取1张,进行苏木精-伊红(HE)染色和过碘酸雪夫(PAS)染色,镜下观察小肠黏膜结构特点以及上皮细胞与杯状细胞形态并拍照,Image-Pro Plus软件测量肠绒毛高度和隐窝深度,计算绒腺比(绒腺比=绒毛高度/隐窝深度,V/C),统计每100个上皮细胞间的上皮内淋巴细胞(IELs)和杯状细胞数量。取1 mm3回肠2.5%戊二醛固定,树脂包埋,超薄切片(70 nm),双重染色(醋酸铀、硝酸铅),透射电子显微镜分析、拍照。
1.6 统计分析试验数据采用SPSS 24.0软件进行单因素方差分析(one-way ANOVA),采用Duncan氏多重比较检验分析组间差异显著性,P < 0.05为差异显著,P < 0.01为差异极显著。数据用平均值±标准差(X±SD)表示。
2 结果与分析 2.1 FMN对免疫抑制小鼠胸腺和脾脏指数的影响由表 1可知,免疫抑制模型组小鼠胸腺指数、脾脏指数均低于空白对照组,尤其脾脏指数差异显著(P < 0.05)。证明CTX对小鼠胸腺和脾脏的发育产生了明显抑制作用,表明小鼠免疫抑制模型复制成功。与免疫抑制模型组相比,FMN各剂量组小鼠胸腺和脾脏指数均有不同程度的升高,尤其FMN中剂量组小鼠胸腺和脾脏指数升高,其中胸腺指数差异显著(P < 0.05),脾脏指数差异极显著(P < 0.01)。结果表明,FMN对免疫抑制小鼠胸腺、脾脏的生长发育具有显著的促进作用。
|
|
表 1 FMN对免疫抑制小鼠胸腺、脾脏指数的影响 Table 1 Effects of FMN on thymus index and spleen index of immunosuppressed mice (n=10) |
由表 2可知,免疫抑制模型组小鼠小肠黏膜IL-2和IL-6含量均显著低于空白对照组(P < 0.05),sIgA含量极显著低于空白对照组(P < 0.01),这也证明CTX对小鼠小肠黏膜免疫功能产生了明显抑制,导致小肠黏膜IL-2、IL-6含量大大降低。与免疫抑制模型组相比,FMN各剂量组小鼠小肠黏膜IL-2、IL-6和sIgA含量均有不同程度的升高,其中FMN中剂量组IL-2含量与sIgA含量差异极显著(P < 0.01),IL-6含量差异显著(P < 0.05)。结果表明FMN对免疫抑制小鼠小肠黏膜免疫功能具有明显的促进作用。
|
|
表 2 FMN对免疫抑制小鼠小肠黏膜IL-2、IL-6及sIgA含量的影响 Table 2 Effects of FMN on IL-2, IL-6 and sIgA contents in small intestine of immunosuppressive mice (n=10) |
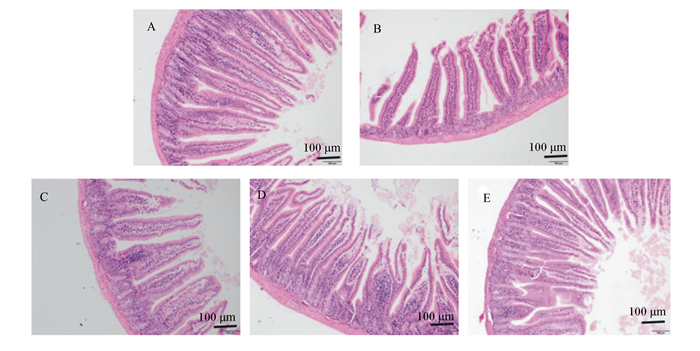
空白对照组小肠绒毛排列紧密、整齐,绒毛上皮细胞连续、完整(图 1-A)。免疫抑制模型组小鼠小肠绒毛排列明显稀疏、杂乱,且黏膜上皮有明显脱落(图 1-B),表明CTX对小鼠小肠黏膜屏障产生了明显的损伤。与免疫抑制模型组比较,FMN各剂量组小鼠小肠绒毛不同程度的增多,绒毛间隙逐渐变窄、整齐,上皮细胞连续性程度不等恢复。其中,以FMN中剂量组表现最明显(图 1-C、图 1-D、图 1-E)。
|
A:空白对照组;B:免疫抑制模型组;C:FMN低剂量组;D:FMN中剂量组;E:FMN高剂量组。图 3同。 A: normal control group; B: immunosuppressive model group; C: FMN low dose group; D: FMN medium dose group; E: FMN high dose group. The same as Fig. 3. 图 1 FMN对免疫抑制小鼠小肠组织结构的影响 Fig. 1 Effects of FMN on mucosal structure in small intestine of immunosuppressive mice (100×) |
由表 3可知,空白对照组十二指肠、空肠及回肠绒毛高度均高于免疫抑制模型组,其中十二指肠和空肠绒毛高度与免疫抑制模型组比较,差异极显著(P < 0.01),这也进一步表明,免疫抑制模型组小鼠小肠黏膜结构受损。与免疫抑制模型组相比,FMN各剂量组小鼠小肠绒毛高度均不同程度的增高,尤其FMN中剂量组最突出,其中十二指肠和空肠绒毛高度极显著增加(P < 0.01)。而各组肠道隐窝深度虽有一定变化,但不具有统计学意义。此外,与免疫抑制模型组比较,FMN各剂量组小鼠小肠各段V/C也均不同程度的增高,其中,FMN中剂量组小肠各段V/C增高最明显,尤其十二指肠V/C显著增高(P < 0.05)。这一结果表明,FMN对免疫抑制小鼠小肠黏膜屏障和结构的损伤有明显的修复作用。
|
|
表 3 FMN对免疫抑制小鼠小肠绒毛高度、隐窝深度及绒腺比的影响 Table 3 Effects of FMN on villus height, crypt depth and V/C in small intestine of immunosuppressed mice (n=25) |
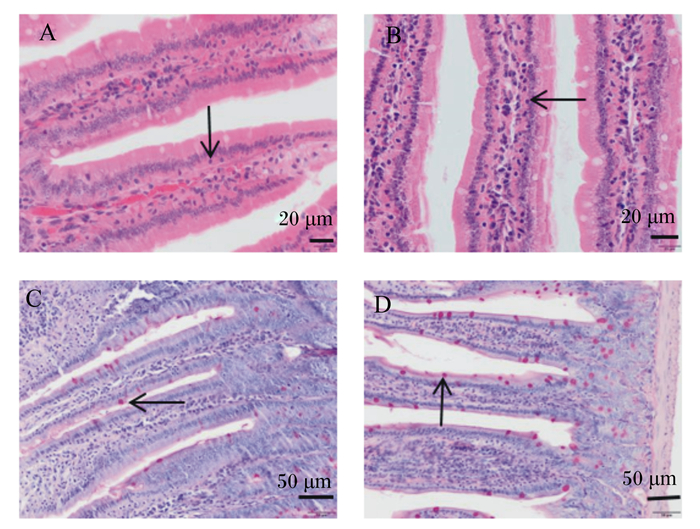
小鼠小肠IELs弥散分布于肠黏膜上皮细胞之间,以小淋巴细胞为主,胞核大而圆、染色深,胞浆少(图 2-A、图 2-B)。小鼠小肠杯状细胞主要分布于肠黏膜上皮细胞和肠腺细胞之间,呈高脚杯状,PAS染色呈阳性反应,胞核呈蓝紫色,糖原及其他PAS反应阳性物质呈红色(图 2-C、图 2-D)。
|
上面2个图为十二指肠IELs,A:免疫抑制模型组,B:FMN中剂量组(HE,400×);下面2个图为十二指肠杯状细胞,C:免疫抑制模型组;D:FMN中剂量组(HE,200×)。 The top two figures were duodenal intraepithelial lymphocytes, A: immunosuppressive model group, B: FMN medium dose group (HE, 400×); the following figures were duodenal goblet cells, C: immunosuppressive model group (HE, 400×), D: FMN medium dose group (HE, 200×). 图 2 FMN对免疫抑制小鼠小肠黏膜IELs和杯状细胞的影响 Fig. 2 Effects of FMN on IELs and goblet cells in small intestine of immunosuppressed mice |
由表 4可知,免疫抑制模型组小鼠小肠黏膜IELs和杯状细胞的数量均低于空白对照组,IELs数量在回肠差异显著(P < 0.05),在其他肠段差异极显著(P < 0.01);杯状细胞数量在十二指肠差异显著(P < 0.05),在回肠差异极显著(P < 0.01),这也进一步证明CTX对小鼠小肠黏膜免疫活性细胞的分化与成熟产生明显的抑制作用。FMN各剂量组与免疫抑制模型组比较,小肠黏膜IELs和杯状细胞的数量均有不同程度的增多,尤其FMN中剂量组小鼠小肠黏膜IELs和杯状细胞的数量增多最突出,其中十二指肠、空肠和回肠IELs的数量差异显著或极显著(P < 0.05或P < 0.01);杯状细胞数量差异极显著(P < 0.01)。这表明FMN对免疫抑制小鼠小肠黏膜免疫活性细胞的分化和成熟也具有明显的促进作用。
|
|
表 4 FMN对免疫抑制小鼠小肠黏膜IELs和杯状细胞数量的影响 Table 4 Effects of FMN on IELs and goblet cells number in small intestine of immunosuppressed mice (n=25) |
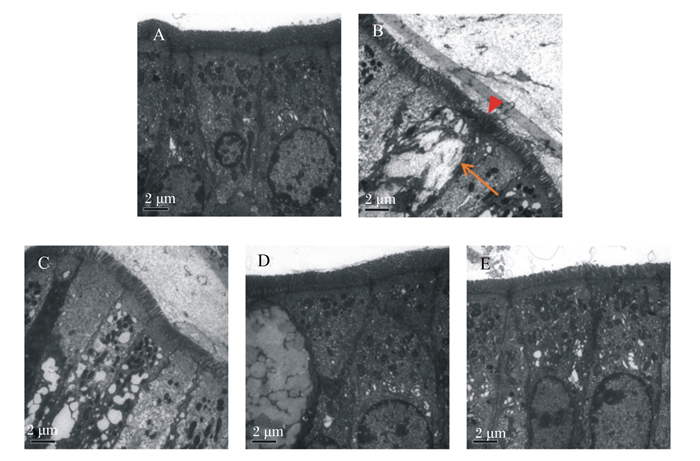
电镜观察表明,空白对照组小鼠小肠黏膜上皮细胞呈柱状,上皮柱状细胞排列整齐,细胞间连接紧密,细胞界限清晰,细胞游离面有许多微绒毛排列整齐的伸向肠腔(图 3-A);同时,上皮柱状细胞内线粒体等细胞器结构完整,胞核完整核膜清晰(图 3-A)。免疫抑制模型组与空白对照组相比较,上皮柱状细胞微绒毛明显缩短,甚至断裂,排列杂乱、稀疏,有的上皮柱状细胞坏死崩解,细胞器程度不等扩张呈空泡状,线粒体肿胀、嵴断裂崩解,有的细胞核溶解,细胞间连接疏散(图 3-B)。与免疫抑制模型组相比,FMN各剂量组小肠黏膜上皮柱状细胞微绒毛明显增长,且逐渐排列紧密整齐,同时,变性上皮柱状细胞明显减少,上皮柱状细胞内细胞器空泡化也明显减少,细胞间连接明显清晰,尤其中剂量组表现明显(图 3-D)。
|
图 3 FMN对免疫抑制小鼠小肠黏膜超微结构的影响 Fig. 3 Effects of FMN on ultrastructure in small intestine of immunosuppressed mice (8 000×) |
大量研究证明,CTX不仅可以造成动物机体外周淋巴细胞数量迅速下降,引发机体免疫抑制,同时也可以导致机体肠道黏膜屏障损伤,从而导致肠道黏膜免疫抑制[7-9]。本试验研究也证明,CTX不仅引起小鼠免疫抑制,胸腺、脾脏显著萎缩,而且对肠道黏膜免疫屏障也造成明显损伤和抑制;当CTX灌胃后,小鼠胸腺指数与脾脏指数均显著低于空白对照组,小肠绒毛高度显著下降,微绒毛断裂,柱状上皮细胞变性坏死,肠黏膜IL-2、IL-6和sIgA含量以及IELs和杯状细胞数量也显著低于空白对照组,再次证明CTX不仅对机体产生免疫抑制,而且对肠道黏膜免疫系统也产生抑制。上述结果也表明,本试验CTX诱导的小鼠黏膜免疫抑制模型复制成功。
IL-2和IL-6属于血细胞生成素(Ⅰ类)家族的细胞因子,IL-2可促进活化T细胞和B细胞生长、增殖和分化,是调控免疫应答的重要因子[10]。IL-6是促使B细胞分化成浆细胞并分泌抗体的重要启动信号[11-12]。因此,黏膜组织中IL-2和IL-6的含量可以反映其中T细胞和B细胞的表达水平。sIgA为机体黏膜免疫的主要效应分子,具有抵抗病原入侵等多种功能[13]。崔艺燕等[14]研究表明,柑橘黄酮可以有效提高断奶仔猪空肠黏膜IL-2、IL-6和sIgA含量;黄其春等[15]也发现银杏叶总黄酮可以显著提高仔猪肠黏膜IL-2和sIgA含量。本试验也表明,免疫抑制小鼠在灌胃FMN后,小肠黏膜IL-2、IL-6和sIgA含量不同程度的升高,其中FMN中剂量组升高最明显,首次证明FMN可促进小肠黏膜T、B淋巴细胞的分化与成熟,促使小肠黏膜IL-2、IL-6和sIgA的分泌,显著增强和改善免疫抑制机体小肠黏膜免疫功能。
肠绒毛高度、隐窝深度和V/C等是衡量小肠消化、吸收功能强弱的重要指标。大量研究指出,动物机体小肠绒毛高度反映出小肠黏膜与接触营养物质的面积大小;隐窝深度反映了细胞的生成率和分泌功能;而V/C则反映小肠功能的状态[16-17]。同时,小肠黏膜的完整性、连续性以及各种免疫活性细胞的数量、分布等还反映出其黏膜屏障的功能和特性。王莹等[18]研究证明,葡萄原花青素可改善营养性肥胖大鼠回肠绒毛高度、隐窝深度和V/C,从而加强小肠消化吸收功能。本研究也证明,CTX诱导的免疫抑制小鼠小肠黏膜结构受损,V/C显著降低,上皮柱状细胞及微绒毛也严重损伤。而FMN具有明显促进免疫抑制小鼠小肠黏膜屏障和结构的修复作用。
小肠黏膜的相关免疫活性细胞是其黏膜免疫活性的重要组成,特别是IELs和杯状细胞等[19]。IELs是机体消化道黏膜免疫系统中与外来抗原及微生物最先发生接触并发生免疫反应的细胞。已有研究表明,IELs可以对小肠道黏膜屏障损伤或感染做出快速反应,诱导黏膜免疫应答,保护小肠黏膜上皮,维持其肠道稳态。杯状细胞可分泌黏蛋白等形成肠道黏液屏障从而对肠黏膜形成保护和润滑作用[20-21]。此外,有研究表明,杯状细胞还具有分泌抗菌肽、趋化因子和细胞因子等免疫活性因子和抗原呈递功能[22]。因此,小肠IELs和杯状细胞的数量的变化可以反映出小肠膜免疫屏障的完整性以及免疫防御完善性。黄其春等[15]和李焰等[23]研究均证明银杏叶总黄酮可以通过改善机体肠黏膜结构,促进机体肠黏膜IELs和杯状细胞的增殖,从而保护肠道黏膜屏障的完整性。本试验研究也首次证明,FMN不仅能够明显改善和修复免疫抑制小鼠小肠黏膜结构和损伤,而且明显促进小肠黏膜IELs和杯状细胞增殖和分化,从而大大增强和改善机体小肠消化和黏膜免疫功能。
已有研究表明,异黄酮化合物可对动物机体肠道黏膜免疫功能产生明显影响。Wei等[24]的研究发现,膳食异黄酮能够抑制小鼠黏膜免疫应答,而染料木黄酮和橙皮苷则能通过促进肠上皮内淋巴细胞的增殖来增强黏膜免疫[25]。胡胜兰等[26]研究从细胞水平证明了低浓度大豆异黄酮对氧化应激仔猪肠上皮细胞具有保护作用,但浓度过高时则对细胞呈抑制作用。杨金玉等[27]研究也证明,作为黄酮类化合物的葡萄原花青素在一定作用剂量下,可有效调节感染球虫的肉仔鸡肠道IELs数量和sIgA含量,然而随着其剂量的增加,调节作用反而降低。这与本试验研究结果均一致,较低作用剂量的FMN可促进小鼠小肠黏膜免疫功能的增强;相反,较高的作用剂量则使小鼠小肠黏膜免疫功能降低或抑制,但关于FMN适宜剂量范围还需要进一步研究证明。因此,本研究认为黄酮类化合物可能对机体肠黏膜免疫功能具有双向调节作用,但具体作用机理有待进一步研究。
4 结论综上所述,一定剂量的FMN可显著改善和促进免疫抑制小鼠小肠黏膜免疫功能的恢复和增强;同时,还可减少小肠黏膜的损伤,恢复和促进小肠黏膜结构和功能的稳定,尤其以FMN中剂量组(150 mg/kg)最为明显。
| [1] |
刘升, 张嘉男, 贾宁, 等. 沙冬青种子总黄酮活性成分分析及对小鼠免疫功能的影响[J]. 中国畜牧兽医, 2019, 46(9): 2726-2736. LIU S, ZHANG J N, JIA N, et al. Analysis of active components of total flavonoids from the seeds of Ammopiptanthus mongolicus and its effects on immune function in mice[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(9): 2726-2736 (in Chinese). |
| [2] |
赵玉民, 冯叶雯, 张黎, 等. 芒柄花素抗肿瘤作用机制的研究进展[J]. 中国实验方剂学杂志, 2021, 27(10): 193-203. ZHAO Y M, FENG Y W, ZHANG L, et al. Research progress on anti-tumor mechanism of formononetin[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(10): 193-203 (in Chinese). |
| [3] |
邹小蓉, 徐露. 刺芒柄花素对脑缺血再灌注损伤大鼠的保护作用及其机制研究[J]. 中国现代应用药学, 2018, 35(6): 855-858. ZOU X R, XU L. Protective effects and mechanism study of formononetin on cerebral ischemia-reperfusion injury in rats[J]. Chinese Journal of Modern Applied Pharmacy, 2018, 35(6): 855-858 (in Chinese). |
| [4] |
TAY K C, TAN L T H, CHAN C K, et al. Formononetin: a review of its anticancer potentials and mechanisms[J]. Frontiers in Pharmacology, 2019, 10: 820. DOI:10.3389/fphar.2019.00820 |
| [5] |
WU Y Y, ZHANG X, LI Z Z, et al. Formononetin inhibits human bladder cancer cell proliferation and invasiveness via regulation of miR-21 and PTEN[J]. Food & Function, 2017, 8(3): 1061-1066. |
| [6] |
张彦平, 邓康, 贾宁, 等. 芒柄花素对免疫抑制小鼠免疫功能影响的研究[J]. 中国畜牧兽医, 2020, 47(3): 922-930. ZHANG Y P, DENG K, JIA N, et al. The effect of formononetin on the immune function in immunosuppressed mice[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(3): 922-930 (in Chinese). |
| [7] |
SALVA S, MARRANZINO G, VILLENA J, et al. Probiotic Lactobacillus strains protect against myelosuppression and immunosuppression in cyclophosphamide-treated mice[J]. International Immunopharmacology, 2014, 22(1): 209-221. DOI:10.1016/j.intimp.2014.06.017 |
| [8] |
MIAO M S, CAO L H, QIAO J Y, et al. Effect of Jinjiang granules on intestinal mucosal immunity in mice model[J]. Journal of Investigative Medicine, 2017, 65(Suppl.7): A7. |
| [9] |
严胜泽, 马玉芳, 廖吕燕, 等. 太子参多糖对环磷酰胺所致肠道黏膜损伤小鼠SIgA、IL-2、IL-6含量的影响[J]. 中国畜牧兽医, 2015, 42(5): 1187-1192. YAN S Z, MA Y F, LIAO L Y, et al. Effect of Pseudostellaria polysaccharides on SIgA, IL-2 and IL-6 contents of intestinal mucosal injured mice caused by cyclophosphamide[J]. China Animal Husbandry & Veterinary Medicine, 2015, 42(5): 1187-1192 (in Chinese). |
| [10] |
JOOSSE M E, CHARBIT-HENRION F, BOISGARD R, et al. Duplication of the IL2RA locus causes excessive IL-2 signaling and may predispose to very early onset colitis[J]. Mucosal Immunology, 2021, 14(5): 1172-1182. DOI:10.1038/s41385-021-00423-5 |
| [11] |
KOSTADINOVA A I, MIDDELBURG J, CIULLA M, et al. PLGA nanoparticles loaded with beta-lactoglobulin-derived peptides modulate mucosal immunity and may facilitate cow's milk allergy prevention[J]. European Journal of Pharmacology, 2018, 818: 211-220. DOI:10.1016/j.ejphar.2017.10.051 |
| [12] |
O'SHEA N R, CHEW T S, DUNNE J, et al. Critical role of the disintegrin metalloprotease ADAM-like decysin-1 [ADAMDEC1] for intestinal immunity and inflammation[J]. Journal of Crohn's & Colitis, 2016, 10(12): 1417-1427. |
| [13] |
SUN H F, BI J C, LEI Q C, et al. Partial enteral nutrition increases intestinal sIgA levels in mice undergoing parenteral nutrition in a dose-dependent manner[J]. International Journal of Surgery, 2018, 49: 74-79. DOI:10.1016/j.ijsu.2017.12.011 |
| [14] |
崔艺燕, 田志梅, 邓盾, 等. 柑橘提取物对仔猪免疫功能的影响[J]. 动物营养学报, 2020, 32(1): 99-108. CUI Y Y, TIAN Z M, DENG D, et al. Effects of citrus extract on immunity of piglets[J]. Chinese Journal of Animal Nutrition, 2020, 32(1): 99-108 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.01.015 |
| [15] |
黄其春, 陈彤, 郑新添, 等. 银杏叶提取物对断奶仔猪小肠黏膜免疫屏障的影响[J]. 安徽农业大学学报, 2015, 42(5): 711-714. HUANG Q C, CHEN T, ZHENG X T, et al. Effects of Ginkgo biloba extract on intestinal mucosal immune barrier in weaned piglets[J]. Journal of Anhui Agricultural University, 2015, 42(5): 711-714 (in Chinese). |
| [16] |
CHEN H, MAO X B, HE J, et al. Dietary fibre affects intestinal mucosal barrier function and regulates intestinal bacteria in weaning piglets[J]. British Journal of Nutrition, 2013, 110(10): 1837-1848. DOI:10.1017/S0007114513001293 |
| [17] |
MAO X B, ZENG X F, QIAO S Y, et al. Specific roles of threonine in intestinal mucosal integrity and barrier function[J]. Frontiers in Bioscience(Elite Edition), 2011, 3: 1192-1200. |
| [18] |
王莹, 张婷, 黄璐璐. 葡萄籽原花青素对肥胖大鼠肠粘膜的影响[J]. 核农学报, 2019, 33(08): 1569-1574. WANG Y, ZHANG T, HUANG L L. Effect of grape seed proanthocyanidin on intestinal mucosa of obese rats[J]. Nuclear agrochemical journal, 2019, 33(8): 1569-1574 (in Chinese). |
| [19] |
LU J T, XU A T, SHEN J, et al. Crosstalk between intestinal epithelial cell and adaptive immune cell in intestinal mucosal immunity[J]. Journal of Gastroenterology and Hepatology, 2017, 32(5): 975-980. DOI:10.1111/jgh.13723 |
| [20] |
TIAN F, SHAO C Y, WANG Y Y, et al. Dietary Lactobacillus casei can be used to influence intraepithelial lymphocyte migration and modulate mucosal immunity in chicks[J]. British Poultry Science, 2021, 62(4): 492-498. DOI:10.1080/00071668.2021.1889464 |
| [21] |
LOSURDO G, PISCITELLI D, IERARDI E, et al. Intraepithelial lymphocytes: bystanders or causative factors in functional gastrointestinal disorders?[J]. Cellular & Molecular Immunology, 2021, 18(7): 1620-1621. |
| [22] |
KNOOP K A, NEWBERRY R D. Goblet cells: multifaceted players in immunity at mucosal surfaces[J]. Mucosal Immunology, 2018, 11(6): 1551-1557. DOI:10.1038/s41385-018-0039-y |
| [23] |
李焰, 王华, 尹会方, 等. 银杏叶复方对肉兔小肠黏膜形态及上皮内淋巴细胞和杯状细胞数量的影响[J]. 安徽农业大学学报, 2013, 40(4): 529-533. LI Y, WANG H, YIN H F, et al. Influence of Ginkgo biloba compound on the morphology of small intestine mucosa and the number of intraepithelial lymphocytes and goblet cells in meat rabbits[J]. Journal of Anhui Agricultural University, 2013, 40(4): 529-533 (in Chinese). |
| [24] |
WEI J, BHATT S, CHANG L M, et al. Isoflavones, genistein and daidzein, regulate mucosal immune response by suppressing dendritic cell function[J]. PLoS One, 2012, 7(10): e47979. DOI:10.1371/journal.pone.0047979 |
| [25] |
KAMBOH A A, HANG S Q, KHAN M A, et al. In vivo immunomodulatory effects of plant flavonoids in lipopolysaccharide-challenged broilers[J]. Animal, 2016, 10(10): 1619-1625. DOI:10.1017/S1751731116000562 |
| [26] |
胡胜兰, 肖昊, 王丽, 等. 大豆异黄酮对体外氧化应激仔猪肠上皮细胞的影响及机制研究[J/OL]. 动物营养学报: 1-10. (2021-09-02)[2021-09-13]. http://kns.cnki.net/kcms/detail/11.5461.s.20210901.1549.002.html. HU S L, XIAO H, WANG L, et al. Effects and mechanism research of soybean isoflavones on intestinal epithelial cells of piglets under oxidative stress in vitro[J/OL]. Chinese Journal of Animal Nutrition: 1-10. (2021-09-02)[2021-09-13]. http://kns.cnki.net/kcms/detail/11.5461.s.20210901.1549.002.html. (in Chinese) |
| [27] |
杨金玉, 张海军, 王晶, 等. 葡萄原花青素对感染柔嫩艾美尔球虫肉仔鸡生长性能和免疫功能的影响[J]. 动物营养学报, 2016, 28(9): 2802-2811. YANG J Y, ZHANG H J, WANG J, et al. Effects of grape procyanidins on growth performance and immune function of broiler chicks challenged with Eimeria tenella[J]. Chinese Journal of Animal Nutrition, 2016, 28(9): 2802-2811 (in Chinese). DOI:10.3969/j.issn.1006-267x.2016.09.019 |




