支链脂肪酸(branched chain fatty acids, BCFAs)是指脂肪酸碳链上有1个或多个烃基支链的脂肪酸,广泛存在于多种微生物中,生物活性强,但是在其他生物体内的含量较少[1]。BCFAs还根据主链碳原子的数量可分为短链(2~5个碳原子)、中链(6~12个碳原子)和长链(13个及以上碳原子)BCFAs。目前,BCFAs相关的研究主要集中在抗癌等疾病治疗方面,而对畜禽生长、健康和营养调控的研究较少,研究多关注于短链和中链BCFAs,对于长链BCFAs(LC-BCFAs)的研究也较少。
肠道是动物体内最大的消化和免疫器官,其生理功能主要包括消化和吸收、屏障作用、内分泌与免疫应答等,这些生理过程均与肠道中的菌群组成息息相关[2]。由此可见,肠道健康对于维持动物整体的健康必不可少[3]。而肠道健康的评定也是一个综合性的概念,其中包括肠道免疫反应、消化吸收功能、肠道菌群组成、肠道屏障完整性和信号传导等[4]。目前已有研究报道,BCFAs作为天然存在的一类功能性脂肪酸,对动物的肠道健康具有良好的调控作用[5]。本文以肠道健康作为研究靶点,聚焦于LC-BCFAs,总结LC-BCFAs在缓解肠道炎症、改善肠道菌群、维持肠道屏障和促进肠道消化吸收等方面发挥的作用,探讨LC-BCFAs调控动物肠道健康的可能机制,以期为深入研究LC-BCFAs对动物肠道健康的调控作用及其在畜禽生产中的应用提供参考。
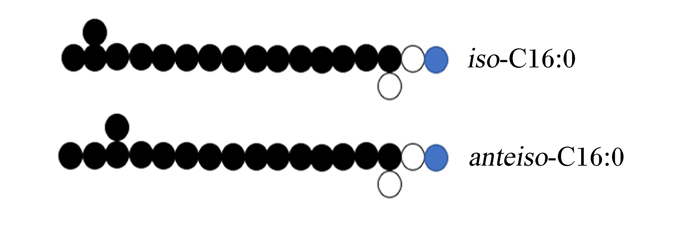
1 LC-BCFAs的结构与分布 1.1 LC-BCFAs的结构BCFAs因其支链种类和支链在主碳链上的位置不同而种类丰富,也因此BCFAs具有不同的结构。BCFAs根据其烃基支链(如甲基或乙基)在主碳链上位置的不同可分为异式BCFAs(iso-BCFAs)和反异式BCFAs(anteiso-BCFAs)。iso-BCFAs的烃基支链位于主碳链的ω-2碳原子处,而anteiso-BCFAs的烃基支链位于主碳链的ω-3碳原子处[6]。在BCFAs中,目前研究较为深入的是单甲基LC-BCFAs,结构式见图 1。除了单甲基LC-BCFAs以外,还有包含乙基和丙基等烃基支链的LC-BCFAs,例如,Dewulf等[7]发现脂肪酸合酶可以将乙基丙二酰基CoA代替经典脂肪酸合成途径中的丙二酰基CoA,进而合成含有乙基支链的LC-BCFAs。因为畜禽饲粮中的脂肪酸主要为长链脂肪酸,而畜禽肠道中的菌群可以参与LC-BCFAs的形成,之后被机体吸收,因此本文主要关注LC-BCFAs在调控动物肠道健康中发挥的作用。
|
●: 碳原子carbon atom; ○: 氧原子oxygen atom;  : 氢原子hydrogen atom。
图 1 不同构型的单甲基LC-BCFAs
Fig. 1
Monomethyl LC-BCFAs with different configurations : 氢原子hydrogen atom。
图 1 不同构型的单甲基LC-BCFAs
Fig. 1
Monomethyl LC-BCFAs with different configurations
|
自然界中常见的LC-BCFAs主要有以下几种:iso-C15∶0(C16H32O2)、anteiso-C15∶0(C16H32O2)、iso-C16∶0(C17H34O2)、iso-C17∶0(C18H36O2)、anteiso-C17∶0(C18H36O2)和iso-C18∶0(C19H38O2)等[8]。
1.2 LC-BCFAs的分布LC-BCFAs主要存在于革兰氏阳性菌中,而在其他生物体中少见[1]。有研究报道,芽孢杆菌属能产生6种LC-BCFAs(anteiso-C15∶0、anteiso-C17∶0、iso-C14∶0、iso-C15∶0、iso-C16∶0和iso-C17∶0)和2种直链脂肪酸(n-C14和n-C16),6种LC-BCFAs占总脂肪酸的60%以上[8]。而存在于微生物细胞膜中的LC-BCFAs,具有通过降低细胞膜上脂肪酸紧密封装形成刚性、高熔点延伸结构的能力,进而降低细胞膜上磷脂层的相变温度[9],从而影响了细菌细胞膜的结构和流动性[10]。例如,金黄色葡萄球菌细胞膜上的脂肪酸是由增加膜流动性的LC-BCFAs和降低膜流动性的直链脂肪酸参与构成[11]。
除在微生物中含量丰富外,LC-BCFAs在发酵食品和反刍动物肉、奶制品中含量较高。例如,羊肉香气中的“羊肉味”就来源于4-甲基辛酸(MOA)、4-乙基辛酸(EOA)和4-甲基壬酸(MNA)这3种BCFAs[12]。对牛乳中的乳脂进行分析,也发现含有14~18个碳原子的iso-BCFAs和anteiso-BCFAs,BCFAs占乳脂总脂肪酸的2.05%左右,其中anteiso-BCFAs占总BCFAs的50%以上[13]。发酵食品纳豆中BCFAs平均含量为0.21~1.43 mg/g,而且主要为14~17个碳原子的LC-BCFAs,其他发酵食品如虾酱和发酵的鱼中,LC-BCFAs分别为总脂肪酸的(1.63±0.72)%和(0.65±0.07)%[14]。
哺乳动物机体内的BCFAs主要由支链氨基酸(branched chain amino acids, BCAAs)衍生而来,在线粒体内的BCAAs可代谢生成多种类型的甲基酰基CoA,脂肪组织特异性表达的肉碱乙酰转移酶(carnitine acetyltransferase, CrAT)将该类代谢中间产物从线粒体运输到细胞质中,并被脂肪酸合酶以乙酰基CoA作为另一种底物所利用,进而完成BCFAs的从头合成[15]。LC-BCFAs在成年哺乳动物组织中分布较少,主要存在于新生儿的皮肤脂质中。例如,LC-BCFAs是新生儿皮肤脂质尤其是皮脂腺(sebaceous glands, SG)分泌物中的主要脂肪酸[16]。
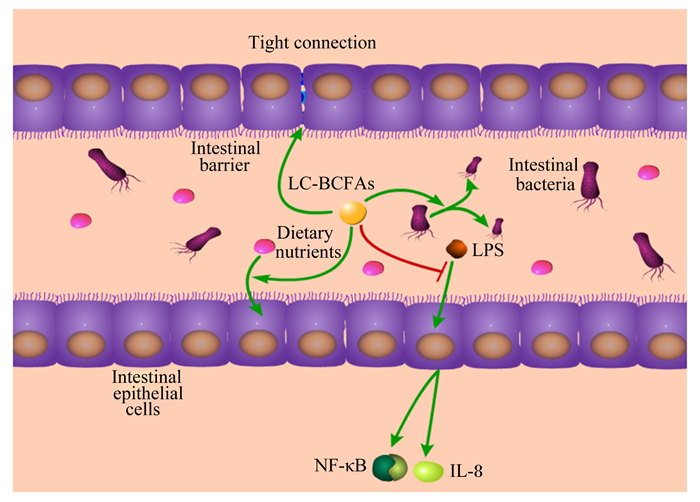
2 LC-BCFAs对动物肠道健康的调控作用肠道作为动物最主要的消化吸收器官,可以允许机体所需要的营养物质从肠腔进入循环系统,并进入机体的内部环境;而肠道作为机体屏障器官,可以阻止有害物质如病原微生物、肠腔内抗原和肠腔内促炎症因子等对机体的侵袭[17]。同时,肠道内的菌群平衡是维持肠道及机体其他部位稳态的重要保障[18]。动物肠道菌群代谢产生的LC-BCFAs在缓解肠道炎症、改善肠道菌群、维持肠道屏障和促进消化吸收等方面发挥着重要调控作用(图 2),并以此调控动物的肠道健康。
|
Tight connection:紧密连接;Intestinal barrier:肠道屏障;LC-BCFAs:长链支链脂肪酸long chain and branched chain fatty acids;LPS:脂多糖lipopolysaccharides;Dietary nutrients:饲粮营养物质;Intestinal bacteria: 肠道菌群;Intestinal epithelial cells:肠道上皮细胞;NF-κB:核转录因子-κB nuclear factor-κB;IL-8:白细胞介素-8 interleukin-8。 图 2 LC-BCFAs对动物肠道健康的调控作用 Fig. 2 Regulatory effect of LC-BCFAs on animal intestinal health[19-20] |
LC-BCFAs可缓解动物的肠道炎症。机体炎症反应会造成畜禽生产效益的低下和经济损失,据报道,促进动物产生快速、急性炎症反应的能力来控制感染的能力,并及时过渡到抗炎、组织修复过程和稳态,被认为是保持动物对病原体的抵抗力和最大限度减少非生产性营养损失的最佳方案[21]。而越来越多的研究表明,LC-BCFAs作为具有抗炎症作用的功能性脂肪酸,可缓解动物的肠道炎症反应。
LC-BCFAs可降低动物早期的坏死性小肠、结肠炎发病率。在畜牧生产中,仔猪新生期的死亡率在所有家畜中最为严重(5%~20%),而腹泻是导致仔猪死亡的重要因素,也是亟待解决的重大问题[22]。对新生仔猪而言,坏死性小肠结肠炎(necrotizing enterocolitis, NEC)是造成仔猪腹泻的常见病因,NEC会导致仔猪短肠综合征、肠狭窄、神经发育迟缓及腹泻等[23]。有研究发现,LC-BCFAs可降低动物早期的NEC发病率,例如Ran-Ressler等[5]研究表明,在饲粮总脂肪水平不变的情况下,添加多种LC-BCFAs(iso-C14∶0、anteiso-C15∶0、iso-C16∶0、anteiso-C17∶0和iso-C18∶0)的混合物可以降低大鼠NEC的发生率,维持肠道形态学和生理功能的完整性。另外,生产上的观察也发现,LC-BCFAs(anteiso-C15∶0、iso-C16∶0、iso-C17∶0和iso-C18∶0等)可作为早期区分腹泻犊牛和健康犊牛的生物标志物,其粪便中的LC-BCFAs组成和含量与犊牛肠道健康状态有密切的相关性[24]。
LC-BCFAs可减少肠道内促炎因子的表达,增加抗炎因子的表达,进而维持机体的肠道健康。近来的研究发现,通过对胎粪和胎儿肠道内容物中LC-BCFAs的含量曲线进行分析,显示BCFAs是正常健康足月新生儿胃肠道的主要定植成分[25]。Yan等[19]研究表明,长链iso-BCFAs(iso-C14∶0、iso-C16∶0、iso-C18∶0和iso-C20∶0)和长链anteiso-BCFAs(anteiso-C13∶0、anteiso-C15∶0和anteiso-C17∶0)均能不同程度抑制脂多糖(LPS)诱导的肠上皮细胞的促炎症标志物白细胞介素-8(interleukin-8,IL-8)和核转录因子-κB(nuclear factor-κB,NF-κB)的表达,从而抑制肠道过度的炎症反应。Ran-Ressler等[5]的研究表明,饲粮中添加多种LC-BCFAs混合物可提高益生菌枯草芽孢杆菌的丰度,且抗炎因子白细胞介素-10(interleukin-10,IL-10)的表达量增加了约3倍。
2.2 LC-BCFAs可改善肠道菌群组成肠道菌群伴随着宿主一起进化,是宿主机体的一部分,动态变化的肠道菌群会参与调控宿主的免疫、代谢、和神经系统功能等[26]。研究发现,LC-BCFAs可影响肠道菌群的增殖,抑制病原菌的致病能力和改变肠道菌群的组成。
LC-BCFAs可影响肠道菌群增殖。有研究报道,LC-BCFAs合成缺陷型的细菌突变体细胞膜结构会发生改变,导致细菌无法完成细胞膜的缢裂,子代细胞不能分离,从而影响细菌的增殖[27]。与高等生物细胞膜中的不饱和脂肪酸类似,LC-BCFAs也可以增加微生物磷脂双层膜的流动性[10]。由于脂质相分离和蛋白质相分离导致细菌细胞膜流动性降低时,会造成细菌的死亡,细菌的存活取决于膜脂质组成的微调[28]。此外,LC-BCFAs作为枯草芽孢杆菌、乳酸杆菌、双歧杆菌等肠道有益菌群的细胞膜主要成分[29],可通过益生菌群与宿主之间的良性互作,促进宿主更好地生长、发育和繁殖。
LC-BCFAs可改变肠道菌群的组成并降低病原微生物致病能力。肠道菌群的组成和功能是动态变化的,并且受饮食特性(例如脂质的数量和组成)的影响[30]。研究表明,饲粮中添加LC-BCFAs混合物[iso-14∶0 (25%)、anteiso-15∶0 (20%)、iso-16∶0 (25%)、anteiso-17∶0 (8%)、iso-18∶0 (10%)],大鼠小肠的微生物区系和菌群丰度相比于正常饲喂的大鼠有所改变,其中杆菌科、假单胞菌科和枯草芽孢菌科等菌群的丰度与对照组相比具有显著差异[5]。另外,体外试验也证明aneteiso-C15∶0可抑制病原菌——铜绿假单胞杆菌的单个菌株的鞭毛运动和菌落的迁移,进而显著减少有害菌群的扩布,使得该病原菌丧失了大部分对于宿主的致病能力[31]。
2.3 LC-BCFAs可保护肠道屏障肠道屏障包括物理屏障、化学屏障、微生物屏障和免疫屏障等,而且肠道屏障受到肠道菌群的调控作用[32]。例如,研究发现存在于肠道菌群中的LC-BCFAs可参与调控机体的肠道物理屏障。Ran-Ressler等[5]的研究表明,在患有肠道炎症的大鼠饲粮中添加LC-BCFAs混合物可以改善炎症导致的肠道黏膜和固有层的损伤,部分恢复消化道小肠绒毛的正常形态和生理功能。
BCFAs可抑制炎症因子导致的屏障损伤。体外试验发现,使用20 mmol/L的BCFAs处理肠道上皮细胞系Caco-2细胞,在添加肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)前预处理2 h条件下,BCFAs可显著逆转TNF-α和IFN-γ导致的Caco-2细胞单层细胞跨膜电阻值(TEER)降低、紧密连接蛋白闭锁小带蛋白(ZO-1)以及封闭蛋白(Claudin-1)的表达下调,BCFAs对Caco-2细胞中炎症诱导的肠道屏障功能改变表现出剂量依赖性保护作用;活体试验也证明BCFAs可以减缓母猪肠道由炎症细胞因子而导致的肠道屏障损伤[25],维持肠道的正常生理功能。
2.4 LC-BCFAs可促进肠道消化吸收LC-BCFAs可促进肠道的消化吸收功能。在人和哺乳动物肠道内,LC-BCFAs是饲粮中的粗纤维、多糖类和蛋白质等经后肠段微生物的发酵产生的[33-34]。LC-BCFAs主要是与甘油结合,以甘油三酯的形式被肠道上皮细胞所吸收,LC-BCFAs主要结合在甘油的sn-2位[35]。Blakeney等[36]在小鼠上的研究表明,BCFAs通过环腺苷酸(cAMP)/蛋白激酶A(PKA)信号通路引起结肠平滑肌松弛,肠道活动增强,进而促进肠道的消化吸收。也有研究表明,一种由亮氨酸衍生的单甲基BCFAs(iso-C17∶0)和下游衍生的鞘糖脂,可以通过肠道和神经元内的哺乳动物雷帕霉素靶蛋白复合物1(mTORC1)信号通路关键地调节整个机体的氨基酸感应,有利于动物肠道从饲料中摄取氨基酸,促进肠上皮细胞对于氨基酸的感应和吸收[37]。
3 LC-BCFAs调控肠道健康的可能机制LC-BCFAs对于动物肠道健康的调控作用是多方面的,因此,LC-BCFAs对于动物肠道健康的调控机制也可能通过多种不同的途径。目前主要的研究表明,LC-BCFAs可以通过Toll样受体4(Toll-like receptor 4, TLR4)调控肠道炎症,亦可以通过改变细菌细胞膜物理学特性来调控菌群的增殖和区系组成,其调控动物肠道健康的调控机制亟待进一步探索。
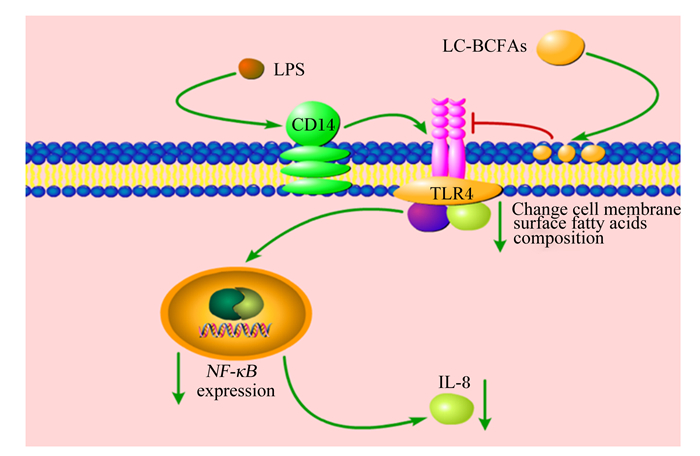
3.1 LC-BCFAs通过TLR4调控肠道炎症LC-BCFAs可以通过TLR4/NF-κB炎症信号通路缓解动物的肠道炎症,主要的机制是:LC-BCFAs可显著逆转LPS诱导的炎症信号通路中TLR4表达量的升高,进而抑制肠道上皮细胞内TLR4下游的核转录因子NF-κB的表达,降低肠道上皮细胞促炎因子IL-8的表达[19]。LC-BCFAs可以被摄取进入肠道细胞炎症模型,并改变肠道上皮细胞膜表面脂肪酸组成,进而通过下调炎症信号受体TLR4的表达缓解肠道炎症,同时,LC-BCFAs也可以在细胞膜处中断LPS对TLR4的激活作用,进而导致NF-κB和IL-8的表达下调[38],缓解LPS等促炎症因子所导致的肠道炎症。LC-BCFAs通过TLR4调控动物肠道健康的机制见图 3。
|
LC-BCFAs:长链支链脂肪酸long chain and branched chain fatty acids;LPS:脂多糖lipopolysaccharide;CD14:白细胞分化抗原14 cluster of differentiation 14;TLR4:Toll样受体4 Toll-like receptor 4;Change cell membrane surface fatty acids composition:改变细胞膜表面的脂肪酸组成;NF-κB expression:核转录因子-κB的表达;IL-8:白细胞介素-8 interleukin-8。 图 3 LC-BCFAs通过TLR4发挥调控作用的可能机制 Fig. 3 Possible mechanism of LC-BCFAs play a regulatory role through TLR4[19, 38] |
革兰氏阳性菌具有较为典型细胞膜特征,而主要存在于革兰氏阳性菌中的LC-BCFAs可以通过改变其含量和分布来调控革兰氏阳性菌的细胞膜流动性和生物学功能[39]。研究发现,LC-BCFAs可显著抑制微生物生物膜的生长,对铜绿假单胞杆菌、金黄色葡萄球菌和沙门氏菌等常见肠道致病菌生物膜的抑制率分别为12.96%、28.99%、36.90%,并且LC-BCFAs浓度越高,抑制作用越大[40]。此外,有研究报道,LC-BCFAs合成缺陷型金黄色葡萄球菌能够利用宿主来源的多不饱和脂肪酸,来合成自身细胞膜成分所需要的LC-BCFAs[41]。正常情况下,金黄色葡萄球菌感染通常会导致炎症的发生,这主要依赖于金黄色葡萄球菌产生脂蛋白,通过激活宿主细胞内Toll样受体2(TLR2)引起炎症细胞因子分泌增多,然而在金黄色葡萄球菌BCFAs合成缺陷突变株中,LC-BCFAs的重新合成可抑制脂蛋白介导的TLR2激活,改善脂肪酶对于脂蛋白的水解,证明细菌细胞膜组成和细菌病原体感染力之间有着相关性[42]。
甲基支链有效地减少细菌细胞膜上脂类物质缩合,降低了细胞膜上磷脂双分子层厚度,降低了链的有序性,分支也导致在分支点处形成扭结,从而增强了脂质双分子层的流动性[43];LC-BCFAs参与磷脂和脂蛋白组成,抑制病原菌脂蛋白介导的炎症感染,主要通过TLR2发挥作用。LC-BCFAs调控细菌细胞膜组成变化,促进其增殖和降低致病能力的具体机制如图 4。

|
LC-BCFAs:长链支链脂肪酸long chain and branched chain fatty acids;Host cell:宿主细胞;TLR2:Toll样受体2 Toll-like receptor 2;IL-6:白细胞介素-6 interleukin-6;Normal lipoprotein:正常脂蛋白;lipoprotein with BCFAs:含有支链脂肪酸的脂蛋白;Involved in the formation of cell membranes:参与细胞膜的构成;Increase of cell membrane fluidity:增加细胞膜流动性;Bacterial cell:细菌细胞。 图 4 LC-BCFAs降低病原微生物致病力的潜在机制 Fig. 4 Potential mechanisms of LC-BCFAs reduce pathogenicity of pathogenic microorganisms[41-43] |
LC-BCFAs作为一类功能性脂肪酸,可通过缓解肠道炎症、改善肠道菌群、维持肠道屏障和促进肠道消化吸收等来维持并调控动物的肠道健康。LC-BCFAs调控动物肠道健康的可能机制包括其激活细胞膜受体信号通路、改变细胞膜组成等。但是,目前对于LC-BCFAs的研究与利用仍很不足[44],例如:LC-BCFAs的纯化上存在技术局限性,规模化生产LC-BCFAs的工艺尚不完善,富含LC-BCFAs的原料利用不充分,LC-BCFAs和微生物间的具体关系尚不清楚,以及LC-BCFAs相关的机制研究尚浅等。因此,深入开展LC-BCFAs对动物肠道健康调控作用及机制的研究,对于促进畜牧产业发展乃至造福人类健康都具有着重要意义。
| [1] |
PRICE N P J, JACKSON M A, HARTMAN T M, et al. Branched chain lipid metabolism as a determinant of the N-Acyl variation of streptomyces natural products[J]. ACS Chemical Biology, 2021, 16(1): 116-124. DOI:10.1021/acschembio.0c00799 |
| [2] |
MOWAT A M, AGACE W W. Regional specialization within the intestinal immune system[J]. Nature Reviews Immunology, 2014, 14(10): 667-685. DOI:10.1038/nri3738 |
| [3] |
WEISS U. Intestinal networks in health and disease[J]. Nature, 2011, 474(7351): 297. DOI:10.1038/474297a |
| [4] |
CAMILLERI M, MADSEN K, SPILLER R, et al. Intestinal barrier function in health and gastrointestinal disease[J]. Neurogastroenterology and Motility, 2012, 24(6): 503-512. DOI:10.1111/j.1365-2982.2012.01921.x |
| [5] |
RAN-RESSLER R R, KHAILOVA L, ARGANBRIGHT K M, et al. Branched chain fatty acids reduce the incidence of necrotizing enterocolitis and alter gastrointestinal microbial ecology in a neonatal rat model[J]. PLoS One, 2011, 6(12): e29032. DOI:10.1371/journal.pone.0029032 |
| [6] |
RAN-RESSLER R R, BAE S, LAWRENCE P, et al. Branched-chain fatty acid content of foods and estimated intake in the USA[J]. British Journal of Nutrition, 2014, 112(4): 565-572. DOI:10.1017/S0007114514001081 |
| [7] |
DEWULF J P, GERIN I, RIDER M H, et al. The synthesis of branched-chain fatty acids is limited by enzymatic decarboxylation of ethyl- and methylmalonyl-CoA[J]. Biochemical Journal, 2019, 476(16): 2427-2447. DOI:10.1042/BCJ20190500 |
| [8] |
HAUFF S, VETTER W. Quantification of branched chain fatty acids in polar and neutral lipids of cheese and fish samples[J]. Journal of Agricultural and Food Chemistry, 2010, 58(2): 707-712. DOI:10.1021/jf9034805 |
| [9] |
KANEDA T. Iso- and anteiso-fatty acids in bacteria: biosynthesis, function, and taxonomic significance[J]. Microbiological Reviews, 1991, 55(2): 288-302. DOI:10.1128/mr.55.2.288-302.1991 |
| [10] |
MOSTOFIAN B, ZHUANG T, CHENG X L, et al. Branched-chain fatty acid content modulates structure, fluidity, and phase in model microbial cell membranes[J]. The Journal of Physical Chemistry B, 2019, 123(27): 5814-5821. DOI:10.1021/acs.jpcb.9b04326 |
| [11] |
SEN S, SIROBHUSHANAM S, JOHNSON S R, et al. Growth-environment dependent modulation of Staphylococcus aureus branched-chain to straight-chain fatty acid ratio and incorporation of unsaturated fatty acids[J]. PLoS One, 2016, 11(10): e0165300. DOI:10.1371/journal.pone.0165300 |
| [12] |
WATKINS P J, FRANK D. Heptadecanoic acid as an indicator of BCFA content in sheep fat[J]. Meat Science, 2019, 151: 33-35. DOI:10.1016/j.meatsci.2019.01.005 |
| [13] |
RAN-RESSLER R R, SIM D, O'DONNELL-MEGARO A M, et al. Branched chain fatty acid content of United States retail cow's milk and implications for dietary intake[J]. Lipids, 2011, 46(7): 569-576. DOI:10.1007/s11745-011-3530-8 |
| [14] |
WANG D H, YANG Y P, WANG Z, et al. High levels of branched chain fatty acids in nātto and other Asian fermented foods[J]. Food Chemistry, 2019, 286: 428-433. DOI:10.1016/j.foodchem.2019.02.018 |
| [15] |
WALLACE M, GREEN C R, ROBERTS L S, et al. Enzyme promiscuity drives branched-chain fatty acid synthesis in adipose tissues[J]. Nature Chemical Biology, 2018, 14(11): 1021-1031. DOI:10.1038/s41589-018-0132-2 |
| [16] |
WANG Z, PARK H G, WANG D H, et al. Fatty acid desaturase 2 (FADS2) but not FADS1 desaturates branched chain and odd chain saturated fatty acids[J]. Biochimica et Biophysica Acta (BBA): Molecular and Cell Biology of Lipids, 2020, 1865(3): 158572. DOI:10.1016/j.bbalip.2019.158572 |
| [17] |
FARHADI A, BANAN A, FIELDS J, et al. Intestinal barrier: an interface between health and disease[J]. Journal of Gastroenterology and Hepatology, 2003, 18(5): 479-497. DOI:10.1046/j.1440-1746.2003.03032.x |
| [18] |
SEKIROV I, RUSSELL S L, ANTUNES L C M, et al. Gut microbiota in health and disease[J]. Physiological Reviews, 2010, 90(3): 859-904. DOI:10.1152/physrev.00045.2009 |
| [19] |
YAN Y, WANG Z, GREENWALD J, et al. BCFA suppresses LPS induced IL-8 mRNA expression in human intestinal epithelial cells[J]. Prostaglandins, Leukotrienes, and Essential Fatty Acids, 2017, 116: 27-31. DOI:10.1016/j.plefa.2016.12.001 |
| [20] |
BOUDRY G, JAMIN A, CHATELAIS L, et al. Dietary protein excess during neonatal life alters colonic microbiota and mucosal response to inflammatory mediators later in life in female pigs[J]. The Journal of Nutrition, 2013, 143(8): 1225-1232. DOI:10.3945/jn.113.175828 |
| [21] |
BROOM L J, KOGUT M H. Inflammation: friend or foe for animal production?[J]. Poultry Science, 2018, 97(2): 510-514. DOI:10.3382/ps/pex314 |
| [22] |
曹长仁, 樊福好. 影响仔猪死亡率的几个生物学因素分析[J]. 猪业科学, 2012, 29(8): 106-107. CAO C R, FAN F H. Analysis of several biological factors affecting piglet mortality[J]. Swine Industry Science, 2012, 29(8): 106-107 (in Chinese). DOI:10.3969/j.issn.1673-5358.2012.08.062 |
| [23] |
RICH B S, DOLGIN S E. Necrotizing enterocolitis[J]. Pediatrics in Review, 2017, 38(12): 552-559. DOI:10.1542/pir.2017-0002 |
| [24] |
XIN H S, MA T, XU Y, et al. Characterization of fecal branched-chain fatty acid profiles and their associations with fecal microbiota in diarrheic and healthy dairy calves[J]. Journal of Dairy Science, 2021, 104(2): 2290-2301. DOI:10.3168/jds.2020-18825 |
| [25] |
RAN-RESSLER R R, DEVAPATLA S, LAWRENCE P, et al. Branched chain fatty acids are constituents of the normal healthy newborn gastrointestinal tract[J]. Pediatric Research, 2008, 64(6): 605-609. DOI:10.1203/PDR.0b013e318184d2e6 |
| [26] |
ADAK A, KHAN M R. An insight into gut microbiota and its functionalities[J]. Cellular and Molecular Life Sciences, 2019, 76(3): 473-493. DOI:10.1007/s00018-018-2943-4 |
| [27] |
MERCIER R, DOMÍNGUEZ-CUEVAS P, ERRINGTON J. Crucial role for membrane fluidity in proliferation of primitive cells[J]. Cell Reports, 2012, 1(5): 417-423. DOI:10.1016/j.celrep.2012.03.008 |
| [28] |
TEOH W P, CHEN X, LACZKOVICH I, et al. Staphylococcus aureus adapts to the host nutritional landscape to overcome tissue-specific branched-chain fatty acid requirement[J]. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(13): e2022720118. DOI:10.1073/pnas.2022720118 |
| [29] |
NICKELS J D, CHATTERJEE S, MOSTOFIAN B, et al. Bacillus subtilis lipid extract, a branched-chain fatty acid model membrane[J]. The Journal of Physical Chemistry Letters, 2017, 8(17): 4214-4217. DOI:10.1021/acs.jpclett.7b01877 |
| [30] |
SCHOELER M, CAESAR R. Dietary lipids, gut microbiota and lipid metabolism[J]. Reviews in Endocrine & Metabolic Disorders, 2019, 20(4): 461-472. |
| [31] |
INOUE T, SHINGAKI R, FUKUI K. Inhibition of swarming motility of Pseudomonas aeruginosa by branched-chain fatty acids[J]. FEMS Microbiology Letters, 2008, 281(1): 81-86. DOI:10.1111/j.1574-6968.2008.01089.x |
| [32] |
TAKIISHI T, FENERO C I M, CÂMARA N O S. Intestinal barrier and gut microbiota: shaping our immune responses throughout life[J]. Tissue Barriers, 2017, 5(4): e1373208. DOI:10.1080/21688370.2017.1373208 |
| [33] |
YE Z, CAO C, LI Q, et al. Different dietary lipid consumption affects the serum lipid profiles, colonic short chain fatty acid composition and the gut health of Sprague Dawley rats[J]. Food Research International, 2020, 132: 109117. DOI:10.1016/j.foodres.2020.109117 |
| [34] |
HEIMANN E, NYMAN M, PÅLBRINK A K, et al. Branched short-chain fatty acids modulate glucose and lipid metabolism in primary adipocytes[J]. Adipocyte, 2016, 5(4): 359-368. DOI:10.1080/21623945.2016.1252011 |
| [35] |
YAN Y Y, WANG Z, WANG X G, et al. Branched chain fatty acids positional distribution in human milk fat and common human food fats and uptake in human intestinal cells[J]. Journal of Functional Foods, 2017, 29: 172-177. DOI:10.1016/j.jff.2016.12.024 |
| [36] |
BLAKENEY B A, CROWE M S, MAHAVADI S, et al. Branched short-chain fatty acid isovaleric acid causes colonic smooth muscle relaxation via cAMP/PKA pathway[J]. Digestive Diseases and Sciences, 2019, 64(5): 1171-1181. DOI:10.1007/s10620-018-5417-5 |
| [37] |
ZHU M N, TENG F K, LI N, et al. Monomethyl branched-chain fatty acid mediates amino acid sensing upstream of mTORC1[J]. Developmental Cell, 2021, 56(19): 2692-2702.e5. DOI:10.1016/j.devcel.2021.09.010 |
| [38] |
闫媛媛. 乳脂支链脂肪酸的微量分离、结构分布与抗炎作用[D]. 博士学位论文. 无锡: 江南大学, 2018. YAN Y Y. Microseparation, TAG distribution and anti-inflammatory function of BCFA in milk fat[D]. Ph. D. Thesis. Wuxi: Jiangnan University, 2018. (in Chinese) |
| [39] |
CHEON D, LEE W C, LEE Y, et al. Structural basis of branched-chain fatty acid synthesis by Propionibacterium acnes β-ketoacyl acyl carrier protein synthase[J]. Biochemical and Biophysical Research Communications, 2019, 509(1): 322-328. DOI:10.1016/j.bbrc.2018.12.134 |
| [40] |
揭良. 早产儿母乳支链脂肪酸组成及抗生物膜研究[D]. 硕士学位论文. 无锡: 江南大学, 2018. JIE L. The composition of branched-chain fatty acids in preterm human breast milk and their anti-biofilm activity[D]. Master's Thesis. Wuxi: Jiangnan University, 2018. (in Chinese) |
| [41] |
SEN S, SIROBHUSHANAM S, HANTAK M P, et al. Short branched-chain C6 carboxylic acids result in increased growth, novel 'unnatural' fatty acids and increased membrane fluidity in a Listeria monocytogenes branched-chain fatty acid-deficient mutant[J]. Biochimica et Biophysica Acta, 2015, 1851(10): 1406-1415. DOI:10.1016/j.bbalip.2015.07.006 |
| [42] |
CHEN X, TEOH W P, STOCK M R, et al. Branched chain fatty acid synthesis drives tissue-specific innate immune response and infection dynamics of Staphylococcus aureus[J]. PLoS Pathogens, 2021, 17(9): e1009930. DOI:10.1371/journal.ppat.1009930 |
| [43] |
POGER D, CARON B, MARK A E. Effect of methyl-branched fatty acids on the structure of lipid bilayers[J]. The Journal of Physical Chemistry.B, 2014, 118(48): 13838-13848. DOI:10.1021/jp503910r |
| [44] |
TAORMINA V M, UNGER A L, SCHIKSNIS M R, et al. Branched-chain fatty acids-an underexplored class of dairy-derived fatty acids[J]. Nutrients, 2020, 12(9): 2875. DOI:10.3390/nu12092875 |




