2. 广东省农业科学院动物科学研究所, 农业部华南动物营养与 饲料重点实验室, 畜禽育种国家重点实验室, 广东省畜禽育种与营养研究重点实验室, 广东省 畜禽肉品质量安全控制与评定工程技术研究中心, 广州 510640
2. Guangdong Engineering and Technology Research Center for Quality and Safety Control and Evaluation of Livestock and Poultry Meat, Guangdong Key Laboratory of Livestock and Poultry Breeding and Nutrition, State Key Laboratory of Livestock and Poultry Breeding, South China Key Laboratory of Animal Nutrition and Feed, Ministry of Agriculture, Institute of Animal Science, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China
在生猪养殖中,为提高养殖经济效益,常采用早期断奶技术。然而,仔猪断奶后,由于环境和饲粮的改变以及胃肠道发育不完全,容易造成断奶应激,从而导致仔猪生长发育缓慢、免疫力低下、肠道结构和功能紊乱、肠道微生态失衡等现象发生,最终给养猪行业带来巨大损失。定殖于动物肠道中的微生物数量庞大,且具有丰富的生物学活性,与宿主存在广泛的互作,对机体营养物质代谢和免疫稳态有十分重要的作用[1]。动物前肠中未被机体消化的碳水化合物和蛋白质,均可在后肠中作为微生物发酵的底物,其中碳水化合物发酵产生的短链脂肪酸对肠道具有益生功能,而蛋白质发酵产生的胺类、酚类和吲哚类等产物在高含量时对健康有害[2-3]。植物提取物,如黄酮、多酚和精油等,具有提高仔猪生长性能、促进机体对蛋白质等营养物质的消化吸收、调控肠道微生物区系、改善肠道发育、增强动物免疫力等功能[4]。因此,通过在饲粮中添加某些植物提取物可以提高动物对营养物质的消化吸收、调控肠道微生物的组成和改善微生物发酵模式,以达到维持肠道健康和调节机体营养物质代谢的目的,最终实现生猪健康高效养殖。
槲皮素是一种广泛存在于多种蔬菜和水果中的黄酮类化合物[5]。诸多研究发现,槲皮素具有促进动物生长、调节机体代谢和维持肠道微生态平衡的功能。Park等[6]研究证实,给生长猪饲喂含有1 000 mg/kg槲皮素的饲粮,可提高其平均日增重(average daily gain,ADG)以及干物质和氮表观消化率。在肉鸡上的研究发现,饲粮中添加250~1 000 mg/kg的槲皮素可线性和二次项增加其回肠中乳酸杆菌(Lactobacillus)的相对丰度[7]。在蛋鸡饲粮中添加400和600 mg/kg槲皮素可提高其血清总蛋白含量,降低血清尿素氮含量[8]。肠道微生物与机体的消化、吸收、代谢、免疫等密切相关,而粪便微生物与肠道微生物的组成、相对丰度和功能相似,可在一定程度上反映肠道微生物的代谢和肠道健康[9-10]。然而,槲皮素在断奶仔猪上的应用相对缺乏,且对其粪便微生物及其代谢产物的研究也鲜有报道。因此,本试验旨在探究饲粮中添加不同水平槲皮素对断奶仔猪生长性能、营养物质表观消化率、血清生化指标、粪便微生物及其代谢产物的影响,以期为槲皮素的饲料开发和断奶仔猪的绿色健康养殖提供科学依据和理论指导。
1 材料与方法 1.1 试验材料槲皮素(纯度≥98.5%)购自上海某生化科技股份有限公司。
1.2 试验动物、设计与饲粮试验采用单因素完全随机试验设计,试验选取144头健康且体重[(7.45±0.09) kg]相近的21日龄“杜×长×大”三元杂交断奶仔猪,根据体重相近原则,随机分成3组,每组8个重复,每个重复6头猪。3组分别饲喂基础饲粮(对照组)、基础饲粮+200 mg/kg槲皮素(Ⅰ组)和基础饲粮+400 mg/kg槲皮素(Ⅱ组)。基础饲粮参照NRC(2012)营养需要配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of the basal diet (as-fed basis) |
仔猪分组后,饲养于温控密闭猪舍内1.2 m×2.1 m大小带有漏风地板的高保育床上,整个试验期24 d,其中预试期5 d,正试期19 d。试验期间,所有仔猪自由采食和饮水,按猪舍防疫标准进行免疫、消毒和管理。
1.4 样品采集正式试验第16~18天,连续3 d采集各组饲粮和粪便样品,饲粮以组为单位每次采集100 g;粪便以栏为单位,在每天晨饲前,使用棉签刺激仔猪肛门排便,每栏(收集至少3头猪)总共收集约200 g新鲜粪便,去除毛屑后混匀,立即测定其pH,然后置于-20 ℃冰箱保存,待测微生物及其代谢产物。
试验结束当天,禁食4 h后,从每栏中选取体重接近平均体重的1头猪(共3组,每组8头猪,一共24头),采集10 mL前腔静脉血,4 ℃冰箱中静置30 min,然后于4 ℃、3 000 r/min条件下离心10 min得到血清,随后分装于-80 ℃冰箱保存待用。
1.5 指标测定与方法 1.5.1 生长性能和腹泻正式试验期间,每天08:00开始投喂,以栏为单位,记录每日饲喂量以及每日剩余饲料量,计算平均日采食量(average daily feed intake,ADFI)。在正式试验第1、19天以及试验结束当天禁食4 h后对每栏的仔猪进行空腹称重,计算ADG、料重比(feed to gain ratio,F/G)。ADFI、ADG、F/G计算公式如下:

|
每天09:00逐只观察各重复仔猪的粪便状况,同时结合精神状态、肛门有无红肿及水样粪便痕迹等,记录仔猪腹泻头数和腹泻评分,腹泻指数评分标准见表 2[11]。腹泻率和腹泻指数计算公式如下:

|
|
|
表 2 腹泻指数评分标准 Table 2 Score standard of diarrhea index |
饲粮和粪便中盐酸不溶灰分含量的测定参照《饲料中盐酸不溶灰分的测定》(GB/T 23742—2009)[12]。钙、磷和干物质含量和能量的测定参照《饲料分析与检测》[13]。粗脂肪、粗蛋白质、粗灰分含量和能量分别采用脂肪分析仪、全自动凯氏定氮仪测定、马弗炉和能量仪进行测定。营养物质表观消化率采用内源性指示剂盐酸不溶灰分标记法,计算公式如下:

|
血清生化指标采用全自动生化分析仪(Selectra Pro XL,VITAL公司,荷兰)测定,所用试剂盒购自中生北控生物科技股份有限公司。
1.5.4 粪便微生物数量称取0.18~0.22 g固体粪便于2 mL离心管,利用粪便DNA纯化试剂盒(购自杭州新景生物制剂开发有限公司)分离总DNA,使用核酸蛋白检测仪(Nanodrop 1100,Thermo Fisher Scientific公司,美国)测定DNA浓度和纯度,标准为吸光度(OD)260/280:1.80~2.00,OD260/230:2.00左右。采用荧光定量PCR仪(CFX96 Real-time PCR System,Bio-Rad公司,美国)对粪便中的总菌、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、Lactobacillus、大肠杆菌(Escherichia coli,E.coli)、梭菌簇Ⅳ(Clostridium cluster Ⅳ)、瘤胃球菌属(Ruminococcus)、普雷沃氏菌属(Prevotella)、双歧杆菌属(Bifidobacterium)的16S rRNA的拷贝数进行定量分析,计算结果均表示为每克粪便中16S rRNA基因拷贝数的对数值。特异性引物由上海生工基因技术有限公司合成,引物序列、PCR反应体系以及扩增程序均参考Yu等[14]的方法。
1.5.5 粪便pH及其微生物代谢产物含量每个新鲜粪便样品混匀后采用pH计(HI 9024C,HANNA Instruments公司,美国)测定,每个样品测定3次,取平均值;根据试剂盒(购自南京建成生物工程研究所)说明书测定粪便中乳酸含量;参照Yu等[14]的方法,采用气相色谱仪(7890B,Agilent Technologies Inc公司,美国)测定粪便中短链脂肪酸含量;参照Chaney等[15]的方法,采用比色法测定粪便中氨态氮含量;参照Yang等[16]的方法,采用高效液相色谱仪(e2695,Waters Alliance公司,美国)测定粪便中生物胺含量。
1.6 数据统计与分析应用SPSS 21.0软件进行单因素方差分析,然后通过Tukey’s法进行组间多重比较,数据采用平均值±标准误(mean±SEM),P<0.05表示差异显著,P<0.01表示差异极显著,0.05<P<0.10表示有趋势。采用SIMCA-P 13.0软件中偏最小二乘分类分析(partial least squares-discriminant analysis,PLS-DA)模型评估各组间微生物和代谢产物的相似性。
2 结果 2.1 槲皮素对断奶仔猪生长性能和腹泻的影响由表 3可知,Ⅱ组的结束体重显著高于对照组(P<0.05),ADG极显著高于对照组(P<0.01);而Ⅰ组的结束体重和ADG与对照组和Ⅱ组均无显著差异(P>0.05)。各组之间F/G、ADFI、腹泻率和腹泻指数均无显著差异(P>0.05)。
|
|
表 3 槲皮素对断奶仔猪生长性能和腹泻的影响 Table 3 Effects of quercetin on growth performance and diarrhea of weaned piglets |
由表 4可知,Ⅰ组和Ⅱ组的干物质表观消化率显著高于对照组(P<0.05),钙表观消化率极显著高于对照组(P<0.01),总能表观消化率有高于对照组的趋势(P=0.088)。Ⅱ组的粗蛋白质表观消化率显著高于对照组(P<0.05),而Ⅰ组的粗蛋白质表观消化率与对照组和Ⅱ组均无显著差异(P>0.05)。各组之间粗脂肪、总能、有机物和磷表观消化率均无显著差异(P>0.05)。
|
|
表 4 槲皮素对断奶仔猪营养物质表观消化率的影响 Table 4 Effects of quercetin on nutrient apparent digestibility of weaned piglets |
由表 5可知,Ⅰ组和Ⅱ组的血清总蛋白含量显著高于对照组(P<0.05),血清球蛋白有高于对照组的趋势(P=0.052)。Ⅱ组的血清尿素氮含量极显著低于对照组和Ⅰ组(P<0.01)。各组之间血清白蛋白、葡萄糖、总胆固醇、甘油三酯、高密度脂蛋白和低密度脂蛋白含量均无显著差异(P>0.05)。
|
|
表 5 槲皮素对断奶仔猪血清生化指标的影响 Table 5 Effects of quercetin on serum biochemical indices of weaned piglets |
由图 1可知,Ⅰ组和Ⅱ组的粪便E.coli数量显著或极显著低于对照组(P<0.05或P<0.01),粪便Lactobacillus(P=0.055)和Ruminococcus(P=0.086)数量有高于对照组的趋势。Ⅱ组的粪便Prevotella和Bifidobacterium数量显著高于对照组(P<0.05)。Ⅱ组的粪便Clostridium cluster Ⅳ数量极显著高于对照组和Ⅰ组(P<0.01)。各组之间粪便总菌、Firmicutes和Bacteroidetes数量均无显著差异(P>0.05)。
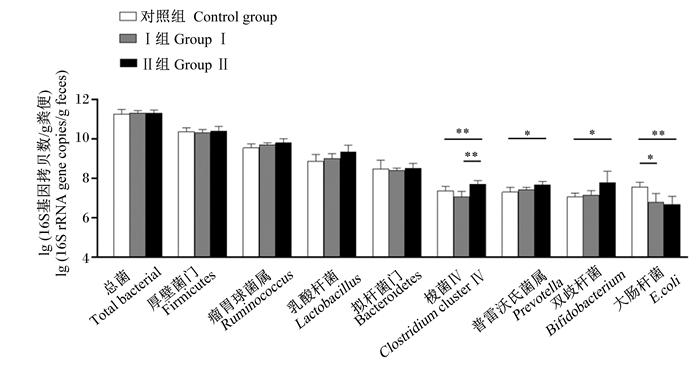
|
*表示差异显著(P<0.05),* *表示差异极显著(P<0.01)。 * mean significant difference (P < 0.05), * * mean extremely significant difference (P < 0.01). 图 1 槲皮素对断奶仔猪粪便微生物数量的影响 Fig. 1 Effects of quercetin on fecal microorganism number of weaned piglets |
由表 6可知,Ⅱ组的粪便乳酸含量显著高于对照组(P<0.05),乙酸含量极显著高于对照组(P<0.01),粪便异丁酸和支链脂肪酸含量显著低于对照组(P<0.05)。Ⅱ组的粪便戊酸含量极显著低于对照组和Ⅰ组(P<0.01)。Ⅰ组和Ⅱ组的粪便异戊酸含量有低于对照组的趋势(P=0.052)。Ⅰ组的粪便乳酸、乙酸和支链脂肪酸含量与对照组和Ⅱ组均无显著差异(P>0.05)。各组之间粪便pH及丙酸、丁酸、总短链脂肪酸含量均无显著差异(P>0.05)。
|
|
表 6 槲皮素对断奶仔猪粪便pH及乳酸、短链脂肪酸含量的影响 Table 6 Effects of quercetin on pH and lactic acid, short chain fatty acid contents in feces of weaned piglets |
由表 7可知,Ⅰ组和Ⅱ组的粪便腐胺、尸胺和总生物胺含量极显著低于对照组(P<0.01),粪便色胺(P=0.064)和亚精胺(P=0.052)含量有低于对照组的趋势。各组之间粪便甲胺、酪胺、精胺和氨态氮含量均无显著差异(P>0.05)。
|
|
表 7 槲皮素对断奶仔猪粪便生物胺和氨态氮含量的影响 Table 7 Effects of quercetin on contents of biogenic amine and ammonia nitrogen in feces of weaned piglets |
为了更加直观显示各组间粪便微生物与其代谢产物的差异,对相关数据进行了PLS-DA。由图 2可知,PLS-DA模型能将各组之间微生物(图 2-A)和代谢产物(图 2-B)明显区分开,表明饲粮中添加槲皮素改变了断奶仔猪粪便微生物数量和代谢产物组成。
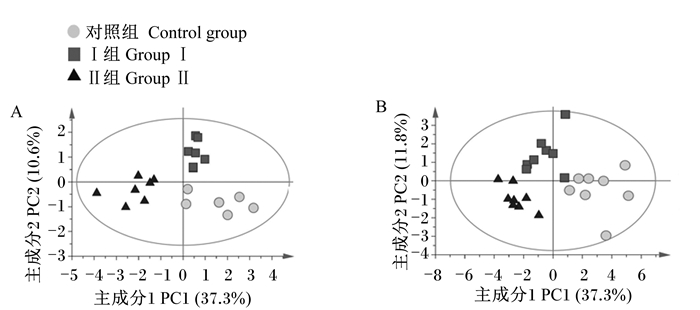
|
图 2 断奶仔猪粪便微生物(A)及其代谢产物(B)PLS-DA得分图 Fig. 2 PLS-DA score plots of microorganism (A) and its metabolites(B)in feces of weaned piglets |
诸多研究发现槲皮素具有促进动物生长的作用。饲粮中添加1 000 mg/kg槲皮素可提高生长猪的ADG[6]。饲粮中添加25 mg/kg的槲皮素4周后,可提高育肥猪的ADG[17]。在肉鸡上的研究同样发现,饲粮中添加200、400和800 mg/kg槲皮素,肉鸡的ADG分别提高了3.34%、3.22%和2.33%[18]。本试验发现,饲粮中添加400 mg/kg的槲皮素可显著提高断奶仔猪的ADG和结束体重。前人研究发现,槲皮素可促进肠道微生态平衡[19],促进猪小肠细胞增殖、分化、更新并维护肠黏膜屏障的完整性[20]。另有研究发现,槲皮素还可提高回肠中营养转运蛋白(葡萄糖转运蛋白2、肽转运蛋白1和脂肪酸合成酶)基因的表达,增加回肠抗氧化酶(谷胱甘肽过氧化酶和超氧化物歧化酶1)基因的表达,改善回肠绒毛高度、宽度及绒隐比[18]。因此,本试验中槲皮素促生长的原因一方面可能是通过促进肠道微生态平衡,维持宿主肠道健康,让宿主更好地吸收营养物质;另一方面可能是通过促进肠道发育,增加肠道对营养物质的转运,同时提高肠道对营养物质的吸收和蛋白质合成,最终提高断奶仔猪生长性能。
断奶仔猪饲粮为高蛋白质饲粮,且胃肠道发育不成熟,肠道微生物区系平衡也尚未建立,会对饲粮中的蛋白质产生消化障碍,未消化的蛋白质进入后肠被细菌降解成胺类等有害物质,易造成仔猪营养性腹泻[21],进而阻碍仔猪生长发育。本试验中,饲粮中添加400 mg/kg槲皮素可使仔猪腹泻率和腹泻指数分别降低33.56%和33.33%,而粗蛋白质表观消化率显著提高。因此,槲皮素可能通过促进仔猪对蛋白质的消化利用,降低仔猪营养性腹泻。此外,槲皮素在体内外均具有较强的抑菌活性,可抑制有害细菌生物膜的形成,影响其生长繁殖和新陈代谢,最终抑制其增殖[22]。本研究结果进一步证实槲皮素的抗菌特性,即槲皮素通过选择性促进有益菌的增殖,同时抑制有害菌的增殖,进而优化肠道中的微生态环境,从而减少腹泻的发生。
3.2 槲皮素对断奶仔猪营养物质表观消化率的影响营养物质表观消化率是反映动物对饲粮中营养物质消化吸收的重要指标。前人研究表明,饲粮中添加一定剂量的槲皮素可增加畜禽动物对营养物质的表观消化率。在蛋鸡上的研究发现,饲粮中添加400 mg/kg的槲皮素可显著提高其粗蛋白质和钙表观消化率[23];在肉鸡上的研究发现,饲粮中添加200 mg/kg的槲皮素可显著提高其粗蛋白质表观消化率[24];在生长猪上的研究也发现,饲粮中添1 000 mg/kg的槲皮素可提高其干物质和氮表观消化率[6]。本研究中,饲粮中添加200和400 mg/kg的槲皮素可显著提高断奶仔猪钙和干物质表观消化率,饲粮中添加400 mg/kg槲皮素还可显著提高粗蛋白质表观消化率。动物对饲粮中营养物质的消化吸收和利用效率越高,对其生长越有利。因此,这一研究结果正好解释了本研究饲粮中添加400 mg/kg槲皮素可提高断奶仔猪生长性能的结果。前人研究发现,槲皮素可增加猪肠道氨基酸转运载体、小肽转运载体和雷帕霉素靶蛋白信号通路相关基因的表达,改善猪小肠肠绒毛高度[25-26]。这一研究结果也正好解释了饲粮中添加400 mg/kg槲皮素可提高断奶仔猪粗蛋白质表观消化率的结果,即槲皮素一方面可能增加了肠道氨基酸的转运;另一方面可能增加肠上皮接触面积,从而促进蛋白质的吸收与利用,最终改善了粗蛋白质表观消化率。
3.3 槲皮素对断奶仔猪血清生化指标的影响血清生化指标可在一定程度上反映机体对营养物质的消化吸收情况。血清总蛋白、白蛋白和球蛋白含量可反映机体肝脏的代谢情况,血清总蛋白含量升高,说明机体合成蛋白质的能力增强,而血清总蛋白由白蛋白和球蛋白组成,这可为机体进一步合成体蛋白提供有利的内环境,进而促进蛋白质合成和动物的生长[27-28]。研究发现,饲粮中添加槲皮素可提高蛋鸡血清总蛋白含量[8]。在肉鸡中也同样发现,饲粮中添加槲皮素可提高血清总蛋白含量[29]。本试验也发现,饲粮中添加200和400 mg/kg的槲皮素均可显著提高血清总蛋白含量,表明仔猪蛋白质合成代谢增强。血清尿素氮是蛋白质水解和氨基酸代谢的终产物之一,其含量可反映饲粮中蛋白质的营养水平和体内蛋白质代谢情况,血清尿素氮含量降低,则表明体内蛋白质合成和沉积增加,饲粮中蛋白质的利用也增加[30]。本研究结果显示,饲粮中添加400 mg/kg的槲皮素可显著降低血清尿素氮含量,这与刘红南等[8]在蛋鸡和李贤等[29]在肉鸡上的研究结果相似。这表明仔猪在摄取槲皮素之后,机体对蛋白质和氨基酸的利用率得以提高。综上所述,槲皮素提高血清总蛋白含量的原因可能是通过提高仔猪对饲粮中蛋白质的消化和吸收,使更多的氨基酸进入血液;同时机体蛋白质的分解代谢降低。
总而言之,上述血清生化指标的结果表明,饲粮中添加400 mg/kg的槲皮素可增加断奶仔猪新陈代谢,并提高蛋白质沉积,进而促进了断奶仔猪的生长。
3.4 槲皮素对断奶仔猪粪便微生物数量的影响肠道菌群与宿主营养物质消化吸收和肠道健康紧密联系。粪便微生物与肠道微生物组成、相对丰度和功能相似,可一定程度反映肠道微生物数量的变化[10]。研究发现,槲皮素可显著增加蛋鸡和肉鸡盲肠中Bifidobacterium数量,同时降低E.coli数量[24, 31]。本研究结果表明,断奶仔猪饲粮中添加400 mg/kg的槲皮素可促进粪便中Clostridium cluster Ⅳ、Prevotella、Bifidobacterium的增殖,抑制E.coli的增殖。同时,饲粮中添加槲皮素还有增加Lactobacillus和Ruminococcus数量的趋势。Bifidobacterium和Lactobacillus是一种潜在益生菌,一方面通过产生乳酸和乙酸,对促进抗炎和促炎细胞因子之间的平衡以及肠道健康有积极作用;另一方面它们还可产生抗菌因子,竞争性抑制致病菌的增殖,从而维护宿主肠道健康[32]。Prevotella、Ruminococcus和Clostridium cluster Ⅳ是降解碳水化合物产生短链脂肪酸和调节免疫发育的关键菌群,通过分解这类物质产生大量挥发性脂肪酸,从而促进宿主肠黏膜免疫系统发育,最终对肠道产生生理保健作用[33-34]。E.coli是条件致病菌,是危害动物的主要致病菌之一,被认为是诱导猪腹泻的潜在致病菌[35],与许多感染和疾病发生有关[36]。一个良好的肠道内环境,不仅可以保持肠道健康,而且能让宿主更好的吸收营养物质,最终改善其生长性能。本试验中,产乳酸菌和产短链脂肪酸菌数量的增加,以及潜在致病菌数量的减少,表明槲皮素可通过促进有益菌增殖、抑制潜在致病菌增殖来调控肠道微生物组成,维持肠道内环境稳态,从而增加宿主对营养物质的吸收。这一研究结果从肠道微生态方面进一步解释了本研究中的研究结果,即饲粮中添加400 mg/kg的槲皮素提高了断奶仔猪的生长性能,降低了仔猪腹泻率。
3.5 槲皮素对断奶仔猪粪便中微生物发酵碳水化合物代谢产物的影响前肠中未被降解的碳水化合物会由后肠微生物发酵产生乳酸和短链脂肪酸,而短链脂肪酸和乳酸有许多对机体健康有益的生理功能。研究发现,槲皮素可提高人粪便中乙酸、丙酸、丁酸和总挥发性脂肪酸含量[37]。体外发酵试验也发现,槲皮素可促进培养基中乙酸、丙酸、丁酸和总挥发性脂肪酸含量的升高[38]。本研究也发现,饲粮中添加400 mg/kg的槲皮素可显著增加仔猪粪便中乳酸和乙酸含量,降低戊酸、异丁酸、异戊酸和支链脂肪酸含量。乳酸可减少E.coli定植;乙酸可被肠道吸收进入血液,是外周组织能量来源之一;丁酸是肠上皮细胞的主要能量来源,可抑制肿瘤和炎症发生[34]。支链氨基酸缬氨酸和亮氨酸可由微生物的脱氨作用生成支链脂肪酸,是蛋白质发酵的重要指标[39]。因此,本试验中碳水化合物代谢产物含量提高和含氮化合物代谢产物含量的降低,表明槲皮素改变了粪便微生物的发酵模式,使其偏向了碳水化合物发酵模式,这有利于肠道健康,同时为宿主生长提供了更多能量物质,最终促进断奶仔猪的生长。
如前所述,饲粮中添加槲皮素增加了主要产乳酸菌Bifidobacterium和Lactobacillu的数量以及产短链脂肪酸菌Prevotella、Ruminococcus和Clostridium cluster Ⅳ数量。在猪肠道中,乙酸和乳酸含量与这些菌的数量存在显著正相关关系[40]。因此,本试验中粪便乳酸和乙酸含量上升可能和产乳酸菌数量和产短链脂肪酸菌数量增加有关。
3.6 槲皮素对断奶仔猪粪便中微生物发酵含氮化合物代谢产物的影响蛋白质被动物摄入后,在胃肠道中经过多种消化酶的作用,分解成小肽和氨基酸,一部分在小肠中被吸收,沿着肝门静脉进入肝脏,在肝脏内进行分解或合成蛋白质,或随血液分布到各个组织器官,合成各种特异性的组织蛋白质;另一部分未被消化吸收的则进入后肠,作为微生物发酵的底物而被分解代谢。由于小肠和大肠的生理功能以及内环境不同,它们的代谢呈现区室化特征:小肠中微生物菌群和种类相对较少,主要进行大分子营养物质(如小肽和氨基酸)的消化吸收;大肠中微生物菌群庞大,且食糜在其中的停留时间较长,小肠内未被消化的蛋白质、小肽和氨基酸进入大肠,主要被大肠内微生物利用。生物胺主要由相应氨基酸通过微生物的脱羧作用而形成的[41]。本研究中,饲粮中添加200和400 mg/kg的槲皮素均可显著降低粪便总生物胺、腐胺和尸胺含量。尸胺和腐胺已被证明对机体产生不利影响,同时可能作为潜在的肿瘤标志物[42]。因此,给断奶仔猪补充槲皮素后,可减少总生物胺、腐胺和尸胺的产生,这可能是槲皮素改善肠道健康的原因之一。E.coli是一种能代谢含氮化合物产生生物胺的蛋白质降解菌[39]。相关研究表明,粪便腐胺和尸胺含量与E.coli数量呈显著正相关[43]。因此,本试验中,槲皮素降低腐胺和尸胺等含氮化合物含量的其中一个原因可能是抑制了E.coli的增殖。此外,本研究中,槲皮素显著增加了饲粮中粗蛋白质表观消化率和提高血清总蛋白含量,表明其可能促进了断奶仔猪前肠对蛋白质的消化吸收,进而减少了氨基酸等含氮物质到达后肠被微生物发酵产生生物胺等代谢产物的含量。
4 结论饲粮中添加400 mg/kg的槲皮素可提高断奶仔猪ADG和结束体重,降低仔猪腹泻;提高粗蛋白质、钙和干物质表观消化率;调节机体代谢,增加血清总蛋白含量,降低血清尿素氮含量;同时调控断奶仔猪粪便微生物组成,促进有益菌增殖,抑制潜在致病菌增殖;改变粪便中微生物发酵模式,增加微生物对碳水化合物的代谢,减少微生物对含氮化合物的代谢。综上所述,断奶仔猪饲粮中添加400 mg/kg的槲皮素对肠道乃至整个机体健康具有益生作用,从而提高生长性能。
| [1] |
BÄCKHED F, LEY R E, SONNENBURG J L, et al. Host-bacterial mutualism in the human intestine[J]. Science, 2005, 307(5717): 1915-1920. DOI:10.1126/science.1104816 |
| [2] |
KNUDSEN K E B, HEDEMANN M S, LÆRKE H N. The role of carbohydrates in intestinal health of pigs[J]. Animal Feed Science and Technology, 2012, 173(1/2): 41-53. |
| [3] |
QAISRANI S N, VAN KRIMPEN M M, KWAKKEL R P, et al. Dietary factors affecting hindgut protein fermentation in broilers: a review[J]. World's Poultry Science Journal, 2015, 71(1): 139-160. DOI:10.1017/S0043933915000124 |
| [4] |
崔艺燕, 田志梅, 李贞明, 等. 植物提取物的生物学功能及其在仔猪生产上的应用[J]. 中国畜牧兽医, 2018, 45(12): 3419-3430. CUI Y Y, TIAN Z M, LI Z M, et al. Progress of biological functions of plant extracts and their application in piglets[J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(12): 3419-3430 (in Chinese). |
| [5] |
NAM J S, SHARMA A R, NGUYEN L T, et al. Application of bioactive quercetin in oncotherapy: from nutrition to nanomedicine[J]. Molecules, 2016, 21(1): 108. DOI:10.3390/molecules21010108 |
| [6] |
PARK J H, SURESHKUMAR S, KIM I H. Influences of dietary flavonoid (quercetin) supplementation on growth performance and immune response of growing pigs challenged with Escherichia coli lipopolysaccharide[J]. Journal of Animal Science and Technology, 2020, 62(5): 605-613. DOI:10.5187/jast.2020.62.5.605 |
| [7] |
ZHANG S, KIM I H. Effect of quercetin (flavonoid) supplementation on growth performance, meat stability, and immunological response in broiler chickens[J]. Livestock Science, 2020, 242: 104286. DOI:10.1016/j.livsci.2020.104286 |
| [8] |
刘红南, 滕楠, 李垚, 等. 饲粮添加槲皮素对蛋鸡蛋品质和蛋组分的影响[J]. 动物营养学报, 2014, 26(8): 2246-2252. LIU H N, TENG N, LI Y, et al. Effects of dietary quercetin on egg quality and egg components in laying hens[J]. Chinese Journal of Animal Nutrition, 2014, 26(8): 2246-2252 (in Chinese). DOI:10.3969/j.issn.1006-267x.2014.08.028 |
| [9] |
WANG C, WEI S Y, CHEN N N, et al. Characteristics of gut microbiota in pigs with different breeds, growth periods and genders[J/OL]. Microbial Biotechnology(2021-02-10)[2021-10-21]. https://pubmed.ncbi.nlm.nih.gov/33566446.
|
| [10] |
ZHAO W J, WANG Y P, LIU S Y, et al. The dynamic distribution of porcine microbiota across different ages and gastrointestinal tract segments[J]. PLoS One, 2015, 10(2): e0117441. DOI:10.1371/journal.pone.0117441 |
| [11] |
王淑楠. 茶树油对断奶仔猪生长性能及肠道屏障功能的影响[D]. 硕士学位论文. 扬州: 扬州大学, 2018. WANG S N. Effects of tea tree oil on growth performance and intestinal barrier function of weaned piglets[D]. Master's Thesis. Yangzhou: Yangzhou University, 2018. (in Chinese) |
| [12] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中盐酸不溶灰分的测定: GB/T 23742—2009[S]. 北京: 中国标准出版社, 2009. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. Animal feeding stuffs-determination of ash insoluble in hydrochloric acid: GB/T 23742—2009[S]. Beijing: China Standards Press, 2009. (in Chinese) |
| [13] |
贺建华. 饲料分析与检测[M]. 北京: 中国农业出版社, 2005. HE J H. Feed analysis and detection[M]. Beijing: China Agriculture Press, 2005 (in Chinese). |
| [14] |
YU M, ZHANG C J, YANG Y X, et al. Long-term effects of early antibiotic intervention on blood parameters, apparent nutrient digestibility, and fecal microbial fermentation profile in pigs with different dietary protein levels[J]. Journal of Animal Science and Biotechnology, 2018, 9(1): 175-186. |
| [15] |
CHANEY A L, MARBACH E P. Modified reagents for determination of urea and ammonia[J]. Clinical Chemistry, 1962, 8(2): 130-132. DOI:10.1093/clinchem/8.2.130 |
| [16] |
YANG Y X, MU C L, ZHANG J F, et al. Determination of biogenic amines in digesta by high performance liquid chromatography with precolumn dansylation[J]. Analytical Letters, 2014, 47(8): 1290-1298. DOI:10.1080/00032719.2013.871550 |
| [17] |
ZOU Y, XIANG Q H, WANG J, et al. Effects of oregano essential oil or quercetin supplementation on body weight loss, carcass characteristics, meat quality and antioxidant status in finishing pigs under transport stress[J]. Livestock Science, 2016, 192: 33-38. DOI:10.1016/j.livsci.2016.08.005 |
| [18] |
ABDEL-LATIF M A, ELBESTAWY A R, EL-FAR A H, et al. Quercetin dietary supplementation advances growth performance, gut microbiota, and intestinal mRNA expression genes in broiler chickens[J]. Animals, 2021, 11(8): 2302. DOI:10.3390/ani11082302 |
| [19] |
SHABBIR U, RUBAB M, DALIRI E B M, et al. Curcumin, quercetin, catechins and metabolic diseases: the role of gut microbiota[J]. Nutrients, 2021, 13(1): 206. DOI:10.3390/nu13010206 |
| [20] |
CHEN Z G, YUAN Q L, XU G R, et al. Effects of quercetin on proliferation and H2O2-induced apoptosis of intestinal porcine enterocyte cells[J]. Molecules, 2018, 23(8): 2012. DOI:10.3390/molecules23082012 |
| [21] |
高尚, 王恬. 仔猪营养性腹泻调控的研究进展[J]. 中国饲料, 2010(18): 19-23. GAO S, WANG T. Research progress of the control measure of nutritional diarrhea in piglets[J]. China Feed, 2010(18): 19-23 (in Chinese). DOI:10.3969/j.issn.1004-3314.2010.18.008 |
| [22] |
MEMARIANI H, MEMARIANI M, GHASEMIAN A. An overview on anti-biofilm properties of quercetin against bacterial pathogens[J]. World Journal of Microbiology and Biotechnology, 2019, 35(9): 143. DOI:10.1007/s11274-019-2719-5 |
| [23] |
金芳, 李垚, 刘红南, 等. 槲皮素对39周龄蛋鸡生产性能的影响[J]. 中国畜牧杂志, 2013, 49(5): 62-65. JIN F, LI Y, LIU H N, et al. Effect of quercetin on production performance of 39 weeks laying hens[J]. Chinese Journal of Animal Science, 2013, 49(5): 62-65 (in Chinese). DOI:10.3969/j.issn.0258-7033.2013.05.015 |
| [24] |
王盛楠. 槲皮素对AA肉鸡蛋白质消化利用的作用及机制[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2018. WANG S N. Effects and mechanism of quercetin on protein digestion and utilization in AA broilers[D]. Master's Thesis. Harbin: Northeast Agricultural University, 2018. (in Chinese) |
| [25] |
姚佳颖, 毛彦军, 王杉杉, 等. 槲皮素对猪肠上皮细胞利用蛋白质的作用机制[J]. 动物营养学报, 2021, 33(1): 553-562. YAO J Y, MAO Y J, WANG S S, et al. Mechanism of quercetin on protein availability in porcine intestinal epithelial cells[J]. Chinese Journal of Animal Nutrition, 2021, 33(1): 553-562 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.01.056 |
| [26] |
ZOU Y, WEI H K, XIANG Q H, et al. Protective effect of quercetin on pig intestinal integrity after transport stress is associated with regulation oxidative status and inflammation[J]. Journal of Veterinary Medical Science, 2016, 78(9): 1487-1494. DOI:10.1292/jvms.16-0090 |
| [27] |
时艺霖, 赵胤博, 王占彬, 等. 紫苏籽提取物对蛋鸡产蛋高峰后期血液生理生化指标的影响[J]. 家畜生态学报, 2015, 36(10): 39-44. SHI Y L, ZHAO Y B, WANG Z B, et al. Effect of Perilla frutescens seed extracts on blood physiological and biochemical indexes of layers during the late laying peak period[J]. Journal of Domestic Animal Ecology, 2015, 36(10): 39-44 (in Chinese). DOI:10.3969/j.issn.1673-1182.2015.10.008 |
| [28] |
TANG Z R, YIN Y L, NYACHOTI C M, et al. Effect of dietary supplementation of chitosan and galacto-mannan-oligosaccharide on serum parameters and the insulin-like growth factor-Ⅰ mRNA expression in early-weaned piglets[J]. Domestic Animal Endocrinology, 2005, 28(4): 430-441. DOI:10.1016/j.domaniend.2005.02.003 |
| [29] |
李贤, 李敬双, 于洋. 洋葱槲皮素对肉鸡肉品质、血液生化及免疫功能的影响[J]. 饲料研究, 2021, 44(6): 45-49. LI X, LI J S, YU Y. Effect of onion quercetin on meat quality, blood biochemistry and immune function of broilers[J]. Feed Research, 2021, 44(6): 45-49 (in Chinese). |
| [30] |
METGES C C, PETZKE K J, HENNIG U. Gas chromatography/combustion/isotope ratio mass spectrometric comparison of N-acetyl- and N-pivaloyl amino acid esters to measure 15N isotopic abundances in physiological samples: a pilot study on amino acid synthesis in the upper gastro-intestinal tract of minipigs[J]. Journal of Mass Spectrometry, 1996, 31(4): 367-376. DOI:10.1002/(SICI)1096-9888(199604)31:4<367::AID-JMS310>3.0.CO;2-V |
| [31] |
LIU H N, LIU Y, HU L L, et al. Effects of dietary supplementation of quercetin on performance, egg quality, cecal microflora populations, and antioxidant status in laying hens[J]. Poultry Science, 2014, 93(2): 347-353. DOI:10.3382/ps.2013-03225 |
| [32] |
WANG W, CHEN L P, ZHOU R, et al. Increased proportions of Bifidobacterium and the Lactobacillus group and loss of butyrate-producing bacteria in inflammatory bowel disease[J]. Journal of Clinical Microbiology, 2014, 52(2): 398-406. DOI:10.1128/JCM.01500-13 |
| [33] |
WANG Y N, LEONG L E X, KEATING R L, et al. Opportunistic bacteria confer the ability to ferment prebiotic starch in the adult cystic fibrosis gut[J]. Gut Microbes, 2019, 10(3): 367-381. DOI:10.1080/19490976.2018.1534512 |
| [34] |
YU M, LI Z M, CHEN W D, et al. Microbiome-metabolomics analysis investigating the impacts of dietary starch types on the composition and metabolism of colonic microbiota in finishing pigs[J]. Frontiers in Microbiology, 2019, 10: 1143. DOI:10.3389/fmicb.2019.01143 |
| [35] |
MU C L, YANG Y X, SU Y, et al. Differences in microbiota membership along the gastrointestinal tract of piglets and their differential alterations following an early-life antibiotic intervention[J]. Frontiers in Microbiology, 2017, 8: 797. DOI:10.3389/fmicb.2017.00797 |
| [36] |
BARNICH N, CARVALHO F A, GLASSER A L, et al. CEACAM6 acts as a receptor for adherent-invasive E. coli, supporting ileal mucosa colonization in Crohn disease[J]. The Journal of Clinical Investigation, 2007, 117(6): 1566-1574. DOI:10.1172/JCI30504 |
| [37] |
MAO S Y, ZHU W Y. Effects of six flavonoid compounds addition on short-chain fatty acids production and human fecal microbial community change during in vitro fermentation[J]. African Journal of Microbiology Research, 2011, 5(26): 4484-4491. |
| [38] |
郭长征. 高精料日粮条件下添加槲皮素对山羊瘤胃发酵及蹄部健康的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2017. GUO C Z. Effects of quercetin addition on rumen fermentation and hoof health in goats fed a high-concentrate diet[D]. Master's Thesis. Nanjing: Nanjing Agricultural University, 2017. (in Chinese) |
| [39] |
RIST V T S, WEISS E, EKLUND M, et al. Impact of dietary protein on microbiota composition and activity in the gastrointestinal tract of piglets in relation to gut health: a review[J]. Animal, 2013, 7(7): 1067-1078. DOI:10.1017/S1751731113000062 |
| [40] |
YU M, LI Z M, CHEN W D, et al. Hermetia illucens larvae as a Fishmeal replacement alters intestinal specific bacterial populations and immune homeostasis in weanling piglets[J]. Journal of Animal Science, 2020, 98(3): skz395. DOI:10.1093/jas/skz395 |
| [41] |
DAVILA A M, BLACHIER F, GOTTELAND M, et al. Re-print of "intestinal luminal nitrogen metabolism: role of the gut microbiota and consequences for the host"[J]. Pharmacological Research, 2013, 69(1): 114-126. DOI:10.1016/j.phrs.2013.01.003 |
| [42] |
YANG Y X, MU C L, LUO Z, et al. Bromochloromethane, a methane analogue, affects the microbiota and metabolic profiles of the rat gastrointestinal tract[J]. Applied and Environmental Microbiology, 2016, 82(3): 778-787. DOI:10.1128/AEM.03174-15 |
| [43] |
余苗, 李贞明, 陈卫东, 等. 不同淀粉类型饲粮对育肥猪盲肠食糜主要微生物及其代谢产物的影响[J]. 动物营养学报, 2020, 32(2): 613-625. YU M, LI Z M, CHEN W D, et al. Effects of different starch type diets on main microbes and their metabolites in cecal digesta of finishing pigs[J]. Chinese Journal of Animal Nutrition, 2020, 32(2): 613-625 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.02.017 |




