2. 宜兴天石饲料有限公司, 宜兴 214200;
3. 江苏恒丰强生物技术有限公司, 南通 226100;
4. 江苏沿海地区农业科学研究所, 盐城 224002
2. Yixing Tianshi Feed Co., Ltd., Yixing 214200, China;
3. Jiangsu Hengfengqiang Biotechnology Co., Ltd., Nantong 226100, China;
4. Institute of Agricultural Sciences in Jiangsu Coastal Area, Yancheng 224002, China
沙门氏菌病和大肠杆菌病是家禽养殖中最常见的疾病,给家禽生产造成巨大经济损失。除此之外,抗生素滥用导致的耐药性问题,不仅通过动物的粪便污染环境,还可以通过食物影响人类健康,更与耐药细菌的激增密切相关[1-2]。因此,家禽业迫切地需要有效的抗生素替代品来控制疾病的爆发。与抗生素相比,噬菌体具有高效灭菌和安全性的优势,它们特异性强,通常只作用于同一种属的细菌,不会破坏肠道菌群的动态平衡[3]。目前,国内噬菌体制剂在肉鸡养殖中的应用鲜有报道。在家禽养殖业中,可通过噬菌体降低肉鸡肠道中沙门氏菌[4]、大肠杆菌[5]、弯曲杆菌[6]的数量,同时不影响其他肠道菌群。也有相关研究报道,噬菌体可替代抗生素,促进肉鸡生长[7]。除此之外,噬菌体也可以作为一种生物防治剂,避免肉鸡胴体感染沙门氏菌,保证食品安全[8]。越来越多的研究表明,噬菌体制剂具有绿色、无公害的优势,在饲料添加剂或畜禽疾病防控等方面具有潜在的应用前景。
随着饲料端禁抗政策的实施,市场中各种各样的替抗产品不断涌现。噬菌体作为细菌的天敌,也可以作为一种饲料添加剂使用,并且主要作用场所在肠道。肠道既是家禽饲粮养分消化吸收的重要器官,也是重要的免疫保护屏障[9]。肠道健康与家禽出栏率及优质肉品生产率密切相关。其中肠道微生物作为肠道的重要组成部分之一,在吸收营养、防御病原体等方面发挥着不可替代的作用[10]。宿主和肠道微生物之间的相互作用会直接影响肠道代谢[11],此外,微生物菌群还通过竞争排斥过程中产生的抑菌或杀菌物质来减少和防止肠道病原体的定植[12]。在我国家禽集约化养殖密度高及饲料营养搭配不科学的条件下,尤其是在禁用抗生素的后抗生素时代,家禽肠道问题日益突出,因此,众多科研工作者热衷于研究绿色、无公害的添加剂,来解决家禽肠道健康问题。因此,本试验通过给肉鸡饲喂大肠杆菌噬菌体和沙门氏菌噬菌体的复合制剂,研究复合噬菌体制剂对肉鸡生长性能、肠道形态、肠道菌群及免疫功能的影响,以期为其在肉鸡养殖中的应用提供理论依据。
1 材料与方法 1.1 试验材料LB液体培养基、SM缓冲液、细菌内毒素测定试剂盒、鸡免疫球蛋白G(IgG)酶联免疫检测试剂盒由南京建成生物研究所提供;多功能酶标仪(Infinite M1000 PRO,瑞士);尼康ECLIPSE 80i光学显微镜(Nikon H550L,日本);超微量紫外分光光度计(Nanodrop 2000,美国)。
1.2 噬菌体复合制剂的制备噬菌体复合制剂:有效成分为2株裂解性大肠杆菌噬菌体(BPEP2、BPEP3)和2株裂解性肠炎沙门氏菌噬菌体(BPT48、BPF13076),以上噬菌体均分离纯化自该鸡场病鸡粪便样品,总效价为109 PFU/mL,于4 ℃保存备用。
制备方法:噬菌体BPEP2、BPEP3、BPT48、BPF13076与其对应宿主EP2、EP3、T48、F13076[细菌生长至对数期,吸光度(OD)600 nm为0.5]以最佳感染复数的比例加入新鲜的LB液体培养基中,37 ℃恒温培养箱培养6 h后,离心过滤,得到BPEP2、BPEP3、BPT48、BPF13076各10 L。通过切向流过滤技术用噬菌体保存液(SM缓冲液)置换出LB液体培养基,最后获得BPEP2、BPEP3、BPT48、BPF13076各5 L。将BPEP2、BPEP3、BPT48、BPF13076按照体积比1 ∶ 1 ∶ 1 ∶ 1混合均匀,得到20 L噬菌体复合制剂,细菌内毒素的含量测定值< 1 EU/mL。
1.3 试验设计选择14 000只体重(850±45) g的37日龄青脚麻鸡,随机分为2组,分别为对照组与试验组,每组7个重复,每个重复1 000只。对照组饲喂基础饲粮,并根据养殖场疫病防治对策,正常使用治疗抗生素、抗球虫药和中药等产品,试验组饲喂基础饲粮,并在饮水中添加噬菌体复合制剂,其他用药情况与对照组相同。试验组肉鸡的饮水罐(体积100 L)中按体积比为1 ∶ 100添加噬菌体复合制剂,保证试验组在2 h内喝完,并保证饮用水中噬菌体的实际效价为107 PFU/mL,连续饲喂6 d,间隔3 d,共循环3次。2组鸡只均按常规的饲养管理方式进行饲养管理。基础饲粮为玉米-豆粕型,参考《鸡饲养标准》(NY/T 33—2004)和试验鸡场营养标准配制,其组成及营养水平见表 1,试验期为27 d。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
肉鸡饲养试验在南京益信家禽育种有限公司进行,采用地面散养,自由采食和饮水。饲养管理及免疫程序按常规方式进行。每日观察试验肉鸡活动情况并记录采食量及死淘数。
1.5 样品采集和指标检测 1.5.1 生长性能各组分别在试验第7、16、25、27天,以重复为单位对空腹(自由饮水)12 h后的肉鸡称重,并准确称量和记录采食量,计算试验各阶段的平均体重、平均日采食量及料重比。
1.5.2 免疫器官指数各组分别在试验第7、16、25天,从每个重复中随机抽取5只称重,然后进行颈静脉放血处死后解剖,摘取胸腺、脾脏和法氏囊,并除去脂肪及结缔组织,用滤纸吸干血水后进行称重,计算免疫器官指数。
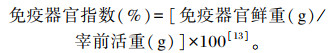
|
各组分别在试验第7、16、25天,从每个重复中随机抽取5只接近平均体重的试验鸡,颈静脉放血处死,收集血液,将采集的血液静止20 min后,3 200 r/min离心15 min,取上层血清,用酶联免疫吸附试验试剂盒测定血清中IgG的含量。
1.5.4 小肠黏膜组织结构各组分别在试验第7、16、25天,从每个重复中随机抽取5只接近平均体重的试验鸡,颈静脉放血处死后解剖,取相同部位的十二指肠、空肠、回肠,长2~3 cm,放入预先准备好的4%多聚甲醛固定液中固定24 h后,乙醇脱水、二甲苯透明、石蜡包埋、苏木精-伊红染色和中性树胶封片,在光学显微镜下观察各段肠黏膜形态结构变化,并测量绒毛高度和隐窝深度。
1.5.5 肠道微生物扩增子测序分析各组分别在试验第7、16、25、27天,从每个重复中随机抽取5只接近平均体重的试验鸡,颈静脉放血处死,采集5个盲肠内容物于灭菌EP管中,迅速置于液氮中保存,待测。样品送到上海天昊生物科技有限公司,进行DNA提取,并使用Nanodrop检测DNA样品质量检测。以16S rRNA V3~V4区为目标片段,扩增引物为341F(5'-CCTACGGGNGGCWGCAG-3')和805R(5'-GACTACHVGGGTATCTAATCC-3')。将样本PCR扩增产物进行文库构建,通过Illumina HiSeq 2×250平台测序及数据分析。
1.6 统计分析采用Excel 2010对试验数据进行整理,用SPSS 16.0软件中的独立样本t检验进行统计分析,以P < 0.05作为差异显著的判断标准,P < 0.01作为差异极显著的判断标准。结果以“平均值±标准差”表示。菌群分析数据采用R绘图进行。
2 结果与分析 2.1 噬菌体复合制剂对肉鸡生长性能影响如表 2所示,与对照组相比,61和63日龄,试验组肉鸡平均体重分别增加9.46%和9.70%(P > 0.05),整个过程的料重比减少了2.81%。
|
|
表 2 噬菌体复合制剂对肉鸡生长性能的影响 Table 2 Effects of phage cocktail preparation on growth performance of broilers |
如表 3所示,与对照组相比,43日龄,试验组肉鸡胸腺指数和脾脏指数分别增加16.80%(P < 0.05)和7.14%(P > 0.05);52日龄,试验组肉鸡法氏囊指数和胸腺指数分别增加8.55%(P > 0.05)和7.37%(P > 0.05);61日龄,试验组肉鸡法氏指数增加了39.66%(P > 0.05)。
|
|
表 3 噬菌体复合制剂对肉鸡免疫器官指数的影响 Table 3 Effects of phage cocktail preparation on immune organ indexes of broilers |
如表 4所示,与对照组相比,43、52及61日龄,试验组肉鸡血清中IgG含量分别增加15.85%(P > 0.05)、29.54%(P > 0.05)和1.45%(P > 0.05)。
|
|
表 4 噬菌体复合制剂对肉鸡血清中IgG含量的影响 Table 4 Effects of phage compound preparation on content of IgG in serum of broilers |
如表 5所示,43、52及61日龄, 试验组的肉鸡十二指肠、空肠、回肠的绒毛高度均比对照组高,且差异显著(P < 0.05);43及52日龄,试验组的肉鸡十二指肠、空肠、回肠的隐窝深度均比对照组深,且差异显著(P < 0.05);43、52及61日龄,试验组的肉鸡十二指肠、空肠、回肠的绒毛高度/隐窝深度均比对照组高,且差异显著(P < 0.05)。
|
|
表 5 噬菌体复合制剂对肉鸡小肠形态结构的影响 Table 5 Effects of phage cocktail preparation on morphological structure of small intestine of broilers |
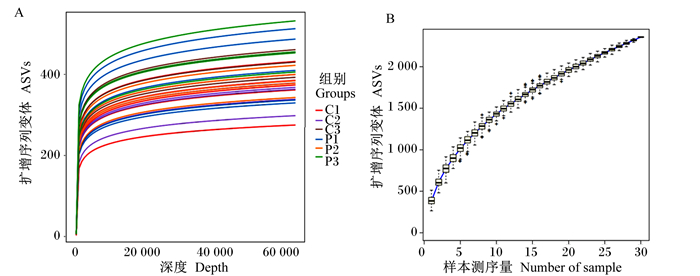
对肉鸡盲肠食糜微生物16S rRNA进行HiSeq测序,得到2 204 912条优质序列,并且序列的长度集中在419~428 bp。从图 1发现,测序序列稀释曲线趋于平坦,表明测序数据量足够大,除此之外物种累计曲线趋于平缓,操作分类单元(OTU)数未显著增加,表明样品量充足,可保证数据分析的可靠性。
|
图A:测序序列稀释曲线;图B:物种积累曲线。 Fig.A: dilution curve of sequencing sequence; Fig.B: species accumulation curve. 图 1 测序序列分析图 Fig. 1 Histogram of sequencing sequence analysis |
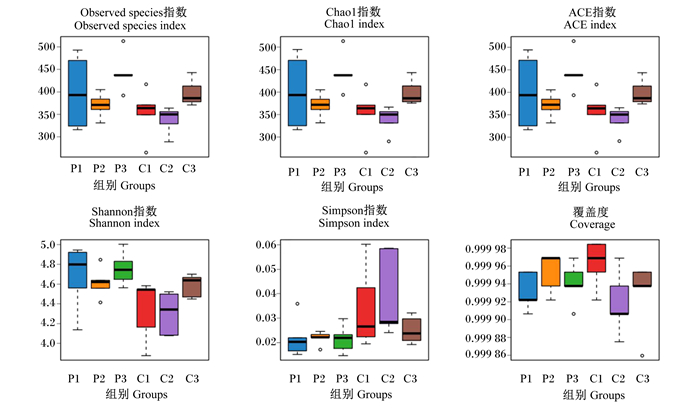
图 2为盲肠食糜微生物的α多样性,结果表明,与对照组相比,第3个周期的噬菌体处理对Chao1指数、Shannon指数、ACE指数均差异显著(P < 0.05),但是Simpson指数和覆盖度差异不显著(P > 0.05)。这说明饮用噬菌体复合制剂会对肉鸡盲肠肠道菌群丰富度和多样性产生一定的影响。
|
横坐标(PC1)和纵坐标(PC2)为样本间差异解释度最大的2个主要成分,刻度是相对距离,无实际意义。图中每个点代表 1个样本,点的不同颜色表示样本所属分组,分布越近的点表示样本越相似。 Abscissa (PC1) and ordinate (PC2) are the two main components with the largest interpretation of the difference between samples. The scale is the relative distance, which has no practical significance. Each point in the figure represents a sample. The different colors of the points represent the group to which the samples belong. The closer the distribution is, the more similar the samples are. 图 2 α多样性分析 Fig. 2 α diversity analysis |
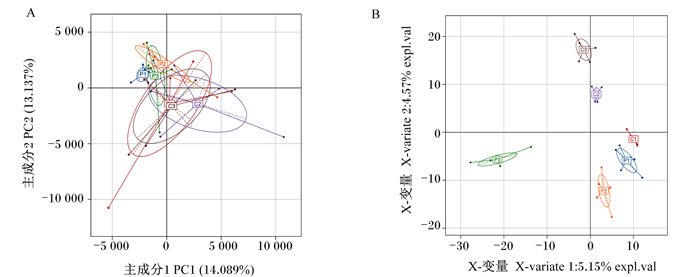
从图 3可以看出,基于OTU/ASV(扩增序列变体)丰度表和Euclidean距离,试验组(P1、P2和P3)在主成分分析(PCA)图中聚集到左上限,而对照组的样本(C1、C2和C3)聚集到右下限,说明试验组和对照组中肉鸡盲肠肠道菌群结构产生了不同的特征。进一步,基于偏最小二乘法判别分析(PLS-DA)发现,试验组(P1、P2和P3)与对照组的样本(C1、C2和C3)距离更远,再次表明试验组和对照组中肉鸡盲肠肠道菌群结构产生了不同的特征。
|
图A:主成分分析;图B:偏最小二乘法判别分析。 Fig.A: PCA; Fig.B: PLS-DA. 图 3 β多样性分析 Fig. 3 β diversity analysis |
如图 4所述,对照组及试验组肉鸡盲肠菌群以拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)为主。与对照组相比,43日龄,试验组肉鸡盲肠食糜中Firmicutes相对丰度增加28.13%,并且Bacteroidetes相对丰度降低9.97%;52日龄,试验组肉鸡噬菌体盲肠食糜中变形菌门(Proteobacteria)相对丰度下降,并且螺旋菌门(Spirochaetes)相对丰度增加;61日龄,肉鸡试验组盲肠食糜中Proteobacteria、Firmicutes相对丰度下降,而Bacteroidetes相对丰度增加。
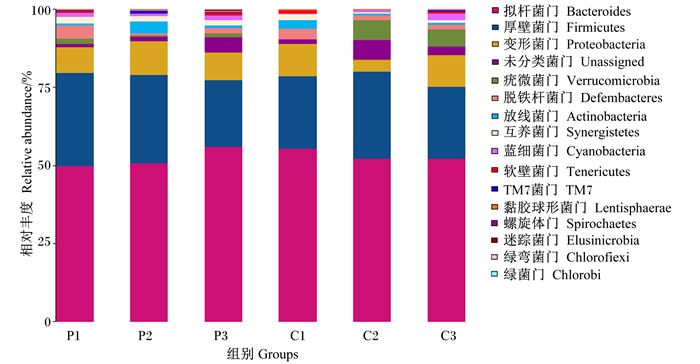
|
每个柱形为1个分组,纵坐标为组内相对丰度平均值,每个分组内所有物种相对丰度平均值加和为1,图中每种颜色对应1个物种,对应的物种见柱状图下方的颜色注释。 Each column is a group, the ordinate is the average relative abundance in the group, and the sum of the average relative abundance of all species in each group is 1.Each color in the figure corresponds to a species, and the corresponding species are shown in the color notes at the bottom of the histogram. 图 4 门水平物种组成柱状图 Fig. 4 Histogram of species composition at phylum level |
如图 5所示,为探索噬菌体复合制剂对肉鸡盲肠微生物属水平的影响,本研究定义水平上相对丰度前8的菌群为优势菌群。在属水平上,拟杆菌属(Bacteroides)、巨单胞菌属(Megamonas)、黏螺旋菌属(Mucispirillum)、脱硫弧菌属(Desulfovibrio)、考拉杆菌属(Phascolarctobacterium)、瘤胃球菌属(Ruminococcus)、副拟杆菌属(Parabacteroides)、萨特氏菌属(Sutterella)是试验组和对照组占优势的细菌。43日龄,2组样品各物种组成属水平大致相当。与对照组相比,52日龄,试验组增加Parabacteroides、Desulfovibrio和Barnesiella在肉鸡盲肠中的相对丰度,降低RFN20相对丰度;61日龄,试验组增加Lactobacillus的相对丰度,降低RFN20相对丰度。
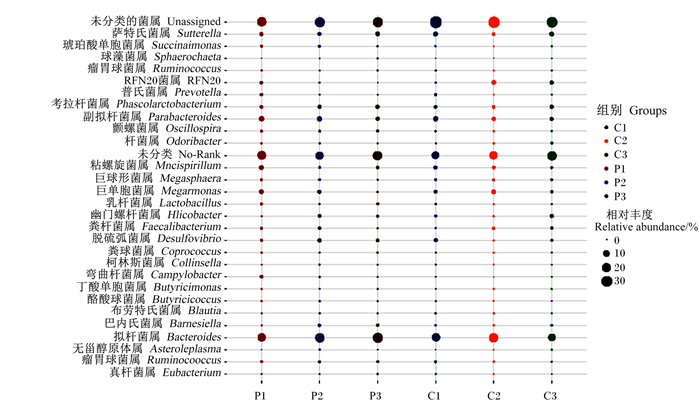
|
图 5 属水平上的物种组成图 Fig. 5 Histogram of species composition at genus level |
家禽肠道菌群在宿主健康与疾病、维持免疫屏障、抵御感染等方面发挥着不可替代的作用[14]。肉鸡肠道具有独特的微生物生态系统,与宿主保持动态平衡。肠道微生物稳态可以促进肉鸡生长及提高其生长性能,而肠道微生物菌群失衡可诱发肠炎,导致生长速度下降和死亡率增加,造成一定的经济损失[15]。葛龙等[16]研究发现,噬菌体一定程度上可以降低白羽肉鸡料重比,提高免疫器官指数。本试验结果表明,与对照组相比,试验组的料重比下降2.81%。本试验的噬菌体复合制剂有效成分为大肠杆菌噬菌体与沙门氏菌噬菌体,可以专一性地杀灭大肠杆菌与沙门氏菌,降低肠道中有害菌的数量,因此猜测肉鸡饮用噬菌体复合制剂后肠道中有害菌数量下降,间接有利于有益菌的生长繁殖,改善了肠道内菌群的分布,从而提高了饲料报酬。
除此之外,通过盲肠食糜微生物16S rRNA进行HiSeq测序,发现在门水平上,与对照组相比,43日龄,试验组肉鸡盲肠食糜中Firmicutes相对丰度增加28.13%,并且Bacteroidetes相对丰度降低9.97%。初步试验的结果发现,饮用噬菌体复合制剂后,肉鸡盲肠中菌群的相对丰度发生了一定程度的改变。宋颖超等[17]研究发现,Firmicutes是影响黄羽肉鸡饲料效率的优势菌门。Knarreborg等[18]研究发现,Bacteroidetes的某些成员能分解结合型胆汁酸,抑制肉鸡生产性能。再结合本试验的研究结果,发现肉鸡料重比的改变与肠道中Firmicutes以及Bacteroidetes相对丰度的改变具有一定的相关性,但肠道菌群的改变对肉鸡饲料转化率的影响机制仍需进一步探讨。
3.2 噬菌体复合制剂对肉鸡免疫功能的影响免疫器官称重是目前研究机体免疫水平的常用方法之一。免疫器官指数的变化,一定程度可以说明机体免疫体系状况,在正常情况下,肉鸡免疫器官指数的增加,一定程度上说明肉鸡免疫体系越强[19]。于明等[20]研究发现,在饲粮中添加复合益生菌制剂可改善肉仔鸡免疫功能。本试验对肉鸡的胸腺、法氏囊及脾进行称重,研究结果发现,与对照组相比,43日龄,试验组肉鸡胸腺指数和脾脏指数分别增加16.80%和7.14%;52日龄,试验组肉鸡法氏囊指数和胸腺指数分别增加8.55%和7.37%;61日龄,试验组肉鸡法氏囊指数加了39.66%。研究结果说明,噬菌体在一定程度上促进了免疫器官的发育,其作用机制与于明等[20]虽不同,但都一定程度上促进了免疫器官的发育。同时,与对照组相比,试验组肉鸡血清中IgG含量升高,一定程度上也反映了机体免疫功能的增强。也有研究发现饲粮中直接添加益生菌也可以促进肉鸡免疫器官发育,提高免疫抗病能力[21],这一研究结果与本试验结果类似。虽然作用机制不同,但噬菌体依然可以达到与益生菌一样的应用效果。
3.3 噬菌体复合制剂对肉鸡肠道形态的影响肠道形态是判断肠道健康的重要依据之一[22],其中绒毛高度/隐窝深度常用来反映小肠上皮细胞更新代谢的程度,可以综合反映小肠功能状态[23]。曾永娣[24]研究发现,400 mg/kg噬菌体能显著提高仔猪十二指肠、空肠、回肠中绒毛高度/隐窝深度,进而提高仔猪肠道对营养物质的消化吸能力。本试验结果同样发现,噬菌体可以显著提高肉鸡十二指肠、空肠、回肠中绒毛高度/隐窝深度,可以改善肠道对营养物质消化吸收能力,促进肉鸡健康。
3.4 噬菌体复合制剂对肉鸡肠道菌群的影响本试验通过第二代测序技术对试验组与对照组之间处理后的肉鸡盲肠食糜微生物16S rRNA基因序列进行高通量测序,取得了一批高质量的数据,保证了肉鸡盲肠肠道菌群结果分析的可靠性。通过对α多样性评估试验组与对照组的肉鸡盲肠肠道菌群丰富度和多样性。与对照组相比,61日龄,试验组Chao1指数、Shannon指数、ACE指数的测定值均差异显著,但是Simpson指数和覆盖度差异不显著。这一结果表明,饮用噬菌体复合制剂会对肉鸡盲肠肠道菌群丰富度和多样性产生一定的影响,已在相关研究[25]中得到证实。除此之外,根据主成分分析发现,试验组与对照组明显分开,且不同组的生物学重复样品各自聚在一起,说明噬菌体对盲肠肠道菌群结构影响显著。进一步,基于偏最小二乘法判别分析发现,试验组与对照组的样本距离更远,再次表明噬菌体对肉鸡盲肠肠道菌群影响显著。因此,可以看出饮用噬菌体复合制剂会对肉鸡的肠道菌群造成一定的影响。
本试验在肉鸡饮用噬菌体复合制剂后,从其肠道菌群在门及属不同分类水平上分析噬菌体对肠道菌群的影响。其中Firmicutes、Bacteroidetes、Proteobacteria相对丰度占据前3位,其中Firmicutes与Bacteroidetes占比较高,该研究结果与以往黄羽肉鸡的研究结果[17]相似。随着饮用噬菌体复合制剂周期的增加,Firmicutes、Bacteroidetes、Proteobacteria在盲肠肠道中的相对丰度发生了一定程度的变化,其中Bacteroidetes相对丰度增加,而Firmicutes及Proteobacteria相对丰度减少。以往研究表明,饲喂抗生素制剂显著降低Proteobacteria的相对丰度,而显著增加Bacteroidetes相对丰度[26]。这与本试验饮用噬菌体复合制剂变化趋势一致。然而饮用噬菌体复合制剂后Bacteroidetes相对丰度增加,Firmicutes及Proteobacteria的相对丰度减少,这一趋势与部分抗生素替代品饲喂结果[27]一致。值得注意的是Firmicutes、Bacteroidetes及Proteobacteria之间的互作关系在宿主饲料转化率方面起到重要作用[17-18]。因此,可以发现饮用噬菌体复合制剂,会一定程度上影响肉鸡肠道菌群,进而影响宿主的新陈代谢功能。
在属水平上,8个优势细菌属的相对丰度在肉鸡饮用噬菌体复合制剂后发生了一定程度的变化。本研究发现,52日龄,试验组可选择性地促进Parabacteroides、Desulfovibrio和Barnesiella的相对丰度;61日龄,选择性地促进Lactobacillus的相对丰度,这些细菌属与宿主的新城代谢、肠道健康等密切相关。有研究发现,Parabacteroides通过肠道紧密连接蛋白表达的增加,来维持肠道屏障的完整,保障肠道健康[28]。也有研究报道,饲喂发酵饲料能显著降低鸡肠道中Desulfovibrio的数量,从而达到预防肠道疾病[29]。此外,Lactobacillus与鸡体内糖代谢、肌肉和个体生长发育呈显著正相关[30]。同时Barnesiella可降低感染性病原菌在肠道中的定植[31]。以上菌属均在饮用噬菌体复合制剂后发生一定程度的变化,说明肉鸡在饮用噬菌体复合制剂后,对于改善肠道菌群以及促进机体健康等方面有着重要作用。
综上所述,噬菌体复合制剂有利于肉鸡生长性能和免疫功能的提高,并且可以改善肠道对营养物质消化吸收能力,此外可以改善肠道菌群,促进肉鸡肠道健康,为其在肉鸡养殖业的应用提供理论基础。
4 结论综上所述,通过饮用水添加噬菌体复合制剂有利于提高肉鸡的生长性能和免疫功能,促进肠道发育,改善肠道菌群,保障肉鸡肠道健康。因此,噬菌体复合制剂在肉鸡养殖业中具有潜在的应用价值。
| [1] |
GAO P F, MA C, SUN Z, et al. Feed-additive probiotics accelerate yet antibiotics delay intestinal microbiota maturation in broiler chicken[J]. Microbiome, 2017, 5(1): 91. DOI:10.1186/s40168-017-0315-1 |
| [2] |
AHMADI M, KARIMI TORSHIZI M A, RAHIMI S, et al. Prophylactic bacteriophage administration more effective than post-infection administration in reducing Salmonella enterica serovar enteritidis shedding in quail[J]. Frontiers in Microbiology, 2016, 7: 1253. |
| [3] |
WERNICKI A, NOWACZEK A, URBAN-CHMIEL R. Bacteriophage therapy to combat bacterial infections in poultry[J]. Virology Journal, 2017, 14(1): 179. DOI:10.1186/s12985-017-0849-7 |
| [4] |
LI M Z, LIN H, JING Y J, et al. Broad-host-range Salmonella bacteriophage STP4-a and its potential application evaluation in poultry industry[J]. Poultry Science, 2020, 99(7): 3643-3654. DOI:10.1016/j.psj.2020.03.051 |
| [5] |
SOROUR H K, GABER A F, HOSNY R A. Evaluation of the efficiency of using Salmonella Kentucky and Escherichia coli O119 bacteriophages in the treatment and prevention of salmonellosis and colibacillosis in broiler chickens[J]. Letters in Applied Microbiology, 2020, 71(4): 345-350. |
| [6] |
GRANT A Q, HASHEM F, PARVEEN S. Salmonella and Campylobacter: antimicrobial resistance and bacteriophage control in poultry[J]. Food Microbiology, 2016, 53(Pt -B): 104-109. |
| [7] |
UPADHAYA S D, AHN J M, CHO J H, et al. Bacteriophage cocktail supplementation improves growth performance, gut microbiome and production traits in broiler chickens[J]. Journal of Animal Science and Biotechnology, 2021, 12(1): 49. DOI:10.1186/s40104-021-00570-6 |
| [8] |
ATTERBURY R J, GIGANTE A M, RUBIO LOZANO M D L S, et al. Reduction of Salmonella contamination on the surface of chicken skin using bacteriophage[J]. Virology Journal, 2020, 17(1): 98. DOI:10.1186/s12985-020-01368-0 |
| [9] |
朱静, 张静. 国际家禽营养与肠道健康研究新动向[J]. 中国家禽, 2014, 36(14): 35. ZHU J, ZHANG J. New trends in international poultry nutrition and intestinal health research[J]. China Poultry, 2014, 36(14): 35 (in Chinese). DOI:10.3969/j.issn.1004-6364.2014.14.009 |
| [10] |
王姝妹, 卢立志. 家禽肠道微生物稳定性影响因素及其生理功能研究进展[J]. 中国家禽, 2017, 39(15): 44-49. WANG S M, LU L Z. Research progress on influence factor of stability and physiological function of intestinal microflora in poultry[J]. China Poultry, 2017, 39(15): 44-49 (in Chinese). |
| [11] |
YAN W, SUN C J, YUAN J W, et al. Gut metagenomic analysis reveals prominent roles of Lactobacillus and cecal microbiota in chicken feed efficiency[J]. Scientific Reports, 2017, 7(1): 45308. DOI:10.1038/srep45308 |
| [12] |
CLAVIJO V, FLÓREZ M J V. The gastrointestinal microbiome and its association with the control of pathogens in broiler chicken production: a review[J]. Poultry Science, 2018, 97(3): 1006-1021. DOI:10.3382/ps/pex359 |
| [13] |
从光雷, 肖蕴祺, 张倩雲, 等. 饲粮添加化香果单宁对肉鸡生长性能、屠宰性能、器官指数、肉品质、抗氧化功能和肠道发育的影响[J]. 动物营养学报, 2021, 33(5): 2661-2671. CONG G L, XIAO Y Q, ZHANG Q Y, et al. Effects of plotytarya strohilacea Sieb. et Zuce tannin on growth performance, slaughter performance, organ indexes, meat quality, antioxidant function and intestinal development of broilers[J]. Chinese Journal of Animal Nutrition, 2021, 33(5): 2661-2671 (in Chinese). |
| [14] |
马晓汶, 卢立志, 邹晓庭. 家禽肠道微生态与免疫的关系[J]. 中国家禽, 2019, 41(7): 42-46. MA X W, LU L Z, ZHOU X T. Relationship between intestinal microecology and immunity in poultry[J]. China Poultry, 2019, 41(7): 42-46 (in Chinese). |
| [15] |
朱静, 张静. 国际家禽营养与肠道健康研究新动向[J]. 中国家禽, 2014, 36(14): 35. ZHU J, ZHANG J. New trends of international poultry nutrition and intestinal health research[J]. China poultry, 2014, 36(14): 35. DOI:10.3969/j.issn.1004-6364.2014.14.009 |
| [16] |
葛龙, 贺永超, 董强, 等. 噬菌体制剂对肉鸡生长性能、肠道菌群及免疫功能的影响[J]. 饲料研究, 2020, 43(4): 111-115. GE L, HE Y C, DONG Q, et al. Effect of bacteriophage preparation on growth performance, intestinal flora and immune organs of broilers[J]. Feed Research, 2020, 43(4): 111-115 (in Chinese). |
| [17] |
宋颖超, 白丽娟, 任晓晗, 等. 黄羽肉鸡饲料效率与粪便微生物多样性及丰度的相关性研究[J]. 中国畜牧杂志, 2019, 55(4): 89-95. SONG Y C, BAI L J, REN X H, et al. Correlation between feed efficiency and microbial diversity and abundance of yellow meat-type broilers[J]. Chinese Journal of Animal Science, 2019, 55(4): 89-95 (in Chinese). |
| [18] |
KNARREBORG A, ENGBERG R M, JENSEN S K, et al. Quantitative determination of bile salt hydrolase activity in bacteria isolated from the small intestine of chickens[J]. Applied and Environmental Microbiology, 2002, 68(12): 6425-6428. DOI:10.1128/AEM.68.12.6425-6428.2002 |
| [19] |
GOEL A, BHANJA S K, MEHRA M, et al. In ovo silver nanoparticle supplementation for improving the post-hatch immunity status of broiler chickens[J]. Archives of Animal Nutrition, 2017, 71(5): 384-394. DOI:10.1080/1745039X.2017.1349637 |
| [20] |
于明, 程波, 张子光, 等. 复合益生菌制剂对肉仔鸡生长性能, 肠道菌群和免疫功能的影响[J]. 现代畜牧兽医, 2021(2): 39-42. YU M, CHENG B, ZHANG Z G, et al. Effect of compound on growth performance, intestinal microflora and immune function of broilers[J]. Modern Journal of Animal Husbandry and Veterinary Medicine, 2021(2): 39-42 (in Chinese). |
| [21] |
刘凤美, 张磊, 黄彬. 日粮添加益生菌对肉鸡生产性能、免疫功能和肠道菌群的影响[J]. 中国饲料, 2018(24): 39-43. LIU F M, ZHANG L, HUANG B. Effects of probiotics on production performance, immunologic function and gut bacteria of broiler chickens[J]. China Feed, 2018(24): 39-43 (in Chinese). |
| [22] |
OLIVER W T, MATHEWS S A, PHILLIPS O, et al. Efficacy of partially hydrolyzed corn syrup solids as a replacement for lactose in manufactured liquid diets for neonatal pigs[J]. Journal of Animal Science, 2002, 80(1): 143-153. DOI:10.2527/2002.801143x |
| [23] |
王娟, 王学静, 付艳芬, 等. 太行鸡、海兰灰蛋鸡1~91日龄肠道组织学结构发育规律比较研究[J]. 中国家禽, 2018, 40(23): 27-31. WANG J, WANG X J, FU Y F, et al. Comparative study on histological development of intestinal tract of Taihang layer and Hy-line layer at 1 to 91 days of age[J]. China Poultry, 2018, 40(23): 27-31 (in Chinese). |
| [24] |
曾永娣. 噬菌体对断奶仔猪生长性能、肠道黏膜屏障功能及盲肠微生物区系的影响[D]. 硕士学位论文. 南昌: 江西农业大学, 2020. ZENG Y D. Effects of bacteriophage on growth performance, intestinal mucosal barrier function and cecal microflora in weaned piglets[D]. Master's Thesis. Nanchang: Jiangxi Agricultural University, 2020. (in Chinese) |
| [25] |
卢国民, 张灿, 刘军伟, 等. 大肠杆菌噬菌体对肉鸡肠道菌群的影响[J]. 中国兽医学报, 2017, 37(5): 833-838. LU G M, ZHANG C, LIU J W, et al. Effects of coliphages on the intestinal microflora of broilers[J]. Chinese Journal of Veterinary Science, 2017, 37(5): 833-838 (in Chinese). |
| [26] |
TREMAROLI V, BÄCKHED F. Functional interactions between the gut microbiota and host metabolism[J]. Nature, 2012, 489(7415): 242-249. DOI:10.1038/nature11552 |
| [27] |
杨瑞思, 江宇航, 张关令, 等. 复合噬菌体裂解酶对白羽肉鸡肠道菌群结构和肝脏抗氧化酶指标的影响[J]. 微生物学通报, 2021, 48(9): 3116-3129. YANG R S, JIANG Y H, ZHANG G L, et al. Effects of complex phage lysin on growth performance, organ index and major antioxidant enzyme activities in white feather broilers[J]. Microbiology, 2021, 48(9): 3116-3129 (in Chinese). |
| [28] |
KOH G Y, KANE A V, WU X, et al. Parabacteroides distasonis attenuates tumorigenesis, modulates inflammatory markers and promotes intestinal barrier integrity in azoxymethane-treated A/J mice[J]. Carcinogenesis, 2020, 41(7): 909-917. DOI:10.1093/carcin/bgaa018 |
| [29] |
张孟阳, 毕付提, 李洁, 等. 发酵饲料对仔鸡肠道微生物群落多样性影响[J]. 中国家禽, 2019, 41(13): 30-36. ZHANG M Y, BI F D, LI J, et al. Diversity of intestinal microbial communities in chicken fed with fermented feed[J]. China Poultry, 2019, 41(13): 30-36 (in Chinese). |
| [30] |
崔磊. 不同性别鸡肠道菌群差异的比较研究[D]. 硕士学位论文. 武汉: 华中农业大学, 2019. CUI L. Comparitive study on the gut microbiota differences of chickens with different gender[D]. Master's Thesis. Wuhan: Huazhong Agricultural University, 2019. (in Chinese) |
| [31] |
UBEDA C, BUCCI V, CABALLERO S, et al. Intestinal microbiota containing Barnesiella species cures vancomycin-resistant Enterococcus faecium colonization[J]. Infection and Immunity, 2013, 81(3): 965-973. DOI:10.1128/IAI.01197-12 |




