2. 延边大学东北寒区肉牛科技创新教育部工程研究中心, 延吉 133002
2. Ministry of Education, Engineering Research Center of North-East Cold Region Beef Cattle Science & Technology Innovation, Yanbian University, Yanji 133002, China
中链脂肪酸(MCFAs)是含有6~12个碳原子数的脂肪酸,主要包括辛酸(C8)、癸酸(C10)和月桂酸(C12)。MCFAs具有易消化、易吸收、抗菌、抗病毒、用于体内饥饿素酰化和降低甲烷产量等特殊的生理功能[1-4]。目前,有关MCFAs的研究报道多集中在猪、鸡和羊上[5-7],在肉牛中的报道相对较少。同时,研究表明,MCFAs在动物生产中的应用效果可能与其种类、添加量和饲粮的类型有关[8]。因此,明确特定饲粮条件下不同种类MCFAs的添加量和效果,对其合理应用具有重要意义。本研究采用体外瘤胃产气量法对MCFAs的效果进行了评价,揭示不同添加量、不同种类的MCFAs对50:50精粗比饲粮体外瘤胃发酵的影响,旨在为MCFAs种类及添加量的选择及后续的相关研究奠定基础。
1 材料与方法 1.1 试验材料 1.1.1 MCFAs未酯化辛酸,分子式为C8H16O2,无色油状液体[购自西格玛奥德里奇(上海)贸易有限公司,纯度≥99%];未酯化癸酸,分子式为C10H20O2,白色结晶[购自西格玛奥德里奇(上海)贸易有限公司,纯度≥99.5%];未酯化月桂酸,分子式为C12H24O2,白色针状晶体[购自西格玛奥德里奇(上海)贸易有限公司,纯度≥99%]。
1.1.2 发酵底物发酵底物为全价混合日粮(精粗比50:50),参考中国《肉牛饲养标准》[9]配制肉牛基础饲粮,其组成及营养水平见表 1。发酵底物经干燥,粉碎至80目备用。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
瘤胃液供体牛为3头体重500 kg左右、安装有永久性瘤胃瘘管的健康延边黄牛。瘘管牛在采集瘤胃液前预饲2周,饲粮成分与试验底物饲粮成分相同。瘘管牛每日饲喂2次(08:00和17:00),自由饮水。
1.2.2 试验设计体外产气试验:采用单因素试验设计,以粉碎为80目的基础饲粮200 mg为发酵底物,然后分别添加0(对照组)、0.2%(T1)、0.8%(T2)、1.2%(T3)、2.0%(T4)(干物质基础)的辛酸、癸酸和月桂酸。每个MCFAs有5组,每组有3个平行。发酵48 h时终止发酵,测定产气参数及发酵参数等指标,发酵期间记录各组产气量变化情况。
体外消化试验:与体外产气试验相似,采用单因素试验设计,以粉碎为80目的基础饲粮1 g为发酵底物,然后分别添加0(对照组)、0.2%(T1)、0.8%(T2)、1.2%(T3)、2.0%(T4)(干物质基础)的辛酸、癸酸和月桂酸。每个MCFAs有5组,每组有3个平行。发酵48 h时终止发酵,进行体外消化率指标的测定。
1.2.3 瘤胃液体外发酵体外发酵采用Menke等[10]体外发酵法进行。在晨饲前采集3头瘘管牛的瘤胃液,混匀后用4层纱布过滤,在39 ℃培养液分装系统中预热并与经CO2饱和的人工唾液以1:2的比例混合,制成混合人工瘤胃培养液,同时通入二氧化碳(CO2)。
体外产气试验:试验前1晚将200 mg发酵底物称好后装入人工瘤胃培养管中,用自动分液器向提前39 ℃预热的(最小刻度1 mL)人工瘤胃培养管中加入30 mL混合人工瘤胃培养液,混匀后读取刻度,然后迅速放入已预热(39 ℃)的恒温水浴培养箱中培养。
体外消化试验:试验前1晚将1 g发酵底物称好后倒入纤维滤袋中用封口机封口并装入体外消化率培养管中,用自动分液器向提前39 ℃预热的体外消化率培养管中加入70 mL混合人工瘤胃培养液,混匀后迅速放入已预热(39 ℃)的恒温水浴培养箱中培养。
1.3 测定指标 1.3.1 净产气量及产气参数当培养至2、4、6、8、10、12、16、20、24、30、36、48 h时,取出人工瘤胃培养管并对活塞底部与培养管刻度重叠处的刻度值(mL)进行记录,计算各时间段的净产气量。

|
根据France等[11]和Ørskov等[12]提出的产气模型:
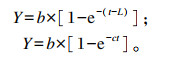
|
式中:Y为发酵底物在t时间点的产气量(mL);b为潜在产气量(mL);c为发酵底物产气速度(mL/h);t为培养时间(h);L为产气延滞时间(h)。利用SPSS 21.0统计软件中非线性(nonlinear)回归程序进行产气参数估算。
1.3.2 发酵48 h甲烷产量在发酵48 h后,将培养管放入冰水浴中终止发酵,立即采集发酵气体。利用气相色谱仪测定气体中甲烷的含量[13]。
1.3.3 瘤胃原虫计数计数前先配制好染色液即MFS溶液(35%福尔马林100 mL,NaCl 8 g,甲基绿0.6 g,用蒸馏水定容至1 000 mL)。取48 h发酵后的瘤胃液滤液1 mL加入MFS染色液1 mL混匀,用血球计数板在显微镜下计数[14]。
1.3.4 48 h发酵液发酵参数发酵48 h后,将人工瘤胃培养管取出放入冰水中终止发酵,迅速排出培养管中的发酵液,使用快速pH测定仪测定发酵液pH;参考Wang等[15]的方法测定挥发性脂肪酸(VFA)含量;参考冯宗慈等[16]的方法测定发酵液中氨态氮(NH3-N)的含量。参考杨平平等[17]的方法测定发酵液中乳酸的含量。
1.3.5 有机物消化率(OMD)、代谢能(ME)值及瘤胃微生物蛋白(MCP)产量OMD、ME及MCP产量计算参考Menke等[18]的方法,根据产气量估算,计算公式如下:

|
式中:GP为24 h的净产气量(mL/200 mg DM);CP为粗蛋白质含量(%);A为粗灰分含量(%), 下式同。
MCP根据每千克可消化有机物(DOM)可产生19.3 g微生物氮求得,计算公式如下:
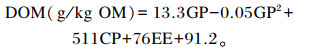
|
式中:EE为粗脂肪含量(%)。
1.3.6 体外消化率的测定体外消化试验培养48 h后,将体外消化培养管放入冰水浴中终止发酵,瘤胃液装入离心管中-80 ℃保存。取出纤维滤袋用蒸馏水清洗后置于烘箱内,105 ℃烘干12~24 h得干物质重,用于计算干物质体外消化率(IVDMD)。粗蛋白质(CP)的含量利用FOSS-8400全自动凯氏定氮仪进行测定;中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)的含量利用国标中的方法进行测定[19-20]。采用以下公式计算DM和各种营养物质的体外消化率:

|
试验数据用SPSS 21.0进行单因素方差分析,用Duncan氏法进行多重比较,并对不同添加量的MCFAs对体外瘤胃发酵参数的影响采用线性(L)和二次曲线(Q)比较,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果 2.1 产气量及产气参数由表 2可知,各时间点辛酸和癸酸各试验组的产气量与对照组相比均无显著差异(P>0.05);月桂酸T2~T4组产气量从24 h开始与对照组相比显著降低(P<0.05),且在24、36 h随着月桂酸添加量的增加,产气量呈先降低后升高的二次曲线变化(P<0.05)。
|
|
表 2 不同添加量、种类的MCFAs对中精粗比饲粮体外产气量的影响 Table 2 Effects of different dosages and types of MCFAs on in vitro gas production of diet with medium concentrate to forage ratio |
由表 3可知,辛酸各组产气参数指标与对照组相比无显著差异(P>0.05);癸酸T4组理论最大产气量和T3组产气速率与对照组相比显著降低(P<0.05),且随着癸酸添加量的增加分别呈先升高后降低和先降低后升高的二次曲线变化(P<0.05);月桂酸各试验组理论最大产气量与对照组相比显著降低(P<0.05),产气延滞时间随着月桂酸添加量的增加呈线性下降(P<0.05)。
|
|
表 3 不同添加量、种类的MCFAs对中精粗比饲粮体外产气参数的影响 Table 3 Effects of different dosages and types of MCFAs on in vitro gas production parameters of diet with medium concentrate to forage ratio |
由表 4可知,辛酸T3、T4组能够显著降低瘤胃原虫数量(P<0.05),随着3种MCFAs添加量的增加,甲烷产量和瘤胃原虫数量呈线性下降(P<0.05)。
|
|
表 4 不同添加量、种类的MCFAs对中精粗比饲粮体外发酵甲烷产量和瘤胃原虫数量的影响 Table 4 Effects of different dosages and types of MCFAs on in vitro fermentation methane production and the number of rumen protozoa of diet with medium concentrate to forage ratio |
由表 5可知,辛酸各试验组pH及氨态氮、乳酸含量与对照组相比均无显著差异(P>0.05),各组间总挥发性脂肪酸、乙酸、丙酸、戊酸等含量均无显著差异(P>0.05),但丁酸含量随着辛酸添加量的增加呈先升高后降低的二次曲线变化(P<0.05)。癸酸T2~T4组氨态氮含量与对照组相比显著降低(P<0.05),且随着癸酸添加量的增加呈线性下降(P<0.05),T3、T4组乳酸含量与对照组相比显著降低(P<0.05),各组间总挥发性脂肪酸及乙酸、丙酸、丁酸等含量均无显著差异(P>0.05)。月桂酸T2、T3、T4组pH、各试验组氨态氮含量及T4组丁酸含量与对照组相比显著降低(P<0.05),且随着月桂酸添加量的增加呈线性下降(P<0.05),各试验组丙酸含量与对照组相比显著升高(P<0.05),且随着月桂酸添加量的增加呈线性上升(P<0.05)。
|
|
表 5 不同添加量、种类的MCFAs对中精粗比饲粮体外48 h发酵参数的影响 Table 5 Effects of different dosages and types of MCFAs on in vitro 48 h fermentation parameters of diet with medium concentrate to forage ratio |
由表 6可知,辛酸和癸酸各试验组OMD、ME值及MCP产量与对照组相比均无显著差异(P>0.05);月桂酸各试验组OMD、ME值及MCP产量与对照组相比显著降低(P<0.05),且随着月桂酸添加量的增加呈线性下降(P<0.05)。
|
|
表 6 不同添加量、种类的MCFAs对中精粗比饲粮体外发酵OMD、ME值及MCP产量的影响 Table 6 Effects of different dosages and types of MCFAs on OMD, ME value and MCP production in vitro fermentation of diet with medium concentrate to forage ratio |
由表 7可知,辛酸、癸酸和月桂酸各试验组的IVDMD、IVNDFD和IVADFD与对照组相比均无显著差异(P>0.05),IVCPD与对照组相比显著降低(P<0.05),且随着辛酸添加量的增加呈先降低后升高的二次曲线变化(P<0.05),随着癸酸和月桂酸添加量的增加呈线性下降(P<0.05)。
|
|
表 7 不同添加量、种类的MCFAs对中精粗比饲粮营养物质体外消化率的影响 Table 7 Effects of different dosages and types of MCFAs on nutrient in vitro digestibility of diet with medium concentrate to forage ratio |
产气量可以综合反映瘤胃微生物的生长情况[21],是评价体外发酵效果的重要指标。本试验中,辛酸和癸酸各试验组的产气量与对照组相比均无显著差异,月桂酸各试验组产气量在产气中后期与对照组相比显著降低。张雨等[22]的试验也表明,体外发酵产气量随椰子油(主要成分为月桂酸)添加水平的增加呈线性降低。本试验中,月桂酸组瘤胃原虫数量的降低可能是导致其产气量下降的原因之一。同时,体外发酵时产生气体的成分主要是甲烷(CH4)和CO2,因此试验组甲烷产量的下降也可能导致月桂酸组产气量的降低。
产气延滞时间的降低有利于饲粮在瘤胃中的降解[18]。在本研究中,虽然辛酸、癸酸和月桂酸各组间产气延滞时间无显著差异,但T4组与其余各组相比均有数值上的降低,说明高添加量的MCFAs对底物的利用产生了积极影响。
3.2 甲烷产量和瘤胃原虫数量反刍动物瘤胃微生物发酵碳水化合物产生甲烷,不但会加剧全球的温室效应,而且会降低反刍动物对饲粮的利用率[23]。现在已经得到证实,中链饱和脂肪酸能够对甲烷产生抑制作用是因为它们能够直接抑制瘤胃原虫。脂肪酸对多种细菌和原虫都有显著的毒性作用[24]。原虫细胞膜内壁的脱氢酶可催化产生氢分子附着在原虫上,并被寄生在原虫上的甲烷菌利用生成甲烷[25]。原虫被抑制后,影响了氢的生成,从而降低了甲烷产量[25-26]。研究表明,在水牛、羔羊和育肥小母牛的饲粮中添加椰子油能够减少瘤胃原虫数量并降低甲烷产量[27-28]。本研究发现,辛酸、癸酸和月桂酸各试验组都能在不同程度上降低瘤胃原虫数量和甲烷产量。这些试验结果均表明,MCFAs可作为反刍动物有效的甲烷抑制剂。
3.3 48 h发酵参数反刍动物瘤胃内pH变化范围为5.5~7.5,pH反映了饲粮在反刍动物瘤胃中发酵水平及瘤胃内微生物的活性状况[29]。本试验中,月桂酸T3、T4组的pH显著降低,但其值都在正常范围(6.56~6.69)内,对微生物的生长和营养物质的降解不会产生负面影响。这与李文婷[30]的月桂酸能显著降低湖羊瘤胃液pH研究结果一致。
瘤胃中NH3-N的适宜含量为10~50 mg/dL[31]。本试验中,各组NH3-N含量均在20~35 mg/dL,属于正常水平。有研究发现,原虫对其吞噬的氮仅能利用50%,而剩余的氮会在蛋白酶和肽酶的作用下以短肽和氨基酸的形式排出,所以瘤胃原虫减少后会使瘤胃氨的产生下降,导致NH3-N的含量降低[32]。本试验中,癸酸和月桂酸试验组的NH3-N含量与对照组相比显著降低。在羔羊上的研究表明,当饲粮中添加75 g/kg的椰子油时瘤胃NH3-N含量显著低于未添加椰子油的对照组[33]。Priambodo[8]的研究结果也表明,在中精粗比饲粮条件下,MCFAs会使NH3-N的含量显著降低。
通常情况下,瘤胃内乳酸的含量应该在1 mmol/L(18 mg/dL)以下[34]。本研究中,各试验组乳酸含量在0.5~1.1 mg/dL,均符合标准。目前未见有关MCFAs对瘤胃内乳酸含量影响的报道,本试验中,癸酸和月桂酸T4组乳酸含量分别降低了19.46%和33.73%,因此可以推测在中精粗比饲粮中添加MCFAs可能会起到抑制瘤胃乳酸生成的作用,有助于缓解或减少瘤胃酸中毒的发生。
挥发性脂肪酸是反刍动物瘤胃营养物质消化代谢的终产物,通常乙酸占主导地位,其次是丙酸和丁酸[35]。目前,有关MCFAs对瘤胃挥发性脂肪酸的影响报道相对较少。李文婷[30]对湖羊进行体外发酵试验的结果表明,试验组间总挥发性脂肪酸含量差异不显著,但与对照组相比,月桂酸组丙酸含量显著升高。有研究者认为,原虫的数量有可能会改变挥发性脂肪酸的组成,丙酸含量的增加可能是由于原虫被抑制后与甲烷菌之间的种间氢转移受到影响,从而使更多的氢被利用到丙酸生成途径中[36]。瘤胃中丙酸比例越高,可供机体利用的能量就越高[37]。本试验中,辛酸和癸酸组的总挥发性脂肪酸、乙酸和丙酸含量等主要指标与对照组相比差异均不显著,月桂酸各试验组丙酸含量与对照组相比显著上升,T3、T4组的乙丙比在数值上有所降低,说明高添加量月桂酸可能使瘤胃发酵向丙酸型发酵转化。体内的研究结果也表明,在水牛的饲粮中添加椰子油后瘤胃乙酸含量和乙丙比降低,丙酸含量升高[27]。
3.4 OMD、ME值及MCP产量和营养物质体外消化率本研究中通过发酵24 h的产气量预测了MCFAs对发酵底物OMD、ME值及MCP产量的影响。结果表明,辛酸和癸酸各试验组的OMD、ME值及MCP产量与对照组相比均无显著差异。月桂酸各试验组的OMD、ME值及MCP产量与对照组相比显著降低,这可能与月桂酸各试验组24 h产气量降低有关。虽然OMD、ME值及MCP产量可以间接地对添加剂的使用效果进行预测,但是体外产气只有气体的物理累积量,而不能反映体内气体不断外排及交换的动态变化,因此仅通过预测值并不能完全真实地反映其在体内实际的应用效果。因此,有必要进一步开展体内的研究。
饲粮消化率与体外瘤胃发酵产气量具有高度相关性,数值越高表明饲粮在瘤胃中的降解程度越高[38-39]。有研究表明,在含5%脂肪的羊羔基础饲粮中加入玉米油、戊酸、月桂酸等脂肪酸可明显降低营养物质的消化率[40]。但也有研究表明,水牛饲粮中添加5%椰子油对营养物质消化率无显著影响,但7%添加量时纤维的消化率降低[27, 41]。本试验中,各试验组的IVCPD与对照组相比均显著降低,其余各体外消化率指标与对照组相比无显著差异。在瘤胃发酵过程中,饲粮中绝大多数蛋白质在瘤胃内被降解,只有小部分蛋白质能进入小肠并被吸收,即过瘤胃蛋白,其含量的增多有利于更多的优质蛋白质进入小肠并提高动物的生产性能[42-44]。本试验结果表明,MCFAs可能对进入瘤胃蛋白有一定保护的作用,其有利于增加过瘤胃蛋白的含量。尽管如此,对其保护蛋白质的作用还需开展更多研究。
4 结论在本试验条件下,不同种类及添加量的MCFAs对瘤胃液体外发酵参数均有一定程度的改善,但其效果存在一定的差异。其中,辛酸能够降低甲烷产量和瘤胃原虫数量,以2.0%添加量的体外发酵效果好;癸酸能够降低甲烷产量、瘤胃原虫数量、NH3-N和乳酸含量,以2.0%添加量的体外发酵效果好;月桂酸能够降低甲烷产量、瘤胃原虫数量、NH3-N、乳酸含量和乙丙比,升高丙酸含量并影响发酵模式,以1.2%添加量的体外发酵效果好。
| [1] |
冯鑫, 张洛萌, 栾嘉明, 等. 中链脂肪酸在动物生产中的应用效果及其影响因素研究进展[J]. 中国畜牧兽医, 2020, 47(6): 1739-1749. FENG X, ZHANG L M, LUAN J M, et al. Advance on application and influence factors of medium chain fatty acids in animal production[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(6): 1739-1749 (in Chinese). |
| [2] |
GENG C Y, YANG L Y, JI S, et al. Effect of ADY and YC on concentration of ruminal medium chain fatty acid, lactic acid, ethanol and relative abundance of bacteria in beef cattle[J]. International Journal of Agriculture & Biology, 2021, 25(2): 455-459. |
| [3] |
BEAUCHEMIN K A, KREUZER M, O'MARA F, et al. Nutritional management for enteric methane abatement: a review[J]. Australian Journal of Experimental Agriculture, 2008, 48(2): 21-27. DOI:10.1071/EA07199 |
| [4] |
MARTIN C, MORGAVI D P, DOREAU M. Methane mitigation in ruminants: from microbe to the farm scale[J]. Animal, 2010, 4(3): 351-365. DOI:10.1017/S1751731109990620 |
| [5] |
HANCZAKOWSKA E, ŚWIATKIEWICZ M, HANCZAKOWSKI P, et al. Medium-chain fatty acids as feed supplements for weaned piglets[J]. Medycyna Weterynaryjna, 2010, 66(5): 331-334. |
| [6] |
马允莉. 中链脂肪酸对鸡的影响[J]. 饲料研究, 1997(3): 29-30. MA Y L. Effects of medium chain fatty acids on chickens[J]. Feed Research, 1997(3): 29-30 (in Chinese). |
| [7] |
DOHME F, MACHMVLLER A, WASSERFALLEN A, et al. Ruminal methanogenesis as influenced by individual fatty acids supplemented to complete ruminant diets[J]. Letters in Applied Microbiology, 2001, 32(1): 47-51. DOI:10.1046/j.1472-765x.2001.00863.x |
| [8] |
PRIAMBODO T W. Effect of medium-chain fatty acids and ration type on in vitro ruminal methane production[D]. Ph. D. Thesis. Bonn: Rheinische Friedrich-Wilhelms-Universität Bonn, 2014.
|
| [9] |
中华人民共和国农业部. 肉牛饲养标准: NY/T 815—2004[S]. 北京: 中国农业出版社, 2004. Ministry of Agriculture of the PRC. Feeding standard of beef cattle: NY/T 815—2004[S]. Beijing: China Agriculture Press, 2004. (in Chinese) |
| [10] |
MENKE K H, STEINGASS H. Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid[J]. Animal Research and Development, 1988, 28: 7-55. |
| [11] |
FRANCE J, DIJKSTRA J, DHANOA M S, et al. Estimating the extent of degradation of ruminant feeds from a description of their gas production profiles observed in vitro: derivation of models and other mathematical considerations[J]. British Journal of Nutrition, 2000, 83(2): 143-150. DOI:10.1017/S0007114500000180 |
| [12] |
ØRSKOV E R, MCDONALD I. The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage[J]. The Journal of Agricultural Science, 1979, 92(2): 499-503. DOI:10.1017/S0021859600063048 |
| [13] |
胡伟莲, 王佳堃, 吕建敏, 等. 瘤胃体外发酵产物中的甲烷和有机酸含量的快速测定[J]. 浙江大学学报(农业与生命科学版), 2006, 32(2): 217-221. HU W L, WANG J K, LYU J M, et al. Rapid gas chromatogram determination of methane, organic acid in in vitro ruminal fermentation products[J]. Journal of Zhejiang University(Agriculture & Life Sciences), 2006, 32(2): 217-221 (in Chinese). DOI:10.3321/j.issn:1008-9209.2006.02.020 |
| [14] |
牛晓雨, 李大彪, 丽丽, 等. 单宁对绵羊瘤胃原虫数量和种群多样性的影响[J]. 动物营养学报, 2021, 33(3): 1783-1791. NIU X Y, LI D B, LI L, et al. Effects of tannin on rumen protozoa number and population diversity in sheep[J]. Chinese Journal of Animal Nutrition, 2021, 33(3): 1783-1791 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.03.059 |
| [15] |
WANG M, WANG R, TANG S X, et al. Comparisons of manual and automated incubation systems: effects of venting procedures on in vitro ruminal fermentation[J]. Livestock Science, 2016, 184: 41-45. DOI:10.1016/j.livsci.2015.12.002 |
| [16] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010, 31(Z1): 37. FENG Z C, GAO M. Improvement of the method for determination of ammonia-nitrogen content in rumen fluid by colorimetry[J]. Animal Husbandry and Feed Science, 2010, 31(Z1): 37 (in Chinese). |
| [17] |
杨平平, 甄玉国, 郑艳秋, 等. 优化对羟基联苯法定量测定瘤胃液中乳酸含量[J]. 畜牧与饲料科学, 2013, 34(2): 1-2, 5. YANG P P, ZHEN Y G, ZHENG Y Q, et al. Optimization on determination of lactic acid content in rumen fluid by p-hydroxybiphenol colorimetry[J]. Animal Husbandry and Feed Science, 2013, 34(2): 1-2, 5 (in Chinese). |
| [18] |
MENKE K H, RAAB L, SALEWSKI A, et al. The estimation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas production when they are incubated with rumen liquor in vitro[J]. The Journal of Agricultural Science, 1979, 93(1): 217-222. DOI:10.1017/S0021859600086305 |
| [19] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中中性洗涤纤维(NDF) 的测定: GB/T 20806—2006[S]. 北京: 中国标准出版社, 2006. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. Determination of neutral detergent fiber in feedstuffs: GB/T 20806—2006[S]. Beijing: Standards Press of China, 2006. (in Chinese) |
| [20] |
中华人民共和国农业部. 饲料中酸性洗涤纤维的测定: NY/T 1459—2007[S]. 北京: 中国农业出版社, 2007. Ministry of Agriculture of the PRC. Determination of acid detergent fiber in feedstuff (ADF): NY/T 1459—2007[S]. Beijing: China Agriculture Press, 2007. (in Chinese) |
| [21] |
张婷, 张彬, 张佩华, 等. 不同能量水平及玉米加工饲粮对瘤胃体外发酵参数的影响[J]. 草业学报, 2015, 24(12): 102-111. ZHANG T, ZHANG B, ZHANG P H, et al. Effects of different energy levels and corn processing diets on ruminal fermentation parameters in vitro[J]. Acta Prataculturae Sinica, 2015, 24(12): 102-111 (in Chinese). |
| [22] |
张雨, 施力光, 荀文娟, 等. 体外产气法研究椰子油对瘤胃发酵、菌群数量及酶活性的影响[J]. 中国畜牧杂志, 2019, 55(5): 66-71. ZHANG Y, SHI L G, XUN W J, et al. Effects of coconut oil supplementation on rumen fermentation, bacteria abundance and enzyme activity in vitro[J]. Chinese Journal of Animal Science, 2019, 55(5): 66-71 (in Chinese). |
| [23] |
JOHNSON K A, JOHNSON D E. Methane emissions from cattle[J]. Journal of Animal Science, 1995, 73(8): 2483-2492. |
| [24] |
GALBRAITH H, MILLER T B, PATON A M, et al. Antibacterial activity of long chain fatty acids and the reversal with calcium, magnesium, ergocalciferol and cholesterol[J]. The Journal of Applied Bacteriology, 1971, 34(4): 803-813. |
| [25] |
VOGELS G D, HOPPE W F, STUMM C K. Association of methanogenic bacteria with rumen ciliates[J]. Applied Environmental Microbiology, 1980, 40(3): 608-612. |
| [26] |
NEWBOLD C J, LASSALAS B, JOUANY J P. The importance of methanogens associated with ciliate protozoa in ruminal methane production in vitro[J]. Letters in Applied Microbiology, 1995, 21(4): 230-234. |
| [27] |
KONGMUN P, WANAPAT M, PAKDEE P, et al. Manipulation of rumen fermentation and ecology of swamp buffalo by coconut oil and garlic powder supplementation[J]. Livestock Science, 2011, 135(1): 84-92. |
| [28] |
LOVETT D, LOVELL S, STACK L, et al. Effect of forage/concentrate ratio and dietary coconut oil level on methane output and performance of finishing beef heifers[J]. Livestock Production Science, 2003, 84(2): 135-146. |
| [29] |
CALSAMIGLIA S, FERRET A, DEVANT M. Effects of pH and pH fluctuations on microbial fermentation and nutrient flow from a dual-flow continuous culture system[J]. Journal of Dairy Science, 2002, 85(3): 574-579. |
| [30] |
李文婷. 月桂酸与亚麻酸对瘤胃甲烷生成及甲烷菌作用效果比较研究[D]. 硕士学位论文. 杭州: 浙江大学, 2008. LI W T. Comparison of effects of lauric acid and linolenic acid on rumen methanogenesis and methanogens[D]. Master's Thesis. Hangzhou: Zhejiang University, 2008. (in Chinese) |
| [31] |
韩正康, 陈杰. 反刍动物瘤胃的消化和代谢[M]. 北京: 科学出版社, 1988. HAN Z K, CHEN J. Digestion and metabolism in the rumen of ruminants[M]. Beijing: Science Press, 1988 (in Chinese). |
| [32] |
ITABASHI H, KOBAYASHI T, MATSUMOTO M. The effects of rumen ciliate protozoa on energy metabolism and some constituents in rumen fluid and blood plasma of goats[J]. Nihon Chikusan Gakkaiho, 1984, 55(4): 248-256. |
| [33] |
BHATT R S, SOREN N M, TRIPATHI M K, et al. Effects of different levels of coconut oil supplementation on performance, digestibility, rumen fermentation and carcass traits of Malpura lambs[J]. Animal Feed Science and Technology, 2011, 164(1/2): 29-37. |
| [34] |
张琪, 欧阳克蕙, 瞿明仁, 等. 反刍动物瘤胃内乳酸代谢的研究进展[J]. 饲料研究, 2013(10): 24-28. ZHANG Q, OUYANG K H, QU M R, et al. Research progress of lactic acid metabolism in ruminants[J]. Feed Research, 2013(10): 24-28 (in Chinese). |
| [35] |
李旺. 瘤胃挥发性脂肪酸的作用及影响因素[J]. 中国畜牧杂志, 2012, 48(7): 63-66. LI W. The effect and influence factors of rumen volatile fatty acid[J]. Chinese Journal of Animal Science, 2012, 48(7): 63-66 (in Chinese). |
| [36] |
MCALLISTER T A, CHENG K J, OKINE E K, et al. Dietary, environmental and microbiological aspects of methane production in ruminants[J]. Canadian Journal of Animal Science, 1996, 76(2): 231-243. |
| [37] |
李宗军. 瘤胃丙酸发酵的增强策略及其对碳水化合物代谢的动态影响[D]. 博士学位论文. 杨凌: 西北农林科技大学, 2018. LI Z J. The ruminal manipulation strategies for enhancing propionate fermentation and their dynamic effects on carbohydrate metabolism[D]. Ph. D. Thesis. Yangling: Northwest Agriculture and Forestry University, 2018. (in Chinese) |
| [38] |
徐子萱, 李冬芳, 于春微, 等. 微生物发酵饲料对奶牛瘤胃发酵功能及饲粮营养物质体外消化率的影响[J]. 动物营养学报, 2021, 33(3): 1513-1522. XU Z X, LI D F, YU C W, et al. Effects of microbial fermented feed on rumen fermentation function of dairy cows and nutrient in vitro digestibilities of diets[J]. Chinese Journal of Animal Nutrition, 2021, 33(3): 1513-1522 (in Chinese). |
| [39] |
冯建芳. 不同粗饲料组合饲粮对奶牛瘤胃发酵、养分消化率及生产性能的影响[D]. 硕士学位论文. 保定: 河北农业大学, 2017. FENG J F. Effects of different roughage combination diets on rumen fermentation, nutrient digestibility and production performance of dairy cows[D]. Master's Thesis. Baoding: Hebei Agricultural University, 2017. (in Chinese) |
| [40] |
郝正里, 刘世民, 孟宪政. 反刍动物营养学[M]. 兰州: 甘肃民族出版社, 2000. HAO Z L, LIU S M, MENG X Z. Ruminant Nutrition[M]. Lanzhou: Gansu Nationalities Press, 2000 (in Chinese). |
| [41] |
PILAJUN R, WANAPAT M. Effect of coconut oil and mangosteen peel supplementation on ruminal fermentation, microbial population, and microbial protein synthesis in swamp buffaloes[J]. Livestock Science, 2011, 141(2/3): 148-154. |
| [42] |
ALI C S, DIN I, SHARIF M, 等. 过瘤胃蛋白和氨基酸对奶牛、绵羊干物质采食量、消化率和生长性能的影响[J]. 饲料与畜牧, 2011(3): 44-48. ALI C S, DIN I, SHARIF M, et al. Effects of rumen-protected protein and amino acids on dry matter intake, digestibility and growth performance of dairy cows and sheep[J]. Feed and Husbandry, 2011(3): 44-48 (in Chinese). |
| [43] |
国春艳, 刁其玉. 过瘤胃蛋白质饲料保护技术研究进展[J]. 饲料与畜牧, 2009(5): 27-29. GUO C Y, DIAO Q Y. Progress of rumen escape protein[J]. Feed and Husbandry, 2009(5): 27-29 (in Chinese). |
| [44] |
王玲, 杨璐玲, 吕永艳, 等. 提高饲料过瘤胃蛋白率的技术措施[J]. 饲料博览, 2014(8): 26-31. WANG L, YANG L L, LYU Y Y, et al. The technical measures to improve the rate of rumen bypass protein in feed[J]. Feed Review, 2014(8): 26-31 (in Chinese). |




