2. 云南省高校高原渔业资源保护与可持续利用重点实验室, 昆明 650201;
3. 内江师范学院, 长江上游鱼类资源保护与利用四川省重点实验室, 内江 641112
2. Key Laboratory of Protection and Sustainable Utilization of Plateau Fishery Resources in University of Yunnan Province, Kunming 650201, China;
3. Key Laboratory of Sichuan Province for Fishes Conservation and Utilization in the Upper Reaches of the Yangtze River, Neijiang Normal University, Neijiang 641112, China
浅色黄姑鱼(Nibea coibor)俗名白奈、金丝,属于鲈形目(Perciformes)、石首鱼科(Sciaenidae)、黄姑鱼属(Nibea),是我国东南沿海地区一种重要的海洋产胶鱼类和海水养殖品种[1]。浅色黄姑鱼具有较大的鱼鳔,鱼鳔可加工成高档鱼胶,在我国东南沿海地区,特别是香港、广东、福建等地具有较大的贸易规模[2-3]。鱼胶富含胶原蛋白(占干重的60%以上),营养价值极高,与燕窝、鱼翅齐名,系“海洋八珍”之一,又有“海洋人参”之誉[4]。近年来,随着人们对鱼胶营养和保健价值的认识,市场上对鱼胶的需求日益旺盛,据不完全统计,2019年全国鱼胶产量7 423 t,产值近200亿元,且有逐年上涨趋势。因此,开展浅色黄姑鱼鱼鳔胶原蛋白代谢的研究,对提高鱼胶品质和产量具有重要理论意义和广阔的市场前景。
胶原蛋白中含有多种人体必需的氨基酸,其代谢副产物参与重要的生命活动,在细胞的营养物质吸收转运、细胞分裂增殖、免疫和抗癌等方面均发挥着重要作用[5]。目前对胶原蛋白结构和功能研究比较多,其化学结构独具特点,甘氨酸(Gly)、脯氨酸(Pro)和羟脯氨酸(Hyp)以三肽形式(Gly-Pro-Y和Gly-X-Hyp,其中X和Y可以是任意的氨基酸)重复构建成前体胶原蛋白多肽链[6]。Pro及其衍生物Hyp占胶原蛋白氨基酸总量的25%,对胶原蛋白的合成、结构和机械力至关重要[7-8]。据报道,Pro可以调控胶原蛋白的合成,促进损伤组织的修复[9];特别是机体处于应激、受伤、妊娠或产后等状态下,对Pro的要求会急剧增加,且因自身内源性合成Pro不足,往往需要在饮食中提供额外的Pro来满足机体的需要,如补充Pro的前体氨基酸(精氨酸和鸟氨酸)及其衍生物Hyp,从而增加细胞外基质胶原蛋白的沉积,促进伤口愈合[10]。有研究指出,鱼类内源合成的Pro无法满足鱼类最适生长、胶原蛋白合成及饲料效率[6]。由此可见,鱼鳔中富含胶原蛋白,Pro作为胶原蛋白合成的底物,但目前鲜有关于Pro对鱼鳔胶原蛋白代谢影响的研究。因此,本试验通过在饲料中梯度添加Pro,探讨Pro对浅色黄姑鱼胶原蛋白沉积及相关基因表达的影响,分析饲料中Pro最适添加量,以期为浅色黄姑鱼功能性饲料的开发奠定理论基础,并为研究胶原蛋白代谢的营养调控提供新思路和新方法。
1 材料与方法 1.1 试验饲料本试验所用饲料以鱼粉、晶体氨基酸为主要蛋白质源,鱼油为主要脂肪源。参考其他鱼类Pro需求量[11],本试验饲料中Pro的添加水平分别为0、5、10、15、20和25 g/kg,用丙氨酸来平衡饲料中的总氨基酸水平,并参照NRC(2011)中大黄鱼的营养需求设计其他营养成分的含量,饲料组成及营养水平见表 1,饲料氨基酸组成见表 2。饲料原料过60目筛,经充分彻底混合,用2.5 mm直径的膨化机制粒,在自然通风环境中风干,干颗粒饲料被密封在塑料袋中,于-20 ℃存储直至使用。
|
|
表 1 饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of diets (air-dry basis) |
|
|
表 2 饲料氨基酸组成(干物质基础) Table 2 Amino acid composition of diets (DM basis) |
养殖试验在汕头大学海洋生物临海实验站进行,浅色黄姑鱼购自当地的一个苗种孵化场。试验鱼暂养2周(粗蛋白质40.0%、粗脂肪10.0%,揭阳通威饲料有限公司,中国)使鱼情稳定。选取450尾体重为(8.64±0.14) g的试验鱼,随机平均分入18个网箱(1.0 m×1.0 m×1.5 m,长×宽×深),每个网箱25尾,以3个网箱(重复)为一组被随机分配到6个饲料处理中。试验期8周。饲养期内,每天人工饱食投喂2次(07:00和16:30),观察并记录饲料投喂量、鱼的健康状况及环境变化等。养殖环境中温度为23~30 ℃,pH为7.8~8.1,氨氮浓度低于0.05 mg/L,盐度为31~33 g/L,溶解氧浓度为5.2~6.0 mg/L。
1.3 样品采集养殖试验结束后,禁食24 h,采用丁香酚(1 ∶ 10 000,纯度99%,上海实验试剂有限公司,中国)麻醉,称重并计数,计算鱼的生长和饲料利用率。随机选取6尾/网箱测量个体体重、体长,并用于血液样本的采集。血浆利用含抗凝剂(肝素钠)的采血管静脉抽取后,静置低温离心(4 000 r/min,10 min,4 ℃),分离上层淡黄色液体(血浆),存于-80 ℃直至后续检测。经采血后的试验鱼用于屠宰,取肝脏和鱼鳔,存于-20 ℃直至后续测定胶原蛋白含量和氨基酸组成。另取试验鱼6尾/网箱,迅速分离鱼鳔组织样本,置入液氮速冻,后存于-80 ℃直至后续RNA的提取和基因表达分析。
1.4 测定指标及方法 1.4.1 生长性能

|
采用Hyp测定试剂盒(Art. No. A030-2;南京建成生物工程研究所,中国),按照操作说明书对样品进行前处理。使用Infinite® Pro 200酶标仪(Tecan,瑞士)分析样品,在550 nm波长下测定吸光度,Hyp含量利用标准品根据标准曲线及公式计算得到。Hyp含量在胶原蛋白中相对固定为12.5%,常用Hyp的含量来计算组织中胶原蛋白含量(AOAC, 2002):
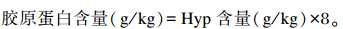
|
饲料和鱼鳔组织中氨基酸组成采用TSQ-Endura液相色谱-质谱联用仪(Thermo Scientific Dionex,美国),根据国标(GB/T 18246—2000)进行测定。首先测得每种氨基酸的单一峰,根据出峰时间和峰高计算出峰面积,结合标准品氨基酸测得的标准曲线(含量为横轴,峰面积为纵轴),计算出单一氨基酸在样品中的绝对含量。然后根据样品处理过程中的稀释倍数,计算出干物质中氨基酸的含量。由于色氨酸在酸水解过程中被破坏,因此,无法测定出色氨酸的数值。
1.4.4 胶原蛋白代谢相关基因相对表达量鱼鳔组织中总RNA提取根据Trizol(InvitrogenTM,美国)试剂说明书使用氯仿-异丙醇法提取,利用脱氧核糖核酸酶Ⅰ消化去除基因组DNA(TaKaRa,大连),通过1.2%(质量体积分数)琼脂糖凝胶分析确定其完整性和质量,利用Nanodrop® ND-2000分光光度计(Thermo Scientific NanoDrop,美国)测定260 nm/280 nm处的吸光度,确定RNA的最终浓度。使用TransScript® One-Step gDNA Removal和cDNA Synthesis Super-Mix Kit(Trans Gen,北京)将总RNA反转录成cDNA,存于-20 ℃直至使用。利用Primer Premier 5.0软件(Premier Biosoft International, Palo Alto, 美国)根据大黄鱼(Larimichthys crocea)、鳜鱼(Siniperca chuatsi)和鲈鱼(Micropterus salmoides)等的相关基因核心序列保守区设计相关基因的特异性引物,引物均由华大基因(深圳)合成,引物序列见表 3。按如下体系配制20.0 μL的实时荧光定量PCR(qRT-PCR)混合液:2.0 μL cDNA、6.4 μL DEPC水、10.0 μL SYBR Premix Ex Taq Ⅱ(TaKaRa)和正、反引物各0.8 μL。qRT-PCR反应在Roche Light Cycler® 480 System(Roche, 瑞士)上按如下条件进行:95 ℃预热30 s,扩增按照95 ℃ 5 s、58 ℃ 20 s、72 ℃ 5 s共执行40个循环,95 ℃ 5 s、60 ℃ 15 s、95 ℃ 5 s、40 ℃ 30 s收集熔解曲线并结束反应。使用ΔΔCt相对量化法[ΔΔCt=每个样本试验组ΔCt/对照组ΔCt(试验参考)]计算基因相对表达量,相对量化的表达式2-ΔΔCt表示为试验组目标基因与对照组内参基因(β-肌动蛋白)的相对表达量。
|
|
表 3 胶原蛋白代谢相关基因的qRT-PCR引物序列 Table 3 qRT-PCR primer sequences of genes related to collagen metabolism |
所有数据均采用SPSS 20.0程序进行单因素方差分析(one-way ANOVA),并采用Tukey法进行组间显著性检验。数据以“平均值±标准误”呈现,以P < 0.05为差异显著性水平。采用折线回归分析方法,以鱼鳔胶原蛋白含量为基础,评价饲料中Pro的最佳添加水平。
2 结果与分析 2.1 饲料中添加不同水平Pro对浅色黄姑鱼生长性能的影响由表 4可知,饲料中添加不同水平Pro对浅色黄姑鱼终末体重、增重率、特定生长率、饲料系数及肥满度均无显著影响(P>0.05);各组浅色黄姑鱼存活率均≥90%,且组间无显著差异(P>0.05)。由此可以看出,试验鱼能很好地适应试验条件,没有出现重大疾病。
|
|
表 4 饲料中添加不同水平Pro对浅色黄姑鱼生长性能的影响 Table 4 Effects of different supplemental levels of Pro in diets on growth performance of Nibea coibor |
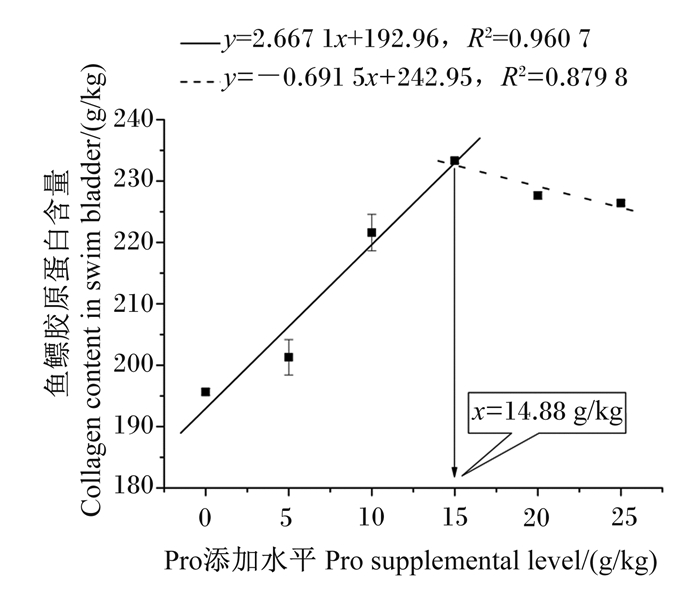
由表 5可知,浅色黄姑鱼血浆游离Hyp含量随饲料中Pro添加水平的提高而显著提高(P < 0.05),肝脏Hyp含量以及鱼鳔Hyp和胶原蛋白含量均随饲料中Pro添加水平的提高呈先升高后降低趋势(P < 0.05),且鱼鳔Hyp和胶原蛋白含量在15 g/kg Pro添加组达到最高值。以鱼鳔胶原蛋白含量评价饲料中Pro的最适添加水平,通过折线回归分析发现(图 1),浅色黄姑鱼饲料中Pro最适添加水平为14.88 g/kg。
|
|
表 5 饲料中添加不同水平的Pro对浅色黄姑鱼胶原蛋白含量的影响 Table 5 Effects of different supplemental levels of Pro in diets on collagen content of Nibea coibor |
|
图 1 采用折线回归分析浅色黄姑鱼饲料中Pro的最适添加水平 Fig. 1 Analysis of optimal supplemental level of Pro in diets for Nibea coibor by broken-line regression |
由表 6可知,浅色黄姑鱼鱼鳔中有7种氨基酸(异亮氨酸、亮氨酸、赖氨酸、组氨酸、苯丙氨酸、天冬氨酸和丙氨酸)受到饲料中Pro添加水平的显著影响(P < 0.05),其他氨基酸含量相对稳定(P>0.05)。具体表现为:异亮氨酸、亮氨酸和苯丙氨酸含量随着饲料中Pro添加水平的提高而提高,而丙氨酸含量却随着饲料中Pro添加水平的提高而降低;另外,赖氨酸和天冬氨酸含量随着饲料中Pro添加水平的提高先提高后降低,相反,组氨酸含量随着饲料中Pro添加水平的提高先降低后提高。
|
|
表 6 饲料中添加不同水平Pro对浅色黄姑鱼鱼鳔中氨基酸组成的影响(干物质基础) Table 6 Effects of different supplemental levels of Pro in diets on amino acid composition in swim bladder of Nibea coibor (DM basis) |
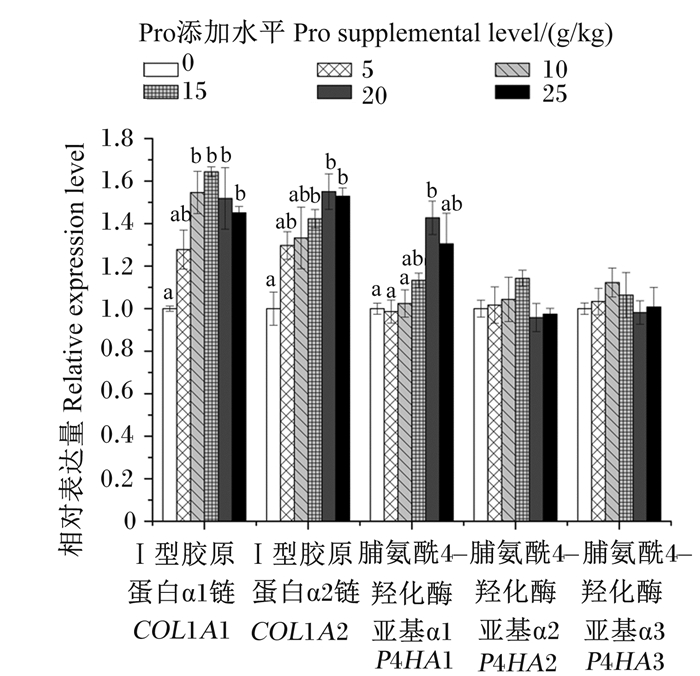
由图 2可知,饲料中添加不同水平Pro对浅色黄姑鱼鱼鳔中胶原蛋白基因和脯氨酸羟化酶基因相对表达量有显著影响(P < 0.05)。其中,Ⅰ型胶原蛋白α1链(COL1A1)和Ⅰ型胶原蛋白α2链(COL1A2)基因相对表达量随饲料中Pro添加水平的提高而提高(P < 0.05);3个脯氨酸羟化酶基因中仅脯氨酰4-羟化酶亚基α1(P4HA1)基因相对表达量受饲料中Pro添加水平的显著影响,20 g/kg Pro添加组P4HA1基因相对表达量显著高于0~15 g/kg Pro添加组(P < 0.05);此外,脯氨酰4-羟化酶亚基α2(P4HA2)和脯氨酰4-羟化酶亚基α3(P4HA3)基因表达相对稳定,不受饲料中Pro添加水平的影响(P>0.05)。
|
同一基因数据柱标记不同小写字母表示差异显著(P < 0.05)。 Value columns of the same gene with different small letters mean significant difference (P < 0.05). 图 2 饲料中添加不同水平Pro对浅色黄姑鱼胶原蛋白代谢相关基因表达的影响 Fig. 2 Effects of different supplemental levels of Pro in diets on expression of genes related to collagen metabolism of Nibea coibor |
Pro及其衍生物Hyp占胶原蛋白分子总氨基酸含量的23%[8, 12]。据报道,动物机体内源性合成的Pro无法满足其最适生长、胶原蛋白合成及饲料效率,其中包括鱼类[11]。鱼鳔富含胶原蛋白,然而,目前有关鱼鳔胶原蛋白的研究鲜有报道,Pro对鱼鳔胶原蛋白代谢的作用及其机制有待探讨。本研究旨在探讨饲料中添加Pro对浅色黄姑鱼生长及胶原蛋白代谢的影响,发现Pro对浅色黄姑鱼生长性能(包括特定生长率、饲料系数和肥满度等)的影响不显著,表明基础饲料中的Pro水平能满足鱼体的最佳生长。然而,值得注意的是,适量添加Pro显著提高了鱼鳔中胶原蛋白的含量,表明Pro作为胶原蛋白合成的底物某种程度上促进了鱼鳔胶原蛋白的合成,这较好地印证了Dabrowski等[13]的观点,也证明内源性Pro合成不能满足许多鱼类最大胶原合成的要求,因此必须在其饮食中额外补充Pro。同时,本试验也间接证实了Karna等[14]的观点,Pro对胶原蛋白代谢的作用远大于其对生长的促进作用,且Pro的可用性决定了胶原蛋白生物合成的速率。此外,本研究中浅色黄姑鱼血浆游离Hyp含量随着Pro添加水平的提高显著升高,这与Kivirikko等[15]的报道相似,因为Hyp残基是脯氨酸羟化酶对原胶原蛋白中Pro翻译后修饰时的产物,所以血浆游离Hyp含量取决于Pro的含量,同时也说明机体胶原蛋白代谢水平可能随着Pro的添加而增强。
均衡的饲料氨基酸组成是动物生长和维持机体氮平衡的关键。Li等[16]报道,机体氨基酸组成受到饲料氨基酸组成的影响。本研究发现,浅色黄姑鱼鱼鳔中有5种必需氨基酸(异亮氨酸、亮氨酸、赖氨酸、组氨酸和苯丙氨酸)和2种非必需氨基酸(天冬氨酸和丙氨酸)含量受到饲料中Pro添加水平的影响。机体必需氨基酸保留率被认为是饲料中氨基酸供应情况最敏感的指标[17],因为平衡氨基酸模式以外的过量必需氨基酸会被用于分解代谢和生产能量,从而降低了该氨基酸的保持效率[18]。氨基酸之间还存在着非常复杂的相互关系,不同物种和不同器官对氨基酸代谢的需求和速度也存在显著差异,如Pro和Hyp、精氨酸和鸟氨酸影响彼此的新陈代谢,因为这些氨基酸的代谢与Pro的代谢途径有共通之处,Pro在多胺、精氨酸、谷氨酸、Hyp和鸟氨酸的合成中起着重要作用[7],本研究仅为复杂的氨基酸代谢及其相互作用提供简单依据。
氨基酸不仅是蛋白质合成的前体分子,还可以作为信号分子介导一系列通路调控基因表达和蛋白质合成而发挥生理功能[19-20]。有研究表明,在复杂的细胞代谢调节机制中,Pro在调控基因表达、转录因子、细胞信号转导和细胞氧化还原反应中,以及在鸟氨酸、精氨酸、多胺、谷氨酸代谢和胶原蛋白的合成等方面发挥着重要作用[21]。胶原蛋白是成纤维细胞通过细胞内蛋白合成的正常途径由氨基酸(主要是甘氨酸和Pro)形成的,其途径包括氨基酸的活化、肽链的产生和翻译后修饰[6, 8];如Ⅰ型胶原蛋白,它由2条α1和1条α2肽链组成,分别由COL1A1和COL1A2基因编码[22]。据报道,核糖体上新合成的原胶原多肽链进入内质网腔后,还需要进行一系列的羟基化和糖基化修饰,至少受到9种分子伴侣与酶的作用[23];如脯氨酸羟化酶是催化细胞内特定胶原修饰的主要酶,脯氨酸羟化酶主要有3个α亚基,通过P4HA1、P4HA2和P4HA3基因编码[24]。目前,关于Pro对脯氨酰4-羟化酶亚基α基因的影响研究相对较少。因此,我们开展了相关研究来探讨Pro促进鱼鳔胶原蛋白合成是否与这些基因的转录调控有关。结果发现,Pro对浅色黄姑鱼鱼鳔中COL1A1、COL1A2和P4HA1基因相对表达量有显著影响,且均随着饲料中Pro添加水平的提高而提高。这与Zhang等[25]报道类似,该研究表明,提高饲料Pro水平能够促进大菱鲆肝脏和肌肉中P4HA1基因的表达,以及增加Pro的羟基化,导致Pro可用性和胶原蛋白的生物合成增加。以上结果表明,Pro对鱼鳔胶原蛋白代谢的影响可能是通过同时调节Ⅰ型胶原蛋白α链基因的转录和Pro的羟基化而介导的。
4 结论① 饲料中添加Pro能够显著促进浅色黄姑鱼鱼鳔中胶原蛋白沉积,而对浅色黄姑鱼生长的促进作用不显著,以鱼鳔中胶原蛋白含量估算出饲料中Pro的最适添加水平为14.88 g/kg。
② 饲料中添加Pro显著影响了浅色黄姑鱼鱼鳔中7种氨基酸的含量,这些氨基酸可能与Pro的内源代谢存在某种关联,需要进一步研究。
③ 饲料中添加Pro显著影响了浅色黄姑鱼鱼鳔中COL1A1、COL1A2和P4HA1基因的相对表达量,这也许是导致鱼鳔中胶原蛋白沉积增加的原因,但还需要进一步从转录调控、蛋白表达及其磷酸化水平等方面深入探讨。
| [1] |
RONG H, ZHANG Y L, HAO M L, et al. Effect of hydroxyproline supplementation on growth performance, body composition, amino acid profiles, blood-biochemistry and collagen synthesis of juvenile Chu's croaker (Nibea coibor)[J]. Aquaculture Research, 2020, 51(3): 1264-1275. DOI:10.1111/are.14477 |
| [2] |
古群红, 罗志平, 吴缥飘, 等. 浅色黄姑鱼的池塘养殖试验[J]. 中国水产, 2011(8): 27-29. GU Q H, LUO Z P, WU P P, et al. Pond culture experiment of Nibea coibor[J]. China Fisheries, 2011(8): 27-29 (in Chinese). DOI:10.3969/j.issn.1002-6681.2011.08.013 |
| [3] |
LIN F, RONG H, LIN J L, et al. Enhancement of collagen deposition in swim bladder of Chu's croaker (Nibea coibor) by proline: view from in-vitro and in-vivo study[J]. Aquaculture, 2020, 523: 735175. DOI:10.1016/j.aquaculture.2020.735175 |
| [4] |
WEN J, ZENG L, CHEN Z M, et al. Comparison of nutritional quality in fish maw product of croaker Protonibea diacanthus and perch Lates niloticus[J]. Journal of Ocean University of China, 2016, 15(4): 726-730. DOI:10.1007/s11802-016-2870-7 |
| [5] |
DA TRINDADE ALFARO A, BALBINOT E, WEBER C I, et al. Fish gelatin: characteristics, functional properties, applications and future potentials[J]. Food Engineering Reviews, 2015, 7(1): 33-44. DOI:10.1007/s12393-014-9096-5 |
| [6] |
LI P, WU G Y. Roles of dietary glycine, proline, and hydroxyproline in collagen synthesis and animal growth[J]. Amino Acids, 2018, 50(1): 29-38. DOI:10.1007/s00726-017-2490-6 |
| [7] |
BARBUL A. Proline precursors to sustain mammalian collagen synthesis[J]. The Journal of Nutrition, 2008, 138(10): 2021S-2024S. DOI:10.1093/jn/138.10.2021S |
| [8] |
荣华, 王正阳, 郝亭亭, 等. 甘氨酸、脯氨酸及羟脯氨酸介导胶原蛋白代谢研究进展[J]. 西北农林科技大学学报(自然科学版), 2021, 49(11): 53-61. RONG H, WANG Z Y, HAO T T, et al. Research progress of glycine, proline and hydroxyproline mediated collagen metabolism[J]. Journal of Northwest A&F University (Natural Science Edition), 2021, 49(11): 53-61 (in Chinese). |
| [9] |
ALBAUGH V L, MUKHERJEE K, BARBUL A. Proline precursors and collagen synthesis: biochemical challenges of nutrient supplementation and wound healing[J]. The Journal of Nutrition, 2017, 147(11): 2011-2017. |
| [10] |
AKSNES A, MUNDHEIM H, TOPPE J, et al. The effect of dietary hydroxyproline supplementation on salmon (Salmo salar L.) fed high plant protein diets[J]. Aquaculture, 2008, 275(1/2/3/4): 242-249. |
| [11] |
RONG H, LIN F, ZHANG Y L, et al. Effects of dietary proline on growth, physiology, biochemistry and TOR pathway-related gene expression in juvenile spotted drum Nibea diacanthus[J]. Fisheries Science, 2020, 86(3): 495-506. DOI:10.1007/s12562-020-01414-4 |
| [12] |
KRANE S M. The importance of proline residues in the structure, stability and susceptibility to proteolytic degradation of collagens[J]. Amino Acids, 2008, 35(4): 703-710. DOI:10.1007/s00726-008-0073-2 |
| [13] |
DABROWSKI K, ZHANG Y F, KWASEK K, et al. Effects of protein-, peptide- and free amino acid-based diets in fish nutrition[J]. Aquaculture Research, 2010, 41(5): 668-683. DOI:10.1111/j.1365-2109.2010.02490.x |
| [14] |
KARNA E, SZOKA L, HUYNH T Y L, et al. Proline-dependent regulation of collagen metabolism[J]. Cellular and Molecular Life Sciences, 2020, 77(10): 1911-1918. DOI:10.1007/s00018-019-03363-3 |
| [15] |
KIVIRIKKO K I, PIHLAJANIEMI T. Collagen hydroxylases and the protein disulfide isomerase subunit of prolyl 4-hydroxylases[J]. Advances in Enzymology and Related Areas of Molecular Biology, 1998, 72: 325-398. |
| [16] |
LI X L, REZAEI R, LI P, et al. Composition of amino acids in feed ingredients for animal diets[J]. Amino Acids, 2011, 40(4): 1159-1168. DOI:10.1007/s00726-010-0740-y |
| [17] |
BULBUL M, KADER M A, KOSHIO S, et al. Effect of replacing fishmeal with canola meal on growth and nutrient utilization in kuruma shrimp Marsupenaeus japonicus (Bate)[J]. Aquaculture Research, 2014, 45(5): 848-858. DOI:10.1111/are.12026 |
| [18] |
UNNIKRISHNAN U, PAULRAJ R. Dietary protein requirement of giant mud crab Scylla serrata juveniles fed iso-energetic formulated diets having graded protein levels[J]. Aquaculture Research, 2010, 41(2): 278-294. DOI:10.1111/j.1365-2109.2009.02330.x |
| [19] |
ANDERSEN S M, WAAGBØ R, ESPE M. Functional amino acids in fish nutrition, health and welfare[J]. Frontiers in Bioscience, 2016, 8: 143-169. |
| [20] |
KIMBALL S R, JEFFERSON L S. Signaling pathways and molecular mechanisms through which branched-chain amino acids mediate translational control of protein synthesis[J]. The Journal of Nutrition, 2006, 136(Suppl.1): 227S-231S. |
| [21] |
WU G Y, BAZER F W, BURGHARDT R C, et al. Proline and hydroxyproline metabolism: implications for animal and human nutrition[J]. Amino Acids, 2011, 40(4): 1053-1063. |
| [22] |
YU E M, LIU B H, WANG G J, et al. Molecular cloning of type Ⅰ collagen cDNA and nutritional regulation of type I collagen mRNA expression in grass carp[J]. Journal of Animal Physiology and Animal Nutrition, 2014, 98(4): 755-765. |
| [23] |
GHOSH A K. Factors involved in the regulation of type Ⅰ collagen gene expression: implication in fibrosis[J]. Experimental Biology and Medicine, 2002, 227(5): 301-314. |
| [24] |
MYLLYHARJU J. Intracellular post-translational modifications of collagens[M]//BRINCKMANN J, NOTBOHM H, MÜLLER P K. Collagen. Berlin, Heidelberg: Springer, 2005: 115-147.
|
| [25] |
ZHANG K K, MAI K S, XU W, et al. Proline with or without hydroxyproline influences collagen concentration and regulates prolyl 4-hydroxylase α (Ⅰ) gene expression in juvenile turbo (Scophthalmus maximus L.)[J]. Journal of Ocean University of China, 2015, 14(3): 541-548. |




