2. 南昌市特色水生生物营养生理与健康养殖重点实验室, 南昌 330045;
3. 四川新希望六和科技创新有限公司, 成都 610100
2. Key Laboratory for Nutritional Physiology and Healthy Breeding of Characteristic Aquatic Life, Nanchang 330045, China;
3. Sichuan New Hope Liuhe Technology Innovation Co., Ltd., Chengdu 610100, China
维生素A是一种脂溶性维生素,对于维持动物的正常生理功能具有重要作用,它参与了鱼类的多个生理过程,包括视觉形成、免疫反应、细胞分化、生长分化和增殖、胚胎发育和代谢[1-3]。鱼类和其他脊椎动物一样,缺乏合成维生素A的能力,需要从食物中获取维生素A以保证健康生长[4]。投喂缺乏维生素A的饲料会导致虹鳟(Oncorhynchus mykiss)食欲减退、生长迟滞、体色白化、眼和鳍基部充血和死亡率增加等缺乏症状[5]。但是,维生素A摄入过多同样会导致鱼类生长减缓[6]和畸形[7-8]。因此,研究目标物种的维生素A需求量,既要预防缺乏,也要避免过量。目前关于鱼类维生素A需求量研究较多,不同鱼种对维生素A的适宜需求量不同,研究表明:青鱼(Mylopharyngodon piceus)幼鱼对维生素A的需求量为2 058.9 IU/kg[9],虹鳟为2 500~3 500 IU/kg[5],吉富罗非鱼(Oreochromis niloticus)为2 954.84 IU/kg[10],尼罗罗非鱼(Oreochromis niloticus)为5 000 IU/kg[6],牙鲆(Paralichthys olivaceus)幼鱼为9 000 IU/kg[11],黄颡鱼(Pelteobagrus fulvidraco)为33 705~40 316 IU/kg[12]。研究表明,饲料适宜维生素A水平可以提高青鱼幼鱼[13]肝脏α-淀粉酶和蛋白酶活性,促进幼建鲤(Cyprinus carpiovar Jian)[14]肠道发育和提高肠道酶活性,增强其消化吸收能力。目前,有关黄鳝(Monopterus albus)营养学研究已有较多报道,主要集中在黄鳝蛋白质及脂肪需求方面[14-17],但有关维生素A需求量的研究未见报道。因此,本试验以人工黄鳝苗为试验对象,旨在探究饲料维生素A水平对黄鳝苗生长性能、血清生化指标及组织消化酶活性等指标的影响,以期为黄鳝人工饲料的配制提供理论依据。
1 材料与方法 1.1 试验设计本试验采用单因素试验设计,以鱼粉为主要饲料蛋白质源,维生素A醋酸酯为维生素A添加源,在7组相同基础饲料中分别添加维生素A醋酸酯,参考鲤(Cyprinus carpio)[18-19]对维生素A的需求量在4 000~20 000 IU/kg,牙鲆[20]对维生素A的需求量在10 000 IU/kg以上,黄鳝维生素A添加量设置在0~16 000 IU/kg,添加水平分别为0、500、1 000、2 000、4 000、8 000、16 000 IU/kg(实测值:3 201、3 620、4 010、4 730、6 510、9 720和16 890 IU/kg,依次记为L1~L7),基础饲料组成及营养水平见表 1。试验所用维生素A醋酸酯(50万IU/g)购买于某科技有限公司。鱼粉、玉米蛋白粉、豆粕购自江西某生物科技有限公司。所有饲料原料经80目过筛[21],按照配比(表 1)将各原料充分混匀,加20%的水分后,经40型单螺杆膨化机在温度为123~125 ℃下制成粒径为1.5~2.1 mm的条状膨化饲料,避光风干后,自封袋密封保存于-20 ℃冰箱备用。
|
|
表 1 基础饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验所用黄鳝选自于江西农业大学水产养殖基地,均为人工繁殖黄鳝苗[平均体重(7.32±0.02) g],从中筛选1 260尾规格整齐、体质健康、无病无伤的幼鳝用于试验。试验分为7组,每组4个重复,每个重复45尾。
养殖试验在江西农业大学水产养殖基地中进行,养殖箱为88 cm×66 cm×64 cm蓝色塑料桶,养殖箱内放置一定数量的水葫芦,养殖用水为经过曝气的自来水。每次喂食记录水温,喂食至大部分黄鳝停止摄食为止,并略带剩余,0.5 h后观察并捞出剩料、风干计重。整个试验期间水温20.9~29.5 ℃,溶解氧浓度不低于5 mg/L,pH为6.5~7.4,氨氮浓度不高于2.0 mg/L,亚硝酸盐浓度不高于0.10 mg/L。
1.3 样品采集从各箱中随机选取4尾接近均重的黄鳝运回实验室解剖取样。准确称重、测量体长后断尾采血,采血完成后将黄鳝置于无菌冰盘上进行解剖,取其肝脏、胃和前肠准确称重并存于冻存管中,液氮速冻后转移至-80 ℃超低温冰箱保存。按照组织样品与生理盐水1:9的比例加入生理盐水,然后使用全自动匀浆机匀浆,制成10%组织匀浆液,4 ℃条件下3 500 r/min离心10 min,小心吸取上清液,24 h内完成测定。血液于4 ℃环境静置24 h,取上清液于-80 ℃超低温保存待用。
1.4 生长性能、形体指标和脏器指数测定养殖70 d后停食24 h,对各养殖箱计数及称重,计算末均重(FBW)、增重率(WGR)、特定生长率(SGR)等,相关计算公式如下:

|
式中:W1、W2分别代表试验黄鳝初均重和末均量(g);t代表养殖天数(d);F代表平均摄食量(g);HW、SW、VW、IW、W分别代表取样黄鳝肝脏、脾脏、内脏、肠道及全鱼重量(g);L代表取样黄鳝体长(cm)。
1.5 营养成分测定饲料及鱼体营养成分测定采用相同方法;水分含量测定参考GB/T 6435—2014;粗灰分含量测定参考GB/T 6438—2007;粗脂肪含量测定参考GB/T 6433—2006;粗蛋白质含量测定参考GB/T 6432—1994;饲料维生素A含量检测参考GB/T 17817—2010。
1.6 血清和肝脏生化指标、组织消化酶活性测定严格按照南京建成生物工程研究试剂盒的说明书测定血清谷草转氨酶(GOT)、谷丙转氨酶(GPT)活性及低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、葡萄糖(GLU)、甘油三酯(TG)、总胆固醇(T-CHO)含量;肝脏T-CHO和TG含量;肝胰脏、胃、前肠蛋白酶、脂肪酶和淀粉酶活性。
组织消化酶活性测定:淀粉酶的单位定义为组织中每毫克蛋白在37 ℃与底物作用30 min,水解10 mg淀粉定义为1个酶活力单位(U/mg prot);脂肪酶的单位定义为组织中每克蛋白在37 ℃条件下与底物反应1 min,每消耗1 μmol底物为1个酶活力单位(U/g prot);胃蛋白酶的单位定义为每毫克组织蛋白在37 ℃条件下每分钟分解蛋白生成1 μg酪氨酸相当于1个酶活力单位(U/mg prot);胰蛋白酶定义为在37 ℃条件下,每毫克蛋白中含有的胰蛋白酶每分钟使吸光度变化0.003即为1个酶活力单位(U/mg prot)。
1.7 数据处理与分析结果采用平均值±标准误(mean±SE)表示,用SPSS 25.0进行单因素方差分析(one-way ANOVA),若组间差异显著,再用Duncan氏法进行多重比较检验,显著水平为P < 0.05。回归折线利用Excel 2019制作分析。
2 结果 2.1 饲料维生素A水平对黄鳝生长性能的影响由表 2可知,随饲料维生素A水平的升高,黄鳝FBW、WGR和SGR先上升后下降,L2~L4组黄鳝FBW、WGR和SGR显著高于L1、L7组(P < 0.05),与L5、L6组无显著差异(P>0.05),L7组FBW、WGR和SGR最低,与L1、L6组无显著差异(P>0.05);试验各组间饲料系数无显著差异(P>0.05);本试验中饲料维生素A水平对黄鳝存活率没有显著影响(P>0.05)。
|
|
表 2 饲料维生素A水平对黄鳝生长性能的影响 Table 2 Effects of dietary vitamin A level on growth performance of Monopterus albus (n=4) |
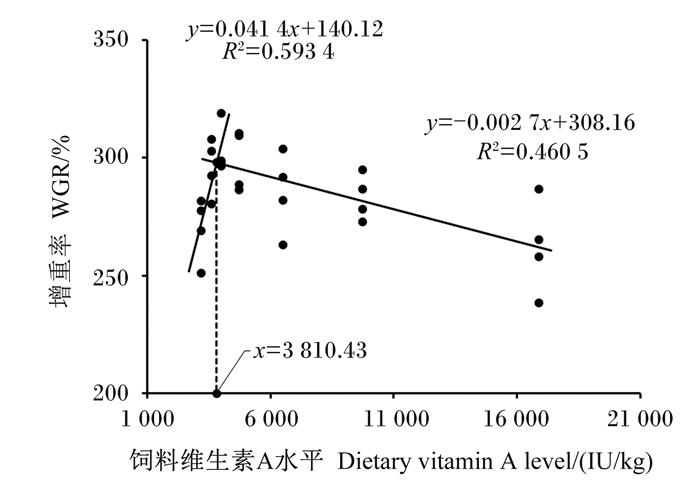
用二次多项式的回归模型分析黄鳝WGR与饲料维生素A水平之间的关系,得到曲线型y=-2E-07x2+0.002 4x+284.23,R2=0.285 5,拟合度过低,因此作折线回归分析饲料维生素A水平与WGR的关系(图 1),当饲料维生素A水平在3 201~4 010 IU/kg时,拟合折线模型为y=0.041 4x+140.12,R2=0.593 4。当饲料维生素A水平在4 010~16 890 IU/kg时,拟合折线模型为y=-0.002 7x+308.16,R2=0.460 5,两者交点坐标为(3 810.43,297.87)。
|
图 1 饲料维生素A水平与黄鳝WGR之间的关系 Fig. 1 Relationship between dietary vitamin A level and WGR of Monopterus albus |
由表 3可知,饲料维生素A水平对黄鳝的形体指标无显著影响(P>0.05)。各试验组VSI、HSI、SI、VI和CF均无显著差异(P>0.05)。
|
|
表 3 饲料维生素A水平对黄鳝形体指标和脏器指数的影响 Table 3 Effects of dietary vitamin A level on body indexes and visceral indexes of Monopterus albus (n=8) |
由表 4可知,黄鳝血清中GPT和GOT活性随饲料维生素A水平的升高呈先下降后上升的趋势,L4、L5组血清GPT活性达到最小值,且显著低于L1和L7组(P < 0.05),但与其余各组无显著差异(P>0.05),L4组血清GOT活性最低,显著低于L1、L2、L5和L7组(P < 0.05)。L5组血清T-CHO和TG含量达到最大值,且TG含量显著高于其他各组(P < 0.05),T-CHO含量与L3组无显著差异(P>0.05),显著高于其余各组(P < 0.05)。血清GLU含量随饲料维生素A水平升高呈先上升后下降的趋势,L3~L5组血清GLU含量显著高于其余各组(P < 0.05),L7组血清GLU含量最低,与L1和L6组无显著差异(P>0.05)。L1~L4组血清LDL-C含量显著高于L7组(P < 0.05),与L5、L6组无显著差异(P>0.05),L4组血清HDL-C含量达到最高,显著高于L6组(P < 0.05),与其余各组无显著差异(P>0.05)。
|
|
表 4 饲料维生素A水平对黄鳝血清生化指标的影响 Table 4 Effects of dietary vitamin A level on serum biochemical indices of Monopterus albus (n=4) |
由表 5可知,黄鳝肝脏TG、T-CHO含量随饲料维生素A水平的升高呈先下降后上升的趋势,L3~L5组肝脏T-CHO含量显著低于其余各组(P < 0.05),其余各组间无显著差异(P>0.05),L1组肝脏TG含量显著高于L2~L6组(P < 0.05),与L7组无显著差异(P>0.05)。
|
|
表 5 饲料维生素A水平对黄鳝肝脏生化指标的影响 Table 5 Effects of dietary vitamin A level on liver biochemical indice of Monopterus albus (n=4) |
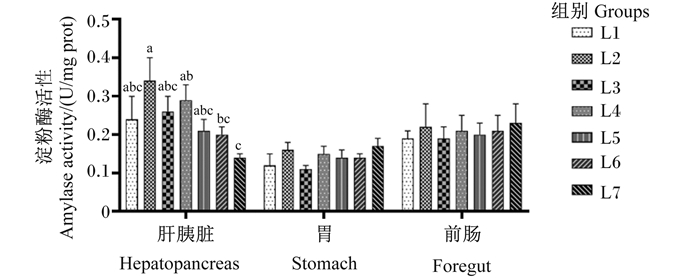
由图 2可知,黄鳝肝胰脏淀粉酶活性随饲料维生素A水平的升高呈先上升后下降的趋势,L2组显著高于L6和L7组(P < 0.05),与其余各组间无显著差异(P>0.05)。饲料维生素A水平对黄鳝胃和前肠淀粉酶活性无显著影响(P>0.05)。
|
数据柱形标注无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P < 0.05)。下图同。 Value columns with no letter or the same letters mean no significant difference (P>0.05), while with different small letters mean significant difference (P < 0.05).The same as below. 图 2 饲料维生素A水平对黄鳝不同组织淀粉酶活性的影响 Fig. 2 Effects of dietary vitamin A level on amylase activity in different tissues of Monopterus albus |
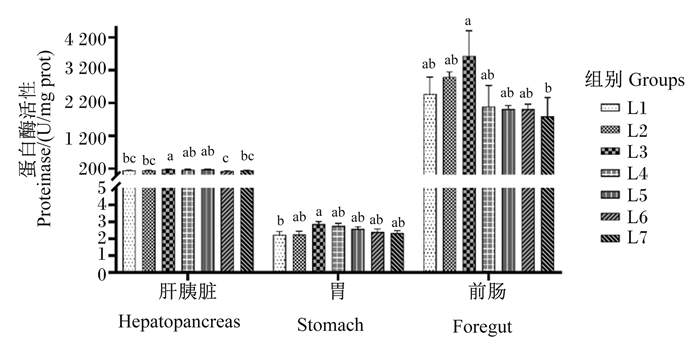
由图 3可知,肝胰脏、胃和前肠蛋白酶活性随饲料维生素A水平的升高呈先上升后下降的趋势,L3组肝胰脏、胃和前肠的蛋白酶活性达到最高,L3组肝胰脏蛋白酶活性与L4、L5组无显著差异(P>0.05),显著高于其余各组(P < 0.05)。L3组胃蛋白酶活性显著高于L1组(P < 0.05),且与其余各组无显著差异(P>0.05)。L3组前肠胰蛋白酶活性显著高于L7组(P < 0.05),与其余各组无显著差异(P>0.05)。
|
图 3 饲料维生素A水平对黄鳝不同组织蛋白酶活性的影响 Fig. 3 Effects of dietary vitamin A level on proteinase activity in different tissues of Monopterus albus |
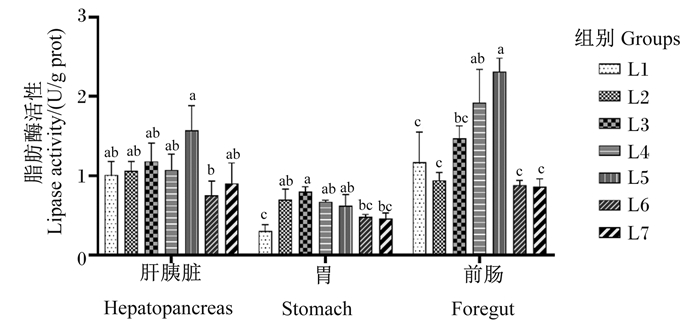
由图 4可知,黄鳝肝胰脏、胃和前肠脂肪酶活性随饲料维生素A水平的升高呈先上升后下降的趋势,L5组肝胰脏脂肪酶活性最高,显著高于L6组(P < 0.05),与其余各组无显著差异(P>0.05)。L3组胃脂肪酶活性与L2、L4、L5组无显著差异(P>0.05),显著高于L7组(P < 0.05),L1组胃脂肪酶活性最低,与L6、L7组无显著差异(P>0.05)。L5组前肠脂肪酶活性最高,与L4组无显著差异(P>0.05),显著高于其余各组(P < 0.05)。
|
图 4 饲料维生素A水平对黄鳝不同组织脂肪酶活性的影响 Fig. 4 Effects of dietary vitamin A level on lipase activity in different tissues of Monopterus albus |
维生素A最初被认为是动物生长的必要因素。生长迟缓是许多试验动物中最早和最易出现的维生素A缺乏迹象[22]。断奶后喂食维生素A缺乏饮食的大鼠,其生长明显停止,随后体重显著减轻[23-24],这些结果表明维生素A对动物的正常生长发育很重要。本试验中,随饲料维生素A水平的升高,黄鳝WGR和SGR均呈先上升后下降的趋势,说明饲料维生素A不足或过量会抑制黄鳝增重,饲料维生素A水平适宜对黄鳝生长具有重要作用。通过折线分析饲料维生素A水平与WGR的关系,得出维生素A适宜水平为3 810.43 IU/kg。这与吉富罗非鱼(2 954.84 IU/kg)[10]和武昌鱼(Megalobrama amblycephala)幼鱼(3 914 IU/kg)[25]适宜需求量接近,但高于草鱼(Ctenopharyngodon idella)(1 653 IU/kg)[26]、青鱼幼鱼(2 058.9 IU/kg)[9]和异育银鲫(Carassius auratus gibelio var. CAS Ⅲ)(1 716~2 698 IU/kg)[27]的需求量,低于牙鲆幼鱼(9 000 IU/kg)[11]和黄颡鱼(33 705~40 316 IU/kg)[12]的需求量,不同鱼类对维生素A的需求量不同,这可能与鱼类的种类、大小、摄食方式等有关。
维生素A缺乏会导致动物生长减缓、视力减弱、眼球突出、眼内出血和夜盲等异常症状[4, 6, 28],维生素A过量也会导致动物死亡率增加、脊椎生长异常和生长减缓等症状[6, 29]。Hernandez等[20]观察到饲喂不同维生素A水平的牙鲆HSI没有显著差异,但饲喂不添加维生素A饲料的鱼HSI较低。缺乏维生素A饲料饲喂花鲈[30]、尼罗罗非鱼幼鱼[6, 31]观察到生长减缓、死亡率升高、眼球膨胀、鳍基和皮肤充血、鳃盖扭曲等典型缺乏症状。本试验条件下,不同维生素A水平饲料对黄鳝的VSI、HSI、SI、VI和CF均无显著影响,除了黄鳝生长有影响外未显示出其他物种报告的缺乏或过量的异常症状。这可能跟黄鳝眼退化细小、皮膜所覆盖、视觉极不发达、昼伏夜出等生活习性有关,同时,基础饲料已含有较高维生素A,没有导致黄鳝严重缺乏维生素A。
3.2 饲料维生素A水平对黄鳝血清、肝脏生化指标的影响肝脏在维生素A的代谢、摄取、储存和释放中起重要作用[32]。在正常代谢过程中,动物血清中的转氨酶活性保持在一定的范围内,血清转氨酶活性升高与细胞坏死程度相关[33]。血清中的转氨酶活性升高表明肝细胞(主要是肝细胞和肝实质细胞)受损,从而使转氨酶释放到血液中[34],因此,血清GOT和GPT在鱼类中常用于肝脏损伤检测[35-36]。本试验中,黄鳝血清GOT、GPT活性随饲料维生素A水平的升高呈先下降后上升的趋势,这与张璐等[30]在花鲈上的研究结果相似,黄鳝摄入低维生素A水平的饲料血清转氨酶活性显著升高,说明饲料维生素A不足可能会导致黄鳝肝脏受到一定程度损伤。Hernandez等[20]研究发现,养殖120 d后,25 000 IU/kg维生素A组牙鲆血清GPT活性较10 000 IU/kg维生素A组显著升高。高浓度维生素A引起的肝损伤可能是由肝星状细胞激活引起的,导致肌成纤维细胞样表型,主要是肝细胞和肝实质细胞受损,酶进入血液中[37]。Hilton[38]报道,虹鳟由于高浓度维生素A中毒,肝脏呈淡黄色且脆弱,HSI降低。黄鳝摄入高维生素A水平饲料后,血清转氨酶活性也显著升高,这可能跟维生素A摄入过量导致肝脏受到一定程度的毒害有关,肝脏正常功能受到影响。饲料维生素A水平过低或过高可能会对鱼类机体造成不良影响,因此,饲料中适宜的维生素A水平对黄鳝健康生长具有重要意义。
脂质在动物体内主要以脂蛋白的形式运输,包括LDL-C和HDL-C。HDL-C的主要功能是将胆固醇(TC)从外周组织运输到肝脏,而LDL-C在TC从肝脏运输到各个组织的过程中发挥作用[39-40],TG是动物体内储存能量的主要形式。内源性脂质的转运可通过血浆TG、LDL-C、HDL-C和TC含量进行评估[41]。哺乳动物中的研究表明,维生素A是脂质代谢的重要调节因子[42],关于水生动物脂质代谢调控的研究有限。本试验中发现,黄鳝摄入低维生素A水平饲料血清TG、T-CHO含量降低,肝脏TG和T-CHO含量显著升高。张璐等[30]在花鲈上的研究也发现相似结果,并指出维生素A缺乏的总体效果是使脂肪合成能力降低,同时又会引起肝脏中脂肪向血液的运输障碍,从而导致脂肪肝的发生。维生素A缺陷老鼠试验表明,肝脏线粒体脂肪酸氧化酶基因表达降低,肝脏增加以TG形式的脂质积累,从而导致脂肪肝[43]。黄鳝摄入维生素A不足饲料的血清TG和T-CHO含量降低也可能是因为肝脏β氧化能力下降,这些可能是导致黄鳝肝脏TG和T-CHO含量升高的原因。
饲料维生素A处于高水平时,血清LDL-C含量显著降低,黄鳝肝脏TG和T-CHO含量显著升高。肝脏在脂质代谢中起着重要作用,大量的脂肪酸在肝脏中进出,有研究表明,维生素A摄入过多的大鼠肝脏脂肪氧化和酮生成率增加[44],另外,由于棕榈酸酯与三酸甘油酯结合和GLU生成甘油磷酸酯的速率增加,肝脏的TG合成速率大大提高[44-45],但是,在维生素A摄入过多的大鼠中,肝脏TG的分泌率并没有改变[46]。陈书健等[9]研究发现,维生素A缺乏时肉碱棕榈酰转移酶-1(CPT-1)和肉碱棕榈酰转移酶-2(CPT-2)基因表达受到显著性抑制,维生素A过量时乙酰辅酶A羧化酶-2(ACC-2)和脂蛋白酯酶(LPL)基因表达受到抑制,肝脏过氧化物酶体增殖物激活受体-γ(PPAR-γ)基因表达显著下降,维生素A代谢失调会对鱼类脂质代谢产生负面影响。这些研究表明,维生素A过量导致肝脏脂质合成的程度远远大于其提高肝脏脂质氧化的程度,最终的结果是肝脏中脂质的积累。
啮齿类动物试验表明,维生素A过量或缺乏都会影响肝脏中的碳水化合物代谢[47]。脂代谢与糖代谢关系密不可分,GLU经肠道吸收后进入肝脏,其中一部分在肝脏中代谢,另一部分进入血液中[48]。本试验中黄鳝血清GLU含量随饲料维生素A水平升高呈先升高后下降的趋势,维生素A不足或过量,血清GLU含量显著降低。维生素A缺陷大鼠试验表明,肝脏葡萄糖-6-磷酸酶和果糖-1, 6-二磷酸酶的活性降低,表现为抑制肝脏糖异生[49],这可能是黄鳝摄入维生素A不足血清GLU含量显著降低原因之一。陈书健等[9]研究发现,饲料中添加过量维生素A会抑制青鱼幼鱼肝脏葡萄糖转运蛋白-2(GLUT-2)基因表达,并推测过量的维生素A会降低细胞或组织对GLU的转运能力,这可能是导致维生素A过量组青鱼幼鱼血糖水平降低的原因之一,饲料中添加过量的维生素A是否影响肠道对GLU的吸收进而影响血糖浓度有待进一步研究。
3.3 饲料维生素A水平对黄鳝组织消化酶活性的影响本试验中,黄鳝肝胰脏、前肠胰蛋白酶活性以及胃蛋白酶活性均随饲料维生素A水平升高呈先上升后下降的趋势,蛋白酶活性均在4 010 IU/kg组时达到最高,表明维生素A水平4 010 IU/kg是黄鳝饲料适宜水平。冯仁勇[14]研究表明,饲料维生素A水平4 000 IU/kg组与0 IU/kg组相比,幼建鲤肠和肝胰脏蛋白酶活性分别提高48.62%和84.96%,糜蛋白酶活性分别提高50.99%和43.67%,肠蛋白酶活性与蛋白质沉积率呈显著正相关,并指出维生素A可以通过提高肠和肝胰脏蛋白酶和糜蛋白酶活性而增加蛋白质沉积,促进幼建鲤的生长。在青鱼幼鱼[13]上的研究结果表明,饲料中维生素A水平从290 IU/kg增加到7 662 IU/kg,肝胰脏中的胰蛋白酶、糜蛋白酶和弹性蛋白酶活性显著升高。推测本试验L2~L4组黄鳝生长速度较高可能主要是维生素A通过提高黄鳝肝胰脏和前肠的蛋白酶活性以及胃蛋白酶活性,适宜维生素A水平可以提高鱼类蛋白酶活性,增强对蛋白质的消化能力,促进蛋白质沉积的结果。
本试验表明,饲料维生素A水平可以影响黄鳝脂肪酶活性,对肝胰脏、前肠和胃脂肪酶活性具有显著影响,肝胰脏和前肠脂肪酶活性在维生素A水平为6 510 IU/kg时达到最高,胃脂肪酶活性在维生素A水平为4 010 IU/kg时达到最高。与冯仁勇[14]对建鲤研究表明,饲料维生素A水平4 000 IU/kg组与0 IU/kg组相比,幼建鲤肠和肝胰脏脂肪酶活性分别提高21.18%和10.51%,与本试验结果类似。
饲料维生素A水平对肝脏淀粉酶活性有显著影响,本试验中发现饲料维生素A水平3 620 IU/kg组肝胰脏淀粉酶活性最高,但摄入高维生素A水平(16 890 IU/kg)的饲料会显著降低肝胰脏淀粉酶活性。这与陈炼等[13]在青鱼幼鱼上的研究结果相似,与在啮齿类动物中的研究结论较为一致[47],维生素A水平在3 620~4 730 IU/kg较适宜,可以提高黄鳝对碳水化合物的利用。
虽然不同研究因为消化酶活性测定方法和取样等的影响使得结果不尽一致,但从本试验测定结果综合分析,饲料维生素A的水平可以显著影响黄鳝消化酶的活性,从消化酶角度评价黄鳝饲料适宜维生素A的水平为4 010 ~6 510 IU/kg。
4 结论饲料中适宜的维生素A水平可以提高黄鳝组织消化酶活性,提高蛋白质、脂肪的消化、吸收和利用,促进黄鳝的生长。综上所述,以鱼粉为饲料主要蛋白质源时,以WGR为指标,推荐黄鳝饲料适宜维生素A水平为3 810 IU/kg。
| [1] |
BIDLACK W R. The vitamins: fundamental aspects in nutrition and health[J]. Journal of the American College of Nutrition, 2000, 19(1): 80. DOI:10.1080/07315724.2000.10718917 |
| [2] |
RUIVO R, CAPITÃO A, CASTRO L F C, et al. The cycling gonad: retinoic-acid synthesis and degradation patterns during adult zebrafish Danio rerio oogenesis[J]. Journal of Fish Biology, 2018, 92(4): 1051-1064. DOI:10.1111/jfb.13564 |
| [3] |
ALSOP D, BROWN S, VAN DER KRAAK G. The effects of copper and benzo[a]pyrene on retinoids and reproduction in zebrafish[J]. Aquatic Toxicology, 2007, 82(4): 281-295. DOI:10.1016/j.aquatox.2007.03.001 |
| [4] |
HALVER J E. 2-the vitamins[M]//HALVER J E, HARDY R W. Fish nutrition. 3rd ed. San Diego: Academic Press, 2003: 61-141.
|
| [5] |
KITAMURA S, SUWA T, OHARA S, et al. Studies on vitamin requirements of rainbow trout-Ⅲ.Requirement for vitamin A and deficiency symptoms[J]. Nippon Suisan Gakkaishi, 1967, 33(12): 1126-1131. DOI:10.2331/suisan.33.1126 |
| [6] |
SALEH G, ELERAKY W, GROPP J M. A short note on the effects of vitamin A hypervitaminosis and hypovitaminosis on health and growth of Tilapia nilotica (Oreochromis niloticus)[J]. Journal of Applied Ichthyology, 1995, 11(3/4): 382-385. |
| [7] |
MAZURAIS D, GLYNATSI N, DARIAS M J, et al. Optimal levels of dietary vitamin A for reduced deformity incidence during development of European sea bass larvae (Dicentrarchus labrax) depend on malformation type[J]. Aquaculture, 2009, 294(3/4): 262-270. |
| [8] |
VILLENEUVE L A N, GISBERT E, MORICEAU J, et al. Intake of high levels of vitamin A and polyunsaturated fatty acids during different developmental periods modifies the expression of morphogenesis genes in European sea bass (Dicentrarchus labrax)[J]. British Journal of Nutrition, 2006, 95(4): 677-687. DOI:10.1079/BJN20051668 |
| [9] |
陈书健, 吴成龙, 叶金云, 等. 饲料中维生素A对青鱼幼鱼生长、血清生化指标和肝脏糖脂代谢酶活性及基因表达的影响[J]. 水产学报, 2020, 44(1): 85-98. CHEN S J, WU C L, YE J Y, et al. Effect of dietary vitamin A on growth, serum biochemical index, digestive enzyme activities and glucose and lipid metabolism in juvenile Mylopharyngodon piceus[J]. Journal of Fisheries of China, 2020, 44(1): 85-98 (in Chinese). |
| [10] |
喻丽娟, 文华, 周书华, 等. 维生素A对吉富罗非鱼生长、血清生化指标和肌肉品质的影响[J]. 西北农林科技大学学报(自然科学版), 2019, 47(2): 16-24. YU L J, WEN H, ZHOU S H, et al. Effect of dietary vitamin A on growth performance, serum biochemical indices and meat quality of GIFT, Oreochromis niloticus[J]. Journal of Northwest A & F University(Natural Science Edition), 2019, 47(2): 16-24 (in Chinese). |
| [11] |
HERNANDEZ L H H, TESHIMA S I, ISHIKAWA M, et al. Dietary vitamin A requirements of juvenile Japanese flounder Paralichthys olivaceus[J]. Aquaculture Nutrition, 2005, 11(1): 3-9. DOI:10.1111/j.1365-2095.2004.00317.x |
| [12] |
陈学豪, 李剑, 姜才根, 等. 维生素A对黄颡鱼生长性能和体色的影响[J]. 饲料研究, 2015(6): 57-60. CHEN X H, LI J, JIANG C G, et al. Effects of vitamin A on growth performance and body color of yellow catfish (Pelteobagrus fulvidraco)[J]. Feed Research, 2015(6): 57-60 (in Chinese). |
| [13] |
陈炼, 吴成龙, 张易祥, 等. 维生素A对青鱼幼鱼生长、代谢、抗氧化能力和免疫能力的影响[J]. 动物营养学报, 2018, 30(7): 2594-2605. CHEN L, WU C L, ZHANG Y X, et al. Effects of vitamin A on growth, metabolism, antioxidant capacity and immunity of juvenile black carp (Mylopharyngodon piceus)[J]. Chinese Journal of Animal Nutrition, 2018, 30(7): 2594-2605 (in Chinese). DOI:10.3969/j.issn.1006-267x.2018.07.019 |
| [14] |
冯仁勇. 维生素A对幼建鲤消化能力和免疫功能的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2006. FENG R Y. Effects of dietary vitamin a on digestive and immune function of juvenile Jian carp (Cyprinus carpio Var. Jian)[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2006. (in Chinese) |
| [15] |
王松, 储张杰, 龚世园, 等. 饲料中脂肪含量对黄鳝生长的影响[J]. 水利渔业, 2008, 28(3): 67-68. WANG S, CHU Z J, GONG S Y, et al. Effects of dietary fat content on growth of Monopterus albus[J]. Reservoir Fisheries, 2008, 28(3): 67-68 (in Chinese). DOI:10.3969/j.issn.1003-1278.2008.03.025 |
| [16] |
杨代勤, 陈芳, 李道霞, 等. 黄鳝的营养素需要量及饲料最适能量蛋白比[J]. 水产学报, 2000, 24(3): 259-262. YANG D Q, CHEN F, LI D X, et al. Requirements of nutrients and optimum energy-protein ratio in the diet for Monopterus albus[J]. Journal of Fisheries of China, 2000, 24(3): 259-262 (in Chinese). |
| [17] |
程玉冰, 曹永红, 夏伦志, 等. 饲粮不同蛋白质原料和水平对黄鳝生长性能与肉质的影响[J]. 饲料工业, 2009, 30(6): 21-24. CHENG Y B, CAO Y H, XIA L Z, et al. Effect of different protein raw material and level on growth performance and meat quality of yellow eel[J]. Feed Industry, 2009, 30(6): 21-24 (in Chinese). DOI:10.3969/j.issn.1001-991X.2009.06.008 |
| [18] |
AOE H, MASUDA I, MIMURA T, et al. Requirement of young carp for vitamin A[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1968, 34(10): 959-964. DOI:10.2331/suisan.34.959 |
| [19] |
SUHENDA N, DJAJADIREDIA R. Determination of the optimum level of vitamin premix for the diet of common carp (Cyprinus carpio L. ) fingerlings[C]//Asian Finfish Nutrition Workshop, Singapore: International Development Research Centre, 1985: 130-135.
|
| [20] |
HERNANDEZ L H H, TESHIMA S I, KOSHIO S, et al. Effects of vitamin A on growth, serum anti-bacterial activity and transaminase activities in the juvenile Japanese flounder, Paralichthys olivaceus[J]. Aquaculture, 2007, 262(2/3/4): 444-450. |
| [21] |
郭枫, 周秋白, 钟杰, 等. 饲料原料粉碎粒度对黄鳝生产性能及氮排放的影响[J]. 江西农业大学学报, 2018, 40(6): 1286-1292. GUO F, ZHOU Q B, ZHONG J, et al. The influence of particle size of raw feed material on production performance and nitrogen emission of rice field eel, Monopterus albus[J]. Acta Agriculturae Universitatis Jiangxiensis(Natural Sciences Edition), 2018, 40(6): 1286-1292 (in Chinese). |
| [22] |
MAYER J, KREHL W A. Influence of vitamin A deficiency on the gross efficiency of growth of rats[J]. The Yale Journal of Biology and Medicine, 1948, 20(4): 403-405. |
| [23] |
SAMPSON M M, KORENCHEVSKY V. The influence of vitamin A deficiency on male rats in paired feeding experiments[J]. Biochemical Journal, 1932, 26(4): 1322-1339. DOI:10.1042/bj0261322 |
| [24] |
ZHANG Y, LI R, LI Y, et al. Vitamin A status affects obesity development and hepatic expression of key genes for fuel metabolism in Zucker fatty rats[J]. Biochemistry and Cell Biology, 2012, 90(4): 548-557. DOI:10.1139/o2012-012 |
| [25] |
LIU B, ZHAO Z X, BROWN P B, et al. Dietary vitamin A requirement of juvenile Wuchang bream (Megalobrama amblycephala) determined by growth and disease resistance[J]. Aquaculture, 2016, 450: 23-30. DOI:10.1016/j.aquaculture.2015.06.042 |
| [26] |
蒋明, 文华, 吴凡, 等. 维生素A对草鱼幼鱼生长、体成分和转氨酶活性的影响[J]. 西北农林科技大学学报(自然科学版), 2012, 40(9): 35-40. JIANG M, WEN H, WU F, et al. Effects of vitamin A on growth performance, body composition and serum transaminase activities in the juvenile grass carp (Ctenopharyngodon idella)[J]. Journal of Northwest A&F University(Natural Science Edition), 2012, 40(9): 35-40 (in Chinese). |
| [27] |
SHAO L Y, ZHU X M, YANG Y X, et al. Effects of dietary vitamin A on growth, hematology, digestion and lipometabolism of on-growing gibel carp (Carassius auratus gibelio var. CAS Ⅲ)[J]. Aquaculture, 2016, 460: 83-89. DOI:10.1016/j.aquaculture.2016.03.054 |
| [28] |
TAKEUCHI T, DEDI J, EBSAWA C, et al. The effect of β-carotene and vitamin A enriched Artemia nauplii on the malformation and color abnormality of larval Japanese flounder[J]. Fisheries Science, 1995, 61(1): 141-148. DOI:10.2331/fishsci.61.141 |
| [29] |
ØRNSRUD R, LOCK E J, WAAGBØ R, et al. Establishing an upper level of intake for vitamin A in Atlantic salmon (Salmo salar L.) postsmolts[J]. Aquaculture Nutrition, 2013, 19(5): 651-664. DOI:10.1111/anu.12013 |
| [30] |
张璐, 李静, 谭芳芳, 等. 饲料中不同维生素A含量对花鲈生长和血清生化指标的影响[J]. 水产学报, 2015, 39(1): 88-96. ZHANG L, LI J, TAN F F, et al. Effects of different dietary vitamin A levels on growth and serum biochemical parameters for Japanese seabass (Lateolabrax japonicus)[J]. Journal of Fisheries of China, 2015, 39(1): 88-96 (in Chinese). |
| [31] |
GUIMARÃES I G, LIM C, YILDIRIM-AKSOY M, et al. Effects of dietary levels of vitamin A on growth, hematology, immune response and resistance of Nile tilapia (Oreochromis niloticus) to Streptococcus iniae[J]. Animal Feed Science and Technology, 2014, 188: 126-136. DOI:10.1016/j.anifeedsci.2013.12.003 |
| [32] |
BATRES R O, OLSON J A. Relative amount and ester composition of vitamin A in rat hepatocytes as a function of the method of cell preparation and of total liver stores[J]. The Journal of Nutrition, 1987, 117(1): 77-82. DOI:10.1093/jn/117.1.77 |
| [33] |
MICHAEL M I, HILMY A M, EL-DOMIATY N A, et al. Serum transaminases activity and histopathological changes in Clarias lazera chronically exposed to nitrite[J]. Comparative Biochemistry and Physiology Part C: Comparative Pharmacology, 1987, 86(2): 255-262. |
| [34] |
LEMAIRE P, DRAI P, MATHIEU A, et al. Changes with different diets in plasma enzymes (GOT, GPT, LDH, ALP) and plasma lipids (cholesterol, triglycerides) of sea-bass (Dicentrarchus labrax)[J]. Aquaculture, 1991, 93(1): 63-75. DOI:10.1016/0044-8486(91)90205-L |
| [35] |
JUNG S H, SIM D S, PARK M S, et al. Effects of formalin on haematological and blood chemistry in olive flounder, Paralichthys olivaceus (Temminck et Schlegel)[J]. Aquaculture Research, 2003, 34(14): 1269-1275. DOI:10.1046/j.1365-2109.2003.00936.x |
| [36] |
LEE S M. Review of the lipid and essential fatty acid requirements of rockfish (Sebastes schlegeli)[J]. Aquaculture Research, 2001, 32(S1): 8-17. |
| [37] |
NOLLEVAUX M C, GUIOT Y, HORSMANS Y, et al. Hypervitaminosis a-induced liver fibrosis: stellate cell activation and daily dose consumption[J]. Liver International, 2006, 26(2): 182-186. DOI:10.1111/j.1478-3231.2005.01207.x |
| [38] |
HILTON J W. Hypervitaminosis A in rainbow trout (Salmo gairdneri): toxicity signs and maximum tolerable level[J]. The Journal of Nutrition, 1983, 113(9): 1737-1745. DOI:10.1093/jn/113.9.1737 |
| [39] |
LUO L, XUE M, VACHOT C, et al. Dietary medium chain fatty acids from coconut oil have little effects on postprandial plasma metabolite profiles in rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2014, 420/421: 24-31. DOI:10.1016/j.aquaculture.2013.10.024 |
| [40] |
WATTS G F, BARRETT P H R, CHAN D C. HDL metabolism in context: looking on the bright side[J]. Current Opinion in Lipidology, 2008, 19(4): 395-404. DOI:10.1097/MOL.0b013e328306596d |
| [41] |
CHEN Y J, TIAN L X, YANG H J, et al. Effect of protein and starch level in practical extruded diets on growth, feed utilization, body composition, and hepatic transaminases of juvenile grass carp, Ctenopharyngodon idella[J]. Journal of the World Aquaculture Society, 2012, 43(2): 187-197. DOI:10.1111/j.1749-7345.2012.00549.x |
| [42] |
BERRY D C, NOY N. Signaling by vitamin A and retinol-binding protein in regulation of insulin responses and lipid homeostasis[J]. Biochimica et Biophysica Acta, 2012, 1821(1): 168-176. DOI:10.1016/j.bbalip.2011.07.002 |
| [43] |
KANG H W, BHIMIDI G R, ODOM D P, et al. Altered lipid catabolism in the vitamin A deficient liver[J]. Molecular and Cellular Endocrinology, 2007, 271(1/2): 18-27. |
| [44] |
RAMACHANDRAN C K, DILEEPAN K N, SINGH V, et al. Effect of excess and deficiency of vitamin A on the utilization of FFA by liver and skeletal muscle[J]. Environmental Physiology & Biochemistry, 1975, 5(3): 208-214. |
| [45] |
SINGH V N, SINGH M, VENKITASUBRAMANIAN T A. Early effects of feeding excess vitamin A: mechanism of fatty liver production in rats[J]. Journal of Lipid Research, 1969, 10(4): 395-401. DOI:10.1016/S0022-2275(20)43066-4 |
| [46] |
SINGH M, SINGH V N. Fatty liver in hypervitaminosis A: synthesis and release of hepatic triglycerides[J]. The American Journal of Physiology, 1978, 234(5): E511-E514. |
| [47] |
ZHAO S, LI R, LI Y, et al. Roles of vitamin A status and retinoids in glucose and fatty acid metabolism[J]. Biochemistry and Cell Biology, 2012, 90(2): 142-152. DOI:10.1139/o11-079 |
| [48] |
BUDDINGTON R K. Does the natural diet influence the intestine's ability to regulate glucose absorption?[J]. Journal of Comparative Physiology.B: Biochemical, Systemic, and Environmental Physiology, 1987, 157(5): 677-688. DOI:10.1007/BF00700989 |
| [49] |
DILEEPAN K N, SINGH V N, RAMACHANDRAN C K. Decreased hepatic gluconeogenesis in vitamin A-deficient rats[J]. Proceedings of the Society for Experimental Biology and Medicine.Society for Experimental Biology and Medicine, 1981, 167(2): 248-253. DOI:10.3181/00379727-167-41158 |




