2. 广东温氏种猪科技有限公司, 云浮 527400
2. Guangdong Wenshi Breeding Swine Technology Co., Ltd., Yunfu 527400, China
雄性动物的生殖能力对于种群繁衍至关重要[1]。雄性激素水平和精子质量不仅决定了受精率[2]和胎儿发育[3],还对子代的健康和生长发育[4]尤为关键。精子发生障碍被定义为精子数量和质量异常,是雄性动物不育最重要的原因之一[5-6]。精子发生是从精原细胞经增殖分化、减数分裂形成精子的复杂过程[7],受睾丸内外因素的影响。内在因素主要表现为睾丸间质细胞可分泌睾酮,维持雄性动物生殖系统发育和正常生精机能[8];外在因素则主要表现为下丘脑和垂体分泌的激素对睾丸间质细胞的刺激[9]。近年来研究发现,雄性动物睾酮分泌和精子生成会受到营养水平[10-11]、饮食方式[12-14]、应激[15]和运动[16]等因素的影响。其中,运动是改善雄性动物生殖机能最有效的方式之一。
系列研究表明,运动可以通过调控雄性动物睾酮含量,进而调节其生殖能力[17-19],但目前关于运动调控雄性动物生殖的机制尚不清楚。功能代谢组学研究发现,运动产生的代谢产物如L-苹果酸和琥珀酸等对提高精子活力和改善精子质量具有重要作用[20-21],提示这些生物活性代谢中间产物可能通过特定的信号分子介导了运动改善雄性动物生殖的功能。运动时体内代谢中间产物变化各异,其中α-酮戊二酸(α-ketoglutaric acid,AKG)是在阻力运动后产生的一种标志性代谢中间产物[22],具有广泛的生理学功能[23]。AKG的受体酮戊二酸受体1(oxoglutarate receptor 1,OXGR1)在睾丸组织中高丰度表达[24]。但OXGR1在睾丸组织中何种细胞上表达且对雄性动物生殖有何影响目前均不清楚。因此,本试验旨在研究AKG/OXGR1系统对雄性动物睾酮分泌和精子生成的影响,为深入揭示代谢中间产物调控睾酮分泌和精子生成的分子机制提供科学依据,且为靶向雄性生殖的营养调控策略提供借鉴价值。
1 材料与方法 1.1 试验动物与试验设计试验所用雄性C57BL/6J小鼠购自广东省医学实验动物中心。酮戊二酸受体1敲除(OXGR1 knockout,OXGR1KO)小鼠购自上海南方模式生物研究中心,是以C57BL/6J为遗传背景进行设计。
为研究OXGR1KO对雄性小鼠血清睾酮含量和精子生成的影响,选取10周龄雄性C57BL/6J小鼠和OXGR1KO小鼠各6只,并按体重随机分成2组(n=3)。
为研究急性注射AKG对雄性C57BL/6J小鼠睾酮分泌的作用,在急性试验中,首先选取16只10周龄雄性C57BL/6J小鼠,按体重随机分成4组(n=4),分别为对照组和注射1、5、10 mg/kg AKG组。再选取10周龄雄性WT小鼠和OXGR1KO小鼠各12只,并按体重随机分成4组(n=3),每组注射5 mg/kg AKG 6 h后检测血清睾酮含量。
为研究AKG对TM3细胞睾酮分泌和胞内瞬时钙离子信号的影响,选取TM3细胞系,分别用不同浓度AKG以及不同浓度AKG和100 ng/mL促黄体生成素(LH)共处理TM3细胞24 h后,检测TM3细胞上清液睾酮含量,并使用200 μmol/L AKG处理TM3细胞检测细胞内瞬时钙离子浓度。
为研究长期添加AKG对雄性小鼠血清睾酮含量和精子生成的影响,在长期试验中,首先选取12只8周龄雄性C57BL/6J小鼠,按体重随机分成2组(n=6),分别是对照组和饮水添加2%AKG组。再选取8周龄雄性C57BL/6J小鼠和OXGR1KO小鼠各12只,按体重随机分成4组(n=6),分别是对照组、对照饮水添加2%AKG组、OXGR1敲除组和OXGR1敲除饮水添加2%AKG组。在室温(23±3) ℃、相对湿度(70±10)%的条件下,进行12 h循环光照试验。对照组和OXGR1敲除组常规饮水,饲喂基础饲粮,对照饮水添加2%AKG组和OXGR1敲除饮水添加2%AKG组饲喂基础饲粮并在饮水中添加2%的α-酮戊二酸钠(S30041,上海源叶生物科技有限公司),并调pH至与对照组和OXGR1敲除组相同(pH=7.4)。本试验饮水AKG添加量是根据Yuan等[22]试验中使用的饮水AKG添加量(2%)所确定。基础饲粮组成及营养水平见表 1。试验期为4周。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
OXGR1KO试验结束后,用异氟烷麻醉小鼠,眼球采血,放置至血清析出,3 000 r/min离心15 min,收集血清于-20 ℃保存待测。采血后用颈椎脱臼法处死小鼠,75%乙醇涂抹小鼠腹部,用手术剪剪开下腹部,开腹后立即采集睾丸置于睾丸组织固定液(G1121,武汉赛维尔生物科技有限公司)中固定24 h,固定结束后置于70%乙醇中脱水保存。另一侧睾丸采集后置于冻存管,立即投入液氮保存,之后放入-80 ℃冰箱保存备用。急性试验结束后,收集血清于-20 ℃保存待测。长期试验结束后,收集血清和睾丸于-20 ℃和睾丸组织固定液中保存待测。
1.3 样品测定 1.3.1 睾丸OXGR1分布的测定使用最佳切割温度复合物(OCT)包埋小鼠睾丸并以10 μm的厚度制作睾丸冰冻切片。切片在37 ℃湿盒中经羊血清封闭30 min后与兔抗OXGR1一抗(1:1 000,ab140630,Abcam公司,英国)和鼠抗3β-羟类固醇脱氢酶(3β-HSD)一抗(1:1 000,sc515120,Santa Cruz Biotechnology公司,美国)孵育过夜,磷酸盐缓冲液(PBS)清洗3次,每次5 min。然后与三氢-吲哚菁类(Cy3)标记山羊抗兔免疫球蛋白G(IgG)二抗和异硫氰酸荧光素(FITC)标记山羊抗鼠IgG二抗,室温下孵育1 h,PBS清洗3次,每次5 min。待样本风干后用含4′, 6-二脒基-2-苯基吲哚二盐酸盐(DAPI)的抗荧光淬灭封片剂(0100-20,SouthernBiotech公司,美国)封片,荧光显微镜(NIKON ECLIPSE Ti,Nikon公司,日本)下观察并拍摄。
1.3.2 睾丸形态和曲细精管空腔面积的测定OXGR1KO试验和长期试验结束后,取固定后的睾丸,经冲水、梯度酒精脱水、二甲苯透明、石蜡包埋等处理后,以5 μm的厚度切片,常规苏木精-伊红(HE)染色,二甲苯透明,中性树胶封片。显微镜(AMEX1000,Thermo Fisher Scientific公司,美国)下观察并拍照。使用ImageJ 1.8.0软件统计睾丸曲细精管空腔面积。
1.3.3 血清睾酮含量的测定OXGR1KO试验、急性试验和长期试验结束后,取-20 ℃保存的血清,使用血清睾酮检测试剂盒(KGE010,R&D Systems公司,美国)测定小鼠血清睾酮含量。
1.3.4 睾丸样本实时荧光定量的测定OXGR1KO试验结束后,取-80 ℃保存的睾丸组织,经全自动样品快速研磨仪(JXFSTPRP-32,上海净信实业发展有限公司)充分研磨后,使用Trizol法抽提小鼠睾丸组织的总RNA,用核酸蛋白测定仪(N60-Touch,NanoPhotometer公司,德国)测定RNA浓度/纯度后反转录合成cDNA,通过实时荧光定量PCR检测精子生成相关标志基因mRNA表达,包括代表精原细胞的早幼粒细胞白血病锌指基因(promyelocytic leukaemia zinc finger,Plzf),代表支持细胞的β-微管蛋白Ⅲ(class Ⅲ beta-tubulin,Tubb3)、性别决定基因盒9(sex-determining region Y box 9,Sox9),代表精母细胞的联会复合体蛋白3(synaptonemalcomplex protein 3,Scp3),代表精子凝集的鱼精蛋白1(protamines 1,Prm1)、鱼精蛋白2(protamines 2,Prm2)、核变蛋白1(transition nuclear proteins 1,Tnp1)、外质特化蛋白(ectoplasmic specialization protein,Espin)[25]。以β-肌动蛋白(β-actin)作为内参,对数据进行处理。基于各目的基因与内参基因的扩增效率接近,根据公式计算目的基因相对于内参基因的比值来反映各基因的相对表达水平:2-ΔΔCt=2-(Ct目的基因-Ct内参基因),其中,Ct目的基因为目的基因的Ct值,Ct内参基因为内参基因的Ct值。所有引物均依据NCBI数据库公布的小鼠基因序列进行设计,由生工生物工程(上海)股份有限公司合成。引物序列见表 2。
|
|
表 2 实时荧光定量PCR所用引物序列 Table 2 Primers used for real-time quantitative PCR |
短期试验期间,对照组腹腔注射200 μL生理盐水,试验组腹腔注射200 μL浓度为5 mg/kg AKG溶液。注射后6 h进行试验。取一内径30 mm、长度300 mm的圆管,将2组小鼠分别置于两端,观察小鼠在管内的运动情况。先被顶出圆管的一方定义为“loser”,另一方则定义为“winner”。2组小鼠分别交叉配对,每次统计各自loser和winner的次数。
1.3.6 小鼠睾丸间质细胞上清睾酮含量的测定将生长状态良好的睾丸间质细胞系(TM3)接种于24孔板,待细胞贴壁后将其分成2组。对照组加含0.1%牛血清白蛋白(BSA)、1×胰岛素-转铁蛋白-硒(insulin-transferrin-selenium,ITS)无酚红杜氏培养基(dulbecco’s modified eagle medium,DMEM),试验组加含0.1%BSA、1×ITS、不同浓度AKG的无酚红DMEM。在处理24 h后收集细胞上清液,并用酶联免疫吸附剂测定(ELISA)试剂盒检测睾酮含量的变化[26]。
1.3.7 小鼠TM3细胞内瞬时钙离子信号的测定将生长状态良好的TM3细胞接种到24孔板,待细胞生长至50%融合时使用Hanks平衡盐溶液(Hanks balanced salt solutions,HBSS)缓冲液清洗细胞2次,将钙离子荧光探针Fluo-8 AM(21096,AAT Bioquest公司,美国)溶于二甲基亚砜(Dimethyl sulfoxide,DMSO)缓冲液并稀释至10 μmol/L的工作液。每孔加入200 μL钙探针缓冲液,置于37 ℃、含5% CO2的培养箱中孵育1 h后取出,使用HBSS缓冲液清洗细胞2次,置于荧光显微镜下拍照。
1.3.8 小鼠爪抓力的测定长期试验结束后,使用抓力测定仪(BIO-GS3,Bioseb公司,法国)检测小鼠爪抓力。将小鼠4只鼠爪抓在金属网格上,轻轻拖动尾巴向后拉直到小鼠无法抓住金属网格为止。每只小鼠进行8次试验,并用平均值来代表每只小鼠的爪抓力。
1.4 数据统计试验数据结果用平均值±均值标准误(SEM)表示。使用Graphpad Prism 8.0.2软件对数据进行单因素方差分析(one-way ANOVA),P < 0.05表示差异显著。
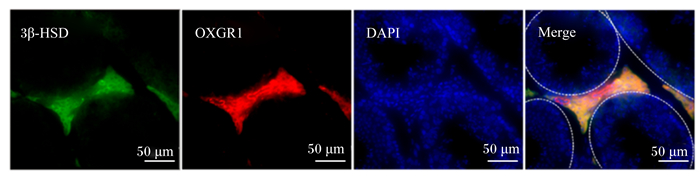
2 结果与分析 2.1 OXGR1在小鼠睾丸组织中的细胞定位He等[24]研究表明,OXGR1在小鼠睾丸组织大量表达,但目前尚无文章报道OXGR1在睾丸何种细胞中表达。对睾丸组织OXGR1与睾丸间质细胞特异性标志物3β-HSD共定位染色发现,OXGR1特异性在睾丸间质细胞中表达(图 1)。
|
3β-HSD:3β-羟类固醇脱氢酶3β-hydroxysteroid dehydrogenase;DAPI:4′, 6-二脒基-2-苯基吲哚二盐酸盐4′,6-diamidino-2-phenylindole;OXGR1:酮戊二酸受体1 oxoglutarate receptor 1;Merge:合并。 睾丸间质细胞用3β-HSD(绿色)染色,细胞核用DAPI(蓝色)染色,比例尺为50 μm。 Leydig cells were stained with 3β-HSD (green), nuclei were stained with DAPI (blue). Scale bar was 50 μm. 图 1 OXGR1在小鼠睾丸组织中的分布 Fig. 1 OXGR1 distribution in mice testis |
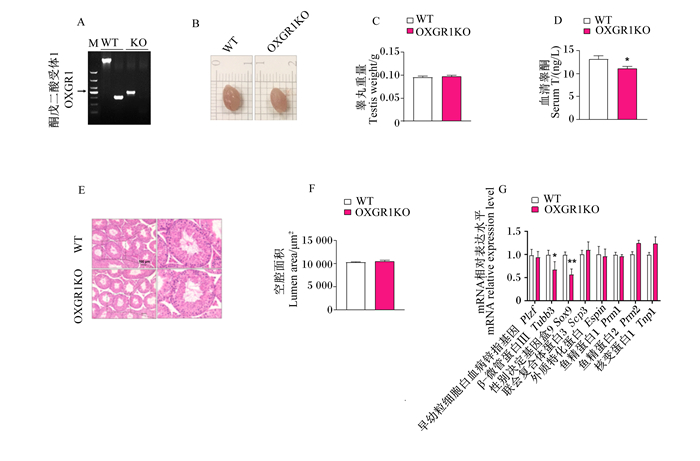
OXGR1KO(图 2-A)对小鼠睾丸形态大小无明显影响(图 2-B),且对小鼠睾丸重量也无显著影响(P>0.05)(图 2-C)。而ELISA结果表明,与对照组相比,OXGR1KO显著降低了小鼠血清睾酮含量(P < 0.05)(图 2-D)。此外,OXGR1KO对睾丸曲细精管管腔形态无明显影响(图 2-E),且对睾丸曲细精管空腔面积也无显著影响(P>0.05)(图 2-F)。实时荧光定量PCR结果表明,OXGR1KO显著或极显著下调了睾丸支持细胞标志基因Tubb3、Sox9的mRNA相对表达水平(P < 0.05或P < 0.01)(图 2-G)。
|
A:OXGR1KO验证图;B、C:睾丸大小图和睾丸重量统计图;D:血清睾酮含量统计图;E、F:睾丸HE染色及空腔面积统计图;G:睾丸精子生成相关标志基因mRNA表达。 WT:对照组;OXGR1KO:OXGR1KO组。数据柱形标注*表示差异显著(P < 0.05),标注**表示差异极显著(P < 0.01)。图 5同。 A: validation diagram of OXGR1KO; B, C: image of testis size and statistical chart of testicular weight: D: statistical chart of serum testosterone content; E, F: HE staining image of testis and statistical chart of lumen area; G: mRNA expression of genes related to testis spermatogenesis. WT: control group; OXGR1KO: OXGR1KO group. Values columns with * mean significant difference (P < 0.05), and with ** mean extremely significant difference (P < 0.01). The same as Fig. 5. 图 2 OXGR1KO对雄性小鼠血清睾酮含量和精子生成的影响 Fig. 2 Effects of OXGR1KO on serum testosterone content and spermatogenesis of male mice |
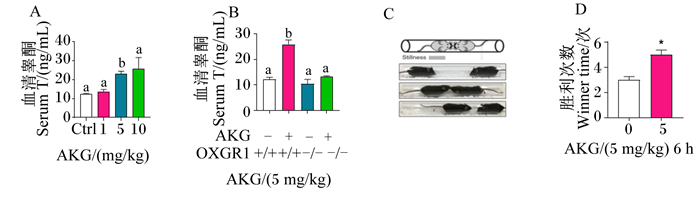
与对照组相比,注射5 mg/kg的AKG 6 h后可显著增加小鼠血清睾酮含量(P < 0.05)(图 3-A)。而OXGR1KO显著逆转了AKG升高血清睾酮含量的效应(P < 0.05)(图 3-B)。由于血清睾酮含量与小鼠攻击行为呈正相关[26],于是对小鼠的攻击行为检测发现,腹腔急性注射5 mg/kg的AKG 6 h后可显著增加小鼠的攻击性(P < 0.05)(图 3-C、图 3-D)。
|
A、B:血清睾酮含量统计图;C:小鼠试管攻击行为试验示意图;D:小鼠胜利次数统计图。 Ctrl:对照组;AKG:α-酮戊二酸;OXGR1:酮戊二酸受体1。数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。 A, B: statistical chart of serum testosterone content; C: schematic diagram of test tube aggressive behavior of mice; D: statistical chart of mice winner times. Ctrl: control group; AKG: α-ketoglutaric acid; OXGR1: oxoglutarate receptor 1. Value columns with the same small letter mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 3 急性注射AKG对雄性小鼠血清睾酮含量和攻击行为的影响 Fig. 3 Effects of acute injection of AKG on serum testosterone content and aggressive behavior of male mice |
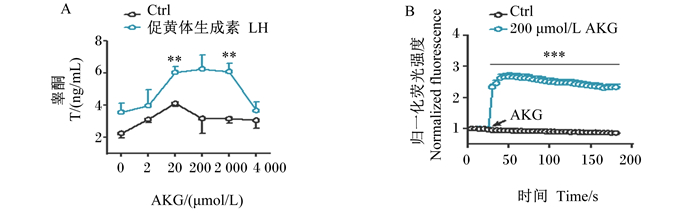
LH处理TM3细胞24 h后提高了TM3细胞上清睾酮含量,且与20和2 000 μmol/L AKG共处理24 h后可极显著提高TM3细胞上清睾酮含量(P < 0.01)(图 4-A)。200 μmol/L AKG处理TM3细胞后可极显著增加胞内瞬时钙离子的释放(P < 0.01)(图 4-B)。
|
A:TM3细胞上清睾酮含量统计图;B:TM3细胞内瞬时钙离子浓度变化统计图。 数据标注**表示差异极显著(P < 0.01)。 A: statistical chart of TM3 cells supernatant testosterone content; B: statistical chart of instantaneous calcium ion concentration change in TM3 cells. Values with ** mean extremely significant difference (P < 0.01). 图 4 AKG对TM3细胞睾酮分泌和细胞内瞬时钙离子信号的影响 Fig. 4 Effects of AKG on testosterone secretion and intracellular instantaneous calcium ion signal in TM3 cells |
与对照组相比,长期饮水添加2%AKG可极显著增加小鼠第10、11和12周的体重(P < 0.01)(图 5-A),且可极显著增加小鼠爪抓力(P < 0.01)(图 5-B)。此外,饮水添加2%AKG可极显著增加小鼠睾丸重量(P < 0.01)(图 5-C、图 5-D)。睾丸组织HE染色结果显示,饮水添加2%AKG可极显著减少曲细精管空腔面积(P < 0.01)(图 5-E、图 5-F),从而促进精子生成[19]。此外,饮水添加2%AKG可极显著增加小鼠血清睾酮含量(P < 0.01)(图 5-G)。而OXGR1KO显著逆转了AKG减少曲细精管空腔面积和血清睾酮含量的效应(P < 0.05)(图 5-H、图 5-I、图 5-J)。
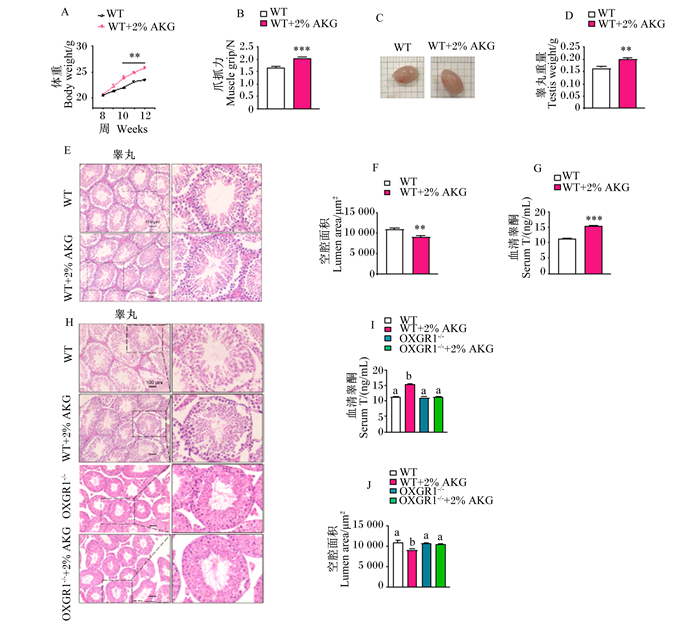
|
A:体重统计图;B:爪抓力统计图;C:睾丸示意图;D:睾丸重量统计图;E、F、H、J:睾丸HE染色及空腔面积统计图;G、I:血清睾酮含量统计图。WT:对照组;AKG:α-酮戊二酸;OXGR1:酮戊二酸受体1。 A: statistical chart of body weight; B: statistical chart of claw grip; C: diagrammatic sketch of testis; D: statistical chart of testis weight; E, F, H and J: HE staining images and statistical chart of testicular seminiferous tubules; G and I: statistical chart of serum testosterone content. WT: control group; AKG: α-酮戊二酸α-ketoglutaric acid; OXGR1: 酮戊二酸受体1 oxoglutarate receptor 1. 图 5 长期饮水添加AKG对雄性WT/OXGR1KO小鼠血清睾酮含量和精子生成的影响 Fig. 5 Effects of long-term supplementation of AKG on serum testosterone content and spermatogenesis in male WT/OXGR1KO mice |
运动可产生多种代谢产物进而调控雄性动物生殖能力。Saraf等[20]研究表明,运动产生的L-苹果酸不仅参与了精子线粒体中丙酮酸的氧化,而且对提高精子活力和受精率都十分重要。Yuan等[22]研究发现,耐力运动产生的代谢物黄嘌呤含量在血清中明显下降,而黄嘌呤是男性不育的生物标志物[27],这意味着耐力运动可间接改善精子质量。此外,运动产生的琥珀酸被发现在弱精子症患者的精液中显著降低[21],这同样说明琥珀酸对调控精子质量十分关键。而AKG作为运动产生的关键代谢中间产物,对其调控雄性动物睾酮含量和精子发生的研究鲜有报道。本研究发现,AKG的受体OXGR1在睾丸间质细胞中高丰度表达,OXGR1KO可显著降低小鼠血清睾酮含量和Tubb3、Sox9等精子发生相关标志基因mRNA相对表达丰度。腹腔急性注射AKG可通过OXGR1显著提高小鼠血清睾酮含量和攻击性。使用AKG和LH共处理小鼠TM3细胞发现,AKG可以浓度依赖性的方式提高TM3细胞上清睾酮含量,其调控机制可能由胞内瞬时钙离子信号介导。长期饮水添加AKG可通过OXGR1减少曲细精管空腔面积,提高血清睾酮含量。总之,AKG可通过睾丸间质细胞上的OXGR1提高雄性动物睾酮含量,促进精子生成。这为采用运动替代营养策略治疗雄性激素分泌不足、精子发生障碍等雄性不育疾病提供了研究依据。
OXGR1作为一种定位于质膜上的G蛋白偶联受体,参与了机体广泛的生理学过程。Cherif等[28]研究表明,分布在视网膜神经节细胞(retinal ganglion cell,RGC)上的OXGR1参与了RGC向丘脑的投射。Liu等[29]研究发现,脂肪细胞中的OXGR1可介导AKG抑制信号转导因子和转录激活因子3(signal transducer and activator of transcription 3,STAT3)/核因子-κB(nuclear factor kappa-B,NF-κB)信号通路,从而减轻脂肪细胞炎症。Wang等[30]研究也发现,成纤维细胞中的OXGR1可通过调控磷脂酰肌醇-4, 5-二磷酸3-激酶催化亚基(phosphatidylinositol-4, 5-bisphosphate 3-kinase catalytic subunit gamma,PIK3CG)/AKT丝氨酸/苏氨酸激酶1(AKT serine/threonine kinase 1,AKT1)信号通路介导成纤维细胞的生长和分化。而本研究发现,OXGR1KO可显著降低小鼠血清睾酮含量,表明OXGR1对小鼠血清睾酮分泌具有重要作用。此外,雄性动物基础血清睾酮含量相对恒定的维持主要依靠LH的调节,OXGR1可能介导了其中一部分作用,且运动产生的AKG可通过OXGR1进一步促进血清睾酮的分泌。
AKG作为三羧酸循环重要代谢中间产物,对促进机体生长发育、调节机体能量代谢、维持机体肠道健康、改善机体免疫力等都具有积极作用。AKG的受体OXGR1也介导了机体肾小管酸碱平衡调节、脂肪细胞炎症、成纤维细胞生长发育等生理过程。本研究发现,急性注射AKG和长期饮水添加AKG均可显著提高小鼠血清睾酮含量,且AKG与LH共处理TM3细胞系同样可显著增加细胞上清睾酮含量。睾酮作为一种调节雄性动物生长发育的类固醇激素,不仅对精子的发生至关重要[31],而且对动物的行为有重要的调控作用[32]。睾酮的分泌受睾丸间质细胞和下丘脑-垂体分泌的激素的影响。陈静[33]研究发现,下丘脑分泌的促性腺激素释放激素(gonadotropin releasing hormone,GnRH)可上调类固醇生成蛋白和合成酶的表达从而刺激睾酮的分泌。Xu等[34]研究发现,钙网膜蛋白可上调睾丸间质细胞胞内钙离子水平从而促进睾酮分泌。而本研究发现,AKG可显著增加TM3细胞内瞬时钙离子的释放,且与LH共处理能显著上调TM3细胞上清睾酮含量。这表明,AKG可能通过TM3细胞上OXGR1促进胞内瞬时钙离子的释放进而促进睾酮的分泌,并最终对雄性动物的生殖能力和行为调控产生积极影响。由于促黄体生成素受体(LHR)胞内信号通路也需要钙离子信号介导[35],且LHR可与G蛋白偶联受体(G protein-coupled receptors,GPCRs)直接形成异源二聚体[36],对于LHR和OXGR1之间有无互作仍有待进一步深入研究。
4 结论AKG可通过睾丸间质细胞中的OXGR1促进雄性小鼠睾酮分泌,影响曲细精管发育和精子生成。
| [1] |
LI D R, MENG L J, XU T, et al. RIPK1-RIPK3-MLKL-dependent necrosis promotes the aging of mouse male reproductive system[J]. eLife, 2017, 6: e27692. DOI:10.7554/eLife.27692 |
| [2] |
RICHARDSON A, JAYAPRAKASAN K. The use of androgen priming in women with reduced ovarian reserve undergoing assisted reproductive technology[J]. Seminars in Reproductive Medicine, 2021, 39(5/6): 207-219. |
| [3] |
SEIFI-JAMADI A, ZHANDI M, KOHRAM H, et al. Influence of seasonal differences on semen quality and subsequent embryo development of Belgian blue bulls[J]. Theriogenology, 2020, 158: 8-17. DOI:10.1016/j.theriogenology.2020.08.037 |
| [4] |
PRESTON B T, SAINT JALME M, HINGRAT Y, et al. The sperm of aging male bustards retards their offspring's development[J]. Nature Communications, 2015, 6: 6146. DOI:10.1038/ncomms7146 |
| [5] |
AGARWAL A, MULGUND A, HAMADA A, et al. A unique view on male infertility around the globe[J]. Reproductive Biology and Endocrinology, 2015, 13: 37. DOI:10.1186/s12958-015-0032-1 |
| [6] |
OLIA BAGHERI F, ALIZADEH A, SADIGHI GILANI M A, et al. Role of peroxisome proliferator-activated receptor gamma (PPARγ) in the regulation of fatty acid metabolism related gene expressions in testis of men with impaired spermatogenesis[J]. Reproductive Biology, 2021, 21(4): 100543. DOI:10.1016/j.repbio.2021.100543 |
| [7] |
GRISWOLD M D. Spermatogenesis: the commitment to meiosis[J]. Physiological Reviews, 2016, 96(1): 1-17. DOI:10.1152/physrev.00013.2015 |
| [8] |
石磊, 牛宏泽, 姚晓磊, 等. 不同饲喂水平对绵羊睾丸发育、睾酮合成相关基因及雄激素受体(AR)表达的影响[J]. 畜牧兽医学报, 2021, 52(5): 1317-1327. SHI L, NIU H Z, YAO X L, et al. Effects of different feeding levels on testis development and the expression of steroidogenesis-related genes and androgen receptor (AR) in sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(5): 1317-1327 (in Chinese). |
| [9] |
胡智添. 呼吸暴露碳黑纳米颗粒对雄性小鼠生殖功能的影响[D]. 硕士学位论文. 兰州: 兰州大学, 2021. HU Z T. Effects of carbon black nanoparticles by respiratory exposure on reproductive function in male mice[D]. Master's Thesis. Lanzhou: Lanzhou University, 2021. (in Chinese) |
| [10] |
PANG J, LI F Z, FENG X, et al. Influences of different dietary energy level on sheep testicular development associated with AMPK/ULK1/autophagy pathway[J]. Theriogenology, 2018, 108: 362-370. DOI:10.1016/j.theriogenology.2017.12.017 |
| [11] |
李碧波, 雷耀庚, 王兴涛, 等. 不同能量水平和采精频率对绒山羊种公羊精液品质的影响[J]. 中国畜牧兽医, 2015, 42(8): 2116-2123. LI B B, LEI Y G, WANG X T, et al. Effects of different dietary energy level and semen collection frequency on buck's semen quality in cashmere goats[J]. China Animal Husbandry & Veterinary Medicine, 2015, 42(8): 2116-2123 (in Chinese). |
| [12] |
MU Y, DAI H G, LUO L B, et al. Irisin alleviates obesity-related spermatogenesis dysfunction via the regulation of the AMPKα signalling pathway[J]. Reproductive Biology and Endocrinology, 2021, 19(1): 135. DOI:10.1186/s12958-021-00821-1 |
| [13] |
OLADELE C A, AKINTAYO C O, BADEJOGBIN O C, et al. Melatonin ameliorates endocrine dysfunction and defective sperm integrity associated with high-fat diet-induced obesity in male Wistar rats[J]. Andrologia, 2021, e14242. |
| [14] |
SERTORIO M N, ESTADELLA D, RIBEIRO D A, et al. Could parental high-fat intake program the reproductive health of male offspring?A review[J]. Critical Reviews in Food Science and Nutrition, 2021, 1-8. |
| [15] |
HU S Q, LIU D L, LIU S J, et al. Lycium barbarum polysaccharide ameliorates heat-stress-induced impairment of primary sertoli cells and the blood-testis barrier in rat via androgen receptor and Akt phosphorylation[J]. Evidence-based Complementary and Alternative Medicine, 2021, 2021: 5574202. |
| [16] |
FRIEDENREICH C M, WOOLCOTT C G, MCTIERNAN A, et al. Alberta physical activity and breast cancer prevention trial: sex hormone changes in a year-long exercise intervention among postmenopausal women[J]. Journal of Clinical Oncology, 2010, 28(9): 1458-1466. DOI:10.1200/JCO.2009.24.9557 |
| [17] |
LI Y H, YANG J, WANG Y Q, et al. Effects of a blood flow restriction exercise under different pressures on testosterone, growth hormone, and insulin-like growth factor levels[J]. Journal of International Medical Research, 2021, 49(9): 3000605211039564. |
| [18] |
SEKINE Y, HIROSE N. Maturity-associated variations in resistance exercise-induced hormonal responses in young male athletes[J]. Pediatric Exercise Science, 2021, 1-8. |
| [19] |
张姹, 魏易焓, 卢静怡, 等. 不同运动方式和运动时间对小鼠睾酮分泌和精子生成的影响[J]. 中国畜牧杂志, 2021, 57(2): 96-100. ZHANG C, WEI Y H, LU J Y, et al. Effects of different exercise modes and exercise time on testosterone secretion and spermatogenesis in mice[J]. Chinese Journal of Animal Science, 2021, 57(2): 96-100 (in Chinese). |
| [20] |
SARAF K K, KUMARESAN A, DASGUPTA M, et al. Metabolomic fingerprinting of bull spermatozoa for identification of fertility signature metabolites[J]. Molecular Reproduction and Development, 2020, 87(6): 692-703. DOI:10.1002/mrd.23354 |
| [21] |
CHEN L G, WEN C W, DENG M J, et al. Metabolic and transcriptional changes in seminal plasma of asthenozoospermia patients[J]. Biomedical Chromatography, 2020, 34(3): e4769. |
| [22] |
YUAN Y X, XU P W, JIANG Q Y, et al. Exercise-induced α-ketoglutaric acid stimulates muscle hypertrophy and fat loss through OXGR1-dependent adrenal activation[J]. The EMBO Journal, 2020, 39(7): e103304. |
| [23] |
BAYLIAK M M, LUSHCHAK V I. Pleiotropic effects of alpha-ketoglutarate as a potential anti-ageing agent[J]. Ageing Research Reviews, 2021, 66: 101237. DOI:10.1016/j.arr.2020.101237 |
| [24] |
HE W H, MIAO F J P, LIN D C H, et al. Citric acid cycle intermediates as ligands for orphan G-protein-coupled receptors[J]. Nature, 2004, 429(6988): 188-193. DOI:10.1038/nature02488 |
| [25] |
WANG H R, ZHAO R, GUO C, et al. Knockout of BRD7 results in impaired spermatogenesis and male infertility[J]. Scientific Reports, 2016, 6(1): 21776. DOI:10.1038/srep21776 |
| [26] |
李翠梅. 双酚A通过生物钟基因Nr1d1影响睾酮合成的机制研究[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2019. LI C M. Reseach on bisphenol a regulation of testosterone synthesis through circadian clock gene Nr1d1[D]. Master's Thesis. Yangling: Northwest A & F University, 2019. (in Chinese) |
| [27] |
HU W Y, DONG T Y, WANG L L, et al. Obesity aggravates toxic effect of BPA on spermatogenesis[J]. Environment International, 2017, 105: 56-65. DOI:10.1016/j.envint.2017.04.014 |
| [28] |
CHERIF H, DUHAMEL F, CÉCYRE B, et al. Receptors of intermediates of carbohydrate metabolism, GPR91 and GPR99, mediate axon growth[J]. PLoS Biology, 2018, 16(5): e2003619. DOI:10.1371/journal.pbio.2003619 |
| [29] |
LIU Z J, GAN L, ZHANG T T, et al. Melatonin alleviates adipose inflammation through elevating α-ketoglutarate and diverting adipose-derived exosomes to macrophages in mice[J]. Journal of Pineal Research, 2018, 64(1): e12455. DOI:10.1111/jpi.12455 |
| [30] |
WANG Q, ZHANG Q W, ZHANG Y, et al. Yak OXGR1 promotes fibroblast proliferation via the PI3K/AKT pathways[J]. Journal of Cellular Biochemistry, 2019, 120(4): 6729-6740. DOI:10.1002/jcb.27970 |
| [31] |
HAMMES S R, LEVIN E R. Impact of estrogens in males and androgens in females[J]. The Journal of Clinical Investigation, 2019, 129(5): 1818-1826. DOI:10.1172/JCI125755 |
| [32] |
林勇, 何成添, 范碧霞, 等. 躁狂患者血清睾酮水平与暴力行为倾向及认同的相关性[J]. 临床精神医学杂志, 2021, 31(2): 127-129. LIN Y, HE C T, FAN B X, et al. Study on the correlation between levels of serum testosterone and violence tendency and acceptance in the euthymic manic patients[J]. Journal of Clinical Psychiatry, 2021, 31(2): 127-129 (in Chinese). |
| [33] |
陈静. 活性氧介导的GCN2/eIF2α通路在微囊藻毒素-LR导致小鼠睾丸睾酮合成障碍中的作用[D]. 硕士学位论文. 合肥: 安徽医科大学, 2021. CHEN J. Microcystin-LR inhibits testosterone synthesis via reactive oxygen species-mediated GCN2/eIF2α pathway in mouse testis[D]. Master's Thesis. Hefei: Anhui Medical University, 2021. (in Chinese) |
| [34] |
XU W D, ZHU Q, LIU S, et al. Calretinin participates in regulating steroidogenesis by PLC-Ca2+-PKC pathway in Leydig cells[J]. Scientific Reports, 2018, 8(1): 7403. |
| [35] |
CARTER R W, KANAGY N L. Tyrosine kinases regulate intracellular calcium during alpha(2)-adrenergic contraction in rat aorta[J]. American Journal of Physiology: Heart and Circulatory Physiology, 2002, 283(4): H1673-H1680. |
| [36] |
WANG Y Y, CHEN F F, YE L P, et al. Steroidogenesis in leydig cells: effects of aging and environmental factors[J]. Reproduction, 2017, 154(4): R111-R122. |




