甲烷(CH4)是一种全球气候变暖潜力巨大的温室气体,在100年内, 其全球变暖潜力是二氧化碳(CO2)的28~34倍[1], 但在释放后的10~20年内,其温室效应是CO2的80倍[2]。从全球来看,反刍动物胃肠道CH4排放量占温室气体排放总量的3%~5%[3]。人们认为CH4排放量的减少是实现《巴黎协定》目标的一种手段,目的是将全球气候稳定在工业化前水平之上(减少1.5 ℃)[4]。胃肠道CH4排放量也占反刍动物总能量摄入的2%~12%[5]。据联合国预测:到我国建国100周年时,世界总人口约达98亿[6]。同时随着经济社会的发展,人们生活水平的提高,对于奶和肉的需求也会极大的提升。毋庸置疑,全球畜牧业都将会面临着反刍动物胃肠道CH4排放的极大挑战。因此,当务之急是需要通过饲粮的管理策略来减少CH4的排放量,逐步实现从碳达峰到碳中和的目标。
1 减少反刍动物瘤胃CH4排放量的措施目前国内降低反刍动物瘤胃CH4烷排放量的措施有:一是通过饲养措施,控制CH4排放,如改变反刍动物饲粮的营养成分组成、控制乙酸和丙酸的比例、增加饲喂的次数(如1次少量饲喂,多次添加)、饲料进行粉碎或制粒[7];二是通过驱原虫技术,降低CH4排放,如在饲粮中添加硫辛酸或含饱和脂肪酸的过瘤胃保护性脂肪来驱除原虫或降低原虫数量、提供电子接受体(如三羧酸循环中的琥珀酸、延胡索酸等中间代谢产物)、添加植物提取物(如单宁、皂素和植物精油)来促进丙酸生成进而降低CH4生成、添加卤族化合物和衍生物(如溴氯甲烷、溴乙烷磺酸、氯化脂肪酸、亚硝酸盐等)以及添加离子载体(如莫能菌素、拉沙里菌素等)[8];三是通过免疫法和噬菌体或细菌素等微生物手段来调控CH4的生成[8]。而上述这些调控CH4生成的方法存在着持续时间短、微生物的适应性和耐受性、宿主的高度特异性、纤维消化率的降低以及毒性等问题,因此在反刍动物生产中应用有所局限性。最近几年,国外的一些学者把注意力转向了CH4的竞争性抑制上并且进行了一系列的试验验证,他们认为用CH4抑制剂补充到饲粮中显示了巨大的CH4缓解潜力,此抑制剂为3-硝基氧基丙醇(3-NOP),这是一种结构类似于甲基辅酶M的化合物[9]。研究表明,饲粮中添加3-NOP可持续降低肉牛和奶牛CH4排放量的20%~80%[10],对动物并没有毒性迹象或饲料消化率下降的现象[11-12]。
2 3-NOP的化学结构和代谢特性3-NOP是由瑞士DSM营养产品有限公司开发的一种小分子有机化合物[13]。3-NOP具有水溶性[14],分子式为C3H7NO4[15]。此物质是一种独特的化合物:它有2个官能团,分别是伯醇和有机硝酸酯基团,并代谢为内源性化合物,即2个主要的代谢步骤是先将伯醇氧化成相应的羧酸,生成3-硝基氧基丙酸(NOPA),然后进行硝酸酯裂解并生成3-羟基丙酸(HPA)参与机体内的代谢[16]。其结构式以及血浆代谢产物见图 1[16]。Thiel等[11, 16]在细菌反向突变试验和大鼠骨髓口服活体微核试验中发现,3-NOP及其代谢产物并无致突变性和遗传毒性;Zhang等[17]在安格斯杂交肉牛的试验中同样发现,饲粮中添加3-NOP除了极大地增加了肉牛对氢气(H2)的排放之外,对动物并没有毒性迹象。
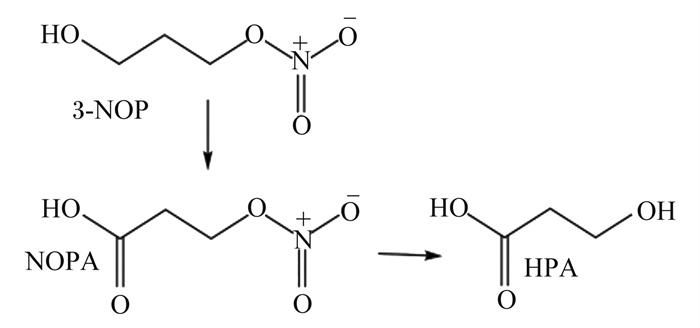
|
图 1 3-NOP及其血浆代谢物NOPA和HPA的化学结构 Fig. 1 Chemical structure of 3-NOP and its plasma metabolites NOPA and HPA[16] |
瘤胃内CH4的生成过程十分复杂。简单来说,主要是由数种产甲烷菌通过H2还原CO2所产生[18]。产甲烷菌是严格的厌氧古菌,在形态学上,产甲烷菌呈现出多种多样的形状和大小,包括棒状杆菌、规则和不规则球菌、长链棒状杆菌、螺旋菌属和八联球菌属以及不规则、异常扁平板菌属[19-20]。该菌对抑制细菌细胞壁合成的抗生素,如青霉素、环丝氨酸和缬氨酸霉素等不敏感[21]。瘤胃微生物是反刍动物瘤胃中的主要产甲烷菌,尽管有些产甲烷菌是通过ATP获得能量,供产甲烷菌生长,但实际上所有产甲烷菌的生长都是由乙酸盐刺激的,所有产甲烷菌都需要微量金属,如镍、某些酶和辅酶的化合物、铁和钴[22]。比如在产甲烷菌中发现了许多独特的辅酶,其中大多数参与CH4生成,包括甲基呋喃、四氢甲氨蝶呤、去杂黄素F420、辅酶M和HS-辅酶B[23]。此外,反刍动物瘤胃中一些产甲烷菌还需要支链脂肪酸的混合物[24]。目前经研究发现,根据产甲烷菌生成CH4的营养途径类别的不同,可以将其分为3类[25-26]:一是氢营养菌氧化H2和还原CO2生成CH4途径;二是甲基营养型生成CH4途径,即有些产甲烷菌可以利用大量的甲基化合物(甲醇、甲酸盐、甲胺或二甲基硫醚等)生长;三是乙酸营养型途径生成CH4,即产甲烷菌利用乙酸产生CH4。然而,正如Garcia等[27]报道的反刍动物瘤胃中约82%的CH4来自CO2的H2还原,而约18%的CH4来自甲酸盐。经Rouvière等[28]研究发现,产甲烷古菌从CO2和H2到形成CH4可能是一个循环过程并且这种产CH4循环现在被称为沃尔夫循环(Wolfe cycle),见图 2[28]。这种生成CH4的生化机制可以描述为:1)CO2接受2个电子与甲烷呋喃在甲酰甲烷呋喃脱氢酶下转变为甲酰甲烷呋喃;2)甲酰甲烷呋喃与四氢甲烷蝶呤(H4MPT)在H4MPT甲酰转移酶的催化下生成5-甲酰四氢甲烷蝶呤;3)5-甲酰四氢甲烷蝶呤在亚甲基-H4MPT环水解酶的作用下脱水生成甲叉亚甲基四氢甲烷蝶呤;4)甲叉亚甲基四氢甲烷蝶呤在亚甲基-H4MPT脱氢酶和F420还原酶的作用下生成甲叉四氢甲烷蝶呤;5)甲叉四氢甲烷蝶呤在亚甲基-H4MPT还原酶的作用下得到2个电子成为甲基四氢甲烷蝶呤;6)甲基四氢甲烷蝶呤与辅酶M(CoM-SH)在CoM-SH甲基转移酶的催化下生成甲基辅酶M;7)甲基辅酶M(CH3-S-CoM)与7-巯基庚基苏糖磷酸酯(HS-HTP)在甲基辅酶M还原酶的作用下,由F430作为辅酶进而生成CH4。该循环反应构成了由CO2、乙酸盐、甲醇或甲胺生成CH4的最后一步,故而这一循环反应催化生成CH4的关键酶为甲基辅酶M还原酶(MCR)[29]。MCR是一种表观分子质量为300 kD的蛋白质,由3个不同的亚基以α2、β2、γ2构型排列组成,并含有2摩尔紧密但非共价结合的镍卟啉(辅酶F430),作为辅基[30]。Goubeaud等[31]在一项柠檬酸钛还原辅酶F430中的镍离子的试验中认为,辅基F430中的镍必须处于+1价氧化态时,酶才能具有活性,MCR才被激活发挥其作用。MCR可以催化甲基-辅酶M(CH3-S-CoM)和辅酶B(HS-CoB)反应生成CH4和相应的异二硫化物CoM-S-S-COB[32-33]。这种独特的反应是在辅酶F430(镍卟啉)存在的严格厌氧条件下进行的,其反应过程见图 3[34-35]。然而,Duina等[36]在一篇文献中报道,3-NOP中的硝基酯基团可以选择性地与MCR结合,并通过在活性位点将镍离子从氧化态+1价暂时氧化为+2价来灭活其酶[由于F430(Ni2+)/F430(Ni1+)电对的氧化还原电位EΘ′为-600 mV,因此该酶很容易被氧化剂氧化并灭活],从而抑制CH4的生成。
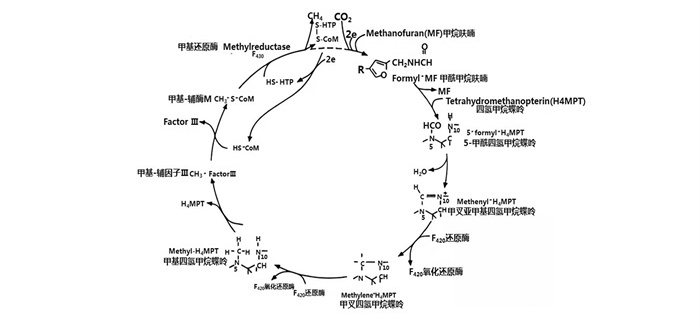
|
图 2 氢氧化产甲烷菌中CO2还原成CH4的Wolfe循环 Fig. 2 Wolfe cycle of CO2 reduction to CH4 in methanogens[28] |
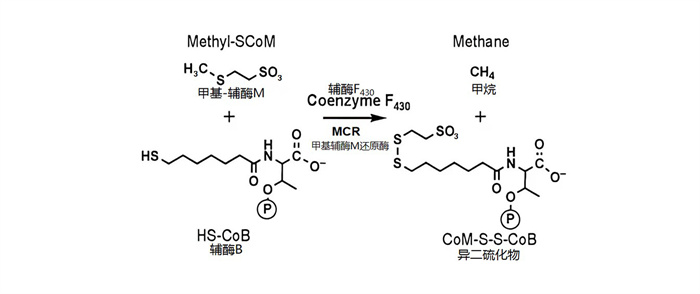
|
图 3 甲基辅酶M还原酶催化甲基-辅酶M为CH4的反应过程 Fig. 3 Methyl coenzyme M reductase catalyzes reaction process of methyl-coenzyme M to CH4[34-35] |
为了验证具有硝基酯基团化合物的3-NOP在反刍动物生产上降低CH4排放量的有效性,Melgar等[37]使用3-NOP在荷斯坦奶牛上以60 mg/kg加入全混合日粮(TMR)干物质(DM)中, 连续饲喂15周,发现3-NOP降低CH4排放量和排放强度达到27%~29%,而且缓解作用持续了15周以上, 同时对产奶量、饲料的消化率以及干物质采食量(DMI)无不利影响, 更值得让人们关注的是这种带有硝基酯基团的3-NOP能以较低的剂量发挥出较大的效用。此外,3-NOP抑制反刍动物瘤胃CH4生成的效应可能是受其添加量的多少所决定的。Romero-Perez等[38]给4头小母牛分别添加0、0.5、1.4和2.8 g/d的带有硝基酯基团化合物的3-NOP,结果发现随着剂量的增加,每头牛的CH4排放总量分别线性减少了3%、13%和38%;Hristov等[10]在荷斯坦奶牛饲粮中分别添加40、60、80 mg/kg带有硝基酯基团化合物的3-NOP,发现CH4的生成量分别减少了20%、25%和29%;Vyas等[39]在生长肥育肉牛饲粮中分别添加0、100和200 mg/kg的带有硝基酯基团化合物的3-NOP,发现添加200 mg/kg 3-NOP,CH4减排的持续性会更久。对于CH4生成量而言,Dijkstra等[40]认为3-NOP对奶牛抑制CH4生成的作用强于肉牛,在肉牛的饲粮中添加3-NOP(144 mg/kg DM)才能达到与奶牛(81 mg/kg DM)CH4减排相同的效果,这可能是与奶牛的更高饲粮摄入水平有关。较高的饲粮摄入水平会增加瘤胃发酵产物的浓度,包括挥发性脂肪酸(VFA)和H2。尽管H2不能从热力学上控制产甲烷古菌的CH4生成,但瘤胃微生物中还原型尼克酰胺腺嘌呤二核苷酸(NADH+)的氧化,以及由此形成的VFA的类型会受到H2分压的调控,从而影响H2在瘤胃中的利用[40]。因此,奶牛比肉牛更高的饲粮摄入水平可能与瘤胃CH4生成的相对更多的H2有关,导致甲基辅酶M的浓度相对较低,从而提高了3-NOP抑制CH4生成的潜力。此外,饲粮纤维含量的增加降低了带有硝基酯基团化合物3-NOP对CH4的抑制效应,Dijkstra等[40]得出,饲粮中中性洗涤纤维(NDF)含量的增加降低了3-NOP减少CH4排放的功效,这可能是由于饲喂低纤维饲粮的牛瘤胃中甲基辅酶M的活性低于饲喂高纤维饲粮的牛。因此,在低纤维饲粮中添加3-NOP可能会更有效地抑制MCR[41]。这就解释了为什么3-NOP在低纤维饲粮中有更大的抑制CH4生成的潜力。
由于3-NOP具有水溶性,其抑制CH4生成的作用可能是短暂的。Reynolds等[42]每天向奶牛瘤胃中直接添加2.5 g/d的3-NOP,奶牛体内的CH4浓度仅下降9%。这可能是因为饲粮消化和3-NOP代谢之间缺乏同步性,导致大量的3-NOP在瘤胃随着瘤胃液外流而流出瘤胃。此外,也很有可能已被瘤胃吸收或被瘤胃微生物代谢[42]。所以将3-NOP混入TMR中,或许是用来饲喂奶牛让3-NOP发挥最大效用的较好办法。
4.2 对反刍动物瘤胃发酵产生的影响杨卓等[43]提到瘤胃液的pH、氨态氮(NH3-N)、VFA以及总挥发性脂肪酸(TVFA)的浓度是用来评估反刍动物瘤胃内发酵程度的指标。Haisan等[44]向奶牛补充2.5 g/d的3-NOP时,瘤胃内的pH在最低水平上有小幅度的增长,NH3-N浓度不受影响,降低了乙酸的摩尔比例,并倾向于增加丙酸的比例,导致乙酸与丙酸的比率降低,然而不影响TVFA的浓度、细菌和原虫的数量,但减少产甲烷菌数量。Romero-Perez等[38]当给小母牛补充2.25和4.50 mg/kg BW的3-NOP时,其瘤胃液的pH始终高于对照组,NH3-N浓度不受影响;当3-NOP添加水平增加至4.50 mg/kg BW时,TVFA浓度呈线性下降。随着3-NOP添加水平的增加,乙酸的摩尔比例降低,丙酸的摩尔比例增加。Jayanegaraa等[45]在一项Meta分析中发现,3-NOP可以降低反刍动物瘤胃内乙酸的浓度,增加丙酸的比例,减少产甲烷古生菌的数量,而不会影响细菌和原生动物的数量,但TVFA的浓度会随着3-NOP添加量的增加呈显著下降,他认为因为VFA可以转化为能量,并且可能为反刍动物提供70%的能量需求。此外,由于3-NOP是CH4的抑制剂,在抑止MCR还原CH3-S-CoM生成CH4的同时必定会有氢离子(H+)的积累,一部分H+会通过无氧酵解、生物氧化、有氧氧化以及磷酸戊糖等途径加强VFA的消耗,可能这就是3-NOP降低TVFA浓度的最好解释了。
4.3 对反刍动物生产性能的影响大量的试验表明,带有硝基酯基团的化合物3-NOP不会影响奶牛的采食量和产奶量,但会增加乳脂浓度和产量。Melgar等[37]在奶牛饲粮中添加60 mg/kg DM的3-NOP,发现3-NOP降低了CH4排放、排放产量和强度,不会影响奶牛乳产量并增加了奶牛6.5%的乳脂浓度、5%的乳脂产量并产生大量的H2(比对照组高6倍)。Melgar等[46]在奶牛TMR中分别添加40、60、80、100、150和200 mg/kg DM的3-NOP,发现3-NOP不影响奶牛的DMI和产奶量,但总体而言,线性增加了乳脂浓度和产量,他们认为这是3-NOP增加了奶牛乳腺中用于脂肪酸从头合成的一些短链脂肪酸的浓度所致。在肉牛中,Alemu等[14]在试验中发现,3-NOP可以增加2.5%的料重比,与Romero-Perez等[38]研究结果一致,他观察到饲喂了3-NOP的肉牛体增重要略高于对照组,这可能是因为3-NOP降低瘤胃CH4的同时,一部分的H+会被机体所利用,从而产生额外的能量来用于肉牛的体增重[14, 43]。
5 小结3-NOP可以特异性靶向MCR,通过氧化其活性位点镍离子(Ni+)暂时失活MCR,进而达到持续抑制反刍动物瘤胃发酵过程中CH4的生成并对其健康和生产性能没有显著影响,但在抑制CH4产生的同时其瘤胃中会聚集大量的H2。H2作为一种高能气体,若积累过多极易导致瘤胃胀气,其亟待有效的利用和处理。3-NOP现在仍处于试验阶段,并没有商品化。3-NOP作为一种新型的CH4抑制剂,其应用前景是可观的,待3-NOP商品化后,在确保不影响反刍动物的采食量、饲料消化率和生产性能的情况下,可以考虑把CH4抑制后所积累H2的如何利用作为切入点来进一步的研究和探讨。
| [1] |
CONRAD R. Quantification of methanogenic pathways using stable carbon isotopic signatures: a review and a proposal[J]. Organic Geochemistry, 2005, 36(5): 739-752. DOI:10.1016/j.orggeochem.2004.09.006 |
| [2] |
PACHAURI R K, ALLEN M R, BARROS V R, et al. .Climate change 2014:synthesis report.Contribution of working groups Ⅰ, Ⅱ and Ⅲ to the fifth assessment report of the intergovernmental panel on climate change[M]. Geneva: IPCC, 2014.
|
| [3] |
Intergovernmental Panel on Climate Change. Climate change 2014:mitigation of climate change.Contribution of working group Ⅲ to the fifth assessment report of the intergovernmental panel on climate change[M]. New York: Cambridge University Press, 2014.
|
| [4] |
CHENG H. Future earth and sustainable developments[J]. Innovation, 2020, 1(3): 100055. |
| [5] |
JOHNSON K A, JOHNSON D E. Methane emissions from cattle[J]. Journal of Animal Science, 1995, 73(8): 2483-2492. DOI:10.2527/1995.7382483x |
| [6] |
乌拉尔·沙尔赛开. 世界人口展望: 人口、资源与环境[J]. 生态经济, 2017, 33(9): 2-5. SHAERSAIKAI W L E. World population outlook: population, resources and environment[J]. Ecological Economy, 2017, 33(9): 2-5 (in Chinese). |
| [7] |
王之盛, 李胜利. 反刍动物营养学[M]. 北京: 中国农业出版社, 2016. WANG Z S, LI S L. Ruminant nutrition[M]. Beijing: China Agriculture Press, 2016 (in Chinese). |
| [8] |
刘建新. 反刍动物营养生理[M]. 北京: 中国农业出版社, 2019. LIU J X. Nutritional physiology of ruminants[M]. Beijing: China Agriculture Press, 2019 (in Chinese). |
| [9] |
DUVAL S, KINDERMANN M. Use of nitrooxy organic molecules in feed for reducing methane emission in ruminants, and/or to improve ruminant performance: US 2014/0147529 A1[P]. 2014-05-29.
|
| [10] |
HRISTOV A N, OH J, GIALLONGO F, et al. An inhibitor persistently decreased enteric methane emission from dairy cows with no negative effect on milk production[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(34): 10663-10668. DOI:10.1073/pnas.1504124112 |
| [11] |
THIEL A, SCHOENMAKERS A C M, VERBAAN I A J, et al. 3-NOP: mutagenicity and genotoxicity assessment[J]. Food and Chemical Toxicology, 2019, 123: 566-573. DOI:10.1016/j.fct.2018.11.010 |
| [12] |
ZHANG X M, GRUNINGER R J, ALEMU A W, et al. 3-Nitrooxypropanol supplementation had little effect on fiber degradation and microbial colonization of forage particles when evaluated using the in situ ruminal incubation technique[J]. Journal of Dairy Science, 2020, 103(10): 8986-8997. DOI:10.3168/jds.2019-18077 |
| [13] |
BLACK J L, DAVISON T M, BOX I. Methane emissions from ruminants in Australia: mitigation potential and applicability of mitigation strategies[J]. Animals, 2021, 11(4): 951. DOI:10.3390/ani11040951 |
| [14] |
ALEMU A W, PEKRUL L K D, SHRECK A L, et al. 3-Nitrooxypropanol decreased enteric methane production from growing beef cattle in a commercial feedlot: implications for sustainable beef cattle production[J]. Frontiers in Animal Science, 2021, 2: 641590. DOI:10.3389/fanim.2021.641590 |
| [15] |
G MARTINEZ-FEMANDEZ, L ABECIA, A ARCO, et al. Effects of ethyl-3-nitrooxy propionate and 3-nitrooxypropanol on ruminal fermentation, microbial abundance, and methane emissions in sheep[J]. Journal of Dairy Science, 2014, 97(6): 3790-3799. DOI:10.3168/jds.2013-7398 |
| [16] |
THIEL A, RÜMBELI R, MAIR P, et al. 3-NOP: ADME studies in rats and ruminating animals[J]. Food and Chemical Toxicology, 2019, 125: 528-539. DOI:10.1016/j.fct.2019.02.002 |
| [17] |
ZHANG X M, SMITH M L, GRUNINGER R J, et al. Combined effects of 3-nitrooxypropanol and canola oil supplementation on methane emissions, rumen fermentation and biohydrogenation, and total tract digestibility in beef cattle[J]. Journal of Animal Science, 2021, 99(4): 1-10. |
| [18] |
RUDOLF K T. Energy metabolism of methanogenic bacteria pathways of energy conservation in methanogenic Archaea[J]. Biochimica et Biophysica Acta, 1990, 1018: 256-259. DOI:10.1016/0005-2728(90)90261-2 |
| [19] |
DEPPENMEIER U. The unique biochemistry of methanogenesis[J]. Progress in Nucleic Acid Research and Molecular Biology, 2002, 71: 223-283. |
| [20] |
GUINDO C O, DAVOUST B, DRANCOURT M, et al. Diversity of methanogens in animals' gut[J]. Microorganisms, 2020, 9(1): 13. DOI:10.3390/microorganisms9010013 |
| [21] |
JONES W J, NAGLE D P, J r, WHITMAN W B. Methanogens and the diversity of archaebacteria[J]. Microbiological Reviews, 1987, 51(1): 135-177. DOI:10.1128/mr.51.1.135-177.1987 |
| [22] |
FERRY J G. Biochemistry of methanogenesis[J]. Critical Reviews in Biochemistry and Molecular Biology, 1992, 27(6): 473-503. DOI:10.3109/10409239209082570 |
| [23] |
李煜珊, 李耀明, 欧阳志云. 产甲烷微生物研究概况[J]. 环境科学, 2014, 35(5): 2025-2030. LI Y S, LI Y M, OUYANG Z Y. A research overview of methanogens[J]. Environmental Science, 2014, 35(5): 2025-2030 (in Chinese). |
| [24] |
郭嫣秋, 胡伟莲, 刘建新. 瘤胃甲烷菌及甲烷生成的调控[J]. 微生物学报, 2005, 45(1): 145-148. GUO Y Q, HU W L, LIU J X. Methanogens and manipulation of methane production in the rumen[J]. Acta Microbiologica Sinica, 2005, 45(1): 145-148 (in Chinese). DOI:10.3321/j.issn:0001-6209.2005.01.034 |
| [25] |
BLAUT M. Metabolism of methanogens[J]. Antonie van Leeuwenhoek, 1994, 66(1/2/3): 187-208. |
| [26] |
DANIELS L. Chapter 3 Biochemistry of methanogenesis[M]//KATES M, KUSHNER D J, MATHESON A T. New Comprehensive Biochemistry: the Biochemistry of Archaea (Archaebacteria). New York: Elsevier, 1993: 41-112.
|
| [27] |
GARCIA J L, PATEL B K C, OLLIVIER B. Taxonomic, phylogenetic, and ecological diversity of methanogenic Archaea[J]. Anaerobe, 2000, 6(4): 205-226. DOI:10.1006/anae.2000.0345 |
| [28] |
ROUVIÈRE P E, WOLFE R S. Novel biochemistry of methanogenesis[J]. Journal of Biological Chemistry, 1988, 263(17): 7913-7916. DOI:10.1016/S0021-9258(18)68417-0 |
| [29] |
CRAFT J L, HORNG Y C, RAGSDALE S W, et al. Nickel oxidation states of F(430) cofactor in methyl-coenzyme M reductase[J]. Journal of the American Chemical Society, 2004, 126(13): 4068-4069. DOI:10.1021/ja038082p |
| [30] |
SCHELLER S, GOENRICH M, THAUER R K, et al. Methyl-coenzyme M reductase from methanogenic Archaea: isotope effects on the formation and anaerobic oxidation of methane[J]. Journal of the American Chemical Society, 2013, 135(40): 14975-14984. DOI:10.1021/ja406485z |
| [31] |
GOUBEAUD M, SCHREINER G, THAUER R K. Purified methyl-coenzyme-M reductase is activated when the enzyme-bound coenzyme F430 is reduced to the nickel(Ⅰ) oxidation state by titanium(Ⅲ) citrate[J]. European Journal of Biochemistry, 1997, 243(1/2): 110-114. |
| [32] |
ERMLER U. On the mechanism of methyl-coenzyme M reductase[J]. Dalton Transactions, 2005, 21: 3451-3458. |
| [33] |
WONGNATE T, SLIWA D, GINOVSKA B, et al. The radical mechanism of biological methane synthesis by methyl-coenzyme M reductase[J]. Science, 2016, 352(6288): 953-958. DOI:10.1126/science.aaf0616 |
| [34] |
CHEN S L, BLOMBERG M R A, SIEGBAHN P E M. An investigation of possible competing mechanisms for Ni-containing methyl-coenzyme M reductase[J]. Physical Chemistry Chemical Physics, 2014, 16(27): 14029-14035. DOI:10.1039/c4cp01483a |
| [35] |
THAUER R K. The Wolfe cycle comes full circle[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(38): 15084-15085. DOI:10.1073/pnas.1213193109 |
| [36] |
DUIN E C, WAGNER T, SHIMA S, et al. Mode of action uncovered for the specific reduction of methane emissions from ruminants by the small molecule 3-nitrooxypropanol[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(22): 6172-6177. DOI:10.1073/pnas.1600298113 |
| [37] |
MELGAR A, LAGE C F A, NEDELKOV K, et al. Enteric methane emission, milk production, and composition of dairy cows fed 3-nitrooxypropanol[J]. Journal of Dairy Science, 2021, 104(1): 357-366. DOI:10.3168/jds.2020-18908 |
| [38] |
ROMERO-PEREZ A, OKINE E K, MCGINN S M, et al. The potential of 3-nitrooxypropanol to lower enteric methane emissions from beef cattle[J]. Journal of Animal Science, 2014, 92(10): 4682-4693. DOI:10.2527/jas.2014-7573 |
| [39] |
VYAS D, MCGINN S M, DUVAL S M, et al. Effects of sustained reduction of enteric methane emissions with dietary supplementation of 3-nitrooxypropanol on growth performance of growing and finishing beef cattle[J]. Journal of Animal Science, 2016, 94(5): 2024-2034. DOI:10.2527/jas.2015-0268 |
| [40] |
DIJKSTRA J, BANNINK A, FRANCE J, et al. Short communication: antimethanogenic effects of 3-nitrooxypropanol depend on supplementation dose, dietary fiber content, and cattle type[J]. Journal of Dairy Science, 2018, 101(10): 9041-9047. DOI:10.3168/jds.2018-14456 |
| [41] |
VYAS D, MCGINN S M, DUVAL S M, et al. Optimal dose of 3-nitrooxypropanol for decreasing enteric methane emissions from beef cattle fed high-forage and high-grain diets[J]. Animal Production Science, 2016, 58(6): 1049-1055. |
| [42] |
REYNOLDS C K, HUMPHRIES D J, KIRTON P, et al. Effects of 3-nitrooxypropanol on methane emission, digestion, and energy and nitrogen balance of lactating dairy cows[J]. Journal of Dairy Science, 2014, 97(6): 3777-3789. DOI:10.3168/jds.2013-7397 |
| [43] |
杨卓, 马勇, 张力莉, 等. 3-硝基酯-1-丙醇在反刍动物生产中的应用研究进展[J]. 动物营养学报, 2020, 32(11): 5053-5058. YANG Z, MA Y, ZHANG L L, et al. Research progress on application of 3-nitrooxypropanol in ruminants production[J]. Chinese Journal of Animal Nutrition, 2020, 32(11): 5053-5058 (in Chinese). |
| [44] |
HAISAN J, SUN Y, GUAN L L, et al. The effects of feeding 3-nitrooxypropanol on methane emissions and productivity of Holstein cows in mid lactation[J]. Journal of Dairy Science, 2014, 97(5): 3110-3119. DOI:10.3168/jds.2013-7834 |
| [45] |
JAYANEGARA A, SARWONO K A, KONDO M, et al. Use of 3-nitrooxypropanol as feed additive for mitigating enteric methane emissions from ruminants: a meta-analysis[J]. Italian Journal of Animal Science, 2018, 17(3): 650-656. DOI:10.1080/1828051X.2017.1404945 |
| [46] |
MELGAR A, WELTER K C, NEDELKOV K, et al. Dose-response effect of 3-nitrooxypropanol on enteric methane emissions in dairy cows[J]. Journal of Dairy Science, 2020, 103(7): 6145-6156. DOI:10.3168/jds.2019-17840 |




