2. 广东省农业科学院动物科学研究所, 广东省动物育种与 营养公共实验室, 广东省畜禽育种与营养研究重点实验室, 畜禽育种国家重点实验室, 广州 510640
2. State Key Laboratory of Livestock and Poultry Breeding, Guangdong Key Laboratory of Animal Breeding and Nutrition, Guangdong Public Laboratory of Animal Breeding and Nutrition, Institute of Animal Science, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China
人群中肥胖的流行及危害性已引起全世界密切关注,而动物乳脂合成、腹脂沉积等生产表现也一直备受畜禽行业研究者关注[1]。近年来,随高通量测序技术发展,肠道微生物结构与功能不断被揭秘,大量研究证明微生物与宿主脂肪代谢存在密切联系,尤其是微生物主要发酵产物短链脂肪酸(SCFAs)在其中扮演着重要的角色[2]。丁酸作为SCFAs的一种,能够预防和治疗动物肥胖的发生。Fang等[3]通过饲喂小鼠丁酸钠可调节肠道菌群的组成并改善高脂饮食诱导的肥胖;赵利芹[4]在饲粮中添加丁酸钠能够减少肉鸡脂肪沉积;在肥胖男性结肠中灌注丁酸钠后,静息能量消耗和空腹脂肪氧化都得到增加[5]。然而,一些研究发现,丁酸有利于促进人和动物体内的脂肪合成,而且肥胖人个体粪便中的丁酸含量明显高于正常个体[6-7]。丁酸一旦被机体吸收可以满足结肠大部分所需能量,部分丁酸经门静脉进入肝脏作为脂肪生成的底物,也可到达乳腺组织合成乳脂[8],而且在体外可诱导前脂肪细胞分化成脂肪细胞[9]。为更进一步探究丁酸与脂肪代谢之间关系,本文对丁酸调节脂肪代谢的作用机制进行综述,为微生物及其产物丁酸调控脂肪代谢提供指导。
1 丁酸以能量底物形式参与脂肪代谢丁酸可为生物体提供能量满足基础代谢要求。丁酸作为肠道微生物利用膳食纤维或抗性淀粉而产生的代谢产物,可被结肠细胞吸收并进行氧化提供能量,1分子丁酸经完全氧化分解生成二氧化碳和水可产生27分子ATP[10-11]。肥胖人个体粪便中SCFAs含量(包括丁酸)往往高于正常个体,肥胖个体似乎更加需要额外的丁酸来满足自身能量需求[7, 12-13]。体内丁酸含量差异往往与肠道微生物区系有关。在体内直肠透析袋试验中,研究发现,肥胖人个体粪便高水平的SCFAs与结肠微生物区系的差异有关,并不是由于SCFAs吸收或饮食的差异造成的[14];在体外微生物培养中,研究发现,用不同能量含量的培养基培养不同个体的粪便微生物群时,来自肥胖个体微生物产生的丁酸都显著高于正常个体[15]。肥胖个体内肠道微生物似乎能更有效率地利用膳食纤维来产生丁酸,从而获取更多的能量。
丁酸也会以底物形式参与脂肪合成。在单胃动物体内,大部分丁酸可被结肠吸收利用,但仍有一部分经门静脉到达肝脏、乳腺组织或其他部位,通过酮体生成及乳脂合成等过程,参与脂肪合成代谢。而在反刍动物瘤胃内,丁酸主要在瘤胃和网胃壁处吸收,大部分转化为胴体如β-羟丁酸,之后可被脂肪组织或者乳腺吸收进行脂肪酸合成[16]。Maxin等[17]在奶牛瘤胃中每日输入800 g丁酸可显著提高乳脂浓度和产奶量。孔庆洋[18]在细胞培养液中添加0.75 mmol/L丁酸钠可显著提高牛乳腺上皮细胞脂肪酸合酶(FAS)和乙酰辅酶A羧化酶(ACC)的mRNA表达,促进乳脂肪生物合成。
2 丁酸以信号分子形式参与脂肪代谢的调控 2.1 丁酸作为GPCRs的激动剂丁酸为肠道(主要是结肠)细胞提供能量,也可作为底物参与脂肪合成,同时又以信号分子形式,被细胞表面GPCRs识别,激发下游通路,进而调控脂肪代谢[19]。
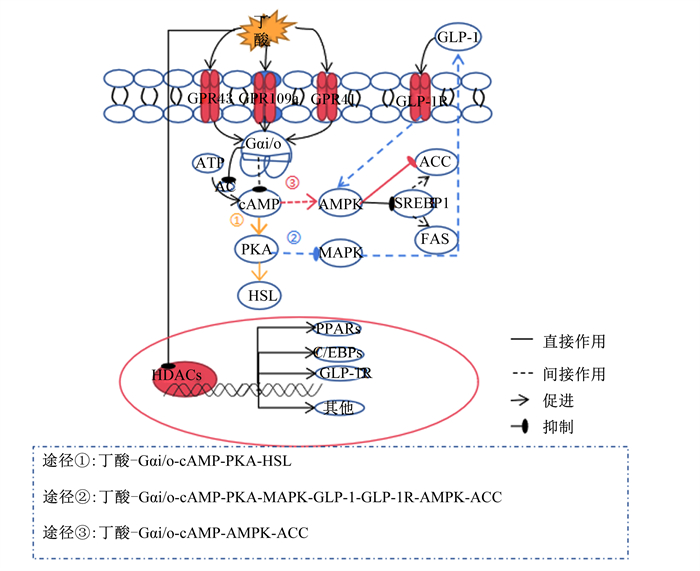
GPCRs是一类具有7个螺旋跨膜结构的膜受体,能激活G蛋白。G蛋白含有α、β和γ 3种亚基,激活的下游通路取决于α亚基的种类,如Gαs、Gαi/o、Gαq/11和Gα12/13[20]。Gαs激活可提高腺苷酸环化酶(AC)的活性,促进细胞的环磷酸腺苷(cAMP)水平升高,激活识别丁酸的GPCRs主要包括GPR41、GPR43和GPR109a,它们在肠道、肝脏、脂肪甚至免疫细胞表面均有表达,但在不同细胞表面或者不同生理状态下表达存在差异[22]。GPR41、GPR43或者GPR109a受体的表达与动物肥胖发生存在紧密联系,这些受体基因的敲除或表达沉默会使得动物对肥胖更敏感[23-25]。在体内,丁酸可以通过结合GPCRs来降低体增重,改善动物高脂饮食所导致的肥胖。Lu等[26]研究发现,丁酸可以降低高脂饮食诱导肥胖小鼠的体重,与体内GPR41和GPR43表达显著上调有关。赵利芹[4]研究发现,在饲粮中添加丁酸钠也能够显著激活肉鸡肝脏和脂肪细胞表面受体GPR41和GPR43,显著降低脂蛋白脂酶(LPL)表达水平, 抑制ACC和FAS活性,抑制肝脏和脂肪细胞的脂肪合成;当用特定的siRNAs干扰GPR41和GPR43表达时,丁酸对脂肪沉积的抑制作用消失。Sato等[25]研究发现,灌胃三丁酸甘油酯能显著提高GPR109a表达来治疗肥胖小鼠,而抑制GPR109a表达则会抑制三丁酸甘油酯的治疗肥胖的作用。
丁酸被GPR41、GPR43和GPR109a识别后,均与Gαi/o发生偶联,激活Gαi/o降低AC的活性,减少ATP转化成AMP,促使cAMP水平下降,进而调节下游通路的腺苷酸活化蛋白激酶(AMPK)活性参与脂肪代谢调控[27-28]。AMPK是体内能量传感器,体内AMP/ATP比值下降会激活其活性,如Lu等[29]利用1,3-二氯-2-丙醇抑制Gαi/o偶联受体表达,通过下调AMP/ATP来抑制AMPK活性,从而诱导肝脏细胞脂质积聚。丁酸通过激活GPCR与Gαi/o的偶联,下调cAMP水平;同时丁酸可作为ATP合成底物,增加体内ATP水平。此外,Cheng等[30]研究发现,高浓度(1 mmol/L)丁酸能够激活牛乳腺上皮细胞GPR41来抑制下游通路AMPK活性,促进固醇调节元件结合蛋白1(SREBP1)活性,最终促进乳脂从头合成。
丁酸也能通过cAMP-PKA-MAPK信号通路参与机体脂肪代谢调控。PKA活化能够促进Raf磷酸化使其失活,进而阻断丝裂原活化蛋白激酶(MAPK)通路的激活[31]。丁酸激活GPCRs与Gαi/o的偶联降低细胞内cAMP水平,抑制PKA活性。张建梅[32]在细胞培养液中添加1 mmol/L丁酸促进肉鸡肠道L细胞的GPR41和GPR43活性,激发下游MAPKs信号通路,进而提高胰高血糖素样肽-1(GLP-1)的分泌,而GLP-1能够促进肝脏和成熟脂肪细胞内AMPK表达增加,促进ACC磷酸化,从而抑制其活性,减少脂肪从头合成。除了提高GLP-1激素的分泌,丁酸还能通过Gαi/o蛋白偶联受体,激活磷脂酰肌醇-3-激酶(PI3K)信号通路,刺激瘦素表达,控制食欲,减少食物摄入量和增加能量消耗从而维持能量平衡[33]。
丁酸还可以通过激活GPCR和Gαi/o的偶联,调节PKA活性来抑制激素敏感脂肪酶(HSL)活性。研究发现,异丙肾上腺素能够刺激Gαs提高细胞内cAMP水平,促进PKA活性,提高HSL活性,促进脂肪分解,而丁酸能够抑制异丙肾上腺素的促脂解过程[34-35]。
丁酸通过GPCRs促进过氧化物酶体增殖物激活受体γ辅激活子-1α(PGC-1α)的表达,进而加速线粒体生物合成和脂肪酸氧化。PGC-1α是线粒体生物合成的调节器,能够促进脂肪酸氧化并上调棕色脂肪中解偶联蛋白-1(UCP-1)的表达,而UCP-1可使脂肪酸氧化和磷酸化过程失去偶联,使脂肪酸氧化不产生ATP,而是以热能的形式释放[36]。Lu等[26]在饲粮中添加丁酸可显著提高小鼠附睾脂肪细胞内PGC-1α基因表达,促进线粒体生物发生,而且其基因表达水平与细胞GPR41和GPR43基因表达呈正相关。Huang等[37]也发现母鼠补充丁酸可促进断奶仔鼠骨骼肌PGC-1α表达,且仔鼠体内GPR41和GPR43表达得到显著提高。
综上所述,作为信号分子,丁酸可以结合GPCRs来调节脂肪代谢,并且表现出对脂肪合成既可促进又可抑制的两面性特征。
2.2 丁酸作为HDACs的抑制剂作为信号分子,除了结合GPCRs之外,丁酸是一种天然的HDACs抑制剂,丁酸可以增加组蛋白乙酰化程度,松散染色质结构,从而有利于提高脂肪代谢有关的基因转录水平,进而调控脂肪代谢[38]。
丁酸主要抑制Ⅰ类和Ⅱa类HDACs活性,而对脂肪代谢的调控更多是对Ⅰ类HDACs(如HDAC1、HDAC2和HDAC3)的抑制[39-40]。Hong等[41]研究发现,在高脂饮食喂养的小鼠时,每隔1 d灌喂80 mg丁酸钠,通过抑制HDAC1的活性,显著提高脂联素受体(AdipoR)和解偶联蛋白(Ucp 2/3)基因启动子乙酰化,促进其表达来预防饮食诱导的肥胖。Zhou等[42]研究表明,丁酸钠可以通过抑制HDAC2活性来提高肝脏细胞表面GLP-1受体(GLP-1R)基因的转录表达,并激活AMPK-ACC信号通路来抑制肝脏细胞内脂肪过度沉积。Whitt等[43]研究发现,肠道表皮细胞内HDAC3表达障碍的小鼠对高脂饮食诱导肥胖表现出不敏感性,并且对于肥胖的正常小鼠,每日口服80 mg丁酸钠后,其肠道HDAC3表达水平下降,肥胖也得到改善。
丁酸通过抑制HDACs活性,除了具有抑制动物肥胖或者细胞脂肪沉积的功能,同时也存在有利于脂肪沉积的作用。如Li等[44]研究发现,丁酸可通过抑制猪血管基质细胞中HDACs的活性,促进过氧化物酶体增殖物激活受体γ(PPARγ)和CCAAT增强子结合蛋白(C/EBPs)的mRNA表达,而PPARγ和C/EBPs是调节脂肪细胞分化的重要转录因子,能够促进细胞内脂肪沉积。Huang等[45]在母体饲粮中补充丁酸钠,组蛋白3乙酰化水平显著增加,诱导后代子鼠脂肪生成基因表达增加,引起子代骨骼肌胰岛素抵抗和脂质积累。
3 丁酸调控脂肪代谢的影响因素在不同试验条件下,作为信号分子,丁酸可以通过结合GPCRs或者抑制HDACs来调控脂肪代谢,但都表现出两面性,在体外发现其原因可能与添加丁酸的剂量有关(表 1)。在体外细胞试验中,Li等[44]采用较高丁酸剂量(1和3 mmol/L)培养猪SVF细胞,通过抑制HDACs来促进脂肪沉积,而低浓度(0.1 mmol/L)下丁酸并没有出现明显的促进脂肪细胞分化作用;Cheng等[30]也发现,添加高浓度(1 mmol/L以上)丁酸能够促进牛乳腺上皮细胞乳脂从头合成;Zhao等[46]研究发现,在低浓度(0.01 mmol/L)下,丁酸通过结合GPCRs抑制肉鸡脂肪细胞的脂肪沉积,而在高浓度(1 mmol/L以上)下,通过促进组蛋白乙酰化来促进细胞脂肪沉积。由此可见,体外试验中丁酸剂量高低影响其生物功能,对脂肪代谢调节表现出两面性,但在体内动物试验中,可能因体内复杂环境并没有表现明显剂量效应。研究发现,丁酸对脂肪代谢的调控方向,也可能与其作用于不同组织有关,如Zhang等[47]每日以10 mL(200 mmol/L)剂量的丁酸钠注射于生长猪静脉内,可减少肌肉组织中脂肪的分解,但增加脂肪组织中的脂肪分解。因此,除了考虑剂量因素以外,不同动物或者细胞模型、丁酸类别以及对试验动物的给药方式都有可能影响丁酸对脂肪代谢的调控作用。
|
|
表 1 不同试验条件下丁酸对脂肪代谢的调节作用 Table 1 Regulatory effects of butyric acid on fat metabolism under different experimental conditions |
本文主要从丁酸作为脂肪合成的底物和通过结合GPCRs或抑制HDACs的信号分子形式2个方面阐述丁酸对脂肪代谢调控(图 1)。丁酸作为脂肪代谢的调节剂,影响机体能量与物质平衡,是连接肠道微生物与宿主代谢之间桥梁, 是调节动物脂质相关性状(如乳脂、腹脂和肌内脂肪等)潜在靶点, 也是未来治疗肥胖、糖尿病等代谢疾病的靶点。丁酸对脂肪代谢调节作用的复杂性,可能因其本身浓度、试验对象或其他环境差异存在两面性,未来需要更多试验研究丁酸浓度的影响以及作为信号分子的调控道路是否存在联系,为治疗肥胖提供新思路。
|
GPR41/43/109a:G蛋白偶联受体41/43/109a G protein-coupled receptors 41/43/109a;Gαi/o:Gαi/o蛋白Gαi/o protein;ATP:腺苷三磷酸adenosine triphosphate;AC:腺苷酸环化酶adenylate cyclase;cAMP:环磷酸腺苷cyclic adenosine monophosphate;PKA:蛋白激酶A protein kinase A;HSL:激素敏感性甘油三酯脂肪酶hormone-sensitive lipase;MAPK:丝裂原激活蛋白激酶mitogen-activated protein kinase;GLP-1:胰高血糖素样肽-1 glucagon-like peptide-1;GLP-1R:胰高血糖素样肽-1受体glucagon-like peptide 1 receptor;AMPK:单磷酸腺苷激酶AMP-activated protein kinase;ACC:乙酰辅酶A羧化酶acetyl CoA carboxylase;FAS:脂肪酸合成酶fatty acid synthetase;SREBP1:固醇反应元件结合蛋白1 sterol response element binding protein 1;PPARs:过氧化物酶体增殖物激活受体peroxisome proliferator-activated receptors;C/EBPs:CCAAT增强子结合蛋白CCAAT enhancer binding proteins。 图 1 丁酸结合GPCRs或抑制HDACs调节脂肪代谢的信号途径 Fig. 1 Signaling pathways of butyric acid regulating fat metabolism by binding GPCRs or inhibiting HDACs activity[31, 33, 35, 39] |
| [1] |
CHANDLER M, CUNNINGHAM S, LUND E M, et al. Obesity and associated comorbidities in people and companion animals: a one health perspective[J]. Journal of Comparative Pathology, 2017, 156(4): 296-309. DOI:10.1016/j.jcpa.2017.03.006 |
| [2] |
ADAK A, KHAN M R. An insight into gut microbiota and its functionalities[J]. Cellular and Molecular Life Sciences, 2019, 76(3): 473-493. DOI:10.1007/s00018-018-2943-4 |
| [3] |
FANG W J, XUE H L, CHEN X, et al. Supplementation with sodium butyrate modulates the composition of the gut microbiota and ameliorates high-fat diet-induced obesity in mice[J]. The Journal of Nutrition, 2019, 149(5): 747-754. DOI:10.1093/jn/nxy324 |
| [4] |
赵利芹. 丁酸钠对肉鸡脂肪沉积的作用及机制研究[D]. 硕士学位论文. 泰安: 山东农业大学, 2019. ZHAO L Q. Effect and mechanism of sodium butyrate on fat deposition in broilers[D]. Master's Thesis. Tai'an: Shandong Agricultural University, 2019. (in Chinese) |
| [5] |
CANFORA E E, VAN DER BEEK C M, JOCKEN J W E, et al. Colonic infusions of short-chain fatty acid mixtures promote energy metabolism in overweight/obese men: a randomized crossover trial[J]. Scientific Reports, 2017, 7(1): 2360. DOI:10.1038/s41598-017-02546-x |
| [6] |
KIM K N, YAO Y, JU S Y. Short chain fatty acids and fecal microbiota abundance in humans with obesity: a systematic review and Meta-analysis[J]. Nutrients, 2019, 11(10): 2512. DOI:10.3390/nu11102512 |
| [7] |
BARCZYŃSKA R, LITWIN M, SLIŻEWSKA K, et al. Bacterial microbiota and fatty acids in the faeces of overweight and obese children[J]. Polish Journal of Microbiology, 2018, 67(3): 339-345. DOI:10.21307/pjm-2018-041 |
| [8] |
URRUTIA N, BOMBERGER R, MATAMOROS C, et al. Effect of dietary supplementation of sodium acetate and calcium butyrate on milk fat synthesis in lactating dairy cows[J]. Journal of Dairy Science, 2019, 102(6): 5172-5181. DOI:10.3168/jds.2018-16024 |
| [9] |
YAN H, AJUWON K M. Mechanism of butyrate stimulation of triglyceride storage and adipokine expression during adipogenic differentiation of porcine stromovascular cells[J]. PLoS One, 2015, 10(12): e0145940. DOI:10.1371/journal.pone.0145940 |
| [10] |
BACH KNUDSEN K E, LÆRKE H N, HEDEMANN M S, et al. Impact of diet-modulated butyrate production on intestinal barrier function and inflammation[J]. Nutrients, 2018, 10(10): 1499. DOI:10.3390/nu10101499 |
| [11] |
罗永富. 脂肪酸体内氧化ATP生成数量计算公式[J]. 卫生职业教育, 2006, 24(6): 87. LUO Y F. Formula for calculating the amount of ATP formed by oxidation of fatty acids in vivo[J]. Health Vocational Education, 2006, 24(6): 87 (in Chinese). DOI:10.3969/j.issn.1671-1246.2006.06.053 |
| [12] |
RIVA A, BORGO F, LASSANDRO C, et al. Pediatric obesity is associated with an altered gut microbiota and discordant shifts in Firmicutes populations[J]. Environmental Microbiology, 2017, 19(1): 95-105. DOI:10.1111/1462-2920.13463 |
| [13] |
SCHWIERTZ A, TARAS D, SCHÄFER K, et al. Microbiota and SCFA in lean and overweight healthy subjects[J]. Obesity, 2010, 18(1): 190-195. DOI:10.1038/oby.2009.167 |
| [14] |
RAHAT-ROZENBLOOM S, FERNANDES J, GLOOR G B, et al. Evidence for greater production of colonic short-chain fatty acids in overweight than lean humans[J]. International Journal of Obesity, 2014, 38(12): 1525-1531. DOI:10.1038/ijo.2014.46 |
| [15] |
MARTÍNEZ-CUESTA M C, DEL CAMPO R, GARRIGA-GARCÍA M, et al. Taxonomic characterization and short-chain fatty acids production of the obese microbiota[J]. Frontiers in Cellular and Infection Microbiology, 2021, 11: 598093. DOI:10.3389/fcimb.2021.598093 |
| [16] |
BAASKE L, GABEL G, DENGLER F. Ruminal epithelium: a checkpoint for cattle health[J]. Journal of Dairy Research, 2020, 87(3): 322-329. DOI:10.1017/S0022029920000369 |
| [17] |
MAXIN G, RULQUIN H, GLASSER F. Response of milk fat concentration and yield to nutrient supply in dairy cows[J]. Animal, 2011, 5(8): 1299-1310. DOI:10.1017/S1751731111000206 |
| [18] |
孔庆洋. 乙酸钠和丁酸钠对奶牛乳腺上皮细胞及腺泡乳脂合成相关基因表达的影响[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2012. KONG Q Y. Effect of sodium acetate and sodium butyrate on expression of genes related to milk fat synthesis of dairy cow mammary epithelial cells and acinus[D]. Master's Thesis. Harbin: Northeast Agricultural University, 2012. (in Chinese) |
| [19] |
KIMURA I, ICHIMURA A, OHUE-KITANO R, et al. Free fatty acid receptors in health and disease[J]. Physiological Reviews, 2020, 100(1): 171-210. DOI:10.1152/physrev.00041.2018 |
| [20] |
INOUE A, RAIMONDI F, KADJI F M N, et al. Illuminating G-protein-coupling selectivity of GPCRs[J]. Cell, 2019, 177(7): 1933-1947.e25. DOI:10.1016/j.cell.2019.04.044 |
| [21] |
ZHOU Q T, YANG D H, WU M, et al. Common activation mechanism of class A GPCRs[J]. eLife, 2019, 8: e50279. DOI:10.7554/eLife.50279 |
| [22] |
ZHANG L, LIU C D, JIANG Q Y, et al. Butyrate in energy metabolism: there is still more to learn[J]. Trends in Endocrinology & Metabolism, 2021, 32(3): 159-169. |
| [23] |
KIMURA I, OZAWA K, INOUE D, et al. The gut microbiota suppresses insulin-mediated fat accumulation via the short-chain fatty acid receptor GPR43[J]. Nature Communications, 2013, 4: 1829. DOI:10.1038/ncomms2852 |
| [24] |
BELLAHCENE M, O'DOWD J F, WARGENT E T, et al. Male mice that lack the G-protein-coupled receptor GPR41 have low energy expenditure and increased body fat content[J]. British Journal of Nutrition, 2013, 109(10): 1755-1764. DOI:10.1017/S0007114512003923 |
| [25] |
SATO F T, YAP Y A, CRISMA A R, et al. Tributyrin attenuates metabolic and inflammatory changes associated with obesity through a GPR109A-dependent mechanism[J]. Cells, 2020, 9(9): 2007. DOI:10.3390/cells9092007 |
| [26] |
LU Y Y, FAN C N, LI P, et al. Short chain fatty acids prevent high-fat-diet-induced obesity in mice by regulating G protein-coupled receptors and gut microbiota[J]. Scientific Reports, 2016, 6: 37589. DOI:10.1038/srep37589 |
| [27] |
WANG A H, SI H W, LIU D M, et al. Butyrate activates the cAMP-protein kinase A-cAMP response element-binding protein signaling pathway in Caco-2 cells[J]. The Journal of Nutrition, 2012, 142(1): 1-6. DOI:10.3945/jn.111.148155 |
| [28] |
SNELSON M, TAN S M, HIGGINS G C, et al. Exploring the role of the metabolite-sensing receptor GPR109a in diabetic nephropathy[J]. American Journal of Physiology. Renal Physiology, 2020, 318(3): F835-F842. DOI:10.1152/ajprenal.00505.2019 |
| [29] |
LU J, FANG B C, ZHENG Y Y, et al. 1, 3-dichloro-2-propanol induced lipid accumulation in HepG2 cells through cAMP/protein kinase A and AMP-activated protein kinase pathways via Gi/o-coupled receptors[J]. Environmental Toxicology and Pharmacology, 2017, 55: 118-126. DOI:10.1016/j.etap.2017.07.013 |
| [30] |
CHENG J, ZHANG Y F, GE Y S, et al. Sodium butyrate promotes milk fat synthesis in bovine mammary epithelial cells via GPR41 and its downstream signalling pathways[J]. Life Sciences, 2020, 259: 118375. DOI:10.1016/j.lfs.2020.118375 |
| [31] |
WALTEREIT R, WELLER M. Signaling from cAMP/PKA to MAPK and synaptic plasticity[J]. Molecular Neurobiology, 2003, 27(1): 99-106. DOI:10.1385/MN:27:1:99 |
| [32] |
张建梅. SCFAs/GLP-1在肠道微生物调控肉鸡脂肪代谢的作用[D]. 博士学位论文. 泰安: 山东农业大学, 2019. ZHANG J M. SCFAs/GLP-1 links the regulation of gut microbiome on lipid metabolism in broiler chickens[D]. Ph. D. Thesis. Tai'an: Shandong Agricultural University, 2019. (in Chinese) |
| [33] |
SOLIMAN M M, AHMED M M, SALAH-ELDIN A E, et al. Butyrate regulates leptin expression through different signaling pathways in adipocytes[J]. Journal of Veterinary Science, 2011, 12(4): 319-323. DOI:10.4142/jvs.2011.12.4.319 |
| [34] |
HEIMANN E, NYMAN M, DEGERMAN E. Propionic acid and butyric acid inhibit lipolysis and de novo lipogenesis and increase insulin-stimulated glucose uptake in primary rat adipocytes[J]. Adipocyte, 2015, 4(2): 81-88. DOI:10.4161/21623945.2014.960694 |
| [35] |
GE H F, LI X F, WEISZMANN J, et al. Activation of G protein-coupled receptor 43 in adipocytes leads to inhibition of lipolysis and suppression of plasma free fatty acids[J]. Endocrinology, 2008, 149(9): 4519-4526. DOI:10.1210/en.2008-0059 |
| [36] |
CUEVAS-RAMOS D, MEHTA R, AGUILAR-SALINAS C A. Fibroblast growth factor 21 and browning of white adipose tissue[J]. Frontiers in Physiology, 2019, 10: 37. DOI:10.3389/fphys.2019.00037 |
| [37] |
HUANG Y P, GAO S X, JUN G, et al. Supplementing the maternal diet of rats with butyrate enhances mitochondrial biogenesis in the skeletal muscles of weaned offspring[J]. British Journal of Nutrition, 2017, 117(1): 12-20. DOI:10.1017/S0007114516004402 |
| [38] |
CHRIETT S, DABEK A, WOJTALA M, et al. Prominent action of butyrate over β-hydroxybutyrate as histone deacetylase inhibitor, transcriptional modulator and anti-inflammatory molecule[J]. Scientific Reports, 2019, 9(1): 742. DOI:10.1038/s41598-018-36941-9 |
| [39] |
MENZIES K J, ZHANG H B, KATSYUBA E, et al. Protein acetylation in metabolism-metabolites and cofactors[J]. Nature Reviews Endocrinology, 2016, 12(1): 43-60. DOI:10.1038/nrendo.2015.181 |
| [40] |
FERRARI A, FIORINO E, GIUDICI M, et al. Linking epigenetics to lipid metabolism: focus on histone deacetylases[J]. Molecular Membrane Biology, 2012, 29(7): 257-266. DOI:10.3109/09687688.2012.729094 |
| [41] |
HONG J, JIA Y M, PAN S F, et al. Butyrate alleviates high fat diet-induced obesity through activation of adiponectin-mediated pathway and stimulation of mitochondrial function in the skeletal muscle of mice[J]. Oncotarget, 2016, 7(35): 56071-56082. DOI:10.18632/oncotarget.11267 |
| [42] |
ZHOU D, CHEN Y W, ZHAO Z H, et al. Sodium butyrate reduces high-fat diet-induced non-alcoholic steatohepatitis through upregulation of hepatic GLP-1R expression[J]. Experimental & Molecular Medicine, 2018, 50(12): 1-12. |
| [43] |
WHITT J, WOO V, LEE P, et al. Disruption of epithelial HDAC3 in intestine prevents diet-induced obesity in mice[J]. Gastroenterology, 2018, 155(2): 501-513. DOI:10.1053/j.gastro.2018.04.017 |
| [44] |
LI G L, YAO W, JIANG H L. Short-chain fatty acids enhance adipocyte differentiation in the stromal vascular fraction of porcine adipose tissue[J]. The Journal of Nutrition, 2014, 144(12): 1887-1895. DOI:10.3945/jn.114.198531 |
| [45] |
HUANG Y P, GAO S X, CHEN J L, et al. Maternal butyrate supplementation induces insulin resistance associated with enhanced intramuscular fat deposition in the offspring[J]. Oncotarget, 2017, 8(8): 13073-13084. DOI:10.18632/oncotarget.14375 |
| [46] |
ZHAO L Q, LIU S, ZHANG Z H, et al. Low and high concentrations of butyrate regulate fat accumulation in chicken adipocytes via different mechanisms[J]. Adipocyte, 2020, 9(1): 120-131. DOI:10.1080/21623945.2020.1738791 |
| [47] |
ZHANG H, REN E D, XU R Y, et al. Transcriptomic responses induced in muscle and adipose tissues of growing pigs by intravenous infusion of sodium butyrate[J]. Biology, 2021, 10(6): 559. DOI:10.3390/biology10060559 |




