过去人们把脂肪组织仅仅看作是一个贮能器官,但随着瘦素、抵抗素、肿瘤坏死因子-α(TNF-α)、血浆纤溶酶原激活物抑制剂-1(PAI-1)、白细胞介素-6(IL-6)等多种脂肪细胞因子的发现,人们开始注意到了脂肪组织的内分泌功能,彻底改变了之前的传统看法。而脂联素(AdipoQ)即是由脂肪组织特异性分泌到血浆,通过与AdipoQ受体[脂联素受体1(adiponectin receptor 1,AdipoRl)和脂联素受体2(adiponectin receptor 2,AdipoR2)]结合,激活下游多条信号通路,从而产生多种生物学效应。研究AdipoQ及其受体的结构、调节脂类代谢的机制,是营养和代谢的研究热点之一。本文主要从AdipoQ及其受体的结构、信号接头蛋白及AdipoQ对脂类代谢的调控机制进行综述。
1 AdipoQ与AdipoQ受体 1.1 AdipoQ的发现与结构AdipoQ也称为Acrp30、apM1、GBP28,是一种主要由脂肪组织分泌的细胞因子。AdipoQ最先是1995年由Scherer等[1]从小鼠的脂肪组织中分离得到,并将其命名为Acrp30;之后,Meada等[2]从人内脏脂肪组织中发现了一种在脂肪组织中表达极为丰富的基因,称其为apM1;Nakano等[3]在人的血浆中分离得到了一种由apMl所编码的Acrp30的类似物,证实其是大小为28 ku的明胶结合蛋白,被称为GBP28;直到1999年,Arita等[4]才将以上物质统一命名为AdipoQ。
不同物种的AdipoQ基因的外显子及内含子数量不同。家禽的AdipoQ基因含有2个外显子和1个内含子,哺乳动物的AdipoQ基因含有3个外显子和2个内含子,二者均编码240~250个氨基酸[5]。不同物种AdipoQ氨基酸数量也存在差异,人、狗、鸡、大鼠的AdipoQ基因编码氨基酸数量为244个,猕猴和野猪的AdipoQ基因编码的氨基酸数量为243个,小鼠的AdipoQ氨基酸数量为247个[6]。AdipoQ由4个不同的结构域组成:N端信号肽、短可变区、胶原结构域和C1q同源的C末端球状结构域,其C末端的球状结构域约由135个氨基酸构成[7]。AdipoQ由脂肪细胞以3种寡聚复合物的形式分泌到血液中,在蛋白质水平上,AdipoQ在脂肪细胞的分泌途径中被多聚化。因此,蛋白质以多聚体的形式分泌,多聚体的形成在很大程度上依赖于翻译后修饰,包括三聚体(67 ku)、六聚体(140 ku)和至少由18个单体组成的高分子质量(300 ku)多聚体。胶原结构域之间的相互作用形成了高度有序的三聚体,并由Cys39介导的二硫键进一步稳定该三聚体,2个三聚体之间由游离的Cys39介导的二硫键形成,从而形成AdipoQ的六聚体,多个三聚物通过胶原域结合形成高分子结构。在血液循环中,超过80%的AdipoQ主要以多聚体的形式发挥各种生理作用[8]。这些多聚体以全长脂联素(full length adiponectin,fAd)和fAd裂解产生的球形脂联素(globular adiponectin,gAd)的形式存在(fAd主要以三聚体、六聚体、多聚体形式存在,gAd主要以三聚体形式存在),不同形式的AdipoQ所发挥的功能也有所不同,fAd能够激活腺苷酸蛋白活化激酶(AMP-activated protein kinase,AMPK)途径,gAd则能够增加脂肪酸氧化、改善胰岛素抵抗等[9]。
1.2 AdipoQ受体的结构AdipoQ的生物学作用主要是通过与相应AdipoQ受体结合而实现的,AdipoRl、AdipoR2和T-钙黏蛋白(T-cadherin,T-cad)是目前已发现的3种AdipoQ受体。AdipoR1主要在骨骼肌中表达并激活AMPK,AdipoR2主要在肝脏表达,调节脂肪和葡萄糖代谢、氧化应激和炎症[10]。研究表明,AdipoR1也存在于内皮细胞、心肌细胞和胰腺β细胞中,AdipoR2也存在于内皮细胞中,且这2种受体都存在于下丘脑中[11]。AdipoR1和AdipoR2的分子结构相似,二者都具有7个跨膜结构域,并且与G蛋白偶联受体的拓扑结构相反,其N端在细胞内,C端在细胞外,受体C端与AdipoQ结合,而受体N端与适应性蛋白结合[12-13]。
Hug等[14]在2004年用分子克隆技术发现了另一种AdipoQ受体——T-cad。T-cad既不包含跨膜信号域,也不包含细胞质信号域,缺乏信号传递能力,其本身是一种含有糖基磷脂酰肌醇锚点的细胞表面糖蛋白。该受体在血管内皮细胞和平滑肌中表达,是六聚体和高分子质量AdipoQ的有效受体,因此只能与中、高分子质量的六聚体和多聚体结合,但不能与三聚体和gAd结合[15]。
AdipoQ通过直接与其特异性受体相互作用发挥其生物学功能,为AdipoQ提供一定的器官和功能特异性。此外,多种调控机制严密调控AdipoQ,进一步控制AdipoQ在正常和疾病状态下对各器官的生物学影响。
2 AdipoQ的信号接头蛋白AdipoQ首先与AdipoR1/2膜外的C端结合,通过AdipoR1/2膜内的N端与信号接头蛋白结合,进而激活下游的信号通路,发挥多种生理作用。目前已发现的信号接头蛋白有:衔接蛋白(APPLl)、酪蛋白激酶2(casein kinase 2,CK2)、蛋白激酶C受体1(receptor for activated C kinase 1,RACKl)和内质网蛋白46(endoplasmic reticulum protein 46,ERp46),其中CK2、RACK1、ERp46仅能与AdipoRl结合,而APPL1能够与AdipoRl和AdipoR2结合。
2.1 APPL1APPL1由709个氨基酸构成,其含有多个功能结构域,从N端到C端依次为BAR (Bin-Amphiphysin-Rvs)结构域、普列克底物蛋白同源物样(pleckstrin homology,PH)结构域和磷酸酪氨酸(phospho-tyrosine binding,PTB)结构域,其中PTB结构域的一般功能是作为蛋白质结合的接头或支架,特别是那些信号通路中的蛋白质[16]。APPL1通过其C端PTB结构域直接与AdipoR1和AdipoR2的胞内结构域结合,从而磷酸化AdipoQ信号通路下游分子AMPK和p38丝裂原激活蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)等,继而促进骨骼肌的脂肪酸氧化和葡萄糖转运蛋白4(glucose transporter 4,GLUT 4)向膜内转位并摄取葡萄糖[17]。
2.2 CK2CK2是一种多亚基的丝氨酸/苏氨酸蛋白激酶,CK2β是CK2的调节亚单位,现已证明CK2β能够与AdipoR1的N端结合,使用基于肽的酶联免疫吸附测定(ELISA)方法,确定CK2β亚基与AdipoR1 N端的结合位点位于N端的第113~132位氨基酸[18]。已发现CK2β与各种蛋白相互作用产生不同的生理效应,如与G-α亚基作用抑制G蛋白偶联受体活性,与血红蛋白-结合珠蛋白清道夫受体CD163相互作用以刺激信号传递,与p38MAPK相互作用以变构激活细胞应激状态下的CK2[19-21]
2.3 RACKlRACK1是一种36 ku大小的高度保守的胞内接合蛋白,有7个WD-重复序列与G蛋白β亚基有显著的同源性,单个WD40重复序列可以同时与不同的信号分子相互作用,这使得RACK1能够整合来自不同信号通路的输入信息[22]。RACK1与AdipoRl结合的具体位点尚不清楚,但通过免疫共沉淀和共定位分析证实RACK1与AdipoR1间的相互作用,且AdipoQ刺激可增强这种相互作用;通过RNA干扰技术,敲除一种名为HepG2细胞中的RACK1后,其葡萄糖摄取效应降低,这是由于AdipoQ及其受体间的接头蛋白减少,抑制了转导通路的某些下游信号,提示RACK1可能通过与AdipoR1相互作用在AdipoQ信号转导中起关键的桥梁作用[23]。
2.4 ERp46ERp46是硫氧还蛋白家族的成员,具有硫氧还原酶活性。Charlton等[24]通过共免疫沉淀和质谱鉴定发现ERp46与AdipoR1共沉淀,而不与AdipoR2共沉淀;对截短结构和GST融合蛋白的分析进一步表明,ERp46与AdipoR1 N端的第1~70位氨基酸相互作用,该序列在AdipoR2中未发现,且AdipoR2不与ERp46形成复合物,虽然AdipoR1和AdipoR2的总体同源性为68%,但N-末端区域[AdipoR1(1~70)、AdipoR2(1~81)]仅显示17%的同源性。尽管ERp46和AdipoR2之间缺乏相互作用,但Charlton等[24]发现短暂敲除ERp46会增加质膜的AdipoR1和AdipoR2的水平,并且AdipoQ刺激的AMPK磷酸化增加,p38MAPK磷酸化减少,这可能是由于ERp46的敲除改变了AdipoR1/2的运输或内吞作用,从而导致对不同信号通路的选择性作用。此外,Keshvari等[25]研究表明,AdipoR1和AdipoR2的共表达会增加细胞表面AdipoR2的表达,而ERp46与AdipoR1特异性的相互作用,阻碍了AdipoR1和AdipoR2的相互作用。因此,敲除ERp46促进了AdipoR1和AdipoR2之间的相互作用,从而增加2种受体的表达。这些结果证实,ERp46是一个AdipoR1特异性互作蛋白,并提示ERp46在AdipoR和AdipoQ信号转导中发挥作用。
3 AdipoQ及其受体介导的信号通路对脂类代谢的调控在脂类代谢中,AdipoQ主要是通过促进脂肪酸氧化及抑制脂质合成进行调控,这些调控效应是通过AdipoQ与AdipoR1和AdipoR2相互作用而发生的。这2种受体触发2种不同的信号通路:AdipoR1激活AMPK和AdipoR2增强过氧化物酶体增殖物激活受体α(PPARα)级联反应。AMPK作为哺乳动物细胞中主要的能量平衡感受器,控制葡萄糖浓度和脂质代谢,AMPK的激活是AdipoQ参与大部分生物学过程,进而发挥相应功能的关键步骤。AdipoQ及其受体调节脂类代谢的详细调控机制如图 1所示。
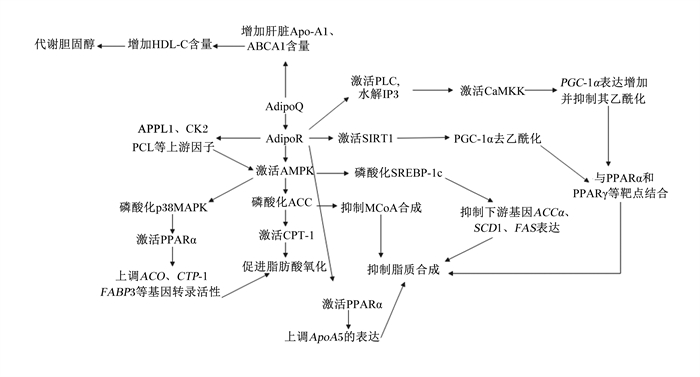
|
AdipoQ:脂联素;AdipoR:脂联素受体adiponectin receptor;AMPK:腺苷酸活化蛋白激酶AMP-activated protein kinase;ACC:乙酰辅酶A羧化酶acetyl CoA carboxylase;CPT-1:肉碱棕榈酰转移酶-1 carnitine palmitoyltransferase-1;Apo-A1/5:载脂蛋白A1/5 apolipoprotein A1/5;ABCA1:ATP结合盒转运体A1 ATP-binding cassette transporter A1;HDL-C:高密度脂蛋白胆固醇high density liptein cholesterol;APPL1:衔接蛋白1 adapter protein 1;PH: 普列克底物蛋白同源性结构域pleckstrin homology domain;CK2:酪蛋白激酶Ⅱ casein kinase Ⅱ;PLC:磷脂酶C phospholipase C;p38MAPK:p38丝裂原激活蛋白激酶p38 mitogen-activated protein kinase;PPARα/γ:过氧化物酶体增殖物激活受体α/γ peroxisome proliferators-activated receptor α/γ;ACO:乙酰辅酶A氧化酶acetyl-CoA oxidase;FABP3:脂肪酸结合蛋白3 fatty acid-binding protein 3;IP3:三磷酸肌醇3 inositol trisphosphate 3;CaMKK:钙/钙调蛋白依赖性蛋白激酶激酶calcium/calmodulin dependent protein kinase kinase;PGC-1α:过氧化物酶体增殖物激活受体γ辅助活化因子-1α peroxlsome proliferator-activated receptor-γ coactlvator-1α;SIRT1:沉默信息调节因子1 silent information regulator 1;SREBP-1c:固醇调节元件结合蛋白-1c sterol-regulatory element binding proteins-1c;MCoA:丙二酰辅酶A malonyl CoA;SCD1:硬脂酰辅酶A去饱和酶1 stearoyl-Co A desaturase 1;FAS:脂肪酸合成酶fatty acid synthase。 图 1 AdipoQ及其受体调节脂类代谢机制 Fig. 1 Mechanism of adipoQ and its receptors regulating lipid metabolism |
当AdipoQ与其受体结合后,AMPK信号通路被激活,乙酰辅酶A羧化酶(ACC)在AMPK的诱导下,磷酸化Ser79,使ACC失活;ACC是丙二酰辅酶A(malonyl CoA,MCoA)合成过程的限速酶,MCoA是肉碱棕榈酰转移酶-1(CPT-1)的有效抑制剂,于是CPT-1被激活,在CPT-1作用下,长链酯酰辅酶A从胞质进入线粒体,从而促进了脂肪酸β-氧化[26-27]。此外,AMPK上游因子APPL1、CK2在AdipoQ的作用下,能够激活AMPK信号通路,在肝细胞和肌细胞中AdipoQ与其受体结合后,APPL1结合并激活蛋白磷酸酶2A(protein phosphatase 2A,PP2A),从而使蛋白激酶Cz(PKCz)去磷酸化,导致肝激酶B1(LKB1)在其Ser307处去磷酸化,允许LKB1从细胞核移位到细胞质,并激活AMPK[8]。AdipoQ还能通过激活磷脂酶C(phospholipase C,PLC),利用PLC对磷脂酰肌醇二磷酸(phosphatidylinositol bisphosphate,PIP2)的水解作用,生成三磷酸肌醇(inositol trisphosphate, IP3),从而促使内质网的Ca2+释放,Ca2+触发钙/钙调蛋白依赖性蛋白激酶激酶(CaMKK),从而激活AMPK[12, 28-29]。
AMPK被激活后,除了使ACC磷酸化,从而促进脂肪酸β-氧化,还能激活PPARα信号转导通路,AMPK可使p38MAPK磷酸化,p38MAPK活化后又使PPARα N端的Ser残基磷酸化,从而活化PPARα,通过诱导转录因子PPARα的表达来调节许多与脂质代谢有关的基因的转录,如乙酰辅酶A氧化酶(acyl-CoA oxidase,ACO)、CPT-Ⅰ、脂肪酸结合蛋白3(fatty acid-binding protein 3,FABP3)等,生成某些蛋白质来调节脂肪酸代谢;在经
AdipoQ处理的C1C12中,AMPK被激活,PPARα转录活性提高,上调ACO、CPT-1、FABP3的转录表达水平,在犊牛的肝细胞中,则上调了ACO、CPT-1的表达水平,从而促进了脂肪酸的氧化[30-32]。然而,一些研究表明,AdipoQ的主要作用不是通过直接提高AMPK活性,而是通过一种继发性的未知机制增加细胞内AMP水平,以维持AdipoQ的下游作用,这一机制可以通过线粒体解偶联或激活腺嘌呤核苷酸磷酸酶来解释,AdipoQ通过这些酶增加AMP水平[33]。
综上所述,AdipoQ与其受体结合主要通过AdipoRl/2-AMPK-ACC通路、AdipoRl/2-AMPK-PPARα通路促进脂肪酸氧化,APPL1、CK2、LKB1作为AMPK信号通路的上游因子,ACC、PPARα作为下游因子,参与AdipoQ促进脂肪酸氧化的作用。
3.2 抑制脂质合成前文提及,活化的AMPK能诱导ACC失活,ACC是MCoA合成的限速酶,除此之外,MCoA也是脂肪酸生物合成的前体,从而脂类合成过程被抑制。另外,AMPK被激活后,会使固醇调节元件结合蛋白-1c(SREBP-1c)Ser372磷酸化,抑制SREBP-1c及其下游基因,如乙酰辅酶A羧化酶α(ACCα)、硬脂酰辅酶A去饱和酶1(SCD1)和脂肪酸合成酶(FAS)的表达。SREBP-1c是脂肪酸合成的主要调节因子,其下游靶基因能够调节脂质合成,通过这种抑制作用抑制脂质的合成[12, 34]。
AdipoQ与AdipoR1结合激活AMPK和沉默信息调节因子1(SIRT1),从而诱导过氧化物酶体增殖物激活受体γ辅助活化因子-1α(PGC-1α)去乙酰化。此外,AdipoQ与AdipoR1结合激活PLC,PLC水解IP3使内质网的Ca2+释放,激活CaMKK,导致PGC-1α表达增加并抑制其乙酰化[35]。PGC-lα能影响胆固醇7α羟化酶(CYP7A1)基因的表达,从而调节机体内胆固醇平衡。PGC-1α是一种分子质量为91 ku的转录因子,可以与PPARα和PPARγ等靶点结合,协调线粒体基因的表达,间接促进脂肪酸的运输和利用。pGC-1α上调三羧酸循环和线粒体脂肪酸氧化途径中几个基因的表达来调节脂质代谢和长链脂肪酸氧化,减少了甘油三酯的合成[36-37]。载脂蛋白A5(ApoA5)能够降低血浆甘油三酯含量,是调控甘油三酯合成的上游靶点。AdipoQ通过激活PPARα,上调ApoA5的表达,从而抑制极低密度脂蛋白(VLDL)的产生并促进肝脏对VLDL的摄取及代谢,但具体的作用机制尚未完全阐明,仍需进一步研究探索[38]。
3.3 参与胆固醇代谢血液循环中的AdipoQ与高密度脂蛋白(HDL)、低密度脂蛋白(LDL)含量呈正相关,与血浆甘油三酯含量呈负相关。AdipoQ能使血清HDL含量升高,还通过促进富含甘油三酯的脂蛋白分解降低血清甘油三酯含量;AdipoQ通过增加肝脏载脂蛋白A1(Apo-A1)和ATP结合盒转运体A1(ABCA1)的产生来增加高密度脂蛋白胆固醇(HDL-C)含量,ABCA1通过反向胆固醇运输诱导HDL组装,通过HDL逆向转运胆固醇的作用将肝外细胞释放的胆固醇转运到肝脏进行代谢[39-41]。
4 小结与展望综上所述,AdipoQ与AdipoRl、AdipoR2结合,通过相应信号转导通路及相关信号因子,促进脂肪酸氧化、抑制脂类合成及调控胆固醇的代谢来调节脂类代谢。此外,AdipoQ在能量代谢中起着关键作用,肥胖时总AdipoQ和高分子质量AdipoQ的含量降低,减肥后升高。因此,AdipoQ对改善肥胖及肥胖相关疾病有积极作用,有利于养殖行业提高瘦肉率等生产性能。尽管目前针对AdipoQ在脂类代谢方面及相关疾病的研究已开展了大量工作,但在畜禽实际生产中仍有许多问题需要解决,应怎样以恰当而经济的方式通过AdipoQ来提高饲料转化率及生产性能、防治代谢紊乱等相关疾病需要进行相关的研究。因此,对AdipoQ及其受体和相关信号转导通路的深入研究,有利于进一步掌握AdipoQ在相关疾病中的作用和机制,对开发调节AdipoQ及受体表达的药物和相关疾病防治具有重要的意义,并能改善动物生产性能和提高动物饲料利用率,为今后的畜禽生产提供服务。
| [1] |
SCHERER P E, WILLIAMS S, FOGLIANO M, et al. A novel serum protein similar to C1q, produced exclusively in adipocytes[J]. Journal of Biological Chemistry, 1995, 270(45): 26746-26749. DOI:10.1074/jbc.270.45.26746 |
| [2] |
MAEDA K, OKUBO K, SHIMOMURA I, et al. cDNA cloning and expression of a novel adipose specific collagen-like factor, apM1 (adipose most abundant gene transcript 1)[J]. Biochemical and Biophysical Research Communications, 1996, 221(2): 286-289. DOI:10.1006/bbrc.1996.0587 |
| [3] |
NAKANO Y, TOBE T, CHOI-MIURA N H, et al. Isolation and characterization of GBP28, a novel gelatin-binding protein purified from human plasma[J]. Journal of Biochemistry, 1996, 120(4): 803-812. DOI:10.1093/oxfordjournals.jbchem.a021483 |
| [4] |
ARITA Y, KIHARA S, OUCHI N, et al. Paradoxical decrease of an adipose-specific protein, adiponectin, in obesity[J]. Biochemical and Biophysical Research Communications, 1999, 257(1): 79-83. DOI:10.1006/bbrc.1999.0255 |
| [5] |
唐妮, 王书瑶, 齐锦雯, 等. 脂联素调控脂质代谢的研究进展[J]. 畜牧兽医学报, 2018, 49(12): 2550-2557. TANG N, WANG S Y, QI J W, et al. Research progress on adiponectin regulating lipid metabolism[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(12): 2550-2557 (in Chinese). DOI:10.11843/j.issn.0366-6964.2018.12.003 |
| [6] |
张德荣. 脂联素及其受体介导绵羊肌内、内脏和皮下脂肪细胞生脂基因表达与分子调控机理研究[D]. 博士学位论文. 兰州: 甘肃农业大学, 2019: 6-7. ZHANG D R. Adiponectin and its receptors mediated adipogenic gene expression and molecular regulation intramuscular, visceral and subcutaneous adipocytes in sheep[D]. Ph. D. Thesis. Lanzhou: Gansu Agricultural University, 2019: 6-7. (in Chinese) |
| [7] |
GHADGE A A, KHAIRE A A, KUVALEKAR A A. Adiponectin: a potential therapeutic target for metabolic syndrome[J]. Cytokine & Growth Factor Reviews, 2018, 39: 151-158. |
| [8] |
ACHARI A E, JAIN S K. Adiponectin, a therapeutic target for obesity, diabetes, and endothelial dysfunction[J]. International Journal of Molecular Sciences, 2017, 18(6): 1321. DOI:10.3390/ijms18061321 |
| [9] |
FANG X, PALANIVEL R, ZHOU X, et al. Hyperglycemia-and hyperinsulinemia-induced alteration of adiponectin receptor expression and adiponectin effects in L6 myoblasts[J]. Journal of Molecular Endocrinology, 2005, 35(3): 465-476. DOI:10.1677/jme.1.01877 |
| [10] |
KADOWAKI T, YAMAUCHI T. Adiponectin and adiponectin receptors[J]. Endocrine Reviews, 2005, 26(3): 439-451. DOI:10.1210/er.2005-0005 |
| [11] |
VON FRANKENBERG A D, REIS A F, GERCHMAN F. Relationships between adiponectin levels, the metabolic syndrome, and type 2 diabetes: a literature review[J]. Archives of Endocrinology and Metabolism, 2017, 61(6): 614-622. DOI:10.1590/2359-3997000000316 |
| [12] |
KHORAMIPOUR K, CHAMARI K, HEKMATIKAR A A, et al. Adiponectin: structure, physiological functions, role in diseases, and effects of nutrition[J]. Nutrients, 2021, 13(4): 1180. DOI:10.3390/nu13041180 |
| [13] |
VASILIAUSKAITÉ-BROOKS I, SOUNIER R, ROCHAIX P, et al. Structural insights into adiponectin receptors suggest ceramidase activity[J]. Nature, 2017, 544(7648): 120-123. DOI:10.1038/nature21714 |
| [14] |
HUG C, WANG J, AHMAD N S, et al. T-cadherin is a receptor for hexameric and high-molecular-weight forms of Acrp30/adiponectin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(28): 10308-10313. DOI:10.1073/pnas.0403382101 |
| [15] |
FUKUDA S, KITA S, OBATA Y, et al. The unique prodomain of T-cadherin plays a key role in adiponectin binding with the essential extracellular cadherin repeats 1 and 2[J]. Journal of Biological Chemistry, 2017, 292(19): 7840-7849. DOI:10.1074/jbc.M117.780734 |
| [16] |
CHEN T, WU Y W, LU H, et al. Adiponectin enhances osteogenic differentiation in human adipose-derived stem cells by activating the APPL1-AMPK signaling pathway[J]. Biochemical and Biophysical Research Communications, 2015, 461(2): 237-242. DOI:10.1016/j.bbrc.2015.03.168 |
| [17] |
ENGIN A. Adiponectin-resistance in obesity[J]. Advances in Experimental Medicine and Biology, 2017, 960: 415-441. |
| [18] |
HEIKER J T, WOTTAWAH C M, JUHL C, et al. Protein kinase CK2 interacts with adiponectin receptor 1 and participates in adiponectin signaling[J]. Cellular Signalling, 2009, 21(6): 936-942. DOI:10.1016/j.cellsig.2009.02.003 |
| [19] |
REBHOLZ H, NISHI A, LIEBSCHER S, et al. CK2 negatively regulates Galphas signaling[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(33): 14096-14101. DOI:10.1073/pnas.0906857106 |
| [20] |
RITTER M, BUECHLER C, KAPINSKY M, et al. Interaction of CD163 with the regulatory subunit of casein kinase Ⅱ (CKⅡ) and dependence of CD163 signaling on CKⅡ and protein kinase C[J]. European Journal of Immunology, 2001, 31(4): 999-1009. DOI:10.1002/1521-4141(200104)31:4<999::AID-IMMU999>3.0.CO;2-R |
| [21] |
SAYED M, KIM S O, SALH B S, et al. Stress-induced activation of protein kinase CK2 by direct interaction with p38 mitogen-activated protein kinase[J]. Journal of Biological Chemistry, 2000, 275(22): 16569-16573. DOI:10.1074/jbc.M000312200 |
| [22] |
ADAMS D R, RON D, KIELY P A. RACK1, a multifaceted scaffolding protein: structure and function[J]. Cell Communication and Signaling, 2011, 9: 22. DOI:10.1186/1478-811X-9-22 |
| [23] |
XU Y Z, WANG N F, LING F, et al. Receptor for activated C-kinase 1, a novel binding partner of adiponectin receptor 1[J]. Biochemical and Biophysical Research Communications, 2009, 378(1): 95-98. DOI:10.1016/j.bbrc.2008.11.026 |
| [24] |
CHARLTON H K, WEBSTER J, KRUGER S, et al. ERp46 binds to AdipoR1, but not AdipoR2, and modulates adiponectin signalling[J]. Biochemical and Biophysical Research Communications, 2010, 392(2): 234-239. DOI:10.1016/j.bbrc.2010.01.029 |
| [25] |
KESHVARI S, ROSE F J, CHARLTON H K, et al. Characterisation of the adiponectin receptors: the non-conserved N-terminal region of AdipoR2 prevents its expression at the cell-surface[J]. Biochemical and Biophysical Research Communications, 2013, 432(1): 28-33. DOI:10.1016/j.bbrc.2013.01.092 |
| [26] |
ESMAILI S, HEMMATI M, KARAMIAN M. Physiological role of adiponectin in different tissues: a review[J]. Archives of Physiology and Biochemistry, 2020, 126(1): 67-73. DOI:10.1080/13813455.2018.1493606 |
| [27] |
GAMBERI T, MAGHERINI F, MODESTI A, et al. Adiponectin signaling pathways in liver diseases[J]. Biomedicines, 2018, 6(2): 52. DOI:10.3390/biomedicines6020052 |
| [28] |
FANG X P, PALANIVEL R, CRESSER J, et al. An APPL1-AMPK signaling axis mediates beneficial metabolic effects of adiponectin in the heart[J]. American Journal of Physiology: Endocrinology and Metabolism, 2010, 299(5): E721-E729. DOI:10.1152/ajpendo.00086.2010 |
| [29] |
邓大同, 王佑民, 程媛, 等. 脂联素通过LKB1途径激活腺苷酸活化蛋白激酶[J]. 中华内分泌代谢杂志, 2012, 28(7): 578-583. DENG D T, WANG Y M, CHENG Y, et al. Adiponectin activates AMP-activated protein kinase via LKB1 pathway[J]. Chinese Journal of Endocrinology and Metabolism, 2012, 28(7): 578-583 (in Chinese). DOI:10.3760/cma.j.issn.1000-6699.2012.07.014 |
| [30] |
YOON M J, LEE G Y, CHUNG J J, et al. Adiponectin increases fatty acid oxidation in skeletal muscle cells by sequential activation of AMP-activated protein kinase, p38 mitogen-activated protein kinase, and peroxisome proliferator-activated receptor alpha[J]. Diabetes, 2006, 55(9): 2562-2570. DOI:10.2337/db05-1322 |
| [31] |
陈灰, 张良, 李心慰, 等. 脂联素对犊牛肝细胞脂氧化关键酶表达的影响[J]. 中国兽医学报, 2012, 32(10): 1551-1555. CHEN H, ZHANG L, LI X W, et al. Effects of adiponectin on the expression of key enzyme genes involved in fatty acid oxidation in bovine hepatocytes cultured in vitro[J]. Chinese Journal of Veterinary Science, 2012, 32(10): 1551-1555 (in Chinese). |
| [32] |
NGUYEN T M D. Adiponectin: role in physiology and pathophysiology[J]. International Journal of Preventive Medicine, 2020, 11: 136. DOI:10.4103/ijpvm.IJPVM_193_20 |
| [33] |
YAMAUCHI T, KAMON J, MINOKOSHI Y, et al. Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase[J]. Nature Medicine, 2002, 8(11): 1288-1295. DOI:10.1038/nm788 |
| [34] |
SHABALALA S C, DLUDLA P V, MABASA L, et al. The effect of adiponectin in the pathogenesis of non-alcoholic fatty liver disease (NAFLD) and the potential role of polyphenols in the modulation of adiponectin signaling[J]. Biomedicine & Pharmacotherapy, 2020, 131: 110785. |
| [35] |
IWABU M, YAMAUCHI T, OKADA-IWABU M, et al. Adiponectin and AdipoR1 regulate PGC-1alpha and mitochondria by Ca2+ and AMPK/SIRT1[J]. Nature, 2010, 464(7293): 1313-1319. DOI:10.1038/nature08991 |
| [36] |
CHENG C F, KU H C, LIN H. PGC-1α as a pivotal factor in lipid and metabolic regulation[J]. International Journal of Molecular Sciences, 2018, 19(11): 3447. DOI:10.3390/ijms19113447 |
| [37] |
SHIN D J, CAMPOS J A, GIL G, et al. PGC-1alpha activates CYP7A1 and bile acid biosynthesis[J]. Journal of Biological Chemistry, 2003, 278(50): 50047-50052. DOI:10.1074/jbc.M309736200 |
| [38] |
阳琰, 邓华聪, 龙健, 等. 脂联素对HepG2细胞内PPARα、ApoA5表达和甘油三酯水平的影响及其机制探讨[J]. 解放军医学杂志, 2012, 37(7): 707-710. YANG Y, DENG H C, LONG J, et al. Effect of adiponectin on PPARα, ApoA5 and triglyceride in HepG2 cells and its mechanism[J]. Medical Journal of Chinese People's Liberation Army, 2012, 37(7): 707-710 (in Chinese). |
| [39] |
VAN LINTHOUT S, FORYST-LUDWIG A, SPILLMANN F, et al. Impact of HDL on adipose tissue metabolism and adiponectin expression[J]. Atherosclerosis, 2010, 210(2): 438-444. DOI:10.1016/j.atherosclerosis.2010.01.001 |
| [40] |
TOMONO Y, HIRAISHI C, YOSHIDA H. Age and sex differences in serum adiponectin and its association with lipoprotein fractions[J]. Annals of Clinical Biochemistry, 2018, 55(1): 165-171. DOI:10.1177/0004563217699233 |
| [41] |
YANAI H, YOSHIDA H. Beneficial effects of adiponectin on glucose and lipid metabolism and atherosclerotic progression: mechanisms and perspectives[J]. International Journal of Molecular Sciences, 2019, 20(5): 1190. DOI:10.3390/ijms20051190 |




