2. 佛山科学技术学院生命科学与工程学院, 佛山 528225;
3. 广东广汇农牧有限公司, 韶关 512040;
4. 岭南现代 农业科学与技术广东省实验室茂名分中心, 茂名 525000
2. College of Life Science and Engineering, Foshan University of Science and Technology, Foshan 528225, China;
3. Guangdong Guanghui Agriculture and Animal Husbandry Co., Ltd., Shaoguan 512040, China;
4. Maoming Branch, Guangdong Laboratory for Lingnan Modern Agricultural Science and Technology, Maoming 525000, China
仔猪在早期断奶时,其消化系统和免疫系统尚未发育完全,加之受采食方式、环境和营养变化等诸多应激因素的影响,仔猪肠道结构形态和功能易发生改变,对营养物质的消化吸收功能下降,机体免疫能力和抗病力降低,容易发生腹泻等疾病,引起仔猪断奶应激综合征,从而造成仔猪生产性能下降甚至死亡[1-2]。我国规定,从2020年7月1日起饲料全面禁抗。如何在无抗条件下,降低断奶仔猪腹泻、提升仔猪机体抗氧化能力和免疫力,从而提高其生产性能已成为当今养猪业的重点。因此,开发具有提高抗氧化能力和增强免疫力的绿色饲料添加剂成为提升断奶仔猪健康养殖的重要手段和研究热点。
桑叶是桑科植物桑树的叶子,在我国的种植面积高达100万hm2,分布遍及全国[3]。桑叶具有较高的营养价值,除了含有丰富的碳水化合物、蛋白质、粗脂肪、粗纤维、维生素和矿物质等营养物质,桑叶中还含有桑叶多酚、黄酮、多糖以及生物碱等多种生物活性物质,具有降血糖、抗氧化和提高免疫力等多种功效[4-7],理论上具有很高的饲用价值。然而,桑叶中含有单宁、植物凝集素等抗营养因子,过量添加不仅会影响饲粮的适口性,还会降低畜禽对蛋白质的利用,阻止机体对钙的吸收[8]。而将桑叶分离提纯并加工成桑叶提取物(mulberry leaf extract,MLE),不仅能够降低单宁、植物凝集素等这些抗营养因子的含量,同时还能将桑叶中的桑叶多酚、黄酮、多糖和生物碱等活性成分分离并提纯出来。因此,MLE作为一种绿色饲料添加剂,以其特有的纯天然、安全、多功效和毒副作用小等特性引起了畜牧业的广泛关注。研究表明,在畜禽和水产饲料中添加MLE能够改善饲料的消化率和利用率,提高动物机体的抗氧化能力、免疫功能和生长性能,改善畜禽、水产产品的肉品质和屠宰性能[9-13]。目前,MLE在动物养殖中的应用大多集中在家禽和水产上,而其对猪的影响则少有报道。因此,本试验以断奶仔猪作为研究对象,通过在饲粮中添加1 000 g/t的MLE,探讨其对仔猪生长性能、养分表观消化率、消化酶活性、抗氧化能力以及免疫功能的影响,旨在为MLE在仔猪饲粮中的应用提供科学依据。
1 材料与方法 1.1 试验材料本试验所用MLE由广州市某公司提供,由桑叶粉的乙醇浸提物浓缩后喷雾干燥制成。其主要活性成分为桑叶黄酮、桑叶多酚、桑叶多糖和生物碱,其中桑叶总黄酮含量为20.51%。
1.2 试验设计试验选取48头初始体重为(8.287±0.141) kg且健康的(28±1)日龄“杜×长×大”三元杂交断奶阉公猪,随机分为2组,每组6个重复,每个重复4头猪。对照组饲喂基础饲粮,试验组(MLE组)在基础饲粮中添加1 000 g/t的MLE(产品企业标准制定前进行了梯度试验,确定推荐的剂量为1 000 g/t)。试验期为28 d。玉米-豆粕型基础饲粮参照NRC(2012)仔猪营养需要量配制,其组成及营养水平见表 1。饲粮按试验期分为2个阶段,分别为断奶前期(7~11 kg)和断奶后期(12~25 kg)。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets (air-dry basis) |
试验在广东省农业科学院动物科学研究所全封闭式仔猪试验场进行。猪舍内温度控制在(25±1) ℃,相对湿度控制在(50±5)%。每个重复的4头仔猪在同一栏中饲养。试验期间所有仔猪自由采食和饮水,每次喂食遵循少量多次原则,每天早晚观察断奶仔猪的精神状态。每天定时清扫猪舍,以保持猪舍清洁。定期对猪舍进行消毒,消毒及免疫程序均按照猪场常规程序进行。
1.4 样品采集试验结束前3 d(第26~28天),每天早上收集粪样。试验结束后,将每头仔猪的全部粪样混合均匀,然后置于105 ℃烘箱中烘干至恒重,再将烘干的粪样粉碎过40目筛,保存备用。
第28天试验结束时,所有仔猪禁食12 h,每个重复选取1头接近平均体重的断奶仔猪进行颈静脉采血,用含抗凝剂(肝素钠)的采血管收集血液,颠倒混匀,室温静置30 min后,3 500 r/min、4 ℃离心10 min,收集血浆,分装于1.5 mL离心管中,并于-80 ℃保存,用于血浆抗氧化和免疫指标的检测。仔猪采血后屠宰,取肝脏组织,用生理盐水冲洗干净,滤纸吸干后迅速切小块,分装于冻存管并转移至液氮中,-80 ℃保存,用于肝脏抗氧化指标的检测。用载玻片分别刮取空肠和回肠的肠黏膜,分装于1.5 mL离心管中,立即置于液氮中保存,用于测定肠道消化酶活性。
1.5 指标测定 1.5.1 生长性能和腹泻率试验第1天和第28天测定各组断奶仔猪空腹体重。试验期间记录每个重复的总采食量,试验结束后计算平均日增重(ADG)、平均日采食量(ADFI)及料重比(F/G)。每天早晚2次仔细检查断奶仔猪的肛门,观察有无腹泻情况并记录,试验结束后,根据以下公式计算每栏仔猪的腹泻率:
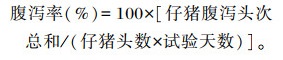
|
采用内源指示剂——盐酸不溶灰分(AIA)法进行养分表观消化率的测定,饲粮和粪便中AIA含量参考GB/T 23742—2009测定;干物质含量参考GB/T 6435—2006测定;粗蛋白质含量参考GB/T 6432—2018测定;粗脂肪含量参考GB/T 6433—2006测定;粗纤维质含量参考GB/T 6434—2006测定;粗灰分含量参考GB/T 6438—2007测定。养分表观消化率计算公式如下:

|
采用空肠和回肠的肠黏膜测定脂肪酶和淀粉酶活性,使用南京建成生物工程研究所试剂盒,根据试剂盒的说明书进行测定。
1.5.4 抗氧化能力使用南京建成生物工程研究所试剂盒对血浆和肝脏中总抗氧化能力(T-AOC)、丙二醛(MDA)含量以及总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)活性等抗氧化能力指标进行测定。检测过程严格按照说明书的步骤进行。
1.5.5 免疫功能血浆中免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)以及肿瘤坏死因子-α(TNF-α)含量等免疫功能指标均使用酶联免疫吸附试验(ELISA)试剂盒测定,试剂盒购于上海酶联生物科技有限公司,操作步骤严格按照说明书进行。
1.6 数据处理试验数据采用SPSS 23.0软件进行独立样本t检验(t-test),测定结果以“平均值±标准误”(mean±SE)表示,P < 0.05表示差异显著,P < 0.01表示差异极显著,0.05≤P < 0.10表示有显著趋势。
2 结果 2.1 MLE对断奶仔猪生长性能和腹泻率的影响由表 2可知,与对照组相比,MLE组断奶仔猪ADFI和F/G无显著性差异(P>0.05),但其ADG有增加的趋势(0.05≤P < 0.10),且腹泻率显著降低(P < 0.05)。
|
|
表 2 MLE对断奶仔猪生长性能和腹泻率的影响 Table 2 Effects of MLE on growth performance and diarrhea rate of weaned piglets |
由表 3可知,2组之间粗蛋白质、粗纤维和粗灰分的表观消化率无显著性差异(P>0.05);但与对照组相比,饲粮添加1 000 g/t的MLE可显著提高粗脂肪的表观消化率(P < 0.05),并有提高干物质表观消化率的趋势(0.05≤P < 0.10)。
|
|
表 3 MLE对断奶仔猪养分表观消化率的影响 Table 3 Effects of MLE on nutrient apparent digestibility of weaned piglets |
由表 4可知,与对照组相比,饲粮添加1 000 g/t的MLE可极显著提高断奶仔猪空肠中脂肪酶的活性(P < 0.01),并显著提高回肠中脂肪酶的活性(P < 0.05),而对空肠和回肠中淀粉酶的活性无显著性影响(P>0.05)。
|
|
表 4 MLE对断奶仔猪消化酶活性的影响 Table 4 Effects of MLE on digestive enzyme activity of weaned piglets |
由表 5可知,与对照组相比,饲粮添加1 000 g/t的MLE可显著提高断奶仔猪血浆中GSH-Px的活性和T-AOC(P < 0.05),而对血浆中MDA含量、T-SOD和CAT活性无显著性影响(P>0.05)。同时,与对照组相比,饲粮添加1 000 g/t的MLE可显著提高断奶仔猪肝脏中T-SOD的活性(P < 0.05),而对肝脏中CAT和GSH-Px活性、MDA含量以及T-AOC无显著性影响(P>0.05)。
|
|
表 5 MLE对断奶仔猪抗氧化能力的影响 Table 5 Effects of MLE on antioxidant ability of weaned piglets |
由表 6可知,与对照组相比,饲粮添加1 000 g/t的MLE显著降低了断奶仔猪血浆中TNF-α的含量(P < 0.05),同时显著提高了血浆中IgA和IgM的含量(P < 0.05),而对断奶仔猪血浆中IgG的含量无显著性影响(P>0.05)。
|
|
表 6 MLE对断奶仔猪免疫功能的影响 Table 6 Effects of MLE on immune function of weaned piglets |
桑叶中除了含有桑叶黄酮、桑叶多糖、生物碱和甾醇类等多种对畜禽生长有益的天然活性物质外,还含有单宁、植物凝集素等抗营养因子,大量添加到饲粮中不仅会影响饲粮的适口性,还会阻碍蛋白质和钙的吸收利用,从而降低畜禽生长性能[10, 14]。MLE可将桑叶中的活性物质分离提纯并加以浓缩,使其充分发挥功效。Zhao等[15]研究表明,饲粮中添加桑叶多糖可降低早期断奶仔猪的腹泻率,改善其肠道微生态环境,提高仔猪的生长性能。此外,李婉涛等[16]研究发现,育肥猪饲粮中添加0.3%的杜仲和MLE能够提高育肥猪的ADG和饲料报酬,从而提高其生产性能。与前人研究结果相一致,在本试验中,饲粮添加1 000 g/t的MLE能显著降低断奶仔猪腹泻率,并有提高断奶仔猪ADG的趋势,这可能跟MLE中的多种活性物质改善了仔猪肠道微生态环境,促进了肠道健康,提高了机体抗氧化能力和免疫力有关。
3.2 MLE对断奶仔猪养分表观消化率和消化酶活性的影响仔猪断奶时,由于其消化系统尚未发育成熟,仔猪往往存在胃酸分泌不足,肠道内消化酶活性较低等问题,这造成断奶仔猪对饲粮中营养物质的消化吸收能力下降,影响其生长性能[17]。养分表观消化率是评价动物对营养物质的消化能力以及饲粮营养价值的重要指标。本试验结果显示,与对照组相比,MLE组断奶仔猪对粗脂肪的表观消化率显著提高,对干物质的表观消化率也有升高的趋势。同时,与对照组相比,饲粮添加MLE显著提高了断奶仔猪空肠和回肠中脂肪酶的活性,表明MLE通过提高仔猪肠道内脂肪酶的活性提高了对粗脂肪的表观消化率。赵卫国等[11]研究表明,在肉用四季鹅饲粮中分别添加0、2%、4%、6%和8%的桑叶粉,鹅对干物质、粗灰分、粗蛋白质、粗纤维和粗脂肪的利用率和能量利用率均随着桑叶粉添加比例的增加而呈现下降趋势,说明桑叶中存在抗营养因子,在饲粮中添加时应选择适当剂量。而本试验中添加的MLE不含有抗营养因子,且浓缩了桑叶中含有的多糖、多酚和黄酮等多种活性物质,因此未出现营养物质消化率下降的现象。有研究表明,在饲粮中添加适量的桑叶黄酮能够改善断奶犊牛胃肠道形态,提高消化酶的活性[18];还能提升绵羊对营养物质的消化率[19]。此外,Li等[20]研究发现,MLE可提高大鲵消化酶活性并改善肠道发育状况,从而促进其对营养物质的消化吸收和利用。因此,在本试验中,MLE提高断奶仔猪肠道内脂肪酶的活性和粗脂肪的表观消化率与MLE中含有的桑叶黄酮等活性物质有关。
3.3 MLE对断奶仔猪抗氧化能力的影响研究表明,桑叶对动物机体中游离的氧自由基、羟自由基和脂类自由基具有较好的清除作用;其中,桑叶中所含的多糖、多酚和黄酮成分除了本身就具有较强的抗氧化作用外,还可直接清除体内超氧离子自由基和脂质过氧化物,尤其是对酶类物质不能清除的羟自由基具有较好的清除效果,因此是桑叶发挥抗氧化活性的主要成分[15, 21-23]。卢桦等[13]研究发现,在饲粮中添加7.5 g/kg的MLE能够显著提高大鲵肝脏中T-AOC和T-SOD的活性,同时降低了肝脏中MDA的含量,从而提高了肝脏的抗氧化能力。Andallu等[24]在Wistar大鼠饲粮中添加25%的桑叶粉,发现其能够降低大鼠血浆中谷胱甘肽的含量和CAT、GSH-Px、谷胱甘肽还原酶(GR)、谷胱甘肽S-转移酶(GST)和超氧化物歧化酶(SOD)的活性,表现出了较强的抗氧化作用。与上述研究结果基本一致,在本试验中,与对照组相比,饲粮添加MLE显著提高了断奶仔猪血浆中GSH-Px的活性和T-AOC,同时也显著提高了肝脏中的T-SOD活性,表明MLE可以增强断奶仔猪血浆和肝脏中抗氧化酶的活性,从而提高仔猪机体的抗氧化能力。
3.4 MLE对断奶仔猪免疫功能的影响MLE对动物机体具有较好的免疫调节作用。卢桦等[13]研究表明,在饲粮中添加7.5 g/kg的MLE能够使大鲵的血浆IgM含量显著高于对照组。雷春龙等[9]在蛋鸡饲粮中添加0.4%和0.8%桑枝叶提取物,发现其均可提高罗曼粉蛋鸡的产蛋率以及血清中IgA、IgM、白细胞介素-6和肿瘤坏死因子含量。研究证实,在MLE中,桑叶多酚和桑叶多糖是发挥免疫调节作用的主要活性物质[25]。沈维治等[26]研究发现,MLE具有明显的抑菌作用,且其抑菌活性与桑叶多酚的含量成显著剂量效应关系。Horng等[27]研究表明,桑叶多酚不仅能通过下调炎症细胞因子及促炎介质的产生来调节机体的炎症反应,还可通过抑制核转录因子-κB(NF-κB)信号途径诱导巨噬细胞活化参与的炎症反应,从而提高机体免疫功能。桑叶多糖对动物机体的免疫调节则主要体现为提高机体的体液免疫和细胞免疫[28]。研究表明,桑叶多糖能增强小鼠单核巨噬细胞的吞噬能力,并能直接促进脾淋巴细胞的有丝分裂,激活T细胞[29]。与上述研究结果相一致,本试验结果显示,与对照组相比,饲粮添加1 000 g/t的MLE显著降低了断奶仔猪血浆中TNF-α的含量,并显著提高了血浆中IgA和IgM的含量。TNF-α是一种促炎细胞因子,由巨噬细胞和淋巴细胞等细胞分泌,在体内具有介导炎症反应以及调节免疫等功能[30]。IgA、IgG和IgM则是机体主要的免疫球蛋白,具有抗体活性,可直接参与动物机体的体液免疫反应。本试验结果表明,MLE通过降低断奶仔猪机体的炎症反应,并提高其体液免疫,从而使仔猪机体的免疫功能得到加强。MLE对仔猪的这种免疫调节功能可能与MLE中的桑叶多酚和桑叶多糖等活性物质密切相关。
4 结论饲粮添加1 000 g/t的MLE对断奶仔猪生长性能无显著影响,但可降低断奶仔猪腹泻率,提高其肠道内脂肪酶的活性和粗脂肪的表观消化率,并能提高断奶仔猪机体的抗氧化能力及免疫功能。
| [1] |
GRESSE R, CHAUCHEYRAS-DURAND F, FLEURY M A, et al. Gut microbiota dysbiosis in postweaning piglets: understanding the keys to health[J]. Trends in Microbiology, 2017, 25(10): 851-873. DOI:10.1016/j.tim.2017.05.004 |
| [2] |
HEO J M, OPAPEJU F O, PLUSKE J R, et al. Gastrointestinal health and function in weaned pigs: a review of feeding strategies to control post-weaning diarrhoea without using in-feed antimicrobial compounds[J]. Journal of Animal Physiology and Animal Nutrition, 2013, 97(2): 207-237. DOI:10.1111/j.1439-0396.2012.01284.x |
| [3] |
高雨飞, 黎力之, 欧阳克蕙, 等. 桑叶在肉牛生产中的开发利用[J]. 中国牛业科学, 2015, 41(1): 68-70, 75. GAO Y F, LI L Z, OUYANG K H, et al. The development and utilization of mulberry leaf in beef cattle production[J]. China Cattle Science, 2015, 41(1): 68-70, 75 (in Chinese). DOI:10.3969/j.issn.1001-9111.2015.01.021 |
| [4] |
ANDALLU B, SURYAKANTHAM V, LAKSHMI SRIKANTHI B, et al. Effect of mulberry (Morus indica L.) therapy on plasma and erythrocyte membrane lipids in patients with type 2 diabetes[J]. Clinica Chimica Acta, 2001, 314(1/2): 47-53. |
| [5] |
HOLLMAN P C, KATAN M B. Dietary flavonoids: intake, health effects and bioavailability[J]. Food and Chemical Toxicology, 1999, 37(9/10): 937-942. |
| [6] |
RAMOS S. Cancer chemoprevention and chemotherapy: dietary polyphenols and signalling pathways[J]. Molecular Nutrition & Food Research, 2010, 52(5): 507-526. |
| [7] |
朱琳, 赵金鸽, 范作卿, 等. 桑叶的主要营养成分及其药理作用的研究进展[J]. 北方蚕业, 2017, 38(2): 9-15, 23. ZHU L, ZHAO J G, FAN Q, et al. Research progress on nutrient components, biological activity and application of mulberry leaves[J]. North Sericulture, 2017, 38(2): 9-15, 23 (in Chinese). DOI:10.3969/j.issn.1673-9922.2017.02.002 |
| [8] |
黄添就, 闭海龙, 陈芳艳, 等. 不同品种桑叶单宁和凝集素含量的检测及评价[J]. 广东蚕业, 2021, 55(5): 7-9. HUANG T J, BI H L, CHEN F Y, et al. The determination and evaluation of tannin and lectin in different varieties mulberry leaves[J]. Guangdong Sericulture, 2021, 55(5): 7-9 (in Chinese). |
| [9] |
雷春龙, 李娟, 吴永胜, 等. 桑枝叶提取物对蛋鸡生产性能、血清免疫指标与抗氧化能力的影响[J]. 中国畜牧杂志, 2019, 55(8): 118-122. LEI C L, LI J, WU Y S, et al. Effects of mulberry branch and leaf extract on growth performance, serum immune indexes and antioxidant capacity of laying hens[J]. Chinese Journal of Animal Science, 2019, 55(8): 118-122 (in Chinese). |
| [10] |
范京辉, 张永华, 楼立峰, 等. 桑叶及其提取物对AA肉鸡生长、养分消化与胴体品质的影响[J]. 杭州农业与科技, 2012(5): 29-32. FAN J H, ZHANG Y H, LOU L F, et al. Effects of mulberry leaf and its extracts on growth, nutrient digestion and carcass quality of AA broilers[J]. Hangzhou Agricultural Science and Technology, 2012(5): 29-32 (in Chinese). |
| [11] |
赵卫国, 孙梦琦, 侯启瑞, 等. 日粮中添加桑叶粉对扬州鹅饲料利用率及生长和屠宰性能的影响[J]. 蚕业科学, 2019, 45(3): 386-392. ZHAO W G, SUN M Q, HOU Q R, et al. Effect of adding mulberry leaf powder to daily diet on feed utilization rate, growth and slaughter performance of Yangzhou goose[J]. Acta Sericologica Sinica, 2019, 45(3): 386-392 (in Chinese). |
| [12] |
SHEIKHLAR A, ALIMON A R, DAUD H, et al. White mulberry (Morus alba) foliage methanolic extract can alleviate Aeromonas hydrophila infection in African catfish (Clarias gariepinus)[J]. The Scientific World Journal, 2014, 2014: 592709. |
| [13] |
卢桦, 李战福, 黄先智, 等. 桑叶提取物和1-脱氧野尻霉素对大鲵生长性能、肝脏功能及免疫能力的影响[J]. 动物营养学报, 2021, 33(1): 584-593. LU H, LI Z F, HUANG X Z, et al. Effects of mulberry leaf extract and 1-deoxynojirimycin on growth performance, liver function and immune ability of giant salamander (Andrias davidianus)[J]. Chinese Journal of Animal Nutrition, 2021, 33(1): 584-593 (in Chinese). |
| [14] |
HAS H, YUNIANTO V D, SUKAMTO B. The effectivity of fermented mulberry leaves with rumen liquor as broiler feed on final body weight, dry matter and crude fiber digestibility, and metabolic energy[J]. Animal Production, 2013, 15(3): 173-179. |
| [15] |
ZHAO X J, LI L, LUO Q L, et al. Effects of mulberry (Morus alba L.) leaf polysaccharides on growth performance, diarrhea, blood parameters, and gut microbiota of early-weanling pigs[J]. Livestock Science, 2015, 177: 88-94. |
| [16] |
李婉涛, 王义翠, 徐秋良, 等. 杜仲和桑叶提取物对育肥猪生长性能及猪肉品质的影响[J]. 黑龙江畜牧兽医, 2018, 10(10): 157-160. LI W T, WANG Y C, XU Q L, et al. Effect of Eucommia ulmoicles Oliv. and mulberry leaf extract on growth performance and pork quality of fattening pigs[J]. Heilongjiang Animal Science and Veterinary Medicine, 2018, 10(157): 160 (in Chinese). |
| [17] |
JAYARAMAN B, NYACHOTI C M. Husbandry practices and gut health outcomes in weaned piglets: a review[J]. Animal Nutrition, 2017, 3(3): 205-211. |
| [18] |
WANG B, YANG C T, DIAO Q Y, et al. The influence of mulberry leaf flavonoids and Candida tropicalis on antioxidant function and gastrointestinal development of preweaning calves challenged with Escherichia coli O141:K99[J]. Journal of Dairy Science, 2018, 101(7): 6098-6108. |
| [19] |
CHEN D D, CHEN X L, TU Y, et al. Effects of mulberry leaf flavonoid and resveratrol on methane emission and nutrient digestion in sheep[J]. Animal Nutrition, 2015, 1(4): 362-367. |
| [20] |
LI Z F, CHEN X C, CHEN Y J, et al. Effects of dietary mulberry leaf extract on the growth, gastrointestinal, hepatic functions of Chinese giant salamander (Andrias davidianus)[J]. Aquaculture Research, 2020, 51(6): 2613-2623. |
| [21] |
KIM D S, KANG Y M, JIN W Y, et al. Antioxidant activities and polyphenol content of Morus alba leaf extracts collected from varying regions[J]. Biomedical Reports, 2014, 2(5): 675-680. |
| [22] |
RADOJKOVIĆ M M, ZEKOVIĆ Z P, VIDOVIĆ S S, et al. Free radical scavenging activity, total phenolic and flavonoid contents of mulberry (Morus spp. L., Moraceae) extracts[J]. Hemijska Industrija, 2012, 66(4): 547-552. |
| [23] |
NAOWABOOT J, PANNANGPETCH P, KUKONGVIRIYAPAN V, et al. Antihyperglycemic, antioxidant and antiglycation activities of mulberry leaf extract in streptozotocin-induced chronic diabetic rats[J]. Plant Foods for Human Nutrition, 2009, 64(2): 116-121. |
| [24] |
ANDALLU B, VARADACHARYULU N C. Antioxidant role of mulberry (Morus indica L. cv. Anantha) leaves in streptozotocin-diabetic rats[J]. Clinica Chimica Acta, 2003, 338(1/2): 3-10. |
| [25] |
王霞, 肖定福. 桑叶提取物对动物免疫功能的调节作用及其机理研究进展[J]. 饲料博览, 2020(12): 9-13, 19. WANG X, XIAO D F. Research progress on the effect of mulberry leaf extract on immune function and its mechanism[J]. Feed Review, 2020(12): 9-13, 19 (in Chinese). |
| [26] |
沈维治, 邹宇晓, 刘凡, 等. 桑叶不同极性溶剂提取物的总多酚含量与抑菌活性[J]. 蚕业科学, 2013, 39(1): 135-138. SHEN W Z, ZOU Y X, LIU F, et al. Total polyphenol content and antibacterial activity of mulberry leaf extracts from different polarity solvents[J]. Science of Sericulture, 2013, 39(1): 135-138 (in Chinese). |
| [27] |
HORNG C T, LIU Z H, HUANG Y T, et al. Extract from mulberry (Morus australis) leaf decelerate acetaminophen induced hepatic inflammation involving downregulation of myeloid differentiation factor 88 (MyD88) signals[J]. Journal of Food and Drug Analysis, 2017, 25(4): 862-871. |
| [28] |
XUE M, SUN H Y, CAO Y, et al. Mulberry leaf polysaccharides modulate murine bone-marrow-derived dendritic cell maturation[J]. Human Vaccines & Immunotherapeutics, 2015, 11(4): 946-950. |
| [29] |
侯瑞宏, 廖森泰, 刘凡, 等. 桑叶多糖对小鼠免疫调节作用的影响[J]. 食品科学, 2011, 32(13): 280-283. HOU R H, LIAO S T, LIU F, et al. Immunomodulatory effect of polysaccharides from mulberry leaves (PML) in mice[J]. Food Science, 2011, 32(13): 280-283 (in Chinese). |
| [30] |
BERCIER P, GRENIER D. TNF-α disrupts the integrity of the porcine respiratory epithelial barrier[J]. Research in Veterinary Science, 2019, 124: 13-17. |




