家禽低粗蛋白质水平饲粮的使用不仅可以降低饲料成本,还可降低氮排放,从而减轻环境污染,因此,采用理想氨基酸模式配制的低粗蛋白质水平饲粮(降低1%~2%粗蛋白质水平)在畜禽养殖生产中得到了广泛应用[1],但低粗蛋白质水平饲粮对家禽脂肪代谢和肝脏健康具有一定影响。研究表明,低粗蛋白质水平饲粮会导致家禽腹脂、肝脏脂肪以及血清中甘油三酯(TG)含量增加,从而增加了患脂肪肝的概率[2-3]。特别是蛋鸡,过度的脂肪沉积会导致蛋鸡肝脏功能损害,造成脂肪肝出血综合征(FLHS),从而导致产蛋量下降,甚至死亡[4]。
家禽肝脏是脂肪代谢和胆汁酸(BAs)代谢的主要场所,肝脏脂肪代谢和BAs代谢异常是引起肝脏功能受损的主要原因。BAs是肝脏胆固醇代谢的终产物,法尼醇衍生物X受体(FXR)作为BAs受体,在调控BAs稳态及脂肪代谢中具有重要作用,FXR表达异常会引起血清和肝脏脂肪含量的增加。相反,FXR激活会通过促进过氧化物酶体增殖物激活受体α(PPARα)表达而降低肝脏脂肪水平。另外,FXR诱导激活小异源二聚体伴侣受体(SHP)的表达,与肝X受体(LXR)相互作用,从而抑制固醇调节元件结合蛋白-1c(SREBP-1c)的转录活性,降低肝脏脂肪沉积[5]。因此,本研究通过探讨低粗蛋白质水平饲粮对蛋鸡育成鸡肝脏脂肪代谢和BAs代谢的影响,阐明BAs代谢在肝脏脂肪代谢中的效应,为低粗蛋白质水平饲粮在蛋鸡生产中的合理应用提供理论基础。
1 材料与方法 1.1 试验动物与设计本试验选用体重相近、健康状况良好的14周龄罗曼育成鸡为试验对象,采用单因素完全随机分组试验设计,将180只鸡分为3组:CP-H组(饲粮粗蛋白质水平为15.5%,高粗蛋白质水平组)、CP-M组(饲粮粗蛋白质水平为14.5%,正常粗蛋白质水平组)以及CP-L组(饲粮粗蛋白质水平为13.5%,低粗蛋白质水平组),每组6个重复,每个重复10只鸡。CP-M组试验饲粮粗蛋白质营养水平参照NRC(2012)和罗曼蛋鸡推荐标准[6],CP-H组和CP-L组饲粮粗蛋白质水平分别增加或降低1%,同时在低粗蛋白质水平饲粮中添加赖氨酸(Lys)、蛋氨酸(Met)、苏氨酸(Thr)、色氨酸(Trp)以使主要氨基酸(赖氨酸、蛋氨酸、色氨酸、苏氨酸)水平保持一致,饲粮组成及营养水平见表 1。
|
|
表 1 饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of diets (air-dry basis) |
试验从14周开始到17周结束,试验记录从15周开始(预试期为1周,采食CP-M组饲粮),正试期为3周,在同一环境下采用笼养,鸡舍温度为(20±2) ℃,相对湿度为(50±5)%,自然通风和光照。各组均为人工饲喂,每天定时定量喂料3次,自由饮水,其余饲养规程采用常规饲养方法进行。
1.3 样品采集正试期第3周末,每个重复选取2只体重接近平均体重、健康状况良好的蛋鸡,禁食12 h,称重后采用颈动脉放血法处死,并用15 mL离心管收集血液,于室温3 000×g离心10 min,取上清于-80 ℃冰箱保存。肉鸡屠宰后剥离腹脂,计算腹脂率,取腿肌、胸肌、肝脏放入自封袋于-20 ℃冰箱保存,以测定组织化学成分;取肝脏于液氮中快速冷冻,再于-80 ℃冰箱保存,以进行后续检测。
1.4 测定指标及方法 1.4.1 生长性能测定正试期开始,记录每只蛋鸡初重(IW),试验期间记录饲粮采食情况,试验期结束时记录蛋鸡末重(FW),根据饲养试验记录,以重复为单位计算平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G)。
1.4.2 组织化学成分测定胸肌、腿肌中的粗蛋白质和粗脂肪含量分别用凯氏定氮法和索氏抽提法测定[7]。肝脏中总胆固醇(TC)和TG的含量使用试剂盒(南京建成生物工程研究所)进行测定。
1.4.3 血清生化指标测定血清中TC、TG、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、极低密度脂蛋白(VLDL)、尿酸(UA)、葡萄糖(GLU)、总蛋白(TP)的含量采用全自动生化仪(日立7600,日本)进行测定,血清脂蛋白脂肪酶(LPL)活性采用试剂盒(南京建成生物工程研究所)进行测定。
1.4.4 肝脏BAs含量测定肝脏BAs含量采用液相色谱质谱联用法(LC-MS)进行测定[8]。
1.4.5 基因定量表达(实时荧光定量PCR)采用实时荧光定量PCR仪(CFX96 Real-time PCR system, Bio-Rad Laboratories, 美国)检测肝脏脂肪代谢相关基因——脂肪酸转位酶(FAT/CD6)、脂肪酸合成酶(FAS)、CCAAT/增强子结合蛋白β(C/EBPβ)、LPL和载脂蛋白极低密度脂蛋白(apoVLDL)及BAs代谢相关基因——FXR和胆固醇7α羟化酶(CYP7A1)相对表达量,利用Primer 5.0软件设计引物。引物序列见表 2。
|
|
表 2 基因引物序列 Table 2 Primer sequences of genes |
肝脏RNA的提取采用Trizol法进行,利用RNA纯化试剂盒对RNA进行纯化,其浓度和完整性用1%的琼脂糖凝胶电泳检测,后保存于-80 ℃。得到的RNA用天根FastKing cDNA第1链合成试剂盒进行反转录得到cDNA。再按照KAPA通用型SYBR快速荧光定量PCR试剂盒以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因进行实时荧光定量表达,其反应过程为:95 ℃,3 min,然后95 ℃,3 s;60 ℃,34 s进行40个循环,最后95 ℃,15 s;60 ℃,1 min;95 ℃,15 s完成反应。采用2-ΔΔCt方法计算目的基因的相对表达量[9]。
1.5 数据统计与分析试验数据利用SAS 9.2统计软件对数据进行单因子方差分析(one-way ANOVA),采用Duncan氏法进行多重比较,P < 0.05表示差异显著。
2 结果与分析 2.1 饲粮粗蛋白质水平对育成鸡生长性能的影响由表 3可见,整个试验期,各饲粮粗蛋白质水平对育成鸡的IW、FW、ADG、ADFI和F/G没有显著影响(P > 0.05)。
|
|
表 3 饲粮粗蛋白质水平对育成鸡生长性能的影响 Table 3 Effects of dietary crude protein level on growth performance of growing hens |
由表 4可见,饲粮粗蛋白质水平对胸肌和腿肌蛋白质含量无显著影响(P > 0.05)。CP-L组的胸肌和腿肌的脂肪含量、腹脂率、肝脏TG和TC含量显著高于CP-M组(P < 0.05)。
|
|
表 4 饲粮粗蛋白质水平对育成鸡肌肉化学成分的影响 Table 4 Effects of dietary crude protein level on muscle chemical composition of growing hens |
由表 5可见,饲粮粗蛋白质水平对血清TC、HDL-C、LDL-C、VLDL、UA、TP含量具有显著影响(P < 0.05),其中CP-L组的TC、HDL-C、LDL-C含量显著高于CP-H组(P < 0.05),而VLDL、UA、TP含量显著低于CP-H组(P < 0.05)。
|
|
表 5 饲粮粗蛋白质水平对育成鸡血清生化指标的影响 Table 5 Effects of dietary crude protein level on serum biochemical indexes of growing hens |
由表 6可见,饲粮粗蛋白质水平对肝脏次级BAs石胆酸(LCA)、去氧胆酸(DCA)、熊去氧胆酸(UDCA)、β-鼠胆酸(β-MCA)含量具有显著影响(P < 0.05),其中CP-L组的肝脏LCA、UDCA含量显著低于CP-M组(P < 0.05),而DCA含量显著高于CP-H组和CP-M组(P < 0.05),CP-H组的肝脏β-MCA含量显著低于CP-M组(P < 0.05)。饲粮粗蛋白质水平对肝脏初级BAs含量均没有显著影响(P > 0.05)。
|
|
表 6 饲粮粗蛋白质水平对育成鸡肝脏BAs含量的影响 Table 6 Effects of dietary crude protein level on liver bile acid contents of growing hens |
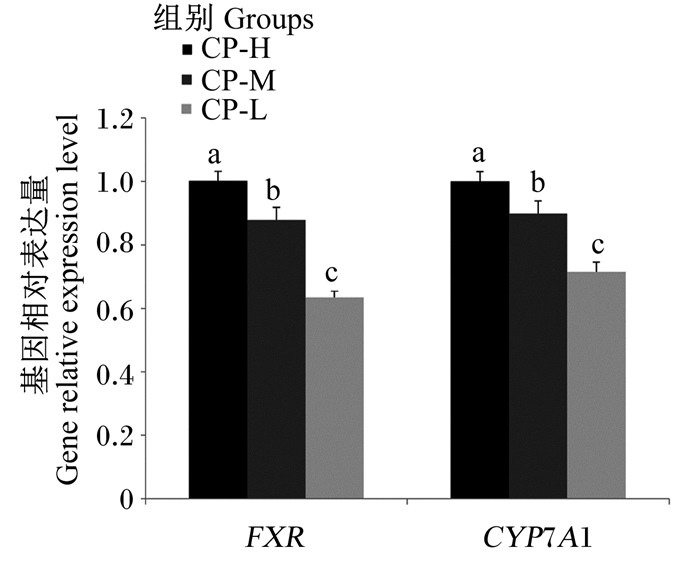
饲粮粗蛋白质水平对育成鸡肝脏BAs代谢相关基因的表达结果如图 1所示。CP-L组的FXR和CYP7A1基因相对表达量均显著低于CP-H组(P < 0.05)。
|
FXR: 法尼醇衍生物X受体derivatives of Farnesol X receptor; CYP7A1: 胆固醇7α羟化酶cholesterol 7α hydroxylase。 数据柱标注相同字母表示差异不显著(P > 0.05),不同小写字母表示差异显著(P < 0.05)。下图同。 Data columns with the same letters mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 1 饲粮粗蛋白质水平对育成鸡肝脏BAs代谢相关基因表达的影响 Fig. 1 Effects of dietary crude protein level on liver bile acids metabolism related gene expression of growing hens |
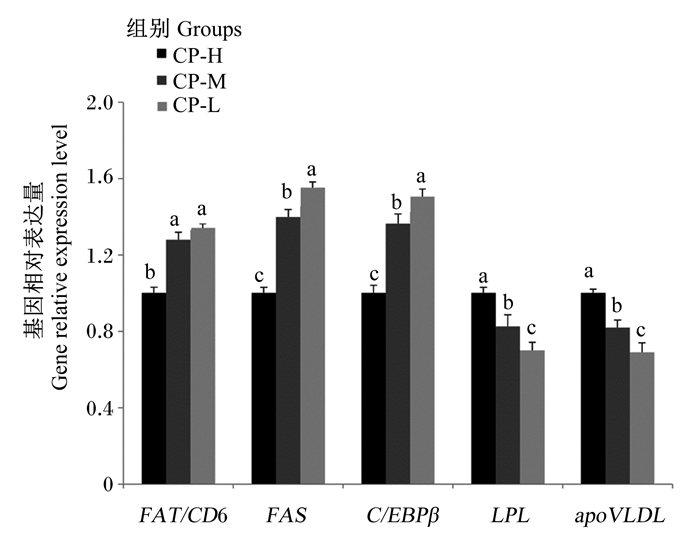
由图 2可见,饲粮粗蛋白质水平对育成鸡肝脏脂肪代谢相关基因的表达具有显著影响(P < 0.05),其中CP-L组的FAT/CD6、FAS、C/EBPβ基因相对表达量显著高于CP-H组(P < 0.05),LPL和apoVLDL基因相对表达量显著低于CP-H组(P < 0.05)。
|
FAT/CD6: 脂肪酸转位酶fatty acid translocase; FAS: 脂肪酸合成酶fatty acid synthetase; C/EBPβ: CCAAT/增强子结合蛋白β CCAAT/ enhancer binding protein β; LPL: 脂蛋白脂肪酶lipoprotein lipase; apoVLDL: 载脂蛋白极低密度脂蛋白apolipoprotein very low density lipoprotein。 图 2 饲粮粗蛋白质水平对育成鸡肝脏脂肪代谢相关基因表达的影响 Fig. 2 Effects of dietary crude protein level on liver lipid metabolism related gene expression of growing hens |
育成期蛋鸡的饲养任务就是培育出体重达标、均匀度一致、健康状态良好的后备蛋鸡。本试验中通过对育成鸡饲喂3种不同粗蛋白质水平的饲粮发现,各组IW、FW、ADG、ADFI和F/G差异不显著。由此可知,在满足必需氨基酸需要的前提下,适当降低饲粮粗蛋白质水平对育成鸡的生长性能不会造成显著影响,这与陈晓慧等[10]和庄宏等[11]的报道结果一致。本研究的饲养试验期只持续了3周,时间相对较短,可能影响了饲粮粗蛋白质水平对脂肪沉积和生长性能影响的效果,大部分育成期的饲养试验一般在5~7周[12-13],但也有研究表明,短期饲养试验也能呈现一定的试验效果,饲喂3周发酵饲粮对海兰褐育成鸡的生长性能也会产生一定的影响效应[14],肉鸡在持续采食2周的牛磺酸后,脂肪沉积也会发生明显的变化[15]。本研究结果表明,短期饲养试验虽然对育成鸡的生长性能没有显著影响,但肝脏脂肪沉积已经发生了明显变化,对后期产蛋期的肝脏健康和产蛋性能可能会产生一定影响。
3.2 饲粮粗蛋白质水平对育成鸡脂肪沉积的影响家禽肝脏是体内脂肪合成的重要器官,当肝脏脂肪代谢异常、脂肪沉积增加将使家禽肝脏功能受损,从而引起脂肪肝或脂肪肝出血综合征,导致蛋禽产蛋率下降、死亡率增加,是蛋鸡生产中常见的一种营养代谢性疾病[16]。饲粮是调控肝脏脂肪代谢的主要因素,研究表明,低粗蛋白质水平饲粮及低氨基酸饲粮是引起肝脏脂肪含量增加的主要原因[2, 16-17]。肝脏脂肪含量与肝脏中脂肪合成、TG的分泌、游离脂肪酸(FFA)的吸收以及脂肪的氧化密切相关[18]。饲粮粗蛋白质通过调控苹果酸酶(ME)活性而调控肝脏脂肪酸(FA)的合成,增加饲粮粗蛋白质水平会抑制肝脏ME活性,从而降低肝脏中FA的合成、脂肪沉积、TC含量以及血脂含量[19]。本研究表明,低粗蛋白质水平饲粮不仅可以上调肝脏脂肪合成相关基因的表达,并且增加肌内脂肪含量、腹脂率及肝脏TG的含量。
另外,低粗蛋白质水平饲粮中必需氨基酸如Lys和Met的不足会使氨基酸不平衡,这是导致脂肪含量增加的主要原因[17]。一方面,当Lys、Met等必需氨基酸不足时,肉毒碱合成能力下降,肉毒碱主要负责长链脂肪酸的转运(FA由细胞质转运至线粒体内并进行β-氧化代谢),因此,肉毒碱合成的减少将导致FA的氧化分解降低[20];另一方面,氨基酸不平衡会增加氨基酸分解代谢,而碳骨架可能会转化为合成碳水化合物和脂肪的中间代谢物,从而增加脂肪合成能力[2]。大量研究表明,在低粗蛋白质水平饲粮中添加Met、精氨酸(Arg)、Thr会降低肝脏脂肪含量, 本研究中,虽然低粗蛋白质水平饲粮也添加了Lys、Met、Thr和Trp,但该组(CP-L组)育成鸡的脂肪沉积也显著增加,这可能还是饲粮粗蛋白质水平对肝脏脂肪代谢的影响比较大。
家禽肝脏是脂肪合成的主要部位,但肝脏本身贮存脂肪的能力却很低,正常情况下大部分脂肪通过与载脂蛋白结合形成脂蛋白的形式被运输到肝脏外组织分解贮存利用。VLDL是调控肝脏脂肪和FFA含量的关键因子,其主要功能是运送内源性的TG到肝脏外组织,而HDL是把外周组织FA及TC运输到肝脏的主要载体。因此,当肝脏中VLDL合成或分泌降低时,肝脏脂肪增加,引起脂肪肝[21],这与本研究结果一致。
3.3 饲粮粗蛋白质水平对育成鸡肝脏BAs代谢的影响BAs是TC分解代谢的终产物。肝脏中TC在CYP7A1催化下产生初级BAs(主要是CA和CDCA),而肠道中的初级BAs在微生物作用下变为次级BAs(主要是LCA、DCA和UDCA)。大量研究表明,饲粮粗蛋白质水平对肠道微生物组成具有重要影响[22],本研究表明,饲粮粗蛋白质水平对次级BAs组成具有显著影响,对初级BAs组成影响不大,这表明饲粮粗蛋白质可能通过肠道微生物效应而影响BAs组成。
微生物的多样性和丰度对次级BAs的形成具有显著影响[23]。初级BAs在微生物胆盐水解酶(BSH)和类固醇脱氢酶等酶作用下,通过脱氢、脱羟基和脱硫等形成次级BAs,而肠道乳杆菌(Lactobacillus)、双歧杆菌(Bifidobacterium)、肠球菌(Enterococcus)、拟杆菌(Bacteroides)、梭菌(Clostridium)等主要微生物都会大量表达BSH[24]。因此,肠道中这些微生物的种类和丰度影响了肠道次级BAs的组成和水平。饲粮粗蛋白质水平增加会导致家禽肠道一些致病菌如产气荚膜梭菌(Clostridium perfringens)和弯曲杆菌(Campylobacter)的生长,抑制有益菌Bifidobacterium的生长[22];降低饲粮粗蛋白质水平则会显著增加家禽盲肠Lactobacillus的数量[25];Peng等[26]也发现,生长猪饲粮粗蛋白质水平降低5个百分点能够提高结肠微生物多样性(Shannon指数),而肠道微生物引起的BAs模式的改变与肝脏脂肪沉积密切相关[27]。
3.4 饲粮粗蛋白质水平对育成鸡肝脏脂肪代谢的影响BAs主要参与TC稳态及脂肪代谢调控。研究表明,所有次级BAs(如DCA、GDCA、TDCA)与肝脏脂肪含量密切相关,BAs可通过激活FXR和SREBP-1c途径,或抑制VLDL产生而调控脂肪合成[28]。FXR作为BAs受体,在调控BAs稳态及脂肪代谢中具有重要作用。研究表明,Fxr-/-小鼠肝脏脂肪、TC及TG沉积增加,而野生型小鼠使用BAs或FXR激动剂处理后,血清TC及TG含量下降。另外,FXR的诱导型基因成纤维细胞生长因子19(FGF19)会抑制脂肪合成及增加代谢。FXR激活会通过促进PPARα表达而降低肝脏脂肪水平;另外,BAs还通过FXR诱导激活SHP表达,与LXR相互作用,从而抑制SREBP-1c的转录活性而降低FA、TG及VLDL的合成[5]。本研究表明,饲粮粗蛋白质水平会导致肝脏BAs代谢模式发生变化,主要是低粗蛋白质水平饲粮显著降低了LCA、UDCA含量,而LCA、UDCA是FXR的激活剂[23],因此CP-L下调了FXR的表达,从而导致肝脏脂肪沉积增加。低粗蛋白质水平饲粮也增加了肝脏DCA含量,而DCA含量的增加与脂肪肝的产生密切相关[27]。另外,CP-H组肝脏中β-MCA含量相对较低,而β-MCA是FXR的抑制剂[29],因此高粗蛋白质水平会抑制肝脏中脂肪沉积。
4 结论家禽低粗蛋白质水平饲粮配制技术不仅可以节约蛋白质资源,还可以降低氮的污染。但本研究表明,13.5%低粗蛋白质水平饲粮对育成鸡肝脏代谢产生了影响,同时使肝脏脂肪沉积增加,并有增加脂肪肝的风险。
| [1] |
宋博, 尹杰, 郑昌炳, 等. 低蛋白质日粮在畜禽生产中的应用研究进展[J]. 中国饲料, 2020(3): 8-15. SONG B, YIN J, ZHENG C B, et al. Advances in application of low protein diets in livestock and poultry production[J]. China Feed, 2020(3): 8-15 (in Chinese). |
| [2] |
XIE M, JIANG Y, TANG J, et al. Effects of low-protein diets on growth performance and carcass yield of growing white Pekin ducks[J]. Poultry Science, 2017, 96(5): 1370-1375. DOI:10.3382/ps/pew349 |
| [3] |
JARIYAHATTHAKIJ P, CHOMTEE B, POEIKHAMPHA T, et al. Effects of adding methionine in low-protein diet and subsequently fed low-energy diet on productive performance, blood chemical profile, and lipid metabolism-related gene expression of broiler chickens[J]. Poultry Science, 2018, 97(6): 2021-2033. DOI:10.3382/ps/pey034 |
| [4] |
SHINI A, SHINI S, BRYDEN W L. Fatty liver haemorrhagic syndrome occurrence in laying hens: impact of production system[J]. Avian Pathology, 2019, 48(1): 25-34. DOI:10.1080/03079457.2018.1538550 |
| [5] |
RAJANI C, JIA W. Bile acids and their effects on diabetes[J]. Frontiers of Medicine, 2018, 12(6): 608-623. DOI:10.1007/s11684-018-0644-x |
| [6] |
LEESON S, SUMMERS J D. 实用家禽营养[M]. 沈慧乐, 周鼎年, 译. 3版. 北京: 中国农业出版社, 2010. LEESON S, SUMMERS J D. Commercial poultry nutrition[M]. SHEN H L, ZHOU D N, translated. 3rd ed. Beijing: China Agriculture Press, 2010. (in Chinese) |
| [7] |
张丽英. 饲料分析及饲料质量检测技术[M]. 4版. 北京: 中国农业大学出版社, 2016: 47-70. ZHANG L Y. Feed analysis and quality test technology[M]. 4th ed. Beijing: China Agricultural University Press, 2016: 47-70 (in Chinese). |
| [8] |
沈淑娇, 张志荣, 曾金, 等. LC-MS/MS测定小鼠肝脏中10种胆汁酸浓度的方法与应用[J]. 肝脏, 2015, 20(4): 285-290, 294. SHEN S J, ZHANG Z R, ZENG J, et al. Determination method of ten kinds of bile acids and its application in mice liver by LC-MS/MS[J]. Chinese Hepatology, 2015, 20(4): 285-290, 294 (in Chinese). DOI:10.3969/j.issn.1008-1704.2015.04.006 |
| [9] |
MOEIN S, JAVANMARD S H, ABEDI M, et al. Identification of appropriate housekeeping genes for gene expression analysis in long-term hypoxia-treated kidney cells[J]. Advanced Biomedical Research, 2017, 6: 15. DOI:10.4103/2277-9175.200790 |
| [10] |
陈晓慧, 孙冬艳, 王通, 等. 低蛋白氨基酸平衡饲粮对蛋鸡育成阶段生长性能的影响[J]. 饲料工业, 2021, 42(18): 24-28. CHEN X H, SUN D Y, WANG T, et al. Effects of low protein and amino acid balanced diet on growth performance of laying hens at growing stage[J]. Feed Industry, 2021, 42(18): 24-28 (in Chinese). |
| [11] |
庄宏, 张甦寅. 低蛋白饲料对育成期海兰褐商品蛋鸡生长性能及血清理化指标的影响[J]. 中国家禽, 2013, 35(22): 25-27. ZHUANG H, ZHANG S Y. Effect of different low-protein feeds on growth performance and serum physical-chemical indicators of Hy-line brown commercial laying hens at growing period[J]. China Poultry, 2013, 35(22): 25-27 (in Chinese). DOI:10.3969/j.issn.1004-6364.2013.22.009 |
| [12] |
曾雨佳, 朱锐, 李德生, 等. 饲粮蛋氨酸水平对大骨母鸡育成期生长性能及胫骨发育的影响[J]. 畜牧与兽医, 2020, 52(9): 25-30. ZENG Y J, ZHU R, LI D S, et al. Effect of dietary methionine levels on growth performance and tibita development of Dagu hens in growing[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(9): 25-30 (in Chinese). |
| [13] |
陈晓慧, 孙冬艳, 王通, 等. 低蛋白氨基酸平衡饲粮对蛋鸡育成阶段生长性能的影响[J]. 饲料工业, 2021, 42(18): 24-28. CHEN X H, SUN D Y, WANG T, et al. Effects of low protein and amino acid balanced diet on growth performance of laying hens at growing stage[J]. Feed Industry Magazine, 2021, 42(18): 24-28 (in Chinese). |
| [14] |
熊爱军, 张增玉, 倪冬姣, 等. 发酵饲料对海兰褐育成鸡后期生长性能的影响试验[J]. 贵州畜牧兽医, 2020, 44(4): 9-11. XIONG A J, ZHANG Z Y, NI D J, et al. Effect of fermented feed on the growth performance of Hy-line variety brown chicken[J]. Guizhou Journal of Animal Husbandry & Veterinary Medicine, 2020, 44(4): 9-11 (in Chinese). |
| [15] |
LU Z, HE X F, MA B B, et al. Dietary taurine supplementation decreases fat synthesis by suppressing the liver X receptor α pathway and alleviates lipid accumulation in the liver of chronic heat-stressed broilers[J]. Journal of the Science of Food and Agriculture, 2019, 99(13): 5631-5637. DOI:10.1002/jsfa.9817 |
| [16] |
LIN C W, HUANG T W, PENG Y J, et al. A novel chicken model of fatty liver disease induced by high cholesterol and low choline diets[J]. Poultry Science, 2021, 100(3): 100869. DOI:10.1016/j.psj.2020.11.046 |
| [17] |
POPP C, HAUCK R, VAHLENKAMP T W, et al. Liver pathology associated with increased mortality in Turkey breeder and meat Turkey flocks[J]. Avian Diseases, 2014, 58(3): 474-481. DOI:10.1637/10675-092413-Case.1 |
| [18] |
OTANI L, NISHI H, KOYAMA A, et al. Low-arginine and low-protein diets induce hepatic lipid accumulation through different mechanisms in growing rats[J]. Nutrition & Metabolism, 2020, 17(1): 60. |
| [19] |
MOHITI-ASLI M, SHIVAZAD M, ZAGHARI M, et al. Dietary fibers and crude protein content alleviate hepatic fat deposition and obesity in broiler breeder hens[J]. Poultry Science, 2012, 91(12): 3107-3114. DOI:10.3382/ps.2011-02040 |
| [20] |
SAVIC D, HODSON L, NEUBAUER S, et al. The importance of the fatty acid transporter L-carnitine in non-alcoholic fatty liver disease (NAFLD)[J]. Nutrients, 2020, 12(8): 2178. DOI:10.3390/nu12082178 |
| [21] |
FUJITA K, NOZAKI Y, WADA K, et al. Dysfunctional very-low-density lipoprotein synthesis and release is a key factor in nonalcoholic steatohepatitis pathogenesis[J]. Hepatology, 2009, 50(3): 772-780. DOI:10.1002/hep.23094 |
| [22] |
RIST V T S, WEISS E, EKLUND M, et al. Impact of dietary protein on microbiota composition and activity in the gastrointestinal tract of piglets in relation to gut health: a review[J]. Animal, 2013, 7(7): 1067-1078. DOI:10.1017/S1751731113000062 |
| [23] |
MARION S, DESHARNAIS L, STUDER N, et al. Biogeography of microbial bile acid transformations along the murine gut[J]. Journal of Lipid Research, 2020, 61(11): 1450-1463. DOI:10.1194/jlr.RA120001021 |
| [24] |
FERRELL J M, CHIANG J Y L. Bile acid receptors and signaling crosstalk in the liver, gut and brain[J]. Liver Research, 2021, 5(3): 105-118. DOI:10.1016/j.livres.2021.07.002 |
| [25] |
DE CESARE A, FARIA DO VALLE Ì, SALA C, et al. Effect of a low protein diet on chicken ceca microbiome and productive performances[J]. Poultry Science, 2019, 98(9): 3963-3976. DOI:10.3382/ps/pez132 |
| [26] |
PENG Y, YU K F, MU C L, et al. Progressive response of large intestinal bacterial community and fermentation to the stepwise decrease of dietary crude protein level in growing pigs[J]. Applied Microbiology and Biotechnology, 2017, 101(13): 5415-5426. DOI:10.1007/s00253-017-8285-6 |
| [27] |
TANG Y Y, ZHANG J Y, LI J, et al. Turnover of bile acids in liver, serum and caecal content by high-fat diet feeding affects hepatic steatosis in rats[J]. Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids, 2019, 1864(10): 1293-1304. DOI:10.1016/j.bbalip.2019.05.016 |
| [28] |
CHEN L M, VAN DEN MUNCKHOF I C L, SCHRAA K, et al. Genetic and microbial associations to plasma and fecal bile acids in obesity Relate to plasma lipids and liver fat content[J]. Cell Reports, 2020, 33(1): 108212. DOI:10.1016/j.celrep.2020.108212 |
| [29] |
WANG W W, WANG J, ZHANG H J, et al. Supplemental Clostridium butyricum modulates lipid metabolism through shaping gut microbiota and bile acid profile of aged laying hens[J]. Frontiers in Microbiology, 2020, 11: 600. DOI:10.3389/fmicb.2020.00600 |




