2. 宁德市农业科学研究所, 宁德 355017
2. Ningde Institute of Agricultural Science, Ningde 355017, China
犊牛养殖过程中存在腹泻、断奶应激等众多问题,严重影响犊牛的健康,进而造成养殖场的重大经济损失。如何改善犊牛健康和提高其生长性能,对犊牛生产具有重要意义。0~6月龄的牛通常被称为犊牛,由于其消化系统和免疫系统未发育成熟[1],此阶段生理功能急剧变化,抵抗力差[2],在断奶阶段的犊牛表现的尤为明显,造成其后期的生长速度缓慢且机体素质变差,还会影响成年后生长性能的发挥[3]。
抗生素的大量使用带来经济效益的同时也会使细菌病毒产生耐药性,对环境和人类健康造成危害。近年来,使用益生菌类添加剂取代抗生素已成为新趋势。有研究显示,丁酸梭菌、乳酸菌和布拉迪酵母等益生菌类添加剂可有效降低犊牛腹泻率[4-5],改善动物健康,提高生长性能[6-8]。自2020年7月1日起,我国已全面禁止在饲料中使用促生长类药物饲料添加剂(中药类除外),表明政府、消费者和养殖从业人员对于食品安全和动物养殖安全的越来越重视。益生菌类添加剂被认为是具有安全、绿色、无残留、无毒副作用等优点的饲料添加剂,逐渐成为替代抗生素的热门产品之一[9]。布拉迪酵母(Saccharomyces boulardii)是酿酒酵母的亚种,具有耐高温、耐酸、耐胆盐、抗氧化特性[10]。Datta等[11]研究表明,与酿酒酵母相比,布拉迪酵母在不同温度及胃酸环境下的存活率更高,对胆盐的耐受性更强,还表现出更优的抗氧化特性,且均达到显著水平。布拉迪酵母因其在防治幼畜腹泻、提高机体免疫力、改善肠道屏障功能以及提高畜禽生产性能等方面具有良好的作用效果而被大力推广应用于畜牧、水产等领域中[12]。
目前,布拉迪酵母在家禽、猪等单胃动物上研究[13]较多,在反刍动物上应用的研究较少。因此,本试验旨在研究饲粮中添加不同剂量的布拉迪酵母对犊牛生长性能、血清免疫指标及粪便微生物区系的影响,探究布拉迪酵母对犊牛生长性能和健康的影响,为犊牛无抗养殖提供理论支持。
1 材料与方法 1.1 试验材料试验所用布拉迪酵母制剂(菌株编号:CNCM I-1079)由北京某生物科技有限公司提供,该制剂通过脂肪酸微胶囊包被技术进行包被,布拉迪酵母有效活菌数为2.2×108 CFU/g。
1.2 试验设计与饲养管理试验采用完全随机分组设计,选用(152±10)日龄、体重[(116.50±17.81) kg]相近的健康安格斯犊牛24头,随机分为3组,每组8头牛。对照组(CG组)饲喂基础饲粮,试验组分别在基础饲粮中添加100(LG组)和200 mg/kg布拉迪酵母(HG组)。布拉迪酵母采用混合到基础饲粮中的方式进行添加。预试期14 d,正试期28 d。
饲养试验于2020年10~11月在福建省南平市某公司开展进行。采用集体围栏饲养,每栏8头,围栏面积为6 m×8 m,每日喂饲2次(08:00、14:30),自由采食和饮水。每天清理犊牛栏,定期消毒。基础饲粮和粗饲料分开饲喂,精粗比为30 ∶ 70。基础饲粮组成及营养水平见表 1。粗饲料(羊草)营养成分含量为:干物质(DM)89.0%,粗蛋白质(CP)7.3%,中性洗涤纤维(NDF)65.5%,酸性洗涤纤维(ADF)42.2%。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
饲粮中干物质、粗蛋白质、粗脂肪和粗灰分含量分别参照GB/T 6435—2014、GB/T 6432—2018、GB/T 6433—2006和GB/T 6438—2007的方法测定,中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)含量参照Van Soest等[15]的方法进行测定,磷(P)含量采用钒钼酸铵显色法测定(UV-1780紫外分光光度计,日本岛津),钙(Ca)含量采用高锰酸钾检测法测定。
1.3.2 生长性能于试验第1和28天晨饲前对所有试验牛进行空腹称重,分别记为初始体重和终末体重,计算平均日增重(ADG);同时测量其体斜长、体高及胸围并计算体躯指数、体长指数和胸围指数。计算公式如下:

|
于试验第28天,全部犊牛晨饲前颈静脉采血5 mL。将收集到的血液置于冰盒中低温保存,迅速带回实验室离心(1 000×g)15 min。血清收集分装于1.5 mL离心管中,-20 ℃保存待测。采用酶联免疫吸附试验(ELISA)法测定血清中白细胞介素-4(IL-4)、白细胞介素-10(IL-l0)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)含量,ELISA试剂盒购自上海晶抗生物工程有限公司,所用仪器为酶标仪(SYNERGY H11,美国BioTek),具体操作参考说明书进行。
1.3.4 粪便样品采集及粪便微生物多样性检测粪便样品于试验第28天晨饲前无菌采集犊牛直肠粪便,分装至无菌冻存管内,立即放入液氮罐中,-80 ℃保存待测。使用TGuideS96磁珠法土壤/粪便基因组DNA提取试剂盒(Tiangen,北京)提取粪便基因组DNA,具体操作步骤参照试剂盒说明书进行。利用酶标仪(Synergy HTX,美国)检测DNA浓度,并通过琼脂糖凝胶电泳检测其完整性。使用通用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rDNA序列的V3~V4区进行扩增。PCR反应体系10 μL:5 μL KOD FX Neo Buffer,2 μL dNTPs(2 mmol/L),各0.3 μL的上、下游引物(10 μmol/L),0.2 μL KOD聚合酶,50 ng的模板DNA,ddH2O补充至10 μL。反应参数为:95 ℃预变性5 min,随后95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸40 s,共循环25次,最后72 ℃延伸7 min。PCR产物经1.8%的琼脂糖凝胶切胶回收,通过Illumina HiSeq 2500测序平台(北京百迈客生物科技有限公司)对DNA片段进行高通量测序,获得原始数据后再进行后续生物信息学分析。
测序结束后,使用FLASH 1.2.11[16]和Trimmomatic 0.33[17]软件对原始数据进行拼接过滤,通过UCHIME 8.1[18]去除嵌合体,得到高质量的序列,使用Usearch 10.0在相似性为97%的水平上进行操作分类单元(OTUs)聚类,然后挑选出相对丰度最高的序列作为每个OTUs的代表性序列。利用RDP classifier 2.2构建OTUs分类信息表。计算每个试验样本的α多样性和β多样性。α多样性由反映群落丰富度的ACE指数和Chao1指数、反映群落多样性的Simpson指数和Shannon指数及反映测序深度覆盖度指数进行评估。β多样性选择利用Bray-Curtis距离计算。利用线性判别分析效应量(LEfSe)差异分析来计算不同组间的物种差异。
1.4 数据处理及统计分析试验数据用Excel 2019进行整理,应用R软件中的one-way ANOVA过程进行单因素方差分析,采用Tukey进行多重比较检验。试验结果以平均值±标准差表示。P>0.05为差异不显著,P<0.05为差异显著,P<0.01为差异极显著,0.05≤P<0.10为有显著趋势。
2 结果 2.1 饲粮中添加布拉迪酵母对犊牛生长性能的影响由表 2可知,试验第28天时,各组间犊牛的终末体重、平均日增重差异均不显著(P>0.05)。
|
|
表 2 饲粮中添加布拉迪酵母对犊牛生长性能的影响 Table 2 Effects of dietary supplementation of Saccharomyces boulardii on growth performance of calves |
由表 3可知,LG组犊牛体高显著高于CG组(P<0.05),而CG组与HG组则差异不显著(P>0.05)。各组间犊牛体斜长、胸围、体长指数、胸围指数、体躯指数差异均不显著(P>0.05)。
|
|
表 3 饲粮中添加布拉迪酵母对犊牛体尺指数的影响 Table 3 Effects of dietary supplementation of Saccharomyces boulardii on body measurement indexes of calves |
由表 4可知,各组间犊牛血清IL-4和IL-10含量差异不显著(P>0.05)。LG和HG组犊牛血清IL-6含量较CG组分别降低了43.18%、23.94%(P<0.01),且HG组显著高于LG组(P<0.05)。LG组犊牛血清TNF-α含量较CG组降低了18.57%(P<0.05),而HG组较CG组则差异不显著(P>0.05),且HG组极显著高于LG组(P<0.01)。
|
|
表 4 饲粮中添加布拉迪酵母对犊牛血清细胞因子含量的影响 Table 4 Effects of dietary supplementation of Saccharomyces boulardii on serum cytokine contents of calves |
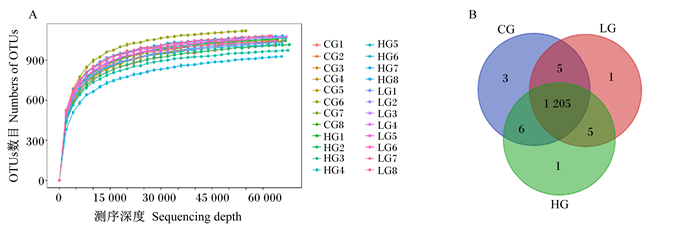
由图 1-A可知,随着测序深度增加,3组OTUs数量和物种丰富度持续增加,在测序深度超过5 000以后,OTUs数量仍持续增长,而物种丰富度先缓慢增加后趋于平缓,表明测序深度已基本覆盖样品中的细菌物种。
|
CG1~CG8代表CG组的8个样品,LG1~LG8代表LG组的8个样品,HG1~HG8代表HG组的8个样品。CG、LG、HG分别代表LG、LG、HG组。下图同。 CG1 to CG8 represented 8 samples of CG group, LG1 to LG8 represented 8 samples of LG group, HG1 to HG8 represented 8 samples of HG group. CG, LG and HG mean groups CG, LG and HG, respectively. The same as below. 图 1 物种稀释曲线(A)和OTUs韦恩图(B) Fig. 1 Rarefaction curves of species (A) and Venn diagram of OTUs (B) |
由图 1-B可知,在相似度为97%的水平下,3组共得到了1 226个OTUs,共有1 205个OTUs。CG、LG和HG组的OTUs数目分别为1 219、1 216、1 217个,其中独有OTUs数目分别为3、1、1个。
2.4.2 各组犊牛粪便菌群α多样性分析由表 5可知,各组间的覆盖率、Chao1和ACE指数差异均不显著(P>0.05)。LG和HG组的Simpson指数较CG组差异均不显著(P>0.05),但LG组显著高于HG组(P<0.05)。LG组的Shannon指数显著高于CG组(P<0.05),而HG组较CG组则差异不显著(P>0.05),且LG组极显著高于HG组(P<0.01)。
|
|
表 5 饲粮中添加布拉迪酵母对犊牛粪便菌群α多样性的影响 Table 5 Effects of dietary supplementation of Saccharomyces boulardii on α diversity of fecal microflora of calves |
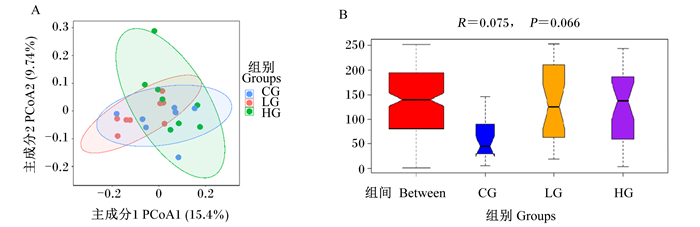
用主坐标分析(PCoA)对基于Bray-Curtis距离的样品进行相似性分析,结果如图 2所示。由图 2-A可知,在主成分1贡献率为15.4%,主成分2贡献率为9.74%时,3组之间分布较近,说明3组菌群多样性差异较小。3组样品组内距离较远,说明组内菌群多样性差异较大。由图 2-B各组的ANOSIM统计分析图可知,R=0.075>0,说明组间差异大于组内,P=0.066,说明组间有显著差异的趋势。
|
图 2 犊牛粪便菌群主坐标分析图(A)和ANOSIM统计分析图(B) Fig. 2 Principal coordinate analysis plot (A) and ANOSIM statistical analysis chart (B)of fecal microflora of calves |
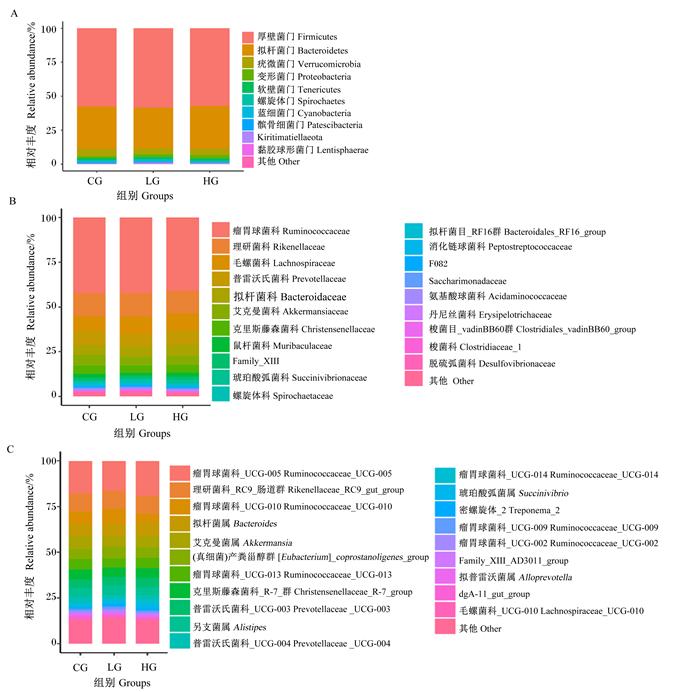
由图 3-A和表 6可知,在门水平上,以厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)3种菌门为主,其相对丰度之和在92%以上。对微生物进行组间差异性分析,在门水平未发现显著差异的菌门。
|
图 3 犊牛粪便菌群门水平、科水平和属水平上的组成 Fig. 3 Composition of fecal microflora of calves on phylum, family and genus levels |
|
|
表 6 饲粮中添加布拉迪酵母对犊牛粪便菌群门水平相对丰度的影响 Table 6 Effects of dietary supplementation of Saccharomyces boulardii on relative abundance of fecal microflora of calves on phylum level |
由图 3-B和表 7可知,在科水平上,主要包括瘤胃球菌科(Ruminococcaceae)、理研菌科(Rikenellaceae)、毛螺菌科(Lachnospiraceae)、普雷沃氏菌科(Prevotellaceae)等。对微生物进行组间差异性分析发现:LG组梭菌_vadinBB60群(Clostridiales_vadinBB60_group)的相对丰度显著高于CG组(P<0.05),而丹尼丝菌科(Erysipelotrichaceae)的相对丰度显著低于CG组(P<0.05)。HG组丹尼丝菌科的相对丰度显著高于CG组(P<0.05),而梭菌_vadinBB60群的相对丰度显著低于CG组(P<0.05)。
|
|
表 7 饲粮中添加布拉迪酵母对犊牛粪便菌群科水平相对丰度的影响 Table 7 Effects of dietary supplementation of Saccharomyces boulardii on relative abundance of fecal microflora of calves on family level |
由图 3-C和表 8可知,在属水平上,主要优势菌群有瘤胃球菌科_UCG-005(Ruminococcaceae_UCG-005)、理研菌科_RC9_肠道群(Rikenellaceae_RC9_gut_group)、瘤胃球菌科_UCG-010(Ruminococcaceae_UCG-010)、拟杆菌属(Bacteroides)、艾克曼菌属(Akkermansia)等。对微生物进行组间差异性分析发现:LG组和HG组中dgA-11_gut_group的相对丰度显著高于CG组(P<0.05)
|
|
表 8 饲粮中添加布拉迪酵母对犊牛粪便菌群属水平相对丰度的影响 Table 8 Effects of dietary supplementation of Saccharomyces boulardii on relative abundance of fecal microflora of calves on genus level |
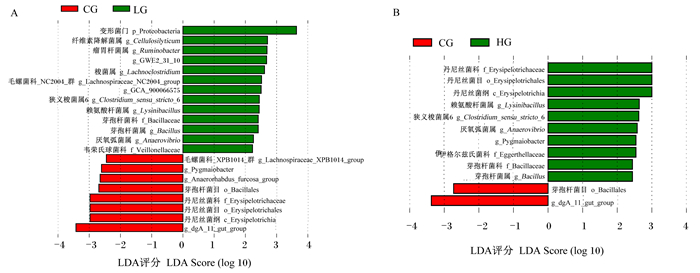
LEfSe分析结果如图 4-A和图 4-B所示,在科水平上,与CG组比较,在LG组中芽孢杆菌科(Bacillaceae)和韦荣氏球菌科(Veillonellaceae)的相对丰度增加,而丹尼丝菌科的相对丰度减少。在HG组中,丹尼丝菌科、伊格尔兹氏菌科(Eggerthellaceae)和芽孢杆菌科的相对丰度增加。属水平上,与CG组比较,在LG组中纤维素降解菌属(Cellulosilyticum)、瘤胃杆菌属(Ruminobacter)、GWE2-31-10、梭菌属(Lachnoclostridium_10)、毛螺菌科_NC2004群(Lachnospiraceae_NC2004_group)、GCA-900066575、狭义梭菌属6(Clostridium_sensu_stricto_6)、赖氨酸杆菌属(Lysinibacillus)、芽孢杆菌属(Bacillus)和厌氧弧菌属(Anaerovibrio)的相对丰度增加,而毛螺菌科_XPB1014群(Lachnospiraceae_XPB1014_group)、Pygmaiobacter、[Anaerorhabdus]_furcosa_group和dgA-11_gut_group的相对丰度减少。在HG组中赖氨酸杆菌属、狭义梭菌属6、厌氧弧菌属、Parvibacter和芽孢杆菌属的相对丰度增加,而dgA-11_gut_group的相对丰度减少。
|
图 4 犊牛粪便菌群LEfSe分析 Fig. 4 LEfSe analysis of fecal microflora of calves |
幼龄时期是反刍动物生长过程的重要阶段,此阶段与其潜在生长性能的发挥有着密切联系。平均日增重是犊牛生长性能的重要指标之一。布拉迪酵母属于酿酒酵母的亚种,是唯一的真菌益生菌[19];其与酿酒酵母相比,具有耐高温、耐酸、抗氧化等特性[10-11]。Saha等[20]研究表明,布拉迪酵母可改善黑孟加拉山羊肠道对钙的吸收,但对羔羊的生长性能和其他血液参数无显著影响。Villot等[5]的研究发现,补充10×109 CFU/d布拉迪酵母无法改善犊牛平均日增重等生长性能,但可以减轻其腹泻症状。此外,布拉迪酵母在犊牛不同生长阶段的作用效果不同。Galvão等[21]的研究结果表明,布拉氏酵母和酿酒酵母对新生犊牛体重增加具有积极影响,而不是在断奶后。在本试验中,试验结束时各组犊牛平均日增重差异不显著,这与前人研究结果类似。此外,由于本试验采用分栏饲养,只统计了每组犊牛的采食量,并未统计犊牛的个体采食量,无法准确计算个体牛的平均日采食量和料重比数据,这是本研究存在的不足之处。
体尺指数是动物机体生长发育的重要指标之一,可以反映犊牛的体格发育状况和生长性能。Lesmeister等[22]通过犊牛饲养试验证实,在饲粮中添加酵母培养物能够提高其体高和胸围。在本试验中,LG组犊牛体高较CG组显著提高,与上述研究结果类似。本试验还观察到,各组间犊牛体尺指数均无显著差异,说明饲粮中添加布拉迪酵母并未影响犊牛体格发育,这可能与动物年龄、阶段和布拉迪酵母的添加量等因素有关。
3.2 饲粮中添加布拉迪酵母对犊牛血清免疫指标的影响细胞因子是由多种细胞受到刺激后分泌的小分子可溶性蛋白质,能够调节免疫应答和参与机体的炎症反应,因此测定细胞因子的产生是评估细胞免疫反应的重要指标。众所周知,断奶应激等可能导致肠道屏障功能的破坏。当肠道屏障受损时,微生物入侵会增加炎症的风险[23]。TNF-α、IL-6是重要的促炎因子,其中TNF-α参与机体局部或系统反应,能刺激免疫细胞合成IL-6等多种细胞因子[24]。IL-4为主要的抗炎因子,能够促进B细胞和自然杀伤细胞的增殖分化,进而促进细胞免疫[25]。刘孟健等[26]研究显示,添加0.3%布拉迪酵母壁多糖能够显著提高早期断奶羔羊结肠黏膜中IL-10的含量。卢奇成等[27]研究结果表明,添加布拉氏酵母能显著提高荷斯坦犊牛血清IL-2和IL-4的含量,显著降低血清IL-1β和TNF-α的含量。在本试验中,与CG组相比,LG和HG组犊牛血清TNF-α和IL-6含量显著降低,但血清IL-4和IL-10含量在3个组间无显著差异。这表明添加适量的布拉迪酵母能够预防炎症的发生,促进肠道健康。
3.3 饲粮中添加布拉迪酵母对犊牛粪便微生物区系的影响虽然在猪和家禽中已经广泛研究了益生菌对肠道微生物组成的影响[28],但对犊牛肠道微生物区系的潜在影响少有报道。随着高通量测序技术的发展,通过分析瘤胃微生物[29-30]和粪便[31-33]样本,可更深入和准确地反映犊牛胃肠道微生物的组成和多样性的变化。
本试验的24个样品的稀释曲线都趋于平缓,说明所采集的粪便样本均能够覆盖绝大多数的微生物群落种类。本试验中,各组覆盖度指数均高于0.99,测序结果能够真实地反映犊牛粪便细菌群落种类和结构。α多样性分析可反映粪便微生物群落的丰富度和多样性。Shannon指数越大,Simpson指数越小,群落多样性越高[34]。本试验中,LG和HG组的Simpson和Shannon指数差异显著,且LG组Shannon指数显著高于CG组。可能因为添加布拉迪酵母补充了犊牛肠道的微生物数量,使菌群多样性增加。本试验还发现,随着布拉迪酵母添加量的增加菌群多样性有所降低,可能是布拉迪酵母添加量的增加抑制部分致病菌所导致的。有研究表明,布拉迪酵母细胞壁上的甘露聚糖对致病菌具有吸附能力,进而减少致病菌对肠上皮细胞的黏附[35]。Czerucka等[36]和Ibáñez等[37]研究结果显示,鼠伤寒沙门氏菌和大肠杆菌可以黏附到布拉迪酵母细胞壁上,并随布拉迪酵母排出体外。也有研究表明,布拉迪酵母主要是通过对大肠杆菌、艰难梭菌、产气荚膜梭菌等致病菌的结合,而不是通过与致病菌竞争肠上皮细胞结合位点来阻止病原菌的黏附,从而起到抑制病原微生物定植的作用[13]。Morales-Amparano等[38]研究结果表明,布拉迪酵母通过无氧发酵的方式将胃肠内容物中的碳水化合物分解成乳酸等有机酸,降低肠道内的pH,从而达到抑制病原菌增殖的效果。此外,布拉迪酵母的小分子分泌物(如溶菌酶等抗菌物质)也可直接或间接起到抑制病原微生物增殖的作用[39]。布拉迪酵母通过抑制病原微生物的定植与增殖,促进犊牛健康。基于Bray-Curtis距离的PCoA及ANOSIM分析结果表明,CG组和LG、HG组的粪便菌群结构有显著差异的趋势。
本研究发现,门水平上,犊牛粪便菌群以厚壁菌门和拟杆菌门为主要优势菌,占总菌的88%以上,这与之前关于反刍动物粪便微生物的研究结果[40]一致。厚壁菌门与碳水化合物和蛋白质的吸收有关,而拟杆菌主要作用于非纤维物质的降解[41]。本试验中,饲粮添加布拉迪酵母对粪便的优势菌门种类没有影响。疣微菌门具有诱导和调节免疫的能力,肠道微生物可能通过影响其相对丰度的变化来实现对免疫功能的调节[42]。本试验中,疣微菌门是第3优势菌门,饲粮中添加布拉迪酵母降低了疣微菌门的相对丰度,表明饲粮添加布拉迪酵母可能会影响犊牛的后肠道免疫功能。
在科水平上,瘤胃球菌科、理研菌科、毛螺菌科、普雷沃氏菌科等是主要优势菌科。瘤胃球菌科和毛螺菌科是厚壁菌门成员,都具有丰富的作用于碳水化合物的活性酶[43]。理研菌科和普雷沃氏菌科是拟杆菌门的主要细菌,含较多的活性酶,参与碳水化合物和蛋白质的分解[44]。本试验中,LG组瘤胃球菌科、理研菌科和普雷沃氏菌科的相对丰度较CG组均有所下降,表明饲粮中添加布拉迪酵母可能降低对碳水化合物的利用率,从而降低饲料的转化率。
在属水平上,瘤胃球菌科_UCG-005、理研菌科_RC9_肠道群、瘤胃球菌科_UCG-010、拟杆菌属、艾克曼菌属等是主要优势菌属。瘤胃球菌科_UCG-005、瘤胃球菌科_UCG-010是瘤胃球菌科成员,其中瘤胃球菌科_UCG-005与纤维降解有关,而瘤胃球菌科_UCG-010则是产丁酸菌[45]。肠道丁酸盐的产生促进Treg细胞的分化,增强上皮屏障的完整性,抑制促炎症反应[46]。本试验中,与CG组相比,HG组提高了瘤胃球菌科_UCG-005的相对丰度,降低了瘤胃球菌科_UCG-010的相对丰度,表明饲粮中添加布拉迪酵母可提高对纤维的利用率,但有增加炎症反应的风险。有研究表明,随着腹泻的加剧,麝鹿粪便中理研菌科_RC9_肠道群的相对丰度显著降低[47]。拟杆菌属能够产生分解纤维素的酶,从而提高饲料的利用率,使动物能够更好的吸收。在本试验中,LG和HG组理研菌科_RC9_肠道群和拟杆菌属的相对丰度较CG组均提高,表明添加布拉迪酵母可提高肠道对纤维素的降解率,防止腹泻的发生。Fujisaka等[48]则证明艾克曼菌可以改善肠道屏障功能、增厚黏膜层,并且对糖代谢有促进作用,其数量的增加有助于缓解炎症性肠病症状[49]。在本试验中,LG和HG组艾克曼菌属的相对丰度在后肠道中所占的比例均下降,表明添加布拉迪酵母可能引起后肠道的黏膜炎症。
通过LEfSe分析,找到组间有显著差异的物种。本试验中,LG和HG组中芽孢杆菌科、芽孢杆菌属、梭状属、厌氧弧菌属的相对丰度均增加。芽孢杆菌等几种益生菌已被广泛用作益生菌类添加剂。Zhang等[50]研究表明,在饲喂布拉迪酵母的断奶仔猪结肠中,芽孢杆菌属的相对丰度显著增加,具有良好的免疫调节和抗炎功效。本试验中添加布拉迪酵母可提高芽孢杆菌属的相对丰度,与上述研究结果一致。有研究表明,酵母菌与芽孢杆菌配伍生产的酿酒酵母培养物,能产生更多的营养活性物质[51],可显著提高反刍动物消化率[52]。因此,我们推测布拉迪酵母是通过与芽孢杆菌产生协同作用,提高饲料的消化率,改善胃肠道健康。以上结果表明布拉迪酵母在维持机体健康方面具有有益的作用。
4 结论① 饲粮中添加布拉氏酵母对犊牛的生长性能无显著影响,可提高犊牛体高,降低血清IL-6和TNF-α含量,增强机体免疫功能,改善粪便微生物区系,促进犊牛健康。
② 本试验中,饲粮中添加100 mg/kg布拉迪酵母的效果最佳。
| [1] |
王佳堃, 杨斌, 黄开朗. 幼龄反刍动物消化道微生物演替与消化道发育及其调控[J]. 动物营养学报, 2020, 32(10): 4697-4707. WANG J K, YANG B, HUANG K L. Regulation of microbial succession and gastrointestinal development in young ruminants[J]. Chinese Journal of Animal Nutrition, 2020, 32(10): 4697-4707 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.10.021 |
| [2] |
崔占鸿. 牦牛犊牛培育方式对生长和消化道发育的影响[D]. 博士学位论文. 杨凌: 西北农林科技大学, 2020. CUI Z H. Effects of rearing patterns on growth and digestive tract development in yak calves[D]. Ph. D. Thesis. Yangling: Northwest A & F University, 2020. (in Chinese) |
| [3] |
SOBERON F, VAN AMBURGH M E. Lactation biology symposium: the effect of nutrient intake from milk or milk replacer of preweaned dairy calves on lactation milk yield as adults: a meta-analysis of current data[J]. Journal of Animal Science, 2013, 91(2): 706-712. DOI:10.2527/jas.2012-5834 |
| [4] |
HU S L, WANG L, JIANG Z Y. Dietary additive probiotics modulation of the intestinal microbiota[J]. Protein and Peptide Letters, 2017, 24(5): 382-387. DOI:10.2174/0929866524666170223143615 |
| [5] |
VILLOT C, MA T, RENAUD D L, et al. Saccharomyces cerevisiae boulardii CNCM I-1079 affects health, growth, and fecal microbiota in milk-fed veal calves[J]. Journal of Dairy Science, 2019, 102(8): 7011-7025. DOI:10.3168/jds.2018-16149 |
| [6] |
WANG K L, CAO G T, ZHANG H R, et al. Effects of Clostridium butyricum and Enterococcus faecalis on growth performance, immune function, intestinal morphology, volatile fatty acids, and intestinal flora in a piglet model[J]. Food & Function, 2019, 10(12): 7844-7854. |
| [7] |
DOWARAH R, VERMA A K, AGARWAL N, et al. Effect of swine based probiotic on performance, diarrhoea scores, intestinal microbiota and gut health of grower-finisher crossbred pigs[J]. Livestock Science, 2017, 195: 74-79. DOI:10.1016/j.livsci.2016.11.006 |
| [8] |
FOMENKY B E, CHIQUETTE J, LESSARD M, et al. Saccharomyces cerevisiae var. boulardii CNCM I-1079 and Lactobacillus acidophilus BT1386 influence innate immune response and serum levels of acute-phase proteins during weaning in Holstein calves[J]. Canadian Journal of Animal Science, 2018, 98(3): 576-588. DOI:10.1139/cjas-2017-0120 |
| [9] |
靳纯嘏, 叶耿坪, 唐新仁. 反刍动物饲用抗生素替代物研究进展[J]. 中国畜牧兽医, 2018, 45(1): 77-85. JIN C J, YE G P, TANG X R. Research advances on alternatives to antibiotic feed additives in ruminant production[J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(1): 77-85 (in Chinese). |
| [10] |
卢奇成, 吴妍妍, 张文举. 布拉迪酵母菌的生物学功能、作用机制及其应用[J]. 中国畜牧兽医, 2020, 47(8): 2472-2480. LU Q C, WU Y Y, ZHANG W J. Biological function, mechanism of action and application of Saccharomyces boulardii[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(8): 2472-2480 (in Chinese). |
| [11] |
DATTA S, TIMSON D J, ANNAPURE U S. Antioxidant properties and global metabolite screening of the probiotic yeast Saccharomyces cerevisiae var. boulardii[J]. Journal of the Science of Food and Agriculture, 2017, 97(9): 3039-3049. DOI:10.1002/jsfa.8147 |
| [12] |
SANTACROCE L, CHARITOS I A, BOTTALICO L. A successful history: probiotics and their potential as antimicrobials[J]. Expert Review of Anti-Infective Therapy, 2019, 17(8): 635-645. DOI:10.1080/14787210.2019.1645597 |
| [13] |
汪棋, 邹朋, 周元浩, 等. 布拉迪酵母菌在畜牧业中的应用研究进展[J]. 动物营养学报, 2020, 32(12): 5596-5605. WANG Q, ZOU P, ZHOU Y H, et al. Research progress in application of Saccharomyces boulardii in animal husbandry[J]. Chinese Journal of Animal Nutrition, 2020, 32(12): 5596-5605 (in Chinese). |
| [14] |
中华人民共和国农业部. 肉牛饲养标准: NY/T 815—2004[S]. 北京: 中国农业出版社, 2004. Ministry of Agriculture of the PRC. Feeding standard of beef cattle: NY/T 815—2004[S]. Beijing: China Agriculture Press, 2004. (in Chinese) |
| [15] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [16] |
MAGOČ T, SALZBERG S L. FLASH: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957-2963. DOI:10.1093/bioinformatics/btr507 |
| [17] |
BOLGER A M, LOHSE M, USADEL B. Trimmomatic: a flexible trimmer for illumina sequence data[J]. Bioinformatics, 2014, 30(15): 2114-2120. DOI:10.1093/bioinformatics/btu170 |
| [18] |
EDGAR R C, HAAS B J, CLEMENTE J C, et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2194-2200. DOI:10.1093/bioinformatics/btr381 |
| [19] |
KHATRI I, TOMAR R, GANESAN K, et al. Complete genome sequence and comparative genomics of the probiotic yeast Saccharomyces boulardii[J]. Scientific Reports, 2017, 7(1): 371. DOI:10.1038/s41598-017-00414-2 |
| [20] |
SAHA S, SINGHA S, AHMED S S U, et al. Effects of yeast (Saccharomyces cerevisiae type boulardii CNCM I-1079) supplementation on growth performance and blood metabolites in Black Bengal goat kids[J]. Veterinarski Arhiv, 2018, 88(5): 661-672. DOI:10.24099/vet.arhiv.0018 |
| [21] |
GALVÃO K N, SANTOS J E P, COSCIONI A, et al. Effect of feeding live yeast products to calves with failure of passive transfer on performance and patterns of antibiotic resistance in fecal Escherichia coli[J]. Reproduction, Nutrition, Development, 2005, 45(4): 427-440. DOI:10.1051/rnd:2005040 |
| [22] |
LESMEISTER K E, HEINRICHS A J, GABLER M T. Effects of supplemental yeast (Saccharomyces cerevisiae) culture on rumen development, growth characteristics, and blood parameters in neonatal dairy calves[J]. Journal of Dairy Science, 2004, 87(6): 1832-1839. DOI:10.3168/jds.S0022-0302(04)73340-8 |
| [23] |
PETERSON L W, ARTIS D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis[J]. Nature Reviews Immunology, 2014, 14(3): 141-153. DOI:10.1038/nri3608 |
| [24] |
胡璧, 王建军, 徐根兴. 肿瘤坏死因子诱导凋亡配体(TRAIL) 抗肿瘤治疗研究进展[J]. 药学与临床研究, 2008, 16(3): 194-200. HU B, WANG J J, XU G X. Progress on the antitumor effect of TNF related apoptosis inducing ligand (TRAIL)[J]. Pharmaceutical and Clinical Research, 2008, 16(3): 194-200 (in Chinese). DOI:10.3969/j.issn.1673-7806.2008.03.010 |
| [25] |
MOSELEY P. Stress proteins and the immune response[J]. Immunopharmacology, 2000, 48(3): 299-302. DOI:10.1016/S0162-3109(00)00227-7 |
| [26] |
刘孟健, 张文举, 姚峻. 布拉迪酵母壁多糖对早期断奶羔羊腹泻及肠道黏膜免疫的影响[J]. 动物营养学报, 2020, 32(9): 4205-4211. LIU M J, ZHANG W J, YAO J. Effects of Saccharomyces boulardii cell wall polysaccharides on diarrhea and intestinal mucosal immunity of early-weaned lambs[J]. Chinese Journal of Animal Nutrition, 2020, 32(9): 4205-4211 (in Chinese). |
| [27] |
卢奇成, 吴妍妍, 张文举. 布拉氏酵母菌对哺乳犊牛腹泻率、血清免疫、抗氧化指标及粪便微生物的影响[J]. 饲料工业, 2020, 41(9): 23-30. LU Q C, WU Y Y, ZHANG W J. Effect of Saccharomyces boulardiion diarrhea rate, serum immunity, antioxidant index, and fecal microorganism in sucking calves[J]. Feed Industry, 2020, 41(9): 23-30 (in Chinese). |
| [28] |
MA T, SUZUKI Y, GUAN L L. Dissect the mode of action of probiotics in affecting host-microbial interactions and immunity in food producing animals[J]. Veterinary Immunology and Immunopathology, 2018, 205: 35-48. DOI:10.1016/j.vetimm.2018.10.004 |
| [29] |
JAMI E, ISRAEL A, KOTSER A, et al. Exploring the bovine rumen bacterial community from birth to adulthood[J]. The ISME Journal, 2013, 7(6): 1069-1079. DOI:10.1038/ismej.2013.2 |
| [30] |
LI R W, CONNOR E E, LI C J, et al. Characterization of the rumen microbiota of pre-ruminant calves using metagenomic tools[J]. Environmental Microbiology, 2012, 14(1): 129-139. DOI:10.1111/j.1462-2920.2011.02543.x |
| [31] |
WEESE J S, JELINSKI M. Assessment of the fecal microbiota in beef calves[J]. Journal of Veterinary Internal Medicine, 2017, 31(1): 176-185. DOI:10.1111/jvim.14611 |
| [32] |
GOMEZ D E, ARROYO L G, COSTA M C, et al. Characterization of the fecal bacterial microbiota of healthy and diarrheic dairy calves[J]. Journal of Veterinary Internal Medicine, 2017, 31(3): 928-939. DOI:10.1111/jvim.14695 |
| [33] |
CARROLL I M, RINGEL-KULKA T, SIDDLE J P, et al. Characterization of the fecal microbiota using high-throughput sequencing reveals a stable microbial community during storage[J]. PLoS One, 2012, 7(10): e46953. DOI:10.1371/journal.pone.0046953 |
| [34] |
曾钰, 高彦华, 彭忠利, 等. 饲粮中添加酵母培养物对舍饲牦牛瘤胃发酵参数及微生物区系的影响[J]. 动物营养学报, 2020, 32(4): 1721-1733. ZENG Y, GAO Y H, PENG Z L, et al. Effects of yeast culture supplementation in diets on rumen fermentation parameters and microflora of house-feeding yak[J]. Chinese Journal of Animal Nutrition, 2020, 32(4): 1721-1733 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.04.031 |
| [35] |
罗世乾. 活性干酵母无抗生素饲粮对断奶仔猪生产性能/营养成分消化率/血清理化参数的影响[D]. 硕士学位论文. 南宁: 广西大学, 2015. LUO S Q. The effect of activity dry yeast diet without antibiotics on production performance, digestibility of nutrients and serum physicochemical parameters of weaned piglets[D]. Master's Thesis. Nanning: Guangxi University, 2015. (in Chinese) |
| [36] |
CZERUCKA D, RAMPAL P. Diversity of Saccharomyces boulardii CNCM I-745 mechanisms of action against intestinal infections[J]. World Journal of Gastroenterology, 2019, 25(18): 2188-2203. DOI:10.3748/wjg.v25.i18.2188 |
| [37] |
IBÁÑEZ L, PONTIER-BRES R, LARBRET F, et al. Saccharomyces boulardii strain CNCM I-745 modifies the mononuclear phagocytes response in the small intestine of mice following Salmonella typhimurium infection[J]. Frontiers in Immunology, 2019, 10: 643. DOI:10.3389/fimmu.2019.00643 |
| [38] |
MORALES-AMPARANO M B, RAMOS-CLAMONT MONTFORT G, BAQUEIRO-PEÑA I, et al. Proteomic response of Saccharomyces boulardii to simulated gastrointestinal conditions and encapsulation[J]. Food Science and Biotechnology, 2019, 28(3): 831-840. DOI:10.1007/s10068-018-0508-9 |
| [39] |
KUNYEIT L, KURREY N K, ANU-APPAIAH K A, et al. Probiotic yeasts inhibit virulence of non-albicans Candida species[J]. mBio, 2019, 10(5): e02307-19. |
| [40] |
TIAN H C, CHEN Y Y, ZHU N, et al. Effect of Broussonetia papyrifera silage on the serum indicators, hindgut parameters and fecal bacterial community of Holstein heifers[J]. AMB Express, 2020, 10(1): 197. DOI:10.1186/s13568-020-01135-y |
| [41] |
GRUNINGER R J, SENSEN C W, MCALLISTER T A, et al. Diversity of rumen bacteria in Canadian cervids[J]. PLoS One, 2014, 9(2): e89682. DOI:10.1371/journal.pone.0089682 |
| [42] |
LINDENBERG F, KRYCH L, FIELDEN J, et al. Expression of immune regulatory genes correlate with the abundance of specific Clostridiales and Verrucomicrobia species in the equine ileum and cecum[J]. Scientific Reports, 2019, 9(1): 12674. DOI:10.1038/s41598-019-49081-5 |
| [43] |
BIDDLE A, STEWART L, BLANCHARD J, et al. Untangling the genetic basis of fibrolytic specialization by Lachnospiraceae and Ruminococcaceae in diverse gut communities[J]. Diversity, 2013, 5(3): 627-640. DOI:10.3390/d5030627 |
| [44] |
FAN P X, BIAN B L, TENG L, et al. Host genetic effects upon the early gut microbiota in a bovine model with graduated spectrum of genetic variation[J]. ISME J, 2020, 14(1): 302-317. DOI:10.1038/s41396-019-0529-2 |
| [45] |
LIAO R R, XIE X H, LV Y H, et al. Ages of weaning influence the gut microbiota diversity and function in Chongming white goats[J]. Applied Microbiology and Biotechnology, 2021, 105(9): 3649-3658. |
| [46] |
SINGH N, GURAV A, SIVAPRAKASAM S, et al. Activation of Gpr109a, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis[J]. Immunity, 2014, 40(1): 128-139. DOI:10.1016/j.immuni.2013.12.007 |
| [47] |
LI Y M, HU X L, YANG S, et al. Comparison between the fecal bacterial microbiota of healthy and diarrheic captive musk deer[J]. Frontiers in Microbiology, 2018, 9: 300. DOI:10.3389/fmicb.2018.00300 |
| [48] |
FUJISAKA S, USUI I, NAWAZ A, et al. Bofutsushosan improves gut barrier function with a bloom of Akkermansia muciniphila and improves glucose metabolism in mice with diet-induced obesity[J]. Scientific Reports, 2020, 10(1): 5544. DOI:10.1038/s41598-020-62506-w |
| [49] |
BELZER C, DE VOS W M. Microbes inside—from diversity to function: the case of Akkermansia[J]. The ISME Journal, 2012, 6(8): 1449-1458. DOI:10.1038/ismej.2012.6 |
| [50] |
ZHANG W X, BAO C L, WANG J, et al. Administration of Saccharomyces boulardii mafic-1701 improves feed conversion ratio, promotes antioxidant capacity, alleviates intestinal inflammation and modulates gut microbiota in weaned piglets[J]. Journal of Animal Science and Biotechnology, 2020, 11(1): 112. DOI:10.1186/s40104-020-00516-4 |
| [51] |
汤志宏, 徐宁宁, 叶均安. 复合益生菌和酵母培养物对热应激奶牛生产性能、瘤胃发酵和血清抗应激指标的影响[J]. 浙江大学学报(农业与生命科学版), 2019, 45(5): 611-618. TANG Z H, XU N N, YE J A. Effect of compound probiotics and yeast culture on milk production, rumen fermentation and serum anti-stress parameters of heat-stressed dairy cows[J]. Journal of Zhejiang University(Agriculture & Life Sciences), 2019, 45(5): 611-618 (in Chinese). |
| [52] |
张锦玲, 王勇, 郭鹏, 等. 不同菌种组合对固态发酵料中营养活性物质含量及体外消化率的影响[J]. 中国畜牧兽医, 2015, 42(8): 2028-2035. ZHANG J L, WANG Y, GUO P, et al. Effect of different strain combination on the nutricines contents and in vitro digestibility of solid state fermentation material[J]. China Animal Husbandry & Veterinary Medicine, 2015, 42(8): 2028-2035 (in Chinese). |




