2. 固原市畜牧技术推广服务中心, 固原 756000;
3. 河南德邻生物制品有限公司, 新乡 453000
2. Guyuan Animal Husbandry Technology Extension and Service Center, Guyuan 756000, China;
3. Henan Delin Biological Products Co., Ltd., Xinxiang 453000, China
随着社会和经济的发展,人们的生活水平日益提高,牛肉越来越受到广大消费者的欢迎[1],极大地促进了肉牛养殖业的发展。饲料添加剂已经成为动物饲粮中不可缺少的一部分,在提高动物生产性能和维护动物健康方面发挥着重要作用。提高肉牛的生长速度,将会为养殖户带来更高的经济效益[2]。当前,关于猪[3-4]和禽[5-6]的饲料添加剂研究日趋完善,反刍动物的饲料添加剂逐渐引起人们的关注[7]。米曲霉培养物、长柄木霉培养物和酿酒酵母具有调节瘤胃微生物区系及提高饲料消化率的功能。本研究将由上述3种微生物混合制成的微生物饲料添加剂添加到饲粮中,研究其对固原黄牛生长性能和瘤胃微生物区系的影响,评价微生物饲料添加剂在肉牛养殖中的应用效果,为其在肉牛养殖中的应用提供科学依据。
1 材料与方法 1.1 微生物饲料添加剂试验用微生物饲料添加剂由35%米曲霉培养物(孢子数1.5亿个/g)、35%长柄木霉培养物(孢子数1.8亿个/g)、酿酒酵母30%(活菌数200亿个/g)组成,该添加剂由河南某生物制品有限公司提供。
1.2 试验动物及饲养管理选取体重[(306.20±14.31) kg]相近的12月龄固原黄牛56头(公母各占1/2),随机分为对照组和试验组,每组公母各2个重复,每个重复7头公(母)牛,每个重复的公牛和母牛皆单圈饲养。对照组肉牛饲喂全混合日粮(total mixed ration, TMR),该TMR参照《肉牛饲养标准》(NY/T 815—2004)配制,其组成及营养水平见表 1。试验组在对照组所喂TMR中添加2 g/kg微生物饲料添加剂。预试期7 d,正试期60 d,试验期间试验牛自由采食、自由饮水。
|
|
表 1 TMR组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the TMR (air-dry basis) |
分别在试验第1天、第30天和第60天称重,同时记录每日的采食量,用于计算不同阶段的平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G,F/G=ADFI/ADG)。
1.3.2 营养物质表观消化率的测定在正试期结束前连续3 d,每个重复每天采集3份新鲜粪样约100 g,加10%硫酸冷冻保存,同时采集饲粮样品。分别把每个重复采集的粪样混合均匀,在65 ℃烘干后粉碎。饲粮和粪便干物质(DM)含量采用烘干恒重法[8]测定,粗蛋白质(CP)含量参照GB/T 6432—2018测定,粗脂肪(EE)含量参照GB/T 6433—2006测定,钙(Ca)含量参照GB/T 6436—2018测定,磷(P)含量参照GB/T 6437—2018测定,中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、纤维素(cellulose)和半纤维素(hemicellulose)含量参照Van Soest等[9]的方法测定,酸不溶灰分含量参照GB 5009.4—2016测定。营养物质表观消化率使用酸不溶灰分(AIA)作为内源指示剂进行测定。
1.3.3 瘤胃发酵参数的测定正试期第58天晨饲前,每个重复随机挑选1头牛,用瘤胃管由食道插入瘤胃中抽取瘤胃液,弃去前200 mL再抽取100 mL瘤胃液,分装30 mL瘤胃液至50 mL离心管,-20 ℃冷冻保存,用于测定瘤胃液pH、挥发性脂肪酸(volatile fatty acids,VFA)和氨态氮(ammonia nitrogen,NH3-N)含量。使用ICS150型离子色谱仪(德国Sykam)测定瘤胃液中乙酸(acetic acid, AA)、丙酸(propionic acid, PA)、异丁酸(isobutyric acid, IA)和丁酸(butyric acid, BA)含量,使用比色法[10]测定瘤胃液中NH3-N含量,使用pH计测定瘤胃液pH。
1.3.4 瘤胃液微生物区系的测定取瘤胃液时分装3~5 mL冻存管并投入液氮罐,24 h后移入-80 ℃冰箱保存。将瘤胃液样品送至上海派森诺生物科技有限公司进行微生物区系测定。首先,采用Illumina平台对样品群落DNA片段进行双端(paired-end)测序,即细菌16S rRNA基因的V3~V4区域;其次,用DADA2方法[11]进行去引物、质量过滤、去噪、拼接和去嵌合体等步骤获得ASVs(application sequence variants);最后,通过QIIME2的classify-sklearn算法[12](https://github.com/QIIME2/q2-feature-classifier)将每个ASVs的特征序列与Greengenes数据库(Rlease 13.8,http://greengenes.secondgenome.com)[13]进行比对,用Naive Bayes分类器进行物种注释。
1.4 ADG及NDF和ADF表观消化率与瘤胃微生物区系的相关性分析通过Genescloud平台(https://www.genescloud.cn),使用Spearman等级相关系数算法对瘤胃微生物区系与ADG及NDF和ADF表观消化率进行相关性分析。
1.5 数据统计分析试验数据先用Excel 2016初步统计,再用SPSS 26.0软件中的one-way ANOVA程序进行方差分析,数据用“平均值±标准差”表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析 2.1 微生物饲料添加剂对肉牛生长性能的影响由表 2可知,经过60 d的饲养,虽然试验组肉牛的ADG比对照组提高11.21%,但差异不显著(P>0.05);然而,在试验后期(第31~60天),试验组肉牛的ADG比对照组显著提高19.05%(P<0.05)。由此可见,肉牛在长期食用含微生物饲料添加剂的饲粮后,微生物饲料添加剂才能发挥其促生长作用。
|
|
表 2 微生物饲料添加剂对肉牛生长性能的影响 Table 2 Effects of microbial feed additive on growth performance of beef |
由表 3可知,与对照组相比,饲粮添加微生物饲料添加剂使肉牛的NDF表观消化率显著提高4.00%(P<0.05),ADF表观消化率显著提高12.11%(P<0.05);其他营养物质表观消化率在试验组和对照组之间无显著差异(P>0.05)
|
|
表 3 微生物饲料添加剂对肉牛营养物质表观消化率的影响 Table 3 Effects of microbial feed additive on nutrient apparent digestibility of beef |
由表 4可知,试验组瘤胃液AA、PA、BA含量较对照组分别极显著提高了56.36%、200.00%、150.00%(P<0.01),pH较对照组显著提高了2.71%(P<0.05), 而IA含量则较对照组显著降低了20.00%(P<0.05)。试验组肉牛瘤胃液中氨态氮含量较对照组有所有降低,但差异不显著(P>0.05)。
|
|
表 4 微生物饲料添加剂对肉牛瘤胃发酵参数的影响 Table 4 Effects of microbial feed additives on rumen fermentation parameters of beef |
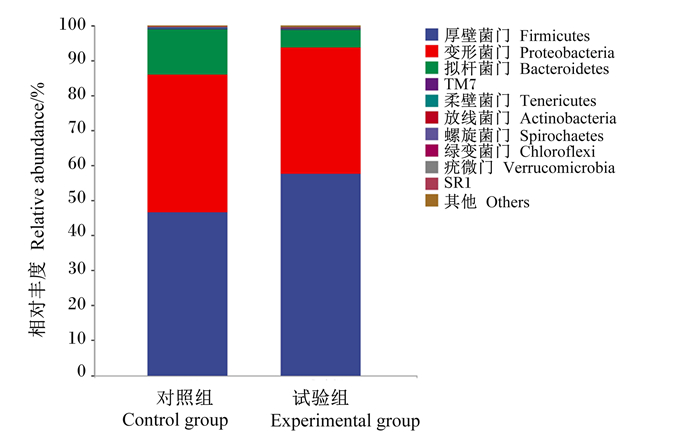
由图 1可知,肉牛瘤胃液微生物中厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)为优势菌门,其相对丰度之和达到95%以上。与对照组相比,试验组厚壁菌门的相对丰度有升高趋势,而拟杆菌门的相对丰度有降低趋势。
|
图 1 瘤胃液微生物在门水平上的相对丰度 Fig. 1 Relative abundances of microbes at phylum level in rumen fluid |
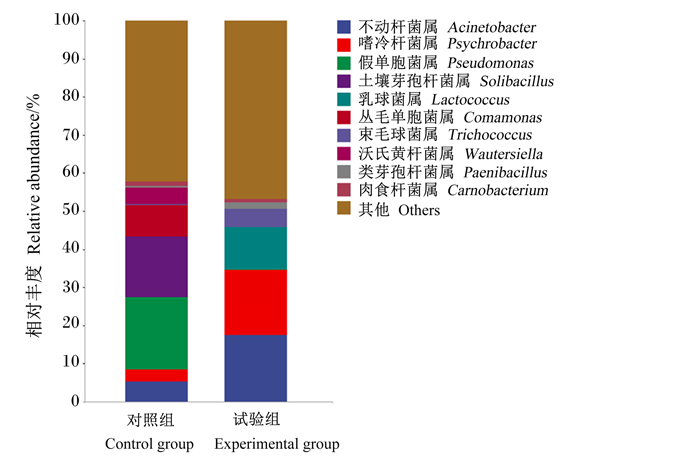
由图 2可知,不动杆菌属(Acinetobacter)、嗜冷杆菌属(Psychrobacter)、假单胞菌属(Pseudomonas)、土壤芽孢杆菌属(Solibacillus)、乳球菌属(Lactococcus)、丛毛单胞菌属(Comamonas)、束毛球菌属(Trichococcus)、沃氏黄杆菌属(Wautersiella)、类芽孢杆菌属(Paenibacillus)和肉食杆菌属(Carnobacterium)为肉牛瘤胃微生物中相对丰度较高的前10个属,占比超过50%。与对照组相比,试验组不动杆菌属、嗜冷杆菌属、乳球菌属、束毛球菌属和类芽孢杆菌属的相对丰度有升高趋势,而假单胞菌属、土壤芽孢杆菌属、丛毛单胞菌属和沃氏黄杆菌属的相对丰度有降低趋势。
|
图 2 瘤胃液微生物在属水平的相对丰度 Fig. 2 Relative abundances of microbes at genus level in rumen fluid |
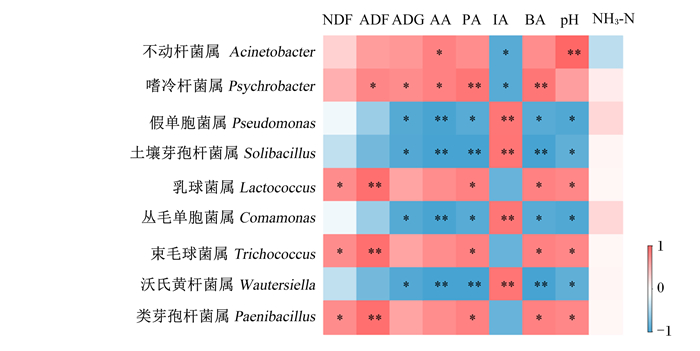
由图 3可知,不动杆菌属相对丰度与AA含量呈显著正相关(P<0.05),与IA含量呈显著负相关(P<0.05),与pH呈极显著正相关(P<0.01)。嗜冷杆菌属相对丰度与ADF表观消化率、ADG和AA含量呈显著正相关(P<0.05),与PA和BA含量呈极显著正相关(P<0.01),与IA含量呈显著负相关(P<0.05)。假单胞菌属和丛毛单胞菌属相对丰度分别与ADG、PA含量、BA含量和pH呈显著负相关(P<0.05),与AA含量呈极显著负相关(P<0.01),与IA含量呈极显著正相关(P<0.01)。土壤芽孢杆菌属和沃氏黄杆菌属相对丰度分别与ADG和pH呈显著负相关(P<0.05),与AA、PA和BA含量呈极显著负相关(P<0.01),与IA含量呈极显著正相关(P<0.01)。乳球菌属、束毛球菌属和类芽孢杆菌属相对丰度分别与NDF表观消化率、PA含量、BA含量和pH呈显著正相关(P<0.05),与ADF表观消化率呈极显著正相关(P<0.01)。图 3中的9个菌属相对丰度与NH3-N含量皆无显著的相关关系(P>0.05)。
|
NDF:中性洗涤纤维neutral detergent fiber;ADF:酸性洗涤纤维acid detergent fiber;ADG:平均日增重average daily gain;AA:乙酸acetic acid;PA:丙酸propionic acid;IA:异丁酸isobutyric acid;BA:丁酸butyric acid;NH3-N:氨态氮ammonia nitrogen。 “*”表示显著相关(P<0.05),“* *”表示极显著相关(P<0.01)。 "*" indicated significant correlation (P < 0.05), and "* *" indicated extremely significant correlation (P < 0.01). 图 3 ADG、NDF和ADF表观消化率及瘤胃发酵参数与瘤胃微生物区系的关联热图 Fig. 3 Heat map of correlations between rumen microbiota and rumen fermentation parameters, ADG, NDF and ADF apparent digestibility |
牛瘤胃环境和微生物对营养物质的消化和吸收、生长性能和健康起到非常重要的作用。申红春[14]的研究表明,在肉牛基础饲粮中添加2.0%含有植物乳杆菌、戊糖片球菌、纤维素酶、半纤维素酶、葡聚糖酶和木聚糖酶的复合饲料添加剂可以提高其生长性能;Kelsey等[15]的研究表明,给断奶犊牛每天每头饲喂10 g含有粪肠球菌、嗜酸乳杆菌、干酪乳杆菌和植物乳杆菌的益生菌可以提高犊肉牛的生产性能;Zhang等[16]的研究表明,给每头犊牛饲喂1×1010 CFU/d鼠李糖乳杆菌有利于瘤胃发育;Yao等[17]的研究表明,每头犊牛饲喂5×109 CFU/d巨大芽孢杆菌对犊牛的生长性能、免疫功能和肠道氧化状态有明显的改善作用;Du等[18]的研究表明,给生长迟缓犊牛饲喂4×1010 CFU/d的淀粉溶解芽孢杆菌或枯草芽孢杆菌均能促进犊牛生长发育。在本试验中,微生物饲料添加剂对固原黄牛试验前期(第1~30天)生长性能的提高作用没有后期(第31~60天)明显,可能是因为添加剂中的微生物在瘤胃内定植发挥作用需要一定的时间[19]。微生物饲料添加剂通过影响肉牛瘤胃微生物区系,从而提高NDF和ADF的消化率,为肉牛提供充足的营养,进而促进肉牛快速生长。
3.2 微生物饲料添加剂对肉牛瘤胃发酵参数的影响添加微生物饲料添加剂对肉牛瘤胃内环境有很大影响,结合瘤胃发酵参数与微生物区系的关联热图可推测:微生物饲料添加剂通过影响有关菌群的相对丰度,进而影响瘤胃内环境,从而促进肉牛的生长。瘤胃微生物发酵是反刍动物重要的能量来源途径[20]。瘤胃内环境的改变不仅可以影响牛的健康情况[21],而且可以改变瘤胃微生物发酵的类型[22]。试验组瘤胃液中AA、PA和BA含量均显著高于对照组,说明试验组发酵功能强于对照组,这与汪成等[23]报道的添加活性干酵母可以提高瘤胃内总VAF含量的结果一致。试验组瘤胃液pH显著高于对照组,更利于抵抗酸中毒的发生,这与McCann等[24]报道的一致。试验组瘤胃液NH3-N含量较对照组有降低趋势,说明微生物饲料添加剂有利于瘤胃对氮利用率的提高,这与Erasmus等[25]的研究结果一致。
3.3 微生物饲料添加剂对肉牛瘤胃微生物区系的影响微生物饲料添加剂对肉牛瘤胃液中菌门和菌属有一定的影响,使瘤胃内有益微生物在丰度上占主导作用,这与Asai等[26]报道的瘤胃微生物区系主要受饲粮的影响是一致的。从门水平来看,厚壁菌门、变形菌门和拟杆菌门是瘤胃液中三大优势菌群,菌群数量的变化与瘤胃消化密切相关[27],这与吴婷婷[28]报道的厚壁菌门与拟杆菌门是反刍动物瘤胃中两大优势菌群的结果是一致的。Bäckhed等[29]和Xu等[30]报道,厚壁菌门和拟杆菌门共同作用于碳水化合物和蛋白质的水解与合成。吴婷婷[28]和张玉莹等[31]研究显示,厚壁菌门与拟杆菌门相对丰度比值越高越有利于营养物质吸收和能量存储。本研究表明,试验组厚壁菌门相对丰度升高,而拟杆菌门相对丰度下降,导致两者相对丰度比值升高,有利于营养物质吸收和能量的存储,与肉牛生长性能的提高相一致。
本研究表明,微生物饲料添加剂可提高肉牛瘤胃液中乳球菌属、束毛球菌属和类芽孢杆菌属的相对丰度。据报道,乳球菌属和类芽孢杆菌属是动物胃肠道两大类重要的益生菌,具有调节胃肠道微生物区系及分解植物细胞壁多糖和纤维素的功能[32-33];束毛球菌属可以代谢多糖、氨基酸、多元醇,甚至能降解纤维素[34-36]。由此可知,微生物饲料添加剂可通过提高肉牛瘤胃中木质纤维素分解菌的相对丰度,达到提高NDF和ADF消化率的目的,从而提高肉牛的生长性能。
4 结论在固原黄牛TMR中添加2 g/kg微生物饲料添加剂可通过调控瘤胃微生物区系提高其生长性能及NDF和ADF的表观消化率。
| [1] |
熊偲皓, 王东阳, 胡志全. 我国牛肉供需及国际竞争力研究[J]. 中国农业资源与区划, 2020, 41(10): 89-100. XIONG S H, WANG D Y, HU Z Q. Research on China's beef supply, demand and international competitiveness[J]. Chinese Journal of Agricultural Resources and Regional Planning, 2020, 41(10): 89-100 (in Chinese). |
| [2] |
高雪. 中国肉牛种业整体发展现状与趋势[J]. 畜牧产业, 2021(5): 15-16. GAO X. The overall development status and trend of China's beef cattle seed industry[J]. Animal Agriculture, 2021(5): 15-16 (in Chinese). |
| [3] |
UPADHAYA S D, KIM S C, VALIENTES R A, et al. The effect of Bacillus-based feed additive on growth performance, nutrient digestibility, fecal gas emission, and pen cleanup characteristics of growing-finishing pigs[J]. Asian-Australasian Journal of Animal Sciences, 2015, 28(7): 999-1005. DOI:10.5713/ajas.15.0066 |
| [4] |
李宗凯, 陆扬, 刘家俊, 等. 益生菌对生长育肥猪生长性能、肉品质和结肠菌群的影响[J]. 南京农业大学学报, 2020, 43(3): 523-528. LI Z K, LU Y, LIU J J, et al. Effects of probiotics on the growth performance, meat quality and colonic microflora of growing and finishing pigs[J]. Journal of Nanjing Agricultural University, 2020, 43(3): 523-528 (in Chinese). |
| [5] |
赵永玉. 微生态制剂对肉鸡生长性能、免疫功能、肠道菌群及血清生化指标的影响[J]. 饲料研究, 2021, 44(2): 50-53. ZHAO Y Y. Effects of microecological preparations on growth performance, immune function, intestinal flora and serum biochemical index of broilers[J]. Feed Research, 2021, 44(2): 50-53 (in Chinese). |
| [6] |
王瑞, 蔡文涛, 王喜亮, 等. 畜禽中药-益生菌复合微生态制剂的研究进展[J]. 生物工程学报, 2019, 35(6): 972-987. WANG R, CAI W T, WANG X L, et al. Progress in Chinese medicine-probiotics compound microecological preparations for livestock and poultry[J]. Chinese Journal of Biotechnology, 2019, 35(6): 972-987 (in Chinese). |
| [7] |
亓鹏, 张菊, 王小伟, 等. 微生态制剂对杜泊羊生长性能、屠宰性能和血液生化指标的影响[J]. 饲料研究, 2021, 44(5): 23-25. QI P, ZHANG J, WANG X W, et al. Effects of probiotics on growth performance, slaughter performance and blood biochemical indexes of Dorper sheep[J]. Feed Research, 2021, 44(5): 23-25 (in Chinese). |
| [8] |
张丽英. 饲料分析及饲料质量检测技术[M]. 4版. 北京: 中国农业大学出版社, 2016. ZHANG L Y. Feed analysis and quality test technology[M]. 4th ed. Beijing: China Agricultural University Press, 2016 (in Chinese). |
| [9] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [10] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010, 31(Z1): 37. FENG Z C, GAO M. Improvement of the method for determination of ammonia nitrogen in rumen juice by colorimetry[J]. Animal Husbandry and Feed Science, 2010, 31(Z1): 37 (in Chinese). |
| [11] |
CALLAHAN B J, MCMURDIE P J, ROSEN M J, et al. DADA2:high-resolution sample inference from Illumina amplicon data[J]. Nature Methods, 2016, 13(7): 581-583. DOI:10.1038/nmeth.3869 |
| [12] |
BOKULICH N A, KAEHLER B D, RIDEOUT J R, et al. Optimizing taxonomic classification of marker-gene amplicon sequences with QⅡME 2's q2-feature-classifier plugin[J]. Microbiome, 2018, 6(1): 90. DOI:10.1186/s40168-018-0470-z |
| [13] |
DESANTIS T Z, HUGENHOLTZ P, LARSEN N, et al. Greengenes, a chimera-checked 16S rRNA gene database and workbench compatible with ARB[J]. Applied and Environmental Microbiology, 2006, 72(7): 5069-5072. DOI:10.1128/AEM.03006-05 |
| [14] |
申红春. 饲料中添加复合微生物制剂对肉牛生长性能及肉品质的影响[J]. 中国饲料, 2018(17): 67-69. SHEN H C. Effects of compound microbial preparation in feed on growth performance and meat quality of beef cattle[J]. China Feed, 2018(17): 67-69 (in Chinese). |
| [15] |
KELSEY A J, COLPOYS J D. Effects of dietary probiotics on beef cattle performance and stress[J]. Journal of Veterinary Behavior-Clinical Applications and Research, 2018, 27: 8-14. DOI:10.1016/j.jveb.2018.05.010 |
| [16] |
ZHANG L Y, JIANG X, LIU X, et al. Growth, health, rumen fermentation, and bacterial community of Holstein calves fed Lactobacillus rhamnosus GG during the preweaning stage[J]. Journal of Animal Science, 2019, 97(6): 2598-2608. DOI:10.1093/jas/skz126 |
| [17] |
YAO J, WANG L L, ZHANG W J, et al. Effects of Bacillus megaterium on growth performance, serum biochemical parameters, antioxidant capacity, and immune function in suckling calves[J]. Open Life Sciences, 2020, 15(1): 1033-1041. DOI:10.1515/biol-2020-0106 |
| [18] |
DU R J, JIAO S Y, DAI Y, et al. Probiotic Bacillus amyloliquefaciens C-1 improves growth performance, stimulates GH/IGF-1, and regulates the gut microbiota of growth-retarded beef calves[J]. Frontiers in Microbiology, 2018, 9: 2006. DOI:10.3389/fmicb.2018.02006 |
| [19] |
VAZQUEZ-MENDOZA O, ELGHANDOUR M M Y, SALEM A Z M, et al. Effects of sodium butyrate and active Bacillus amyloliquefaciens supplemented to pasteurized waste milk on growth performance and health condition of Holstein dairy calves[J]. Animal Biotechnology, 2020, 31(3): 209-216. DOI:10.1080/10495398.2019.1578785 |
| [20] |
徐子萱, 李冬芳, 于春微, 等. 微生物发酵饲料对奶牛瘤胃发酵功能及饲粮营养物质体外消化率的影响[J]. 动物营养学报, 2021, 33(3): 1513-1522. XU Z X, LI D F, YU C W, et al. Effects of microbial fermented feed on rumen fermentation function of dairy cows and nutrient in vitro digestibilities of diets[J]. Chinese Journal of Animal Nutrition, 2021, 33(3): 1513-1522 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.03.033 |
| [21] |
MONTEIRO H F, FACIOLA A P. Ruminal acidosis, bacterial changes, and lipopolysaccharides[J]. Journal of Animal Science, 2020, 98(8): skaa248. DOI:10.1093/jas/skaa248 |
| [22] |
谢亮, 龙江松, 伍志武, 等. 硒源和微生态制剂对肉牛营养物质消化率、瘤胃发酵及瘤胃微生物区系的影响[J]. 动物营养学报, 2021, 33(12): 6864-6875. XIE L, LONG J S, WU Z W, et al. Effects of selenium source and microecological agent on nutrient digestibility, rumen fermentation and rumen microflora of beef cattle[J]. Chinese Journal of Animal Nutrition, 2021, 33(12): 6864-6875 (in Chinese). |
| [23] |
汪成, 马健, 胡瑞, 等. 活性干酵母对西门塔尔杂交牛生长性能、营养物质表观消化率、瘤胃发酵参数及血清生化和抗氧化指标的影响[J]. 动物营养学报, 2021, 33(7): 3925-3933. WANG C, MA J, HU R, et al. Effects of active dry yeast on growth performance, nutrient apparent digestibilities, rumen fermentation parameters and serum biochemical and antioxidant indexes of Simmental crossbred cattle[J]. Chinese Journal of Animal Nutrition, 2021, 33(7): 3925-3933 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.07.034 |
| [24] |
MCCANN J C, LUAN S Y, CARDOSO F C, et al. Induction of subacute ruminal acidosis affects the ruminal microbiome and epithelium[J]. Frontiers in Microbiology, 2016, 7: 701. |
| [25] |
ERASMUS L J, BOTHA P M, KISTNER A. Effect of yeast culture supplement on production, rumen fermentation, and duodenal nitrogen flow in dairy cows[J]. Journal of Dairy Science, 1992, 75(11): 3056-3065. DOI:10.3168/jds.S0022-0302(92)78069-2 |
| [26] |
ASAI K, LWIN K O, TANDANG A G, et al. Comparative analysis of rumen bacteria between water buffalo and cattle fed the same diet during their fattening period in the philippines[J]. Japan Agricultural Research Quarterly, 2021, 55(1): 69-75. DOI:10.6090/jarq.55.69 |
| [27] |
SHANKS O C, KELTY C A, ARCHIBEQUE S, et al. Community structures of fecal bacteria in cattle from different animal feeding operations[J]. Applied and Environmental Microbiology, 2011, 77(9): 2992-3001. DOI:10.1128/AEM.02988-10 |
| [28] |
吴婷婷. 补喂绵羊瘤胃液、益生菌对28日龄羔羊胃肠道菌群及免疫的影响[D]. 博士学位论文. 乌鲁木齐: 新疆农业大学, 2016. WU T T. The Effects of supplement with ruminal fluid, probiotics on the gastrointestinal microbiota and immunity of lambs aged 28 days[D]. Ph. D. Thesis. Urumqi: Xinjiang Agricultural University, 2016. (in Chinese) |
| [29] |
BÄCKHED F, LEY R E, SONNENBURG J L, et al. Host-bacterial mutualism in the human intestine[J]. Science, 2005, 307(5717): 1915-1920. DOI:10.1126/science.1104816 |
| [30] |
XU J, BJURSELL M K, HIMROD J, et al. A genomic view of the human-Bacteroides thetaiotaomicron symbiosis[J]. Science, 2003, 299(5615): 2074-2076. DOI:10.1126/science.1080029 |
| [31] |
张玉莹, 刘书杰, 冯宇哲, 等. 基于16S rRNA测序分析正常与腹泻牦牛犊牛粪便细菌区系组成[J]. 中国畜牧兽医, 2021, 48(9): 3293-3302. ZHANG Y Y, LIU S J, FENG Y Z, et al. Bacterial flora composition of normal and diarrhea yak calves based on 16S rRNA sequencing[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(9): 3293-3302 (in Chinese). |
| [32] |
KEGGI C, DORAN-PETERSON J. The homogalacturonan deconstruction system of Paenibacillus amylolyticus 27C64 requires no extracellular pectin methylesterase and has significant industrial potential[J]. Applied and Environmental Microbiology, 2020, 86(12): e02275-19. |
| [33] |
YADAV S, DUBEY S K. Cellulose degradation potential of Paenibacillus lautus strain BHU3 and its whole genome sequence[J]. Bioresource Technology, 2018, 262: 124-131. DOI:10.1016/j.biortech.2018.04.067 |
| [34] |
STREPIS N, SÁNCHEZ-ANDREA I, VAN GELDER A H, et al. Description of Trichococcus ilyis sp. nov. by combined physiological and in silico genome hybridization analyses[J]. International Journal of Systematic and Evolutionary Microbiology, 2016, 66(10): 3957-3963. DOI:10.1099/ijsem.0.001294 |
| [35] |
GAO Z M, XU X, RUAN L W. Enrichment and characterization of an anaerobic cellulolytic microbial consortium SQD-1.1 from mangrove soil[J]. Applied Microbiology and Biotechnology, 2014, 98(1): 465-474. DOI:10.1007/s00253-013-4857-2 |
| [36] |
DAI Y M, ZHANG L L, LI Y, et al. Corrigendum: characterization of Trichococcus paludicola sp. nov. and Trichococcus alkaliphilus sp. nov., isolated from a high-elevation wetland, by phenotypic and genomic analyses[J]. International Journal of Systematic and Evolutionary Microbiology, 2018, 68(6): 2115. |




