亚急性瘤胃酸中毒(subacute ruminal acidosis, SARA)是如今反刍动物养殖业最常见、造成经济损失最严重的营养代谢疾病之一。精料比例的增加、饲粮类型的转变使反刍动物瘤胃环境内富集较多的挥发性脂肪酸和乳酸,导致瘤胃液pH降低。当瘤胃液pH下降至5.2~5.8且每日维持3 h以上时,即认为SARA发生[1],SARA会进一步导致瘤胃壁受损,释放组胺引发宿主炎症,甚至导致动物体腹泻和脱水[2]。研究发现,饲粮中添加抗生素对SARA的发生能起到一定的作用,沙里菌素和莫能霉素等离子类抗生素能够有效防止SARA的发生,另外,四环素类、硫肽菌素等肽类抗生素在预防SARA中的作用也被证明[3]。然而,抗生素已被禁止在食品动物饲粮中添加使用。植物提取物作为禁抗时代的新型饲料添加剂,越来越受到各界的广泛关注。核桃青皮,又名“青龙衣”,是一种农业作物废弃物。研究发现,核桃青皮乙醇提取物经乙酸乙酯萃取后对革兰氏菌、大肠杆菌、金黄色葡萄球菌等均具有较好的抑制效果[4]。魏欢[5]研究发现,在绵羊精粗比为65∶35的高精料饲粮中添加核桃青皮提取物,能够通过调节绵羊瘤胃液滤纸酶和纤维二糖酶活性以及原虫数量,调节瘤胃发酵,提高瘤胃液pH,可能具有预防瘤胃酸中毒的潜能。但关于核桃青皮提取物调控反刍动物瘤胃发酵的机制还很模糊。鉴于此,本研究拟在饲粮中添加核桃青皮提取物,探究其对绵羊瘤胃发酵的调控机制,以期为核桃青皮提取物作为饲料添加剂在预防反刍动物SARA的实际应用中提供科学依据。
1 材料与方法 1.1 核桃青皮提取物的制备核桃青皮原料选用新疆阿克苏地区的核桃“温185”,成熟后将核桃青皮剥离,50 ℃烘干至恒重,过100目筛粉碎后与乙酸乙酯以1∶20料液比常温搅拌2 h,充分过滤,60 ℃旋转蒸发后,65 ℃烘干备用。
1.2 SARA建模、试验设计与饲养管理本试验于2021年4月至2021年8月在新疆农业大学三坪试验实习基地进行。选取平均体重为(43.3±1.5) kg、健康状况良好的安装有永久性瘤胃瘘管的7月龄小尾寒羊公羊4只作为试验动物。在建立SARA模型期间,给4只绵羊饲喂精粗比为65∶35的基础饲粮(其组成及营养水平见表 1),连续饲喂15 d,每天在晨饲前及饲喂后每间隔1 h连续10 h采集瘤胃液50 mL以监测瘤胃液pH。通过调整饲粮饲喂量使所有试验羊瘤胃液pH处于5.2~5.8达3 h以上,以此判定SARA是否建模成功。通过试验发现,每天饲喂2次,每次饲喂0.75 kg精粗比为65∶35的颗粒料可以成功诱导绵羊SARA模型。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
采用4×4拉丁方试验设计,以精粗比为65∶35的基础饲粮诱导SARA模型后,在基础饲粮中分别添加0(对照)、0.125%、0.250%和0.500%的核桃青皮提取物进行饲养试验。4期试验均包含预试期9 d,采样期8 d(采样期前5 d为粪便收集期,后3 d为瘤胃液采集期),每期间隔期3 d。在间隔期,各组试验羊均不添喂核桃青皮提取物,每天早、晚在基础饲粮饲喂后2 h时从瘤胃瘘管采集处于SARA状态的对照组试验羊的瘤胃内容物300 mL,平均分成3份,从瘤胃瘘管导入3个核桃青皮提取物添加组试验羊瘤胃内。试验期间,试验羊单栏限饲,分别在每天早(08:00)和晚(19:00)各饲喂0.75 kg饲粮,自由饮水。
1.3 样品收集与保存试验结束前,各组分别采集100 g颗粒料,过筛粉碎,60 ℃烘干保存待测。在粪便收集期,将绵羊置于代谢笼,全收粪法收集全部粪便。取20%新鲜粪便经10%盐酸固氮处理后,自然阴干,过筛粉碎,60 ℃烘干回潮后保存待测。在瘤胃液采集期,每天在饲喂前(0 h)以及饲喂后1.5、3、6、10 h时经瘤胃瘘管采集瘤胃内容物约50 mL,采后立即测pH,之后用4层纱布过滤,保留瘤胃液。瘤胃液连续采集3 d,将3 d的瘤胃液样品按照同一羊只同一时间点等量混合,放入-20 ℃冰箱保存待测。
1.4 指标测定 1.4.1 营养物质表观消化率的测定饲粮和粪便中的干物质(dry matter, DM)、有机物(organic matter, OM)、粗蛋白质(crude protein, CP)、粗脂肪(ether extract, EE)、磷(phosphorus, P)、中性洗涤纤维(neutral detergent fiber, NDF)、酸性洗涤纤维(acid detergent fiber, ADF)含量及总能(gross energy, GE)参考《饲料分析及饲料质量检测技术》[6]中的方法测定,钙(calcium, Ca)含量采用邻-甲酚酞比色法[7]测定。相关营养物质表观消化率的计算公式如下:

|
每次取完瘤胃液后迅速采用梅特勒FiveEasy pH计测定pH;瘤胃液氨态氮(ammonia nitrogen,NH3-N)浓度采用靛酚蓝比色法[8]测定;瘤胃液经福尔马林-冰醋酸固定、甲基绿染色后采用显微镜(目镜4倍,物镜100倍)计数原虫数量[9];以4-甲基戊酸为内标,采用岛津GC2010型气相色谱仪测定瘤胃液挥发性脂肪酸(volatile fatty acids, VFA)(乙酸、丙酸、丁酸、异丁酸、异戊酸和戊酸)浓度[10],并计算总挥发性脂肪酸(total volatile fatty acids, TVFA)浓度和乙丙比。
1.4.3 瘤胃液中乳酸浓度及乳酸生成相关酶活性的测定取出-20 ℃冰箱保存的瘤胃液,室温解冻后摇匀,取1.2 mL以12 000 r/min离心5 min;取1.0 mL上清至具塞试管中,加入0.5 mL 50%硫酸和1 mL甲醇,56 ℃酯化1 h;自来水冷却后,加入1 mL蒸馏水,3 000 r/min离心15 min;全部取出上清,加入2 mL三氯甲烷,振荡萃取3 min;静置,分层后取下层相1 mL采用配置有Stabilwax-DA色谱柱的气相色谱仪经外标法测定乳酸浓度。色谱条件为进样口200 ℃,柱温箱起始温度100 ℃,以10 ℃/min升温到120 ℃后,不保留,再以40 ℃/min升温到200 ℃,保持1 min,火焰离子化检测器(FID)220 ℃。瘤胃液中淀粉酶(amylase, AMS)活性参考张龙翔[11]的方法测定,己糖激酶(hexokinase, HK)、6-磷酸果糖激酶(6-phosphofructokinase, PFK)、丙酮酸激酶(pyruvate kinase, PK)和乳酸脱氢酶(lactate dehydrogenase, LDH)活性采用试剂盒测定,试剂盒全部购自南京建成生物工程研究所。
1.5 数据统计与分析采用SPSS 18.0统计软件“一般线性模型”中的单变量进行统计分析,分析模型如下:
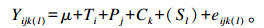
|
式中:Yijk(l)为试验羊在不同饲粮处理下的观测值;μ为均值;Ti为处理效应(i=1~4);Pj为试验期效应(j=1~4);Ck为试验羊的随机效应(k=1~4);Sl为采样时间(l=1~5),分析营养物质表观消化率时,该因素不计入分析模型;eijk(l)为误差项。同时对核桃青皮提取物添加水平的线性和二次效应进行分析,P<0.01为极显著,P<0.05为显著,0.05≤P<0.10为具有显著趋势。
2 结果与分析 2.1 核桃青皮提取物对SARA绵羊养分表观消化率的影响由表 2可知,与对照组相比,饲粮中添加0.125%、0.250%或0.500%核桃青皮提取物对绵羊各营养物质表观消化率均无显著影响(P>0.05)。饲粮中添加不同水平核桃青皮提取物后,磷的表观消化率有明显提高,并随着核桃青皮提取物添加水平的增加有二次提高的趋势(P=0.089)。
|
|
表 2 核桃青皮提取物对SARA绵羊营养物质表观消化率的影响 Table 2 Effects of walnut green husk extract on apparent digestibility of nutrients of SARA sheep |
由图 1可知,随着时间的推移,瘤胃液pH、原虫数量与异丁酸、异戊酸浓度先降低再升高,而氨态氮、总挥发性脂肪酸、乙酸、丙酸浓度先升高再降低。由表 3可知,与对照组相比,饲粮中添加0.125%、0.250%或0.500%核桃青皮提取物后瘤胃液pH显著提高(P<0.05),而总挥发性脂肪酸、乙酸、丁酸浓度显著降低(P<0.05);饲粮中添加0.125%或0.250%核桃青皮提取物后瘤胃液氨态氮浓度显著降低(P<0.05);饲粮中添加0.250%或0.500%核桃青皮提取物后瘤胃液原虫数量和异丁酸浓度显著降低(P<0.05);饲粮中添加0.125%或0.500%核桃青皮提取物后瘤胃液丙酸浓度显著降低(P<0.05);饲粮中添加0.250%核桃青皮提取物后瘤胃液异戊酸浓度显著降低(P<0.05)。饲粮中添加核桃青皮提取物有降低瘤胃液中乙丙比的趋势(P=0.070),但对戊酸浓度没有显著影响(P>0.05)。随着核桃青皮提取物添加水平的增加,瘤胃液pH呈极显著的线性增加(P<0.01),原虫数量与总挥发性脂肪酸、乙酸、丁酸、异丁酸浓度呈极显著的线性降低(P<0.01),异戊酸浓度呈显著的线性降低(P<0.05)。瘤胃液氨态氮浓度则随着核桃青皮提取物添加水平的增加呈显著的二次降低(P<0.05)。

|
图 1 各组绵羊瘤胃发酵参数及原虫数量变化趋势 Fig. 1 Variation trends of ruminal fermentation parameters and protozoa number of sheep in each group |
|
|
表 3 核桃青皮提取物对SARA绵羊瘤胃发酵参数及原虫数量的影响 Table 3 Effects of walnut green husk extract on ruminal fermentation parameters and protozoa number of SARA sheep |
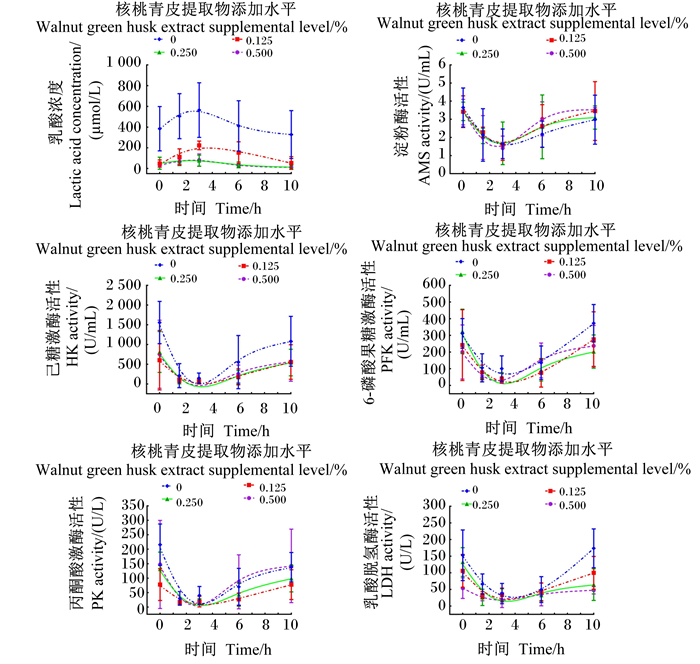
由图 2可知,随着时间的推移,瘤胃液中AMS、HK、PFK、PK、LDH活性先降低再升高,而乳酸浓度则先升高再降低。由表 4可知,与对照组相比,饲粮中添加0.125%、0.250%或0.500%核桃青皮提取物后瘤胃液中HK、LDH活性和乳酸浓度显著降低(P<0.05);饲粮中添加0.125%核桃青皮提取物后瘤胃液PK活性显著降低(P<0.05)。饲粮中添加核桃青皮提取物有降低瘤胃液中PFK活性的趋势(P=0.098),但对AMS活性没有显著影响(P>0.05)。随着核桃青皮提取物添加水平的增加,瘤胃液中乳酸浓度与HK、LDH活性呈极显著的线性降低(P<0.01),PFK活性呈显著的线性降低(P<0.05)。瘤胃液中PK活性则随着核桃青皮提取物添加水平的增加呈显著的二次降低(P<0.05)。
|
图 2 各组绵羊瘤胃液中乳酸浓度及乳酸生成相关酶活性变化趋势 Fig. 2 Variation trends of lactic acid concentration and activities of lactic acid production-related enzymes in ruminal fluid of sheep in each group |
|
|
表 4 核桃青皮提取物添加水平对SARA绵羊瘤胃液中乳酸浓度及乳酸生成相关酶活性的影响 Table 4 Effects of walnut green husk extract on lactic acid concentration and activities of lactic acid production-related enzymes in ruminal fluid of SARA sheep |
大多数植物提取物中都含有多种抗营养成分,如皂苷、单宁等,这些抗营养成分可以与饲粮中的淀粉相互作用,抑制其分解,并进一步影响营养物质的消化代谢[12]。核桃青皮中也含有单宁等抗营养成分[13]。Beauchemin等[14]报道,在饲粮中添加精油(主要成分为商业精油和香料提取物)后,安格斯母牛的所有营养物质的消化率均降低。但总体来讲,大部分植物提取物的添加对反刍动物的营养物质的消化代谢没有不良影响。Yatoo等[15]研究发现,在精粗比为67∶33的高精料饲粮中添加植物精油(主要成分为大蒜油和肉桂油)对水牛的营养物质表观消化率无显著影响。本研究发现,在精粗比为65∶35的高精料饲粮中添加0.125%、0.250%或0.500%核桃青皮提取物后,绵羊对各营养物质的表观消化率没有显著变化,这说明添加不同水平核桃青皮提取物后,绵羊瘤胃环境维持相对稳定,不会对其产生不利影响。
3.2 核桃青皮提取物对SARA绵羊瘤胃发酵的影响瘤胃液pH是反映瘤胃发酵状况的综合指标之一,反刍动物瘤胃液pH的正常范围是5.50~6.80,最适范围是6.00~6.30[16]。当反刍动物发生SARA时,瘤胃液会持续处于低pH状态[17]。已有研究显示在饲粮中添加植物提取物可以提高反刍动物瘤胃液pH,如郭长征[18]研究发现,在高精料饲粮中添加100 mg/kg槲皮素可提高山羊瘤胃液pH;Abdel-Raheemab等[19]研究表明,在饲粮中添加15%的辣木叶粕能够提高水牛犊牛瘤胃液pH。在本研究中,饲粮中添加0.125%、0.250%或0.500%核桃青皮提取物能够显著提高绵羊瘤胃液pH,表明核桃青皮提取物可能具有调节瘤胃发酵的作用。
反刍动物瘤胃微生物主要由细菌、厌氧真菌和原虫组成,这些微生物的种类和数量繁多且相互之间存在着竞争和协同的关系。瘤胃原虫可分泌脱氨酶来降解饲粮中的蛋白质生成总氨态氮,但其并不能利用氨态氮来合成自身需要的蛋白质[20],而氨态氮浓度是评价瘤胃内氮存留率的重要指标。植物提取物具有驱原虫作用,并且会使瘤胃液中氨态氮浓度降低,樊艳华等[21]研究报道,饲粮中添加丝兰皂苷会使山羊瘤胃内的原虫数量显著降低,氨态氮浓度显著降低。本试验中,饲粮中添加0.250%核桃青皮提取物后,绵羊瘤胃液原虫数量显著降低,并且显著降低了氨态氮浓度,由此推测核桃青皮提取物可能具有驱原虫作用,并进一步影响了绵羊瘤胃氮代谢。
反刍动物采食饲粮后,饲粮中的可溶性碳水化合物会在瘤胃微生物的作用下产生挥发性脂肪酸,动物机体所需消化能的70%~80%由这些挥发性脂肪酸提供[22],可见挥发性脂肪酸在反刍动物能量代谢中的重要地位。然而,近年来仅有少数学者发现添加植物提取物增加了瘤胃液总挥发性脂肪酸浓度,Wang等[23]研究报道,饲粮中添加黄芪能够导致臧羊瘤胃液中总挥发性脂肪酸浓度的提升,进而调控瘤胃发酵模式。但目前大多数研究报道,饲粮中添加植物提取物会导致瘤胃液总挥发性脂肪酸浓度下降或者不发生变化。梁贤威等[24]在高精料饲粮中添加4%的葵花籽油、茶油及其组合,发现泌乳水牛瘤胃液总挥发性脂肪酸浓度有降低趋势。Neubauer等[25]研究显示,在饲粮中添加植物源性化合物对奶牛瘤胃液总挥发性脂肪酸浓度没有显著影响。虽然添加植物提取物后瘤胃液总挥发性脂肪酸浓度可能无变化或下降,但是会改变各挥发性脂肪酸的比值。Castillejos等[26]报道了饲粮中添加丁香酚(500 mg/L)减少了瘤胃液中丙酸的比例,而没有影响总挥发性脂肪酸浓度。Saeedi等[27]研究发现,在精料中添加0.4%(干物质基础)的茴香粉可提高荷斯坦奶牛瘤胃液丙酸浓度,降低乙丙比。本试验发现,与对照组相比,添加核桃青皮提取物的各组绵羊瘤胃液总挥发性脂肪酸、乙酸、丁酸、异丁酸浓度显著下降,乙丙比具有下降的趋势。这可能是因为添加核桃青皮提取物后,瘤胃中产酸过程被抑制,进一步导致瘤胃液挥发性脂肪酸浓度降低。
3.3 核桃青皮提取物对SARA绵羊瘤胃液中乳酸浓度及乳酸生成相关酶活性的影响饲喂高精料饲粮的反刍动物,碳水化合物在瘤胃微生物代谢产酸过程中,淀粉类高分子化合物首先在AMS作用下分解为小分子糖类,再通过糖酵解途径生成丙酮酸。丙酮酸作为糖酵解的第1阶段产物,以及产乳酸反应中必需前体物质,它的浓度对于产生乳酸速率也有一定的影响[28]。而HK、PFK、PK作为丙酮酸生成过程中的关键限速酶,它们在瘤胃液中的活性变化间接影响着乳酸的生成。LDH作为丙酮酸生成乳酸过程中的催化酶,它的活性高低直接影响着乳酸产生过程是促进或是抑制。李颖[28]在体外产气系统中添加不同浓度的猴头菇多糖后,发现乳酸浓度与AMS、HK、PK和LDH活性较对照组均有降低的趋势,PFK活性有提高的趋势。本试验发现,饲粮中添加0.125%核桃青皮提取物后,SARA绵羊瘤胃液中乳酸浓度与HK、PK和LDH活性显著降低,AMS和PFK活性保持不变。这可能表明核桃青皮提取物可以减缓小分子糖类在瘤胃中的分解速率,从而达到整体调控瘤胃发酵的作用。
4 结论综上可知,核桃青皮提取物可通过降低乳酸合成关键酶活性、抑制原虫增殖等途径,减少乳酸、挥发性脂肪酸和氨态氮的生成,从而提高瘤胃液pH,改善瘤胃发酵,缓解高精料饲粮诱导的绵羊SARA。饲粮中添加0.125%的核桃青皮提取物即有助于缓解绵羊SARA。
| [1] |
MIRZAEI-ALAMOUTI H, MORADI S, SHAHALIZADEH Z, et al. Both monensin and plant extract alter ruminal fermentation in sheep but only monensin affects the expression of genes involved in acid-base transport of the ruminal epithelium[J]. Animal Feed Science and Technology, 2016, 219: 132-143. DOI:10.1016/j.anifeedsci.2016.06.009 |
| [2] |
JARAMILLO-LÓPEZ E, ITZA-ORTIZ M F, PERAZA-MERCADO G, et al. Ruminal acidosis: strategies for its control[J]. Austral Journal of Veterinary Sciences, 2017, 49(3): 139-148. DOI:10.4067/S0719-81322017000300139 |
| [3] |
龙淼, 李鹏, 尤丽霞. 奶牛亚急性瘤胃酸中毒(SARA)防治措施[J]. 饲料工业, 2010, 31(23): 61-64. LONG M, LI P, YOU L X. Prevention and treatment of subacute rumen acidosis (SARA) in dairy cows[J]. Feed Industry, 2010, 31(23): 61-64 (in Chinese). DOI:10.3969/j.issn.1001-991X.2010.23.018 |
| [4] |
任先伟, 魏晓璐, 黄鑫, 等. 核桃青皮提取物抑菌活性及抑菌机理研究[J]. 食品工业科技, 2015, 36(18): 93-98. REN X W, WEI X L, HUANG X, et al. Antibacterial activity and mechanism of walnut green husk' extract[J]. Science and Technology of Food Industry, 2015, 36(18): 93-98 (in Chinese). |
| [5] |
魏欢. 添加几种酚类化合物及核桃青皮提取物对绵羊瘤胃发酵的影响[D]. 硕士学位论文. 乌鲁木齐: 新疆农业大学, 2018. WEI H. Effect of several phenolic compounds and walnut green husk extracts on rumen fermentation in sheep[D]. Master's Thesis. Urumqi: Xinjiang Agricultural University, 2018. (in Chinese) |
| [6] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业大学出版社, 2007: 48-193. ZHANG L Y. Technology of feed analysis and feed quality test[M]. 3rd ed. Beijing: China Agricultural University Press, 2007: 48-193 (in Chinese). |
| [7] |
傅启高, 雒秋江. 用邻-甲酚酞比色法测定饲料中钙含量的研究[J]. 动物营养学报, 1996(3): 25-30. FU Q G, LUO Q J. Determination of feed calcium contents by o-cresolphthalein complexone colorimetry[J]. Chinese Journal of Animal Nutrition, 1996(3): 25-30 (in Chinese). |
| [8] |
李晴. 添加不同组合支链氨基酸对绵羊整体消化代谢及瘤胃微生物多样性的影响[D]. 硕士学位论文. 乌鲁木齐: 新疆农业大学, 2015. LI Q. Effects of adding different combinations branched-chain amino acid on sheep whole digestion metabolism and rumen microbial diversity[D]. Master's Thesis. Urumqi: Xinjiang Agricultural University, 2015. (in Chinese) |
| [9] |
王加启. 反刍动物营养学研究方法[M]. 北京: 现代教育出版社, 2011. WANG J Q. Research methods of ruminant nutrition[M]. Beijing: Modern Education Press, 2011 (in Chinese). |
| [10] |
许晓莉. 添加大豆磷脂对绵羊瘤胃消化代谢及微生物区系的影响[D]. 硕士学位论文. 乌鲁木齐: 新疆农业大学, 2013. XU X L. Effects of dietary addition of soybean lecithin on ruminal metabolism and microbial diverisity in sheep[D]. Master's Thesis. Urumqi: Xinjiang Agricultural University, 2013. (in Chinese) |
| [11] |
张龙翔. 生化实验方法和技术[M]. 2版. 北京: 高等教育出版社, 1997. ZHANG L X. Biochemical experimental methods and techniques[M]. 2nd ed. Beijing: Higher Education Press, 1997 (in Chinese). |
| [12] |
张芮铭, 田可, 何天乐, 等. 植物提取物对高精料饲粮下反刍动物瘤胃功能、微生物区系和炎症反应的调控效果[J]. 动物营养学报, 2020, 32(1): 36-41. ZHANG R M, TIAN K, HE T L, et al. Regulation effects of plant extracts on rumen function, microflora and inflammatory response in ruminants under high-concentrate diet[J]. Chinese Journal of Animal Nutrition, 2020, 32(1): 36-41 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.01.006 |
| [13] |
CHRZANOWSKI G, LESZCZYŃSKI B, CZERNIEWICZ P, et al. Phenolic acids of walnut (Juglans regia L.)[J]. Herba Polonica, 2011, 57(2): 22-29. |
| [14] |
BEAUCHEMIN K A, MCGINN S M. Methane emissions from beef cattle: effects of fumaric acid, essential oil, and canola oil[J]. Journal of Animal Science, 2006, 84(6): 1489-1496. DOI:10.2527/2006.8461489x |
| [15] |
YATOO M A, CHAUDHARY L C, AGARWAL N, et al. Effect of feeding of blend of essential oils on methane production, growth, and nutrient utilization in growing buffaloes[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(5): 672-676. DOI:10.5713/ajas.16.0508 |
| [16] |
MURPHY J J, KENNELLY J J. Effect of protein concentration and protein source on the degradability of dry matter and protein in situ[J]. Journal of Dairy Science, 1987, 70(9): 1841-1849. DOI:10.3168/jds.S0022-0302(87)80223-0 |
| [17] |
OGATA T, KIM Y H, MASAKI T, et al. Effects of an increased concentrate diet on rumen pH and the bacterial community in Japanese black beef cattle at different fattening stages[J]. Journal of Veterinary Medical Science, 2019, 81(7): 968-974. DOI:10.1292/jvms.19-0077 |
| [18] |
郭长征. 高精料日粮条件下添加槲皮素对山羊瘤胃发酵及蹄部健康的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2017. GUO C Z. Effects of quercetin addition on rumen fermentation and hoof health in goats fed a high-concentrate diet[D]. Master's Thesis. Nanjing: Nanjing Agricultural University, 2017. (in Chinese) |
| [19] |
ABDEL-RAHEEMAB S M, HASSAN E H. Effects of dietary inclusion of Moringa oleifera leaf meal on nutrient digestibility, rumen fermentation, ruminal enzyme activities and growth performance of buffalo calves[J]. Saudi Journal of Biological Sciences, 2021, 28(8): 4430-4436. DOI:10.1016/j.sjbs.2021.04.037 |
| [20] |
WILLIAMS A G, COLEMAN G S. The rumen protozoa[M]. New York: Springer-Verlag, 1992.
|
| [21] |
樊艳华, 孙海洲, 李胜利, 等. 不同蛋白质水平下丝兰皂甙对山羊氮代谢的影响[J]. 家畜生态学报, 2015, 36(2): 21-28. FAN Y H, SUN H Z, LI S L, et al. Effect of saponins from Yucca schidigera extract on nitrogen metabolism of goats with different dietary protein level[J]. Journal of Domestic Animal Ecology, 2015, 36(2): 21-28 (in Chinese). |
| [22] |
BANNINK A, FRANCE J, LOPEZ S, et al. Modelling the implications of feeding strategy on rumen fermentation and functioning of the rumen wall[J]. Animal Feed Science and Technology, 2008, 143(1/4): 3-26. |
| [23] |
WANG X J, DING L M, WEI H Y, et al. Astragalus membranaceus root supplementation improves average daily gain rumen fermentation, serum immunity and antioxidant indices of Tibetan sheep[J]. Animal, 2021, 15(1): 100061. DOI:10.1016/j.animal.2020.100061 |
| [24] |
梁贤威, 张双双, 韦升菊, 等. 葵花籽油和茶油对奶水牛瘤胃发酵参数及瘤胃液脂肪酸组成的影响[J]. 畜牧与兽医, 2015, 47(5): 50-54. LIANG X W, ZHANG S S, WEI S J, et al. Effects of sunflower seed oil and tea oil on ruminal fermentation parameters and fatty acid composition of ruminal fluid in dairy buffalo[J]. Animal Husbandry & Veterinary Medicine, 2015, 47(5): 50-54 (in Chinese). |
| [25] |
NEUBAUER V, PETRI R, HUMER E, et al. High-grain diets supplemented with phytogenic compounds or autolyzed yeast modulate ruminal bacterial community and fermentation in dry cows[J]. Journal of Dairy Science, 2018, 101(3): 2335-2349. DOI:10.3168/jds.2017-13565 |
| [26] |
CASTILLEJOS L, CALSAMIGLIA S, FERRET A. Effect of essential oil active compounds on rumen microbial fermentation and nutrient flow in in vitro systems[J]. Journal of Dairy Science, 2006, 89(7): 2649-2658. DOI:10.3168/jds.S0022-0302(06)72341-4 |
| [27] |
SAEEDI S, DAYANI O, TAHMASBI R, et al. Effect of supplementation of calf starter with fennel powder on performance, weaning age and fermentation characteristics in Holstein dairy calves[J]. Journal of Animal Physiology and Animal Nutrition, 2017, 101(1): 81-87. DOI:10.1111/jpn.12511 |
| [28] |
李颖. 猴头菇多糖缓解山羊亚急性瘤胃酸中毒效果及作用机理[D]. 硕士学位论文. 福州: 福建农林大学, 2019. LI Y. The effect and mechanism of Hericium erinaceus polysaccharides mitigating SARA in goat[D]. Master's Thesis. Fuzhou: Fujian Agriculture and Forestry University, 2019. (in Chinese) |




