2. 河北农业大学山区研究所, 保定 071001;
3. 河北省山区农业技术创新中心, 保定 071001
2. Mountainous Area Research Institute of Hebei Province, Hebei Agricultural University, Baoding 071001, China;
3. Agricultural Technology Innovation Centre in Mountainous Areas of Hebei Province, Baoding 071001, China
胃肠道作为机体最大的免疫器官,在营养物质消化、吸收和代谢中起重要作用,其肠道形态结构、肠道内环境及微生物区系等因素直接关系畜禽肠道功能,肠道感染病原微生物是引起动物肠道黏膜和上皮细胞损伤、肠道菌群失调、免疫力下降进而导致腹泻、细菌感染、生长速度缓慢甚至死亡的重要原因[1]。肠道功能的优化对动物生长发育各阶段的整体代谢、生理、疾病状态和生长性能具有重要意义,为解决畜禽肠道健康问题,近年来研究人员寻找了多种代替抗生素的绿色添加剂,其中植物精油(essential oils,EO)是热门研究之一,植物精油是从天然植物中提取的,具有多种生物活性,其中香芹酚(carvacrol)是牛至、百里香等常用精油中的主要成分,具有促进动物生长、改善肠道形态、调节肠道菌群[2-3]、提高消化酶活性[4]、提高免疫力和抗氧化能力等诸多作用。曾子悠等[5]研究发现,植物精油(香芹酚和百里香酚)和酸化剂可提高麻黄肉鸡绒隐比,改善肠道形态。同时,香芹酚和百里香酚可破坏病原微生物结构,杀灭病原菌[6],提高仔猪结肠内有益菌的相对丰度,降低有害菌的相对丰度,促进机体内肠道微生物的代谢功能[7]。综合发现,香芹酚作为添加剂多在猪和禽上使用,且多为联合使用,单独使用较少,在兔中应用更是鲜有报道。本课题组前期饲养试验结果表明,香芹酚添加水平为300 g/t时肉兔的料重比最低,养分表观消化率最高[8],在此基础上,本试验旨在从肠道形态、胃肠道pH、盲肠发酵和盲肠微生物区系等方面进一步研究香芹酚添加水平对肉兔肠道健康的影响,为香芹酚作为新型饲料添加剂在肉兔养殖中的应用提供理论依据及实践参考。
1 材料与方法 1.1 试验饲粮香芹酚由广州某公司提供(含量为4.56%),基础饲粮参照谷子林等[9]推荐的肉兔饲粮营养水平进行配制,基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
选取120只35日龄健康新西兰肉兔,体重为(1.06±0.04) kg,公母各占1/2,随机分为4组,每组30个重复,每个重复1只。对照组(CON组)饲喂基础饲粮,试验组(T1、T2、T3组)饲喂在基础饲粮中分别添加150、300和450 g/t香芹酚的试验饲粮。自由采食与饮水,预试期7 d,正试期28 d。
1.3 检测指标与方法 1.3.1 肠道形态结构的测定试验结束后,每组选取10只平均体重相近的肉兔进行屠宰,屠宰后各取1 cm空肠和回肠肠段固定备测。采用BA210 Digital数码三目摄像显微摄像系统对肠段切片进行图像采集,测量肠道绒毛高度和隐窝深度,每张切片测量10次取平均值,并计算绒隐比。
1.3.2 胃肠道内环境的测定胃肠道pH:屠宰后取胃、空肠、回肠和盲肠,用pH SJ-3F型pH计插入肠道内测定pH,每个部分测定3次取平均值。
盲肠挥发性脂肪酸含量:取1 g盲肠内容物3倍稀释,10 000×g离心10 min,取1 mL上清液和0.2 mL含有内标物2-乙基丁酸(2EB)的25%偏磷酸溶液,混匀,冰浴30 min以上,再次离心10 min,去除样品中蛋白质沉淀物,取上清液使用Agilent 6890N气相色谱仪进行测定。
取盲肠食糜装入5 mL无菌冻存管中,-80 ℃保存备测。在杭州联川生物技术有限公司对样品进行细菌16S rRNA的高通量测序分析。
1.4 数据的统计分析试验数据采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),Duncan氏法进行多重比较检验,数据结果采用“平均值±标准误”表示,微生物多样性数据显著性采用Graphpad Software非参数检验分析,以P<0.05表示差异显著,0.05≤P<0.10表示有趋势。
2 结果与分析 2.1 香芹酚对肉兔肠道形态的影响由表 2可知,添加不同水平香芹酚仅对肉兔空肠绒毛高度有显著影响(P<0.05),其中T1组的绒毛高度显著低于其他3组(P<0.05),与T1组相比,CON、T2和T3组空肠绒毛高度分别提高25.39%、30.61%和38.94%。饲粮添加香芹酚降低了肉兔空肠隐窝深度,提高了空肠绒隐比,但无显著影响(P>0.05)。饲粮添加香芹酚水平对肉兔回肠肠道形态无显著影响(P>0.05)。
|
|
表 2 香芹酚对肉兔肠道形态的影响 Table 2 Effects of carvacrol on intestinal morphology of meat rabbits (n=10) |
由表 3可知,饲粮添加香芹酚对肉兔胃、空肠、回肠和盲肠内pH均无显著影响(P>0.05),其中,T1、T2和T3组的肉兔胃、空肠和回肠的pH均略低于CON组。
|
|
表 3 香芹酚对肉兔胃肠道pH的影响 Table 3 Effects of carvacrol on pH in stomach and intestines of meat rabbits (n=10) |
由表 4可知,饲粮添加香芹酚,肉兔盲肠的丙酸、丁酸、异戊酸和戊酸含量均略有增加,但差异不显著(P>0.05),对戊酸含量有增加趋势(0.05≤P<0.10),对异丁酸和总挥发性脂肪酸含量无显著影响(P>0.05),其中T2组的丁酸和总挥发性脂肪酸含量最高,较CON组分别提高了16.35%和4.03%。
|
|
表 4 香芹酚对肉兔盲肠挥发性脂肪酸含量的影响 Table 4 Effects of carvacrol on volatile fatty acid contents in cecum of meat rabbits (n=10) |
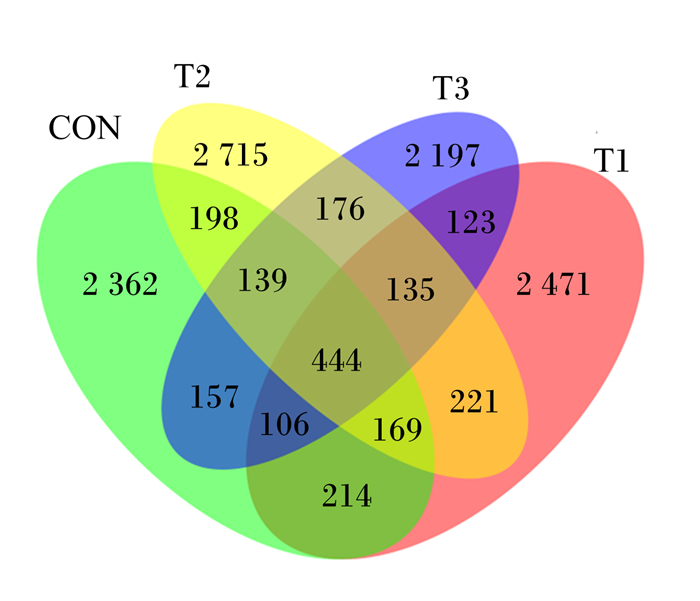
由图 1可知,根据feature丰度表,计算各组共有feature的数量,并通过Venn图直观地呈现各组共有和特有的feature数目,若feature只存在于1个分组,则该feature为该分组特有。由图 1可以看出,CON、T1、T2、T3组特有的feature数目分别为2 362、2 471、2 715和2 197。
|
CON、T1、T2、T3分别代表对照组、试验1组、试验2组和试验3组。下图同 CON, T1, T2 and T3 mean control group and test groups T1, T2 and T3, respectively. The same as below. 图 1 特征值分布Venn图 Fig. 1 Eigenvalue distribution Venn diagram |
由表 5可知,在物种丰富度上,T3组盲肠微生物Chao1指数和操作分类单元(OTU)数量指数显著低于T1和T2组(P<0.05),与CON组无显著差异(P>0.05)。饲粮添加香芹酚对盲肠菌群的Shannon指数、Simpson指数和覆盖度指数无显著影响(P>0.05)。
|
|
表 5 香芹酚对肉兔盲肠微生物菌群Alpha多样性指数的影响 Table 5 Effects of carvacrol on Alpha diversity indexes in cecal microbiota of meat rabbits (n=10) |
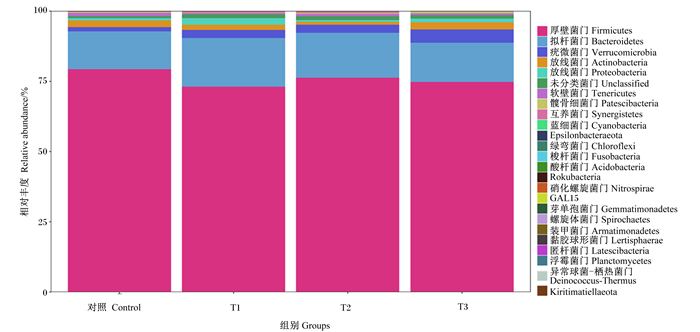
门水平上以微生物丰度前10作为各组的优势菌门进行分析。由图 2可知,肉兔盲肠微生物在门水平上均主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)和放线菌门(Actinobacteria)4种菌门组成,各组4种菌门相对丰度总和分别为96.67%、95.18%、96.21%和95.96%。对微生物群落构成比例进一步分析结果见表 6,与CON组相比,饲粮添加香芹酚对盲肠内厚壁菌门、拟杆菌门、疣微菌门、放线菌门、未分类菌群(unclassified)、变形菌门(Proteobacteria)、软壁菌门(Tenericutes)、髋骨细菌门(Patescibacteria)、互养菌门(Synergistetes)和蓝细菌(Cyanobacteria)相对丰富度均无显著影响(P>0.05)。
|
图 2 门水平上盲肠微生物菌群相对丰度 Fig. 2 Relative abundance of cecal microflora at phylum level |
|
|
表 6 香芹酚对肉兔盲肠菌群门水平的影响 Table 6 Effects of carvacrol on cecal microflora at phylum level of meat rabbits (n=10) |
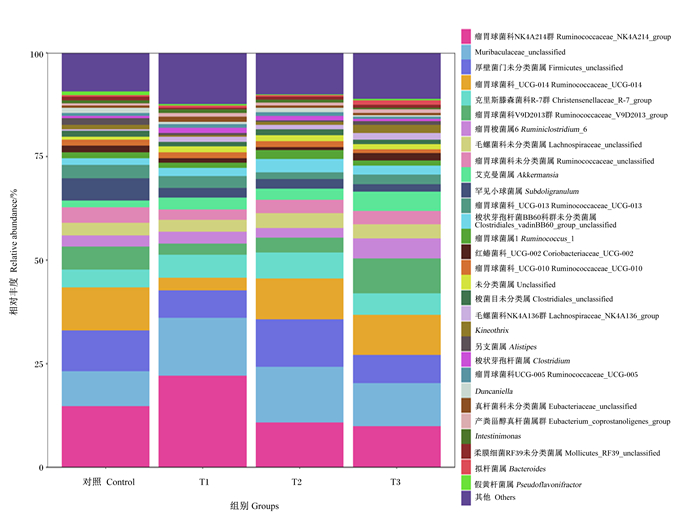
微生物菌群在属水平上以微生物丰度前30作为各组的优势菌属进行分析(图 3),并选取丰度>1%的24类菌属进行显著性分析。由表 7可知,T1组的肉兔盲肠瘤胃球菌科NK4A214群(Ruminococcaceae_NK4A214_group)相对丰度显著高于T2和T3组(P<0.05),与CON组相比无显著差异(P>0.05);CON和T3组梭状芽孢杆菌属(Clostridium)相对丰度显著低于T1和T2组(P<0.05);饲粮添加香芹酚有降低肉兔盲肠瘤胃球菌科_UCG-014(Ruminococcaceae_UCG-014)的趋势(0.05≤P<0.10),对其他菌属相对丰度均无显著影响(P>0.05)。
|
图 3 属水平上盲肠微生物菌群相对丰度 Fig. 3 Relative abundance of cecal microflora at genus level |
|
|
表 7 香芹酚对肉兔盲肠菌群属水平的影响 Table 7 Effects of carvacrol on cecal microflora at genus level of meat rabbits (n=10) |
小肠是机体内养分消化吸收的主要场所,其中绒毛高度、隐窝深度以及绒隐比等决定着小肠的消化吸收功能,绒毛高度越大,小肠吸收面积越大,隐窝深度越浅,细胞生成速度越快,绒隐比越大,机体的消化吸收能力越强。大多数研究表明,香芹酚单独使用或与其他植物精油联合使用,可改善动物的肠道形态。宋转等[10]研究发现,饲粮中添加肉桂醛、百里香和牛至油的复合植物精油可改善仔猪肠道形态,缓解氧化应激引起的肠道损伤。Mohiti-Asli等[11-12]研究发现,添加300 mg/kg牛至油可以显著提高肉鸡的肠道绒毛高度和绒隐比,添加500 mg/kg可缓解球虫病引起的肠道损伤。本试验中,添加150 g/t香芹酚显著降低了空肠的绒毛高度,小肠吸收面积减少,但隐窝深度在一定程度上变浅有利于肠上皮细胞成熟,由于空肠绒隐比没有显著差异,说明上述变化不会影响空肠整体的消化吸收能力。添加300和450 g/t香芹酚提高了空肠绒毛高度和绒隐比,降低了隐窝深度,对回肠肠道形态无显著作用。肠道绒毛发育受肠道环境、食糜黏度变化、饲粮组成和肠道微生物等多方面影响,其中食糜黏度降低,可减少有害菌数量,增加有益微生物繁殖,减少肠道损伤[13]。Hashemipour等[14]研究发现,在黏性基础饲粮中添加百里香酚+香芹酚可能有助于减轻黏性化合物在畜禽饲粮中的负面影响。牛金玲等[15]提出牛至精油和抗菌肽对肠道闭合蛋白1(Claudin 1)基因相对表达量具有位置特异性,具体机制尚未清楚。本试验未研究香芹酚对肠道屏障相关基因表达的影响,150 g/t和300~450 g/t香芹酚对空肠绒毛高度的差异,可能是通过肠道黏膜相关基因表达量改变所引起的,具体作用机制需进一步研究。
3.2 香芹酚对肉兔胃肠道pH和盲肠发酵的影响部分植物精油具有独特香气,影响畜禽采食量且能够降低畜禽肠道pH,改善肠道内环境,调整胃肠道菌群分布,影响肠道未消化的纤维颗粒发酵,提高畜禽饲料转化率[16]。本试验中,添加香芹酚降低了胃、空肠和回肠内的pH,且添加300 g/t香芹酚时盲肠pH最低,为胃肠道提供了酸性环境。肠道中的挥发性脂肪酸是微生物的代谢产物,短链脂肪酸甲酸、乙酸、丙酸和丁酸可发挥抑菌作用,提高肠道营养物质的吸收[17]。周瑞[18]发现牛至油可显著提高羔羊盲肠总挥发性脂肪酸和乙酸含量,显著降低异戊酸和戊酸含量,且发现牛至精油对微生物发酵可能具有一定的选择性。本试验中,添加不同水平香芹酚对肉兔盲肠丙酸、丁酸、异戊酸和戊酸含量均略有增加,其中添加300 g/t香芹酚时盲肠内丁酸和总挥发性脂肪酸含量最高,丙酸经过肝脏糖原异生作用生成葡萄糖为机体供能[19],丁酸转化为丁酸盐可为结肠黏膜提供能量,增强肠道免疫功能[20],为机体提供能量。可见,香芹酚在一定程度上提高肉兔盲肠挥发性脂肪酸的含量,并通过调节肠道pH,共同影响肠道的营养消化能力和机体健康,其挥发性脂肪酸组成不同,同时受肠道微生物、饲粮组成、饲料添加剂、不同日龄及品种等多方面影响[19]。
3.3 香芹酚对肉兔盲肠微生物区系的影响肉兔肠道的微生物区系主要包括肠道微生物多样性及其丰度,研究发现植物精油既可降低也可升高微生物多样性[21-22],通过有效抑制有害菌[1, 23],较弱抑制或提高有益菌来降低或升高微生物的多样性[24]。肠道微生物区系的稳定与变动虽与宿主的健康密切相关,但是肠道健康状况的改变很可能是部分病原体的增加或减少引起的,而非整体菌群多样性的变动导致。本试验中,肉兔盲肠内的主要优势菌门为厚壁菌门、拟杆菌门、疣微菌门和放线菌门,饲粮添加香芹酚对盲肠微生物门水平无显著影响,对少数属水平微生物有显著影响。饲粮添加150 g/t香芹酚时瘤胃球菌科NK4A214相对丰度大幅度提高,添加150~300 g/t香芹酚时显著增加了梭状芽孢杆菌属的相对丰度,添加150和300 g/t的香芹酚能显著增加梭状芽孢杆菌属的相对丰度,梭状芽孢杆菌属在肠道健康中发挥作用主要有代谢物的产生和免疫系统的直接相互作用2种途径,梭状芽孢杆菌属是碳水化合物发酵产生短链脂肪酸的主要力量,特别是丁酸盐,作为杰出的导体,可以协调多种生理功能,维持肠道健康,与饲粮添加300 g/t香芹酚使丁酸含量最高的结果相对应。与此同时,Atarashi等[25-26]研究发现,梭状芽孢杆菌属不仅可促进结肠黏膜调节性T细胞(Treg)的积累,丰富结肠中的转化生长因子-β,还可诱导Treg细胞增殖和分化,口服梭状芽孢杆菌属可减轻小鼠的结肠炎和过敏性腹泻,这可能是添加300 g/t香芹酚虽显著降低采食量,但生长速度和腹泻率较对照组减少的原因之一。Treg细胞是维持机体免疫耐受的重要因素之一,它由胸腺产生后输出至外周,通过主动调节的方式,抑制存在于正常机体内潜在自身反应性T细胞的活化与增殖,从而调节机体的免疫力[27],前期生长试验结果中,饲粮添加300 g/t香芹酚使胸腺指数增加趋势明显[8],从侧面也验证了梭状芽孢杆菌属可增强机体免疫能力,通过释放生长因子、增加肠道黏膜能量以及增强免疫力等方式在肠道健康中发挥着重要作用。饲粮添加150~450 g/t香芹酚增加了毛螺菌科NK4A136群、瘤胃球菌科UCG-005、克里斯滕森菌科R-7群和艾克曼菌属的相对丰度,瘤胃球菌科和毛螺菌科是短链脂肪酸的产生者,在降解多种多糖和纤维中发挥着关键作用[28],克里斯滕森菌科属和艾克曼菌属在肠道黏膜中广泛存在,是定植于黏膜层的肠道共存体[29]。综上所述,香芹酚稍改善了肉兔的盲肠微生物区系,且抑菌作用可能需要某些特定的作用机制来实现,不同作用机制间又受到途径反应物或者生成物的影响,且最终作用途径取决于中间产物pH、化学结构、含量及机体细菌微生物的数量和类型[6, 30-31]。综合何楚俐等[32]在体外抑菌试验发现,香芹酚抑菌效果强于其他种类植物精油,且与其他添加剂联合使用会有协同或相加效果,抑菌能力更强,以及考虑到断奶肉兔肠道功能的复杂机制,香芹酚与其他抗炎、抗氧化和抗菌成分的饲料添加剂混合使用可能更有利于提高肉兔的肠道健康。
4 结论在肉兔饲粮中添加香芹酚可改善肉兔盲肠微生物内环境与区系组成,促进肉兔的肠道健康。
| [1] |
武瑞. 植物精油与动物肠道健康研究进展[J]. 饲料与畜牧, 2016(9): 13-16. WU R. Progress in plant essential oils and animal intestinal health[J]. Feed and Husbandry, 2016(9): 13-16 (in Chinese). |
| [2] |
WEI H K, XUE H X, ZHOU Z X, et al. A carvacrol-thymol blend decreased intestinal oxidative stress and influenced selected microbes without changing the messenger RNA levels of tight junction proteins in jejunal mucosa of weaning piglets[J]. Animal, 2017, 11(2): 193-201. DOI:10.1017/S1751731116001397 |
| [3] |
ZOU Y, XIANG Q H, WANG J, et al. Oregano essential oil improves intestinal morphology and expression of tight junction proteins associated with modulation of selected intestinal bacteria and immune status in a pig model[J]. BioMed Research International, 2016, 2016: 5436738. |
| [4] |
张文静, 雷连成, 魏静元. 植物精油对肉仔鸡脏器指数、血清中激素含量和抗氧化指标的影响[J]. 饲料工业, 2016, 37(24): 9-12. ZHANG W J, LEI L C, WEI J Y. Effect of essential oil on organ indexes, hormone contents and antioxidant indexes in serum of broiler chicken[J]. Feed Industry, 2016, 37(24): 9-12 (in Chinese). |
| [5] |
曾子悠, 苟清碧, 古长松, 等. 饲粮添加植物精油和酸化剂组合对麻黄肉鸡生长性能、肠道健康和肉品质的影响[J]. 动物营养学报, 2021, 33(6): 3237-3249. ZENG Z Y, GOU Q B, GU C S, et al. Effects of dietary plant essential oil and acidifier combination on growth performance, intestinal health and meat quality of Mahuang broilers[J]. Chinese Journal of Animal Nutrition, 2021, 33(6): 3237-3249 (in Chinese). |
| [6] |
LAMBERT R J, SKANDAMIS P N, COOTE P J, et al. A study of the minimum inhibitory concentration and mode of action of oregano essential oil, thymol and carvacrol[J]. Journal of Applied Microbiology, 2001, 91(3): 453-462. DOI:10.1046/j.1365-2672.2001.01428.x |
| [7] |
刘仲昊, 郑梓, 陈亮, 等. 香芹酚和百里香酚对断奶仔猪结肠微生物的影响研究[J]. 中国畜牧兽医, 2020, 47(12): 3897-3908. LIU Z H, ZHENG Z, CHEN L, et al. Effects of carvacrol and thymol on colonic microorganisms in weaned piglets[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(12): 3897-3908 (in Chinese). |
| [8] |
刘福鑫, 孔繁根, 王国洲, 等. 香芹酚对肉兔生长性能、养分表观消化率、肠道消化酶活性、免疫器官发育及抗氧化能力的影响[J]. 动物营养学报, 2022, 34(3): 1875-1884. LIU F X, KONG F G, WANG G Z, et al. Effects of carvacrol on growth performance, nutrient apparent digestibilities, intestinal digestive enzyme activities, immune organ development and antioxidant capacity of meat rabbits[J]. Chinese Journal of Animal Nutrition, 2022, 34(3): 1875-1884 (in Chinese). DOI:10.3969/j.issn.1006-267x.2022.03.047 |
| [9] |
谷子林, 秦应和, 任克良. 中国养兔学[M]. 北京: 中国农业出版社, 2013: 435. GU Z L, QIN Y H, REN K L. China rabbit science[M]. Beijing: China Agriculture Press, 2013: 435 (in Chinese). |
| [10] |
宋转, 赵广宇, 董毅, 等. 复合植物精油对脂多糖刺激断奶仔猪肠道形态结构和抗氧化能力的影响[J]. 中国畜牧兽医, 2019, 46(3): 684-689. SONG Z, ZHAO G Y, DONG Y, et al. Effect of compound plant essential oils on structure of intestinal mucosa and antioxidant capacity of weaned piglets challenged with lipopolysaccharide[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(3): 684-689 (in Chinese). |
| [11] |
MOHITI-ASLI M, GHANAATPARAST-RASHTI M. Comparing the effects of a combined phytogenic feed additive with an individual essential oil of oregano on intestinal morphology and microflora in broilers[J]. Journal of Applied Animal Research, 2018, 46(1): 184-189. DOI:10.1080/09712119.2017.1284074 |
| [12] |
MOHITI-ASLI M, GHANAATPARAST-RASHTI M. Dietary oregano essential oil alleviates experimentally induced coccidiosis in broilers[J]. Preventive Veterinary Medicine, 2015, 120(2): 195-202. DOI:10.1016/j.prevetmed.2015.03.014 |
| [13] |
蒋桂韬. 小麦型日粮添加细菌性木聚糖酶对黄羽肉鸡生产性能的影响及作用机理研究[D]. 硕士学位论文. 长沙: 湖南农业大学, 2009. JIANG G T. Effects of bacterial xylanase supplementation in wheat-based diets on production performance and mechanism of yellow-feathered broilers[D]. Master's Thesis. Changsha: Hunan Agricultural University, 2009. (in Chinese) |
| [14] |
HASHEMIPOUR H, KERMANSHAHI H, GOLIAN A, et al. Effects of carboxy methyl cellulose and thymol+carvacrol on performance, digesta viscosity and some blood metabolites of broilers[J]. Journal of Animal Physiology and Animal Nutrition, 2014, 98(4): 672-679. DOI:10.1111/jpn.12121 |
| [15] |
牛金玲, 刘永需, 李福昌, 等. 饲粮中联合添加牛至精油和抗菌肽对肉兔生长性能和肠道屏障的影响[J]. 动物营养学报, 2022, 34(1): 555-562. NIU J L, LIU Y X, LI F C, et al. Effects of combined dietary oregano essential oil and antimicrobial peptides on growth performance and intestinal barrier in meat rabbits[J]. Chinese Journal of Animal Nutrition, 2022, 34(1): 555-562 (in Chinese). DOI:10.3969/j.issn.1006-267x.2022.01.051 |
| [16] |
王光富. 植物精油和有机酸对蛋鸡生产性能、蛋品质及肠道健康的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2018. WANG G F. Effects of essential oil and/or organic acids on the performance, egg quality and intestinal health of laying hens[D]. Master's Thesis. Yangling: Northwest A and F University, 2018. (in Chinese) |
| [17] |
HÖGBERG A, LINDBERG J E. The effect of level and type of cereal non-starch polysaccharides on the performance, nutrient utilization and gut environment of pigs around weaning[J]. Animal Feed Science and Technology, 2006, 127(3/4): 200-219. |
| [18] |
周瑞. 牛至精油对羔羊胃肠道结构和功能及其微生物多样性的影响[D]. 博士学位论文. 兰州: 甘肃农业大学, 2019. ZHOU R. The effects of oregano essential oil on gastrointestinal tract structure, function and microbiota diversity of lambs[D]. Ph. D. Thesis. Lanzhou: Gansu Agricultural University, 2019. (in Chinese) |
| [19] |
王淑玲, 王后福, 盖叶顶, 等. 浅析反刍动物胃肠道微生物通过肠道—脑轴对宿主的影响[J]. 中国畜牧兽医, 2019, 46(12): 3598-3606. WANG S L, WANG H F, GE Y D, et al. Research on effects of ruminant gastrointestinal microorganisms on the host through the gut-brain axis[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(12): 3598-3606 (in Chinese). |
| [20] |
TⅡHONEN K, KETTUNEN H, BENTO M H L, et al. The effect of feeding essential oils on broiler performance and gut microbiota[J]. British Poultry Science, 2010, 51(3): 381-392. DOI:10.1080/00071668.2010.496446 |
| [21] |
杨建平, 王笑笑, 李新锋, 等. 饲粮中添加复合植物精油对58周龄海兰褐壳蛋鸡生产性能、蛋品质和肠道菌群结构的影响[J]. 动物营养学报, 2020, 32(6): 2869-2879. YANG J P, WANG X X, LI X F, et al. Effects of compound plant essential oils on performance, egg quality and cecal microflora of 58-week-old Hy-line brown laying hens[J]. Chinese Journal of Animal Nutrition, 2020, 32(6): 2869-2879 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.06.047 |
| [22] |
程浩, 唐圣果, 贺长青, 等. 饲粮添加凹凸棒石负载植物精油复合物对蛋鸡生产性能和肠道微生物的影响[J]. 动物营养学报, 2021, 33(5): 2631-2641. CHENG H, TANG S G, HE C Q, et al. Effects of dietary essential oil/palygorskite composite on performance and intestinal microflora of laying hens[J]. Chinese Journal of Animal Nutrition, 2021, 33(5): 2631-2641 (in Chinese). |
| [23] |
张显东. 香芹酚和百里香酚的作用机理及其在单胃动物中的应用研究进展[J]. 中国畜牧杂志, 2017, 53(11): 25-30. ZHANG X D. The mode of action and application of carvacrol and thymol in monogastric animals: a review[J]. Chinese Journal of Animal Science, 2017, 53(11): 25-30 (in Chinese). |
| [24] |
夏梦芳. 植物精油水剂对肉鸡生产性能、血清生化指标、抗氧化性及肠道微生物菌群的影响[D]. 硕士学位论文. 郑州: 河南农业大学, 2017. XIA M F. Effect of plant essential oil on growth performance, serum biochemical indexes, antioxidative and intestinal microecology of broiler[D]. Master's Thesis. Zhengzhou: Henan Agricultural University, 2017. (in Chinese) |
| [25] |
ATARASHI K, TANOUE T, SHIMA T, et al. Induction of colonic regulatory T cells by indigenous Clostridium species[J]. Science, 2011, 331(6015): 337-341. DOI:10.1126/science.1198469 |
| [26] |
ATARASHI K, TANOUE T, OSHIMA K, et al. Treg induction by a rationally selected mixture of Clostridia strains from the human microbiota[J]. Nature, 2013, 500(7461): 232-236. DOI:10.1038/nature12331 |
| [27] |
俸家富, 黄文芳. 现代临床检验诊断大全[M]. 成都: 四川科学技术出版社, 2013. FENG J F, HUANG W F. Modern clinical laboratory diagnostic manual[M]. Chengdu: Sichuan Science and Technology Press, 2013 (in Chinese). |
| [28] |
YANG Q Z M, WEI C C, GUO S T, et al. Cloning and characterization of a L-lactate dehydrogenase gene from Ruminococcaceae bacterium CPB6[J]. World Journal of Microbiology and Biotechnology, 2020, 36(12): 182. DOI:10.1007/s11274-020-02958-4 |
| [29] |
ZHANG T, LI Q Q, CHENG L, et al. Akkermansia muciniphila is a promising probiotic[J]. Microbial Biotechnology, 2019, 12(6): 1109-1125. DOI:10.1111/1751-7915.13410 |
| [30] |
BURT S. Essential oils: their antibacterial properties and potential applications in foods—a review[J]. International Journal of Food Microbiology, 2004, 94(3): 223-253. DOI:10.1016/j.ijfoodmicro.2004.03.022 |
| [31] |
DE SOUZA C, EYNG C, VIOTT A M, et al. Effect of dietary guanidinoacetic acid or nucleotides supplementation on growth performances, carcass traits, meat quality and occurrence of myopathies in broilers[J]. Livestock Science, 2021, 251: 104659. DOI:10.1016/j.livsci.2021.104659 |
| [32] |
何楚俐, 胡豪, 井俊南, 等. 不同种类的植物精油体外抑菌效果观察[J]. 广东饲料, 2020, 29(8): 23-25. HE C L, HU H, JING J N, et al. Research of antibacterial effect in vitro of different kinds of plant essential oils[J]. Guangdong Feed, 2020, 29(8): 23-25 (in Chinese). DOI:10.3969/j.issn.1005-8613.2020.08.006 |




