精氨酸是一种功能性必需氨基酸,在生物体生长发育过程中非常重要。在动物细胞内,精氨酸是目前发现的功能最多的氨基酸,其不仅是合成蛋白质的重要原料,也是机体内一氧化氮(nitric oxide, NO)、多胺和肌酸等重要物质的合成前体,在动物的调控和营养代谢中起着重要的作用[1]。精氨酸在动物体内有2条直接代谢的途径:一条途径是在精氨酸酶(arginase, ARG)的作用下分解为鸟氨酸和尿素,鸟氨酸又经多种酶催化合成多胺类物质[2];另一条途径是在一氧化氮合酶催化下,结合氧生成NO和瓜氨酸,NO是一种小型双原子气体,在许多发育和生理过程中作为扩散的第二信使。
随着养殖业的发展,动物饲粮越来越受到养殖业的重视,氨基酸作为饲粮蛋白质的重要组成物质也受到人们的广泛关注,精氨酸在大多动物中属于必需氨基酸,机体内不能合成,需要额外添加。周凡[3]研究表明,饲粮中精氨酸添加水平显著影响了黑鲷的生长性能,并且指出了精氨酸和赖氨酸这2种碱性氨基酸之间的拮抗作用以及两者在饲料中的配比,为黑鲷饲料的配制提供了参考依据。饲粮精氨酸添加水平对哺乳仔猪采食量、血液中氨基酸含量以及胰岛素等激素水平都有显著影响,适宜的精氨酸添加水平提高了哺乳仔猪的健康状况[4]。以豆粕替代饲料中鱼粉并添加精氨酸对点带石斑鱼肠道消化酶活性和后肠黏膜下层厚度、肌层厚度、皱襞高度均有显著影响[5]。总之,精氨酸在哺乳动物和水产动物生产中的应用已有很大的发展。近几年,精氨酸在昆虫上的研究也越来越多。有研究表明,饲粮中添加L-精氨酸可促进果蝇化蛹,缩短果蝇的化蛹时间,提高其蛋白质水平,但会引起氧化应激,降低繁殖力和寿命[6]。在免疫方面,饲粮中添加精氨酸可通过诱导合成NO限制疟原虫的发育,减少按蚊对该虫的感染率[7];当给被寄生虫感染的果蝇幼虫喂食L-精氨酸时,其血细胞数量增加,并且精氨酸提高了幼虫包裹寄生虫卵的能力,增强了自身对寄生虫的抵抗力[8]。蜜蜂的必需氨基酸包括精氨酸、组氨酸、赖氨酸、色氨酸、苯丙氨酸、蛋氨酸、苏氨酸、亮氨酸、异亮氨酸和缬氨酸[9]。已有研究表明,在室内饲养的蜜蜂幼虫饲粮中添加L-精氨酸增强了粒细胞对创伤和脂多糖(lipopolysaccharide, LPS)注射后的免疫激活[10]。目前已有研究报道了精氨酸对昆虫生理作用的影响,但对蜜蜂的作用还未有研究。因此,本试验拟在饲粮中添加不同水平的精氨酸,研究其对意大利蜜蜂工蜂幼虫化蛹率、羽化率、抗氧化能力以及免疫力的影响,以期为意大利蜜蜂工蜂幼虫的饲养提供依据。
1 材料与方法 1.1 试验材料试验用精氨酸纯度为99%,购自郑州某化工产品有限公司。
1.2 试验动物试验用意大利蜜蜂工蜂幼虫取自山东农业大学试验蜂群。在2020年春、夏季节蜜粉源充足的情况下,从群势相当的意大利蜜蜂姊妹蜂群中选取1日龄工蜂幼虫1 200只。
1.3 试验饲粮配制5种添加不同水平精氨酸的试验饲粮,其组成见表 1。
|
|
表 1 试验饲粮组成 Table 1 Composition of experiment Diets |
将1 200只意大利蜜蜂工蜂幼虫随机分成5组,每组5个重复,每个重复48只。5组工蜂幼虫分别饲喂精氨酸添加水平为0(对照组)、0.2%、0.4%、0.6%、0.8%的试验饲粮。将1日龄工蜂幼虫用移虫针从蜂房移到温度适宜盛有200 μL试验饲粮的24孔细胞培养板中,将培养板放置在实验室恒温培养箱(温度33 ℃,相对湿度55%)中,试验期间每天定时更换新鲜的试验饲粮,饲喂至6日龄末或7日龄初时,幼虫会出现直立和排便现象,将幼虫移至事先铺好灭菌纸的24孔培养板进行化蛹。每天检查培养板并及时移出死亡的幼虫,同时记录白眼蛹数和新蜂数,以便计算化蛹率和羽化率。在试验过程中取4、6日龄幼虫及6日龄幼虫血淋巴测定相关酶、基因及生化指标。
1.5 测定指标 1.5.1 化蛹率与羽化率的测定从试验第1天开始,每天记录工蜂幼虫的死亡数量,并及时清理死亡虫体,直至存活幼虫全部羽化出房,记录白眼蛹数和新蜂数,计算化蛹率和羽化率:

|
在1.5 mL离心管中加入少量的苯基硫脲,放置在预先制冷(0 ℃)的金属浴中,选用40 μL规格的毛细血管吸取6日龄工蜂幼虫的血淋巴,用吸耳球将血淋巴吹入1.5 mL的离心管中,采集完立即将样品放入-80 ℃保存。检测时,用4 ℃离心机12 000×g离心5 min,取200 μL上清备用,采用日立7020型全自动生化分析仪测定幼虫血淋巴中胆固醇(cholesterol, CHO)、总蛋白(total protein, TP)、白蛋白(albumin, ALB)、尿素(urea, UREA)含量和谷丙转氨酶(alanine transaminase, ALT)活性。
1.5.3 精氨酸代谢、抗氧化及免疫相关指标的测定将4、6日龄工蜂幼虫按照1 ∶ 9的质量比加入一定体积的磷酸盐缓冲液(PBS),进行组织匀浆,4 ℃离心机12 000×g离心15 min,取上清测定ARG、鸟氨酸脱羧酶(ornithine decarboxylase, ODC)、过氧化氢酶(catalase, CAT)、溶菌酶(lysozyme, LYS)、酚氧化酶(phenol oxidase, PO)活性与总抗氧化能力(total antioxidant capacity,T-AOC)。昆虫ARG、CAT、LYS、PO酶联免疫吸附测定(ELISA)试剂盒购自江苏酶免实业有限公司,昆虫ODC ELISA试剂盒购自上海酶联生物科技有限公司,T-AOC试剂盒购自苏州科铭生物技术有限公司。
1.5.4 精氨酸代谢、抗氧化和免疫相关基因表达的测定使用Total RNA Kit Ⅱ试剂盒(OMEGA公司)提取4和6日龄工蜂幼虫总RNA,用微量紫外可见分光光度计测定RNA的纯度和浓度,用Evo M-MLV反转录试剂盒(湖南艾科瑞生物工程有限公司)将RNA反转录为cDNA,-20 ℃保存。利用实时荧光定量PCR方法检测目的基因的相对表达量,内参基因为表达稳定的β-肌动蛋白(β-actin),引物设计与合成由生工生物工程(上海)股份有限公司完成,引物信息见表 2。按照TransStart Top Green qPCR SuperMix试剂盒(北京全氏金生物技术有限公司),利用美国AB17500仪器系统进行PCR检测,反应体系为20 μL,反应条件:94 ℃ 30 s,94 ℃ 5 s,60 ℃ 34 s,40个循环。
|
|
表 2 引物信息 Table 2 Primer information |
6日龄工蜂幼虫中肠形态学检测在武汉塞维尔生物科技有限公司协助下完成。蜜蜂肠道置于4%多聚甲醛溶液内固定,脱水后进行包埋、切片,将切片进行苏木精-伊红(HE)染色,光学显微镜下进行拍摄和测量。
1.6 数据分析数据采用SAS 9.2软件进行单因素方差分析(one-way ANOVA),并采用Turkey检验进行多重比较,P<0.05为差异显著,P<0.01为差异极显著,试验数据均以平均值±标准差(mean±SD)的形式表示。
2 结果 2.1 饲粮中添加精氨酸对意大利蜜蜂工蜂幼虫化蛹率和羽化率的影响由表 3可知,与对照组相比,0.2%、0.4%精氨酸组的化蛹率、羽化率均无显著变化(P>0.05),0.6%、0.8%精氨酸组的化蛹率、羽化率均显著降低(P<0.05),且0.6%、0.8%精氨酸组还显著低于0.2%、0.4%精氨酸组(P<0.05)。
|
|
表 3 饲粮中精氨酸添加水平对工蜂幼虫化蛹率和羽化率的影响 Table 3 Effects of arginine supplemental level on pupation rate and emergence rate of Apis mellifera ligustica worker bee larvae |
由表 4可知,与对照组相比,0.2%、0.4%和0.6%精氨酸组血淋巴中胆固醇含量无显著变化(P>0.05),而0.8%精氨酸组显著降低(P<0.05),且0.8%精氨酸组还显著低于0.2%、0.4%和0.6%精氨酸组(P<0.05)。与对照组相比,0.2%、0.4%、0.6%和0.8%精氨酸组血淋巴中谷丙转氨酶活性和总蛋白含量无显著变化(P>0.05);0.2%、0.6%和0.8%精氨酸组血淋巴中谷丙转氨酶活性显著低于0.4%精氨酸组(P<0.05);0.8%精氨酸组血淋巴中总蛋白含量显著低于0.2%、0.4%精氨酸组(P<0.05)。与对照组相比,0.4%、0.6%和0.8%精氨酸组血淋巴中白蛋白含量无显著变化(P>0.05),0.2%精氨酸组则显著升高(P<0.05),且0.2%精氨酸组还显著高于0.4%和0.8%精氨酸组(P<0.05)。0.2%、0.4%、0.6%和0.8%精氨酸组血淋巴中尿素含量均显著高于对照组(P<0.05),0.6%、0.8%精氨酸组还显著高于0.2%、0.4%精氨酸组(P<0.05)。
|
|
表 4 饲粮中精氨酸添加水平对6日龄意大利蜜蜂工蜂幼虫血淋巴生化指标的影响 Table 4 Effects of dietary arginine supplemental level on hemolymph biochemical indexes of 6-day-old Apis mellifera ligustica worker bee larvae |
对于4日龄幼虫,与对照组相比,4个添加精氨酸组的ARG活性均无显著变化(P>0.05),但0.2%精氨酸组显著高于0.6%、0.8%精氨酸组(P<0.05)(图 1-A)。对于6日龄幼虫,与对照组相比,0.2%、0.4%和0.8%精氨酸组ARG活性均无显著变化(P>0.05),0.6%精氨酸组显著升高(P<0.05),且0.6%精氨酸组还显著高于0.8%精氨酸组(P<0.05)(图 1-A)。
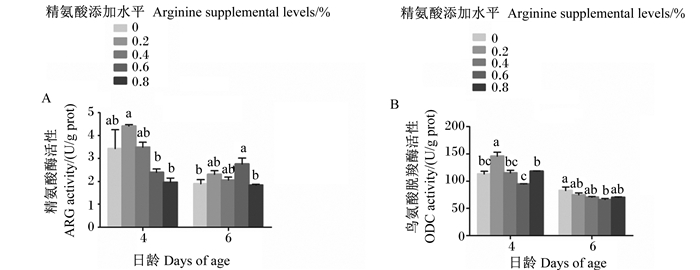
|
数据柱标注相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。 Data columns with the same letters mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 1 饲粮中精氨酸添加水平对4、6日龄意大利蜜蜂工蜂幼虫精氨酸酶、鸟氨酸脱羧酶活性的影响 Fig. 1 Effects of dietary arginine supplemental level on ARG and ODC activities of 4- and 6-day-old Apis mellifera ligustica worker bee larvae |
对于4日龄幼虫,与对照组相比,0.4%、0.6%和0.8%精氨酸组ODC活性均无显著变化(P>0.05),0.2%精氨酸组则显著升高(P<0.05),且0.2%精氨酸组还显著高于0.4%、0.6%和0.8%精氨酸组(P<0.05)(图 1-B)。对于6日龄幼虫,与对照组相比,0.2%、0.4%和0.8%精氨酸组ODC活性均无显著变化(P>0.05),而0.6%精氨酸组显著降低(P<0.05)(图 1-B)。
对于4日龄幼虫,与对照组相比,0.2%、0.4%和0.8%精氨酸组ODC基因相对表达量无显著变化(P>0.05),而0.6%精氨酸组显著降低(P<0.05)(图 2)。对于6日龄幼虫,与对照组相比,0.6%精氨酸组ODC基因相对表达量无显著变化(P>0.05),但0.2%、0.4%和0.8%精氨酸组均显著升高(P<0.05),且0.4%和0.8%精氨酸组还显著高于0.6%精氨酸组(P<0.05)(图 2)。
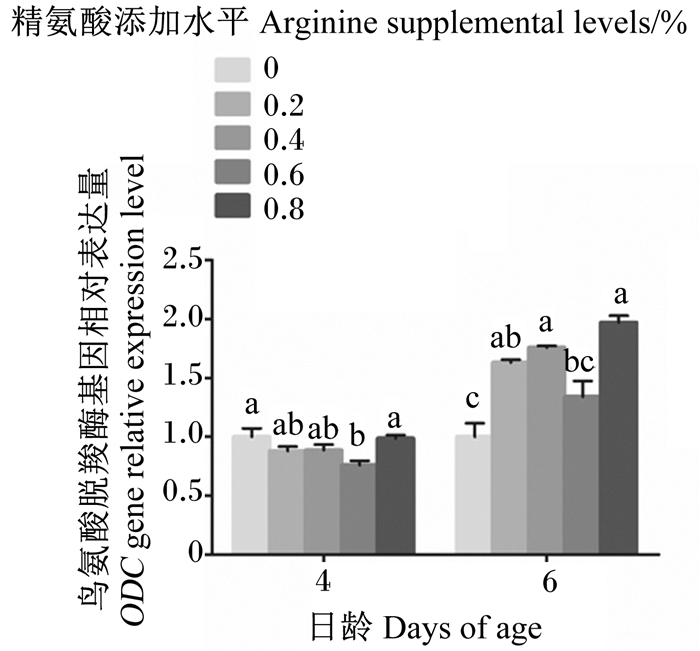
|
图 2 饲粮中精氨酸添加水平对4、6日龄意大利蜜蜂工蜂幼虫鸟氨酸脱羧酶基因相对表达量的影响 Fig. 2 Effects of dietary supplemental arginine level on relative expression level of ODC gene of 4- and 6-day-old Apis mellifera ligustica worker bee larvae |
对于4日龄幼虫,与对照组相比,0.2%、0.6%和0.8%精氨酸组CAT活性均无显著变化(P>0.05),0.4%精氨酸组则显著升高(P<0.05),且0.4%精氨酸组还显著高于0.2%、0.8%精氨酸组(P<0.05)(图 3-A)。对于6日龄幼虫,与对照组相比,0.6%、0.8%精氨酸组CAT活性均无显著变化(P>0.05),0.2%、0.4%精氨酸组则显著升高(P<0.05),且0.2%精氨酸组还显著高于0.6%、0.8%精氨酸组(P<0.05)(图 3-A)。
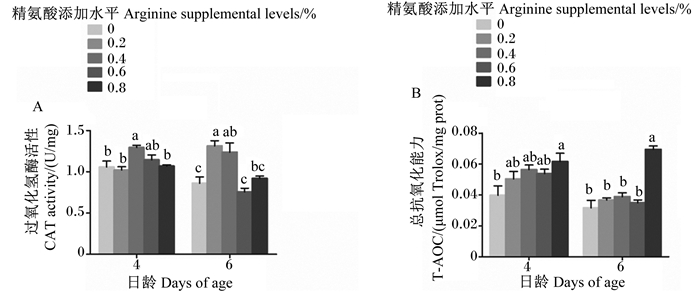
|
图 3 饲粮中精氨酸添加水平对4、6日龄意大利蜜蜂工蜂幼虫过氧化氢酶活性、总抗氧化能力的影响 Fig. 3 Effects of dietary arginine supplemental level on CAT activity and T-AOC of 4- and 6-day-old Apis mellifera ligustica worker bee larvae |
对于4、6日龄幼虫,与对照组相比,0.2%、0.4%和0.6%精氨酸组T-AOC均无显著变化(P>0.05),但0.8%精氨酸组显著升高(P<0.05)(图 3-B)。
对于4日龄幼虫,与对照组相比,0.2%、0.8%精氨酸组CAT基因相对表达量无显著变化(P>0.05),而0.4%、0.6%精氨酸组则显著升高(P<0.05),且0.6%精氨酸组还显著高于其他添加精氨酸组(P<0.05)(图 4)。对于6日龄幼虫,与对照组相比,0.2%、0.6%精氨酸组CAT基因相对表达量无显著变化(P>0.05),0.4%、0.8%精氨酸组则显著升高(P<0.05),且0.4%、0.8%精氨酸组还显著高于0.2%、0.6%精氨酸组(P<0.05)(图 4)。
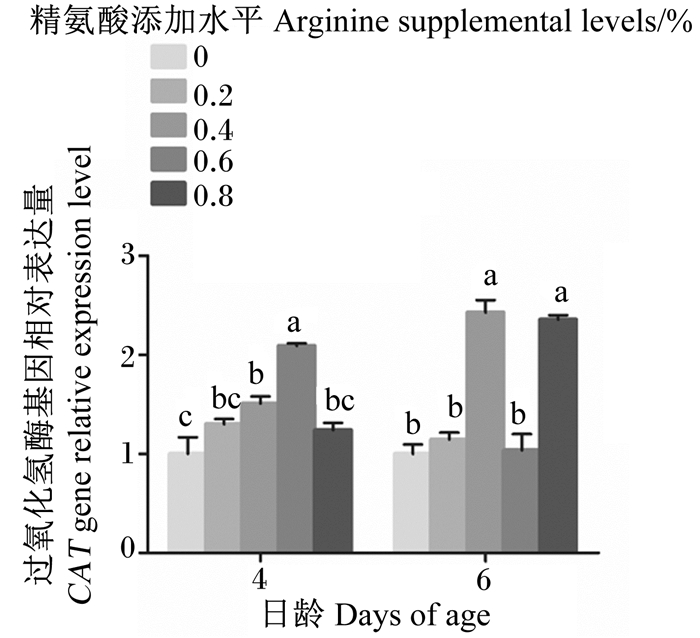
|
图 4 饲粮中精氨酸添加水平对4、6日龄意大利蜜蜂工蜂幼虫过氧化氢酶基因相对表达量的影响 Fig. 4 Effects of dietary arginine supplemental level on relative expression level of CAT gene of 4- and 6-day-old Apis mellifera ligustica worker bee larvae |
对于4日龄幼虫,与对照组相比,4个添加精氨酸组LYS活性均显著降低(P<0.05)(图 5-A)。对于6日龄幼虫,与对照组相比,0.4%、0.6%和0.8%精氨酸组LYS活性无显著变化(P>0.05),0.2%精氨酸组则显著升高(P<0.05)(图 5-A)。
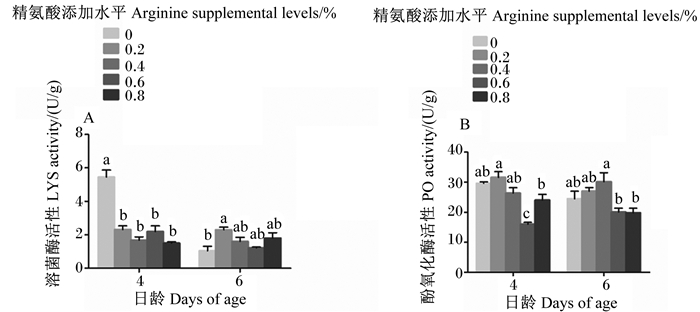
|
图 5 饲粮中添加精氨酸水平对4、6日龄意大利蜜蜂工蜂幼虫溶菌酶、酚氧化酶活性的影响 Fig. 5 Effects of dietary arginine supplemental level on LYS and PO activities of 4- and 6-day-old Apis mellifera ligustica worker bee larvae |
对于4日龄幼虫,与对照组相比,0.2%、0.4%和0.8%精氨酸组PO活性无显著变化(P>0.05),而0.6%精氨酸组显著降低(P<0.05),且0.6%精氨酸组还显著低于其他添加精氨酸组(P<0.05)(图 5-B)。对于6日龄幼虫,与对照组相比,0.2%、0.4%精氨酸组PO活性无显著变化(P>0.05),而0.6%、0.8%精氨酸组则显著降低(P<0.05),且0.6%、0.8%精氨酸组还显著低于0.4%精氨酸组(P<0.05)(图 5-B)。
对于4日龄幼虫,与对照组相比,4个添加精氨酸组LYS基因相对表达量均无显著变化(P>0.05),但0.2%精氨酸组显著高于0.8%精氨酸组(P<0.05)(图 6-A)。对于6日龄幼虫,与对照组相比,0.2%、0.4%和0.8%精氨酸组LYS基因相对表达量均无显著变化(P>0.05),0.6%精氨酸组则显著升高(P<0.05),且0.6%精氨酸组还显著高于其他添加精氨酸组(P<0.05)(图 6-A)。
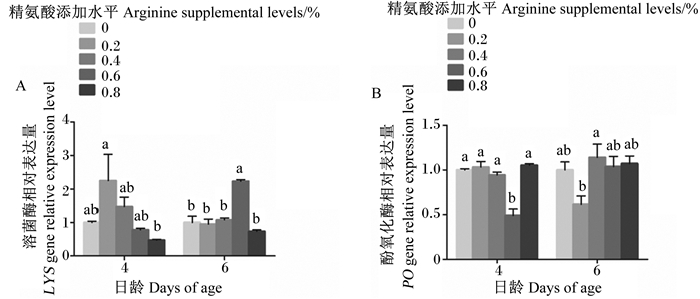
|
图 6 饲粮中精氨酸添加水平对4、6日龄意大利蜜蜂工蜂幼虫溶菌酶、酚氧化酶基因相对表达量的影响 Fig. 6 Effects of dietary arginine supplemental level on relative expression levels of LYS and PO genes of 4- and 6-day-old Apis mellifera ligustica worker bee larvae |
对于4日龄幼虫,与对照组相比,0.2%、0.4%和0.8%精氨酸组PO基因相对表达量均无显著变化(P>0.05),而0.6%精氨酸组则显著降低(P<0.05),且0.6%精氨酸组还显著低于其他添加精氨酸组(P<0.05)(图 6-B)。对于6日龄幼虫,与对照组相比,4个添加精氨酸组PO基因相对表达量均无显著变化(P>0.05),但0.2%精氨酸组显著低于0.4%精氨酸组(P<0.05)(图 6-B)。
2.6 饲粮中添加精氨酸对6日龄意大利蜜蜂工蜂幼虫中肠形态的影响由图 7可知,6日龄意大利蜜蜂工蜂幼虫已经开始进行中肠重建,中肠上皮细胞已经完全退化,成虫中肠与幼虫中肠之间已形成清晰可见的间隙。从图中还可以看出,添加低剂量精氨酸对中肠重建无明显影响,但添加0.8%精氨酸则明显缩小了成虫中肠与幼虫中肠之间的间隙。
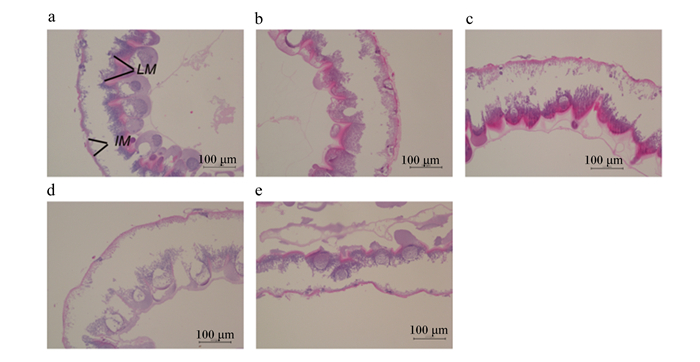
|
a:对照组;b:0.2%精氨酸组;c:0.4%精氨酸组,d:0.6%精氨酸组;e:0.8%精氨酸组。IM代表成虫中肠,LM代表幼虫中肠。 a: control group; b: 0.2% arginine group; c: 0.4% arginine group; d: 0.6% arginine group; e: 0.8% arginine group. IM represents adult midgut, and LM represents larval midgut. 图 7 饲粮中精氨酸添加水平对6日龄意大利蜜蜂工蜂幼虫中肠形态的影响 Fig. 7 Effects of dietary arginine supplemental level on midgut morphology of 6-day-old Apis mellifera ligustica worker larvae |
研究表明,缺乏必需氨基酸会阻碍蜜蜂的生长发育[9]。在自然蜂群中,常以饲喂花粉来提供蜜蜂发育所需的氨基酸。精氨酸对蜜蜂生长发育影响的研究较少,但在其他动物中已有大量研究。封福鲜[11]发现,在饲粮中添加精氨酸显著影响了瓦氏黄颡鱼的生长性能,使其终末体重、增重率和特定增长率都有升高的趋势。而在研究较多的果蝇昆虫中,在果蝇的培养基中加入适量的精氨酸能够加速果蝇的蛹化速度,提高它的蛋白质水平[6]。本试验探究了精氨酸对工蜂幼虫生长发育的影响,研究发现添加低剂量的精氨酸对幼虫化蛹率、羽化率均无显著影响,但添加高剂量的精氨酸增加了工蜂幼虫的死亡率。由此可见,添加高剂量的精氨酸对工蜂幼虫生长发育有不利影响。
3.2 饲粮中添加精氨酸对意大利蜜蜂工蜂幼虫血淋巴生化指标的影响昆虫的血淋巴在体腔内循环(血腔)具有多种生物功能,如生物分子、营养物质和激素的运输[12-13]。有研究表明膳食甾醇(包括胆固醇和植物甾醇)可以通过脂蛋白在昆虫前胸腺合成蜕皮激素,对昆虫蜕皮发育有重要的作用[14]。刘军等[15]研究发现,饲粮中添加精氨酸能够提高断奶仔猪肝脏中胆固醇、甘油三酯含量,增强断奶仔猪的机体营养水平。此外,精氨酸可促进尿素循环,使血氨转化为尿素排出,维持体内氮平衡。果蝇ARG在脂肪组织中表达,并将精氨酸水解为鸟氨酸和尿素[16]。本研究中,低剂量精氨酸对工蜂幼虫血淋巴胆固醇含量无显著影响,但0.8%精氨酸组血淋巴中胆固醇含量显著降低,这可能是导致工蜂幼虫蜕皮失败的重要原因;添加精氨酸使工蜂幼虫血淋巴中尿素含量显著高于对照组,这可能是由ARG代谢活性增加导致的。
3.3 饲粮中添加精氨酸对意大利蜜蜂工蜂幼虫精氨酸代谢的影响精氨酸经ARG代谢产生鸟氨酸和尿素,鸟氨酸又经ODC等多种酶代谢反应,最终进入三羧酸循环,氧化供能生成CO2[3]。ARG是在细菌、酵母、植物、无脊椎动物和脊椎动物中普遍存在的一种酶,该酶不仅参与机体尿酸循环,还与机体病理过程密切相关。曾雯娉[17]在凡纳滨对虾幼虾精氨酸需要量的研究中得出,适量添加精氨酸能够提高ARG活性,其与特定生长率呈正相关。本试验中,饲粮中添加0.6%精氨酸显著提高了6日龄工蜂幼虫ARG活性,且添加0.2%精氨酸显著提高了4日龄工蜂幼虫ODC活性,说明饲粮中添加一定剂量的精氨酸能够促进工蜂幼虫体内精氨酸的代谢循环。
3.4 饲粮中添加精氨酸对意大利蜜蜂工蜂幼虫抗氧化能力的影响抗氧化能力对于一个蜂群的发展至关重要。T-AOC反映了存在于组织或细胞中的抗氧化分子,特别是含硫醇的化合物的非特异性自由基清除能力[18-19]。CAT是一种源于生命体的活性物质,它是机体内氧自由基的头号杀手,能消除生物体在新陈代谢过程中产生的有害物质,具有清除生物体内自由基、保护细胞免受损害等多种作用。王世昌等[20]研究显示,补喂瘤胃保护性精氨酸提高了绵羊血清中超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶活性,增强了绵羊的抗氧化能力。研究表明,膳食中添加L-精氨酸可以通过增强抗氧化防御机制来预防敌草快诱导的大鼠氧化应激[21],精氨酸对人工饲养仔猪的抗氧化能力也有显著提高[22]。本试验结果显示,饲粮中添加0.4%精氨酸显著提高了4、6日龄工蜂幼虫的CAT活性及其基因相对表达量,与上述研究结果一致,说明饲粮中添加精氨酸可以提高工蜂幼虫机体内CAT活性,增强机体的抗氧化能力。
3.5 饲粮中添加精氨酸对意大利蜜蜂工蜂幼虫免疫力的影响昆虫是无脊椎动物,缺少脊椎动物的抗原抗体特性,但它们也有一套完整的免疫系统。有研究发现,营养应激影响蜜蜂肠道微生物群,对蜜蜂的免疫和病原体的发育产生影响[23]。LYS是一种小分子抗菌肽,是从昆虫的血淋巴中分离纯化出来的抗菌因子之一,又称其为细胞壁溶解酶,在昆虫的体液免疫中扮演着重要角色。同时,它是一种非特异性免疫因子,能够水解细菌细胞壁肽聚糖层中的1,4-糖苷键[24],同时也可促进抗菌肽的表达,优化免疫应答[25]。在瓦氏黄颡鱼[11]和吉富罗非鱼[26]的研究中发现,饲粮中添加精氨酸提高了机体中LYS的活性,增强了鱼体的免疫能力。在本试验中,饲粮中添加0.2%精氨酸显著提高了6日龄工蜂幼虫的LYS活性,添加0.6%精氨酸显著增加了6日龄工蜂幼虫的LYS基因相对表达量,表明饲粮中添加适量精氨酸能增强工蜂幼虫的免疫力。
3.6 饲粮中添加精氨酸对意大利工蜂幼虫中肠形态的影响在意大利蜜蜂中,幼虫消化道由1个有气孔瓣的前肠、1个未分化的中肠和1个由回肠和直肠组成的后肠构成[27]。蜜蜂幼虫的中肠是肠道中最宽的区域,由3种细胞组成:可合成消化酶、吸收营养的消化细胞,产生激素的内分泌细胞和负责替代其他2种细胞类型的再生细胞[28]。在正常情况下,昆虫中肠的形态改变只发生在变态期间,消化细胞死亡和上皮细胞重塑以形成成虫中肠,发生中肠重建[27-29]。家蚕末龄幼虫发生变态时,成熟的中肠细胞开始从基底膜局部分离,直至完全分离后中肠细胞被推入中肠腔最终被分解,同时下面再生细胞分裂形成新的上皮细胞[30]。本试验显示,6日龄工蜂幼虫的中肠出现了如上述中提到的幼虫中肠和成虫中肠,且有明显的分裂痕迹,说明意大利蜜蜂末龄幼虫也会进行中肠重建来完成变态发育;同时,结果还表明,添加高剂量精氨酸可能不利于工蜂幼虫中肠发生分裂。
4 结论饲粮中添加精氨酸对意大利蜜蜂工蜂幼虫化蛹率和羽化率、抗氧化能力以及免疫力均有一定的影响,适量添加可以提高意大利蜜蜂工蜂幼虫的抗氧化能力,而高剂量添加则会降低意大利蜜蜂工蜂幼虫的化蛹率和羽化率,对生长发育有不利影响。
| [1] |
GURBUZ A T, KUNZELMAN J, RATZER E E. Supplemental dietary arginine accelerates intestinal mucosal regeneration and enhances bacterial clearance following radiation enteritis in rats[J]. Journal of Surgical Research, 1998, 74(2): 149-154. DOI:10.1006/jsre.1997.5231 |
| [2] |
NIEVES C Jr, LANGKAMP-HENKEN B. Arginine and immunity: a unique perspective[J]. Biomedicine & Pharmacotherapy, 2002, 56(10): 471-482. |
| [3] |
周凡. 饲料赖氨酸和精氨酸对黑鲷幼鱼生长影响及其拮抗作用机理研究[D]. 博士学位论文. 杭州: 浙江大学, 2011. ZHOU F. Study on effects of dietary lysine and arginine on growth performance, and the arginine/lysine antagonism mechanism in juvenile black sea bream, Acanthopagrus schlegelii[D]. Ph. D. Thesis. Hangzhou: Zhejiang University, 2011. (in Chinese) |
| [4] |
姚康, 褚武英, 邓敦, 等. 不同精氨酸添加水平对哺乳仔猪生长性能的影响[J]. 天然产物研究与开发, 2008(1): 121-124. YAO K, CHU W Y, DENG D, et al. Effects of different dietary arginine supplementation on sucking piglets' growth performance[J]. Natural Product Research and Development, 2008(1): 121-124 (in Chinese). DOI:10.3969/j.issn.1001-6880.2008.01.031 |
| [5] |
陈思琦, 程镇燕, 安贸麟, 等. 豆粕替代鱼粉并添加精氨酸对点带石斑鱼消化酶活性和肠道组织结构的影响[J]. 中国饲料, 2019(1): 57-64. CHEN S Q, CHENG Z Y, AN M L, et al. Effect of dietary soybean meal replacing fish meal and supplemented with arginine on digestion and intestinal structure of grouper in Epinephelus malabaricus[J]. China Feed, 2019(1): 57-64 (in Chinese). |
| [6] |
BAYLIAK M M, LYLYK M P, MANIUKH O V, et al. Dietary L-arginine accelerates pupation and promotes high protein levels but induces oxidative stress and reduces fecundity and life span in Drosophila melanogaster[J]. Journal of Comparative Physiology B, 2018, 188(1): 37-55. DOI:10.1007/s00360-017-1113-6 |
| [7] |
LUCKHART S, VODOVOTZ Y, CUI L, et al. The mosquito Anopheles stephensi limits malaria parasite development with inducible synthesis of nitric oxide[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(10): 5700-5705. DOI:10.1073/pnas.95.10.5700 |
| [8] |
KRAAIJEVELD A R, ELRAYES N P, SCHUPPE H, et al. L-arginine enhances immunity to parasitoids in Drosophila melanogaster and increases NO production in lamellocytes[J]. Developmental & Comparative Immunology, 2011, 35(8): 857-864. |
| [9] |
DE GROOT A P. Amino acid requirements for growth of the honeybee (Apis mellifica L.)[J]. Experientia, 1952, 8(5): 192-194. DOI:10.1007/BF02173740 |
| [10] |
NEGRI P, RAMIREZ L, QUINTANA S, et al. Dietary supplementation of honey bee larvae with arginine and abscisic acid enhances nitric oxide and granulocyte immune responses after trauma[J]. Insects, 2017, 8(3): 85. DOI:10.3390/insects8030085 |
| [11] |
封福鲜. 精氨酸、赖氨酸和苏氨酸对瓦氏黄颡鱼幼鱼生长、代谢及免疫力的影响[D]. 硕士学位论文. 青岛: 中国海洋大学, 2011. FENG F X. Effects of dietary arginine, lysine and threonine on growth, metabolism and immune responses of juvenile darkbarbel catfish (Pelteobagrus vachelli)[D]. Master's Thesis. Qingdao: Ocean University of China, 2011. (in Chinese) |
| [12] |
VIERSTRAETE E, CERSTIAENS A, BAGGERMAN G, et al. Proteomics in Drosophila melanogaster: first 2D database of larval hemolymph proteins[J]. Biochemical and Biophysical Research Communications, 2003, 304(4): 831-838. DOI:10.1016/S0006-291X(03)00683-1 |
| [13] |
CHAN Q W T, HOWES C G, FOSTER L J. Quantitative comparison of caste differences in honeybee hemolymph[J]. Molecular & Cellular Proteomics, 2006, 5(12): 2252-2262. |
| [14] |
IGARASHI F, OGIHARA M H, IGA M, et al. Cholesterol internalization and metabolism in insect prothoracic gland, a steroidogenic organ, via lipoproteins[J]. Steroids, 2018, 134: 110-116. DOI:10.1016/j.steroids.2018.01.012 |
| [15] |
刘军, 仲召鑫, 彭众, 等. 哺乳期补饲精氨酸对断奶仔猪肝脏脂代谢功能的影响[J]. 动物营养学报, 2020, 32(2): 674-681. LIU J, ZHONG Z X, PENG Z, et al. Effects of arginine supplementation during lactation period on liver lipid metabolism function of weaned piglets[J]. Chinese Journal of Animal Nutrition, 2020, 32(2): 674-681 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.02.023 |
| [16] |
SAMSON M L. Drosophila arginase is produced from a nonvital gene that contains the elav locus within its third intron[J]. Journal of Biological Chemistry, 2000, 275(40): 31107-31114. DOI:10.1074/jbc.M001346200 |
| [17] |
曾雯娉. 凡纳滨对虾幼虾对赖氨酸、蛋氨酸、精氨酸和苯丙氨酸需要量的研究[D]. 硕士学位论文. 湛江: 广东海洋大学, 2012. ZENG W P. Study on the requirements of lysine, methionine, arginine and phenylalanine for juvenile pacific white shrimp, Litopenaeus vannamei[D]. Master's Thesis. Zhanjiang: Guangdong Ocean University, 2012. (in Chinese) |
| [18] |
EREL O. A novel automated direct measurement method for total antioxidant capacity using a new generation, more stable ABTS radical cation[J]. Clinical Biochemistry, 2004, 37(4): 277-285. DOI:10.1016/j.clinbiochem.2003.11.015 |
| [19] |
VASYLKOVSKA R, PETRIV N, SEMCHYSHYN H. Carbon sources for yeast growth as a precondition of hydrogen peroxide induced hormetic phenotype[J]. International Journal of Microbiology, 2015, 2015: 697813. |
| [20] |
王世昌, 张文杰, 韩明, 等. 补喂瘤胃保护性精氨酸对绵羊血浆中氨基酸浓度、激素水平和抗氧化能力的影响[J]. 中国饲料, 2020(17): 20-28. WANG S C, ZHANG W J, HAN M, et al. The supplemental effects of rumen-protected arginine on plasma amino acids concentrations, hormone levels and antioxidant status in sheep[J]. China Feed, 2020(17): 20-28 (in Chinese). |
| [21] |
CAO W, XIAO L, LIU G M, et al. Dietary arginine and N-carbamylglutamate supplementation enhances the antioxidant statuses of the liver and plasma against oxidative stress in rats[J]. Food & Function, 2016, 7(5): 2303-2311. |
| [22] |
贾建英, 李成贤. 精氨酸对人工饲养仔猪生长性能及机体抗氧化功能的影响[J]. 饲料研究, 2020, 43(5): 52-54. JIA J Y, LI C X. Effect of arginine on growth performance and body antioxidation function of artificial feeding piglets[J]. Feed Research, 2020, 43(5): 52-54 (in Chinese). |
| [23] |
CASTELLI L, BRANCHICCELA B, GARRIDO M, et al. Impact of nutritional stress on honeybee gut microbiota, immunity, and Nosema ceranae infection[J]. Microbial Ecology, 2020, 80(4): 908-919. DOI:10.1007/s00248-020-01538-1 |
| [24] |
GILLESPIE J P, KANOST M R, TRENCZEK T. Biological mediators of insect immunity[J]. Annual Review of Entomology, 1997, 42: 611-643. DOI:10.1146/annurev.ento.42.1.611 |
| [25] |
IMLER J L, BULET P. Antimicrobial peptides in Drosophila: structures, activities and gene regulation[J]. Chemical Immunology and Allergy, 2005, 86: 1-21. |
| [26] |
武文一. 吉富罗非鱼对饲料精氨酸、苯丙氨酸和缬氨酸的需要量研究[D]. 硕士学位论文. 上海: 上海海洋大学, 2016. WU W Y. Studies on the requirements of arginine, phenylalanine and valine in the diet to GIFT tilapia (Oreochromis niloticus)[D]. Master's Thesis. Shanghai: Shanghai Ocean University, 2016. (in Chinese) |
| [27] |
DA CRUZ-LANDIM C, CAVALCANTE V M. Ultrastructural and cytochemical aspects of metamorphosis in the midgut of Apis mellifera L. (Hymenoptera: Apidae: Apinae)[J]. Zoological Science, 2003, 20(9): 1099-1107. DOI:10.2108/zsj.20.1099 |
| [28] |
MARTINS G F, NEVES C A, CAMPOS L A O, et al. The regenerative cells during the metamorphosis in the midgut of bees[J]. Micron, 2006, 37(2): 161-168. DOI:10.1016/j.micron.2005.07.003 |
| [29] |
GREGORC A, BOWEN I D. Programmed cell death in the honey-bee (Apis mellifera L.) larvae midgut[J]. Cell Biology International, 1997, 21(3): 151-158. DOI:10.1006/cbir.1997.0127 |
| [30] |
GONCU E, URANLI R, SELEK G, et al. Developmental expression of ecdysone-related genes associated with metamorphic changes during midgut remodeling of silkworm Bombyx mori (Lepidoptera: Bombycidae)[J]. Journal of Insect Science, 2016, 16(1): 86. DOI:10.1093/jisesa/iew061 |




