大肠杆菌(Escherichia coli, E. coli)是一类广泛存在于自然界,并能引起人和动物共同感染的重要人兽共患病病原[1]。产肠毒素性大肠杆菌(enterotoxigenic Escherichia coli,ETEC)K88是ETEC最常见的血清型,可导致新生儿和幼小动物的肠道疾病和腹泻[2]。肠道屏障在保护肠道免受病原微生物的侵袭和维持肠道稳态方面具有重要的作用[3]。ETEC通过定殖于肠道上皮细胞分泌肠毒素破坏肠道屏障功能,增加肠道通透性和引起炎症反应,最终诱发炎症性肠病[4]。此外,在畜牧生产中,大肠杆菌感染会降低动物体重增加的速度和效率,增加死亡率,造成严重的经济损失[5]。长期以来抗生素被广泛用于预防和治疗大肠杆菌感染,然而,日益增长的抗生素耐药性和负面的公共卫生后果引起了全世界的关注[6]。此外,我国也已经全面停止生产含有促生长类药物饲料添加剂的商品饲粮。因此,寻找天然的抗生素替代品成为当前研究的热点。
腐殖酸(humic acids,HAs)是由泥炭和腐泥中腐烂的有机物分解转化而成,含有羧基、酚基、酮基等活性基团,具有多种药理特性[7]。作为HAs的钠盐,腐殖酸钠(sodium humate, HNa)在中国传统医学应用已有数千年的历史。HNa是一种有效的抗菌、抗炎、止泻、止血和免疫调节的药物,已被用作动物消化不良、腹泻和急性中毒的治疗[8]。体内外的毒理学研究均表明,适当剂量的HAs无毒副作用[9]。研究表明,饲粮中添加HNa可有效降低ETEC感染仔猪肠道中大肠杆菌的黏附和定植,表明其具有潜在的抗菌活性[10]。对断奶仔猪的研究表明,饲粮中添加HNa可以通过激活免疫系统和降低炎症反应缓解断奶对仔猪造成的损伤[11]。此外,本实验室前期的研究也表明,HNa在体外能有效抑制大肠杆菌的增殖[12]。以上结果为HNa对动物大肠杆菌感染的保护作用提供了证据。然而,HNa对ETEC K88感染引起肠道损伤的保护作用和相关机制尚待研究。因此,本研究旨在通过检测肠道形态、肠道屏障、肠道组织炎性小体和大肠杆菌定植等,探究HNa能否缓解ETEC K88感染引起的小鼠肠道损伤,并揭示其作用机制。
1 材料与方法 1.1 试验动物及主要试剂选取无特定病原体(SPF)级4周龄雌性昆明小鼠30只,购自辽宁长生生物有限公司,进行标准化饲养管理,饲养温度22~24 ℃,相对湿度50%~60%,室内光照12 h/12 h昼夜交替,自由采食和饮水,适应性饲养1周后进行试验。
HNa(纯度75%)由中国科学院山西煤炭化学研究所提供,成分包括75.00%的HAs(干物质基础)、20.52%的燃烧残渣(干物质基础)、14.22%的水(风干基础)和4.48%的水溶性物质(干物质基础)。主要试剂包括总RNA提取试剂盒(Promega公司,美国),苏木精-伊红(HE)染液(上海碧云天生物技术有限公司),反转录和实时荧光定量试剂盒(大连TaKaRa公司),RIPA裂解液、生物素标记兔抗鼠免疫球蛋白G(immunoglobulin G,IgG)、β-肌动蛋白(β-actin)、核因子-κB(nuclear factor kappa B,NF-κB)、核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)、半胱天冬蛋白酶-1(cysteinyl aspartate specific proteinase-1,Caspase-1)、B细胞淋巴瘤/白血病-2相关X蛋白(B-cell lymphoma/leukaemia-2-associated X protein,Bax)、B细胞淋巴瘤/白血病-2(B-cell lymphoma/leukaemia-2,Bcl-2)和白细胞介素-1β(interleukin-1β,IL-1β)抗体(沈阳万类生物科技有限公司)。闭合蛋白(Occludin)、封闭蛋白-1(Claudin-1)、闭锁小带蛋白-1(zonula occludens protein-1,ZO-1)、上皮型钙黏蛋白(epithelial cadherin,E-cadherin)、β-连环蛋白(β-catenin)、黏蛋白-2(mucin-2,MUC-2)和白细胞介素-18(interleukin-18,IL-18)抗体(北京优维宁生物科技有限公司)。
ETEC K88由本实验室保存。将ETEC K88接种于LB培养基,置于37 ℃恒温培养8 h,5 000×g离心10 min。将收集的菌体用磷酸盐缓冲液(PBS)洗3次,之后,用PBS将菌体稀释到5×1010 CFU/mL。
1.2 试验设计将30只健康小鼠随机分为3组,分别为对照组、模型组(ETEC组)和腐殖酸钠干预组(ETEC+HNa组),每组10只。参照Yu等[2]的方法进行大肠杆菌感染小鼠肠炎模型的建立。试验第1~7天,对照组和ETEC组小鼠每天灌胃0.2 mL生理盐水,ETEC+HNa组小鼠每天灌胃0.2 mL 5% HNa;试验第8天,ETEC和ETEC+HNa组小鼠灌胃0.2 mL 5×1010 CFU/mL ETEC K88,对照组小鼠灌胃0.2 mL生理盐水;试验第9~10天,ETEC+HNa组小鼠每天灌胃0.2 mL 5% HNa,对照组和ETEC组小鼠每天灌胃0.2 mL生理盐水。试验期10 d。HNa浓度参考本课题组前期的研究结果[12]。ETEC K88感染前小鼠禁食12 h,禁水4 h,ETEC K88感染前1 h,小鼠腹腔注射西咪替丁(50 mg/kg)以减少胃酸对细菌的影响。ETEC K88感染前和试验结束后分别对小鼠进行称重,分析ETEC K88感染对小鼠体重的影响。
1.3 样品采集与指标检测小鼠进行眼眶静脉丛采血,经异氟醚麻醉后,采用颈椎脱臼法处死小鼠,无菌打开腹腔,收集直肠粪便,液氮速冻后置于-80 ℃冰箱保存。分离空肠组织,用预冷的PBS进行冲洗,一部分置于4%多聚甲醛中固定,一部分放入冻存管,液氮速冻后置于-80 ℃冰箱保存。
1.3.1 病理组织学观察空肠组织预固定后,进行乙醇梯度脱水,二甲苯透明和石蜡包埋,制备3~5 μm切片,进行HE染色,在光学显微镜下观察,采用病理图像分析系统进行拍照和分析。
1.3.2 血液细胞计数和酶联免疫吸附测定(ELISA)将采集的血液一部分置于含乙二胺四乙酸(EDTA)的抗凝管,采用全自动五分类血细胞分析仪(BC-5300,深圳迈瑞生物医疗电子股份有限公司)进行血液白细胞、粒细胞、单核细胞和淋巴细胞的计数;一部分置于不含抗凝剂的离心管,经离心后收集血清;采用ELISA法进行血清白细胞介素-4(IL-4)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)、二胺氧化酶(DAO)和D-乳酸(D-Lac)含量检测,试剂盒购于江苏晶美生物科技有限公司。
1.3.3 实时荧光定量PCR(qPCR)检测各试验组随机选取6只小鼠的空肠组织用于mRNA检测。采用总RNA提取试剂盒提取RNA,根据说明书要求进行操作,采用逆转录试剂盒将提取的总RNA逆转录为cDNA,得到的cDNA用于qPCR检测空肠组织Occludin、Claudin-1、ZO-1、E-cadherin、β-catenin和MUC-2的mRNA相对表达量。qPCR引物序列见表 1。反应体系为:含酶混合物5.0 μL,ROX液0.2 μL,cDNA模板1.0 μL,上、下游引物各0.2 μL,ddH2O 3.4 μL。扩增条件为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,95 ℃ 15 s,60 ℃ 1 min,35个循环。mRNA的相对表达量采用2-ΔΔCt方法计算,β-actin为内参基因。
|
|
表 1 qPCR引物序列 Table 1 qPCR primer sequences |
称取50 mg小鼠空肠组织,使用RIPA裂解液提取空肠组织蛋白,采用BCA法检测总蛋白浓度,将蛋白样品中比例加入PAGE loading buffer,混匀后煮沸,使蛋白变性。制备分离胶和浓缩胶,依次进行电泳、转模、封闭、孵育一抗、孵育二抗和化学自发光等操作对空肠Occludin、Claudin-1、ZO-1、E-cadherin、β-catenin、MUC-2、Bax、Bcl-2、NF-κB、NLRP3、ASC、Caspase-1、IL-1β和IL-18的蛋白表达量进行检测,β-actin为内参蛋白。
1.3.5 粪便微生物菌群检测采用qPCR法检测小鼠直肠粪便中微生物菌群的组成。具体操作参考Sabat等[13]的方法。采用TIANamp Stool DNA Kit试剂盒提取直肠内容物总细菌DNA,并检测DNA的浓度和纯度。将提取的总细菌DNA分别和不同浓度大肠杆菌、双歧杆菌和乳酸菌的标准质粒进行qPCR检测,将标准质粒浓度和Ct值做回归分析,制定标准曲线。然后将样品Ct值带入回归方程计算目标菌属DNA拷贝数,结果用每克内容物中细菌拷贝数的常用对数[lg(拷贝数/g)]表示。微生物的特异性引物序列见表 2。
|
|
表 2 微生物的特异性引物序列 Table 2 Specific primer sequences for microbes |
数据用Excel 2010进行初步整理,采用SPSS 20.0软件进行统计分析,使用one-way ANOVA程序进行单因素方差分析,差异显著时以LSD法进行多重比较,P < 0.05表示差异显著。
2 结果与分析 2.1 HNa对ETEC K88感染小鼠体重的影响如图 1所示,大肠杆菌ETET K88感染后,与对照组相比,ETEC组小鼠体重显著降低(P < 0.05)。与ETEC组相比,ETEC+HNa组体重显著升高(P < 0.05),表明HNa干预缓解了ETEC K88感染引起的体重下降,促进了小鼠体重的恢复。
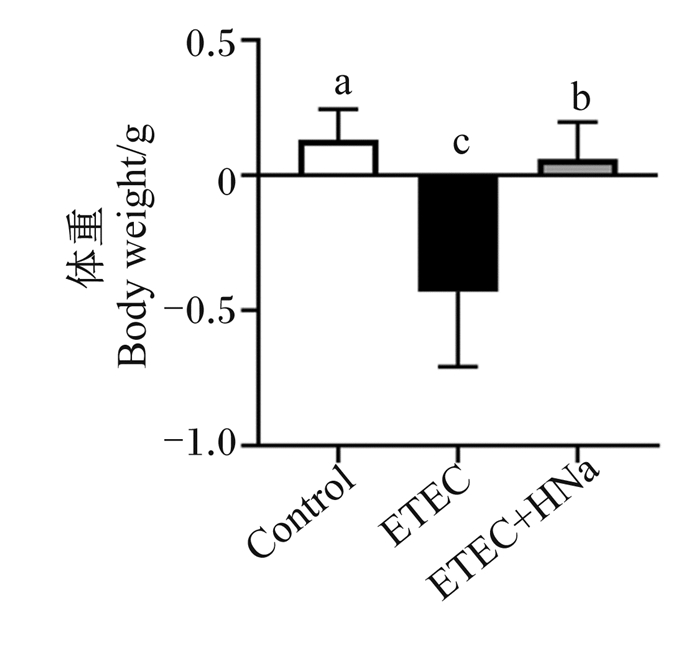
|
Control:对照组;ETEC:ETEC组;ETEC+HNa:ETEC+HNa组。数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。 Control: control group; ETEC: ETEC group; ETEC+HNa: ETEC+HNa group. Value columns with the same small letter mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 1 HNa对ETEC K88感染小鼠体重的影响 Fig. 1 Effects of HNa on body weight of ETEC K88 infected mice |
如图 2所示,ETEC K88感染后,ETEC组空肠绒毛有一定的损伤,表现为绒毛缩短和断裂。与病理组织学观察一致,与对照组相比,ETEC组空肠绒毛高度和绒毛高度/隐窝深度显著降低(P < 0.05);与ETEC组相比,ETEC+HNa组空肠绒毛高度和绒毛高度/隐窝深度显著升高(P < 0.05),表明HNa干预缓解了空肠绒毛的损伤。
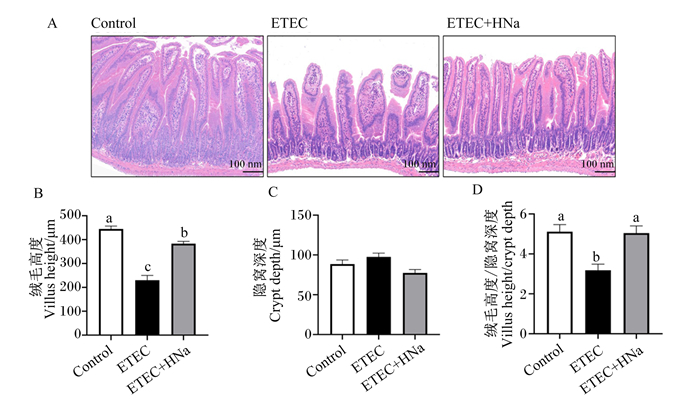
|
图 2 HNa对ETEC K88感染小鼠肠道形态的影响 Fig. 2 Effects of HNa on intestinal morphology of ETEC K88 infected mice |
由图 3可知,与对照组相比,ETEC组血液白细胞、单核细胞、粒细胞数量及血清IL-6、TNF-α、DAO、D-Lac含量显著增加(P < 0.05),血清IL-4和IL-10含量显著降低(P < 0.05)。与ETEC组相比,ETEC+HNa组血液白细胞、单核细胞、粒细胞数量及血清IL-6、TNF-α、DAO、D-Lac含量显著降低(P < 0.05),血清IL-4和IL-10含量显著增加(P < 0.05),表明HNa干预降低了小鼠血清炎症相关因子含量,增加了小鼠血清抗炎因子含量。
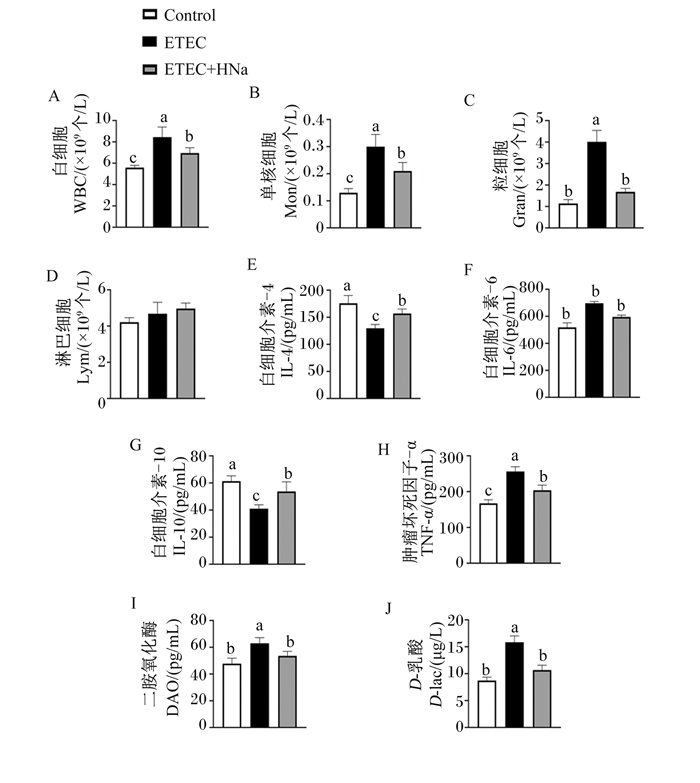
|
图 3 HNa对ETEC K88感染小鼠炎症因子的影响 Fig. 3 Effects of HNa on inflammatory cytokines of ETEC K88 infected mice |
由图 4可知,与对照组相比,ETEC组空肠Occludin、Claudin-1、E-cadherin和MUC-2的mRNA相对表达量显著降低(P < 0.05),空肠Claudin-1、ZO-1、E-cadherin、β-catenin和MUC-2的蛋白表达量也显著降低(P < 0.05)。与ETEC组相比,ETEC+HNa组空肠Occludin、Claudin-1、E-cadherin和MUC-2的mRNA相对表达量显著升高(P < 0.05),空肠Claudin-1、ZO-1、E-cadherin和MUC-2的蛋白表达量也显著升高(P < 0.05),表明HNa干预上调了部分紧密连接和黏附连接的mRNA和蛋白表达,对ETEC K88感染引起的肠道屏障损伤具有保护作用。
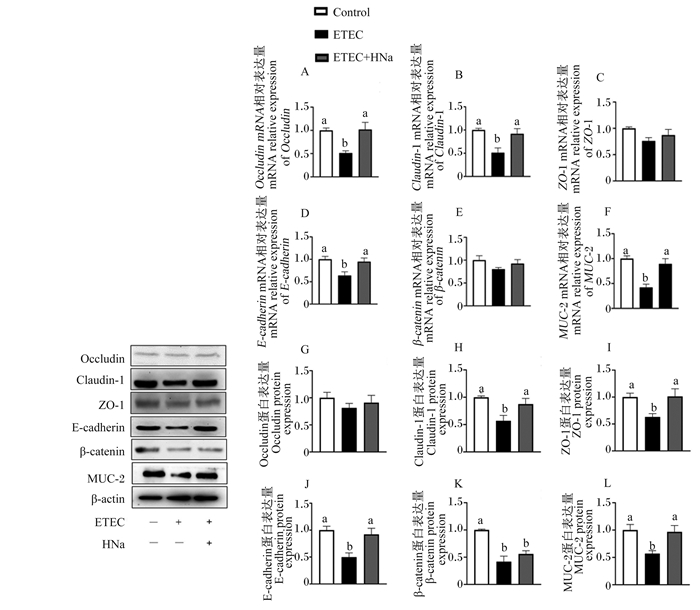
|
Occludin:闭合蛋白;Claudin-1:封闭蛋白-1;ZO-1:闭锁小带蛋白-1 zonula occludens protein-1;E-cadherin:上皮型钙黏蛋白epithelial cadherin;β-catenin:β-连环蛋白;MUC-2:黏蛋白-2 mucin-2;β-actin:β-肌动蛋白;ETEC:产肠毒素性大肠杆菌enterotoxigenic Escherichia coli;HNa:腐殖酸钠sodium humate。 -:未添加no added;+:添加added。下图同the same as below。 图 4 HNa对ETEC K88感染小鼠肠道屏障的影响 Fig. 4 Effects of HNa on intestinal barrier of ETEC K88 infected mice |
由图 5可知,与对照组相比,ETEC组空肠促细胞凋亡蛋白Bax的蛋白表达量和Bax/Bcl-2显著增加(P < 0.05),空肠抑制细胞凋亡蛋白Bcl-2的蛋白表达量显著降低(P < 0.05)。与ETEC组相比,ETEC+HNa组空肠Bax的蛋白表达量和Bax/Bcl-2显著降低(P < 0.05),空肠Bcl-2的蛋白表达量显著增加(P < 0.05),说明HNa干预逆转了小鼠肠道上皮细胞凋亡的趋势。
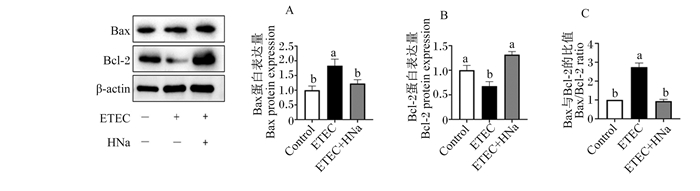
|
Bax:B细胞淋巴瘤/白血病-2相关X蛋白B-cell lymphoma/leukaemia-2-associated X protein;Bcl-2:B细胞淋巴瘤/白血病-2 B-cell lymphoma/leukaemia-2;β-肌动蛋白;ETEC:产肠毒素性大肠杆菌enterotoxigenic Escherichia coli;HNa:腐殖酸钠sodium humate。 图 5 HNa对ETEC K88感染小鼠肠道上皮细胞凋亡的影响 Fig. 5 Effects of HNa on intestinal epithelial cell apoptosis of ETEC K88 infected mice |
为了探究HNa对ETEC K88感染小鼠肠道的保护作用是否通过下调NLRP3炎性小体实现,检测了空肠NLRP3炎性小体相关蛋白的表达。由图 6可知,与对照组相比,ETEC组空肠NF-κB、NLRP3、ASC、Caspase-1、IL-1β和IL-18的蛋白表达量显著升高(P < 0.05)。与ETEC组相比,ETEC+HNa组空肠NF-κB、NLRP3、Caspase-1和IL-1β的蛋白表达量显著降低(P < 0.05),表明HNa干预抑制了ETEC K88感染对空肠NLRP3炎性小体的激活。
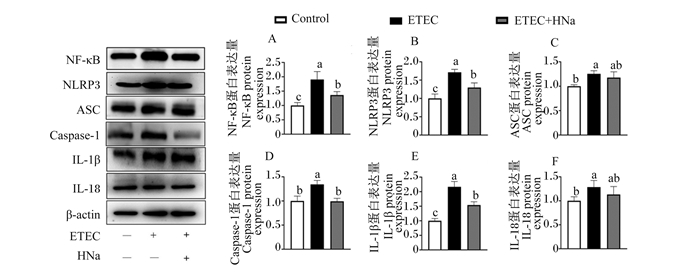
|
NF-κB:核因子-κB nuclear factor kappa B;NLRP3:核苷酸结合寡聚化结构域样受体蛋白3 nucleotide-binding oligomerization domain-like receptor protein 3;ASC:凋亡相关斑点样蛋白apoptosis-associated speck-like protein containing a CARD;Caspase-1:半胱天冬蛋白酶-1(cysteinyl aspartate specific proteinase-1;IL-1β:白细胞介素-1β interleukin-1β;IL-18:白细胞介素-18 interleukin-18;β-肌动蛋白;ETEC:产肠毒素性大肠杆菌enterotoxigenic Escherichia coli;HNa:腐殖酸钠sodium humate。 图 6 HNa对ETEC K88感染小鼠肠道NLRP3炎性小体的影响 Fig. 6 Effects of HNa on intestinal NLRP3 inflammasome of ETEC K88 infected mice |
由图 7可知,与对照组相比,ETEC组粪便大肠杆菌数量显著增加(P < 0.05),而乳酸菌数量则显著降低(P < 0.05)。与ETEC组相比,ETEC+HNa组粪便大肠杆菌数量显著降低(P < 0.05),表明HNa干预降低了小鼠肠道大肠杆菌的增殖。
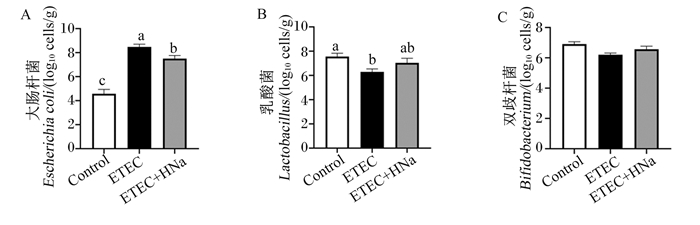
|
图 7 HNa对ETEC K88感染小鼠粪便微生物菌群的影响 Fig. 7 Effects of HNa on fecal microflora of ETEC K88 infected mice |
ETEC是一种常见的环境病原体,可导致新生儿和幼畜急性水样腹泻,并伴有发烧、呕吐和脱水[16]。研究表明,大肠杆菌感染是导致动物生长性能降低和死亡率升高的主要原因之一[5]。因此,在本研究中,我们探究了HNa对ETEC K88感染小鼠的保护作用及相关机制。本研究的结果表明,ETEC K88感染会引起小鼠体重的显著下降,而HNa干预则缓解了小鼠体重下降的这一趋势。完整的肠道结构对于维持肠道屏障功能至关重要。研究发现,大肠杆菌感染后通过黏附素定殖于肠道上皮细胞进行繁殖并分泌肠毒素,破坏肠道结构,引起肠道绒毛的萎缩和断裂[17]。本研究发现,ETEC K88感染后小鼠空肠绒毛稀疏、萎缩和断裂,此外,空肠绒毛高度和绒毛高度/隐窝深度也显著降低。这表明ETEC K88感染导致了严重的肠道损伤。HNa干预则有效缓解了ETEC K88感染引起的小鼠肠道结构的损伤。Yasar等[18]研究也表明,喂服HAs可以通过提高大鼠回肠绒毛高度和降低隐窝深度改善肠道形态,促进营养物质的吸收,提高生长性能。为了进一步探究HNa对肠道的保护作用,我们分析了肠道上皮细胞紧密连接、黏附连接和MUC-2的mRNA和蛋白表达。
肠道屏障是抵御病原体和毒素侵袭的重要功能性屏障,紧密连接、黏附连接和黏蛋白是肠道屏障的重要组成部分,肠道紧密连接主要包括Claudin-1、ZO-1和Occludin,黏附连接主要包括E-cadherin和β-catenin[19]。之前的研究表明,大肠杆菌黏附于肠道上皮细胞会损伤肠道黏液层,降低紧密连接和黏附连接的蛋白表达,破坏黏膜屏障结构,增加肠道通透性[4]。与之前的研究一致,本研究结果表明,ETEC K88感染显著下调了小鼠空肠Occludin、Claudin-1、E-cadherin和MUC-2的mRNA和蛋白表达。血清DAO和D-Lac是肠上皮细胞成熟、完整和功能状态的重要标志物,其在血清中的含量与肠道通透性呈正相关[20]。因此,我们进一步检测了血清DAO和D-Lac含量,结果表明,ETEC组小鼠血清DAO和D-Lac含量显著高于其他各组。研究发现,HNa能通过增加腹泻仔猪空肠紧密连接蛋白的表达,改善肠道屏障功能,进而降低腹泻率[21]。对断奶仔猪[10]的研究也表明,饲粮中添加HNa可降低血清DAO和D-Lac含量,增加肠道屏障功能,降低肠道通透性,这与本试验结果一致。因此,以上的研究均表明HNa可以有效缓解ETEC K88感染引起的小鼠肠道屏障结构的损伤。此外,有研究发现,ETEC释放的肠毒素会引起肠道上皮细胞凋亡[16]。我们通过分析促细胞凋亡蛋白Bax和抑制细胞凋亡蛋白Bcl-2的蛋白表达进一步探究了HNa能否缓解ETEC K88感染引起的肠道上皮细胞凋亡,结果表明,HNa显著下调了Bax和上调了Bcl-2的蛋白表达,进一步证实了HNa可以通过上调肠道紧密连接和黏附连接相关蛋白的表达以及抑制肠道上皮细胞凋亡来改善ETEC K88感染引起的小鼠肠道屏障的损伤。
ETEC K88黏附于肠道黏膜会激活免疫细胞并产生细胞因子,在调节炎症过程中发挥重要作用[22]。促炎因子如IL-6和TNF-α是响应ETEC K88感染的重要指标[23]。本研究发现,ETEC K88感染显著增加了小鼠血液白细胞、粒细胞、单核细胞数量和血清IL-6、TNF-α含量。炎性小体主要由模式识别受体(pattern recognition receptor,PRR)、Caspase-1和ASC组成,是参与天然免疫反应的多蛋白复合物[24]。NLRP3炎性小体是核苷酸结合寡聚化结构域样受体(NLR)家族中具有代表性的炎性小体,在细胞监视、防御、识别病原体和炎症的发生发展中起着至关重要的作用[25]。NLRP3炎性小体的活化依赖双信号模式:1)启动信号,NLRP3炎性小体受Toll样受体(TLR)激动剂或某些细胞因子被刺激后,通过NF-κB通路启动NLRP3和白细胞介素-1β前体(pro-IL-1β)等前体蛋白的转录和表达;2)激活信号,病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)和宿主来源的危险信号分子模式(danger-associated molecular patterns,DAMPs)参与介导,推动NLRP3炎性小体的组成和激活,当NLRP3被激活后,可以将Caspase-1裂解为有活性的Caspase-1,活化的Caspase-1将白细胞介素前体如pro-IL-1β、白细胞介素-18前体(pro-IL-18)等进行分解剪切,促进炎症细胞因子的成熟和分泌,从而引起炎症反应[26-27]。研究表明,大肠杆菌黏附于肠黏膜可以直接或者通过NF-κB信号通路间接激活NLRP3炎性小体,引起肠道炎症反应[28]。本研究的结果表明,ETEC K88感染通过上调NF-κB的蛋白表达激活了NLRP3炎性小体,增加了促炎因子IL-1β和IL-18的成熟和分泌,加剧了肠道炎症反应。Brandts等[29]对欧洲鲈鱼的研究发现,HNa具有抗炎和免疫调节的特性,推测可能与其富含酚羟基、羧基、巯基和羰基等活性基团有关。本研究也表明,HNa有效抑制了NLRP3炎性小体的激活,降低了促炎因子IL-1β的分泌,增加了抗炎因子IL-4和IL-10的分泌。因此,我们推测HNa缓解肠道损伤的机制与其抑制肠道组织炎性小体的激活和炎症反应密切相关。
稳定的肠道微生物群在维持肠道健康、调节肠道免疫应答、保护宿主免受病原体侵害等方面发挥着关键作用[30]。大肠杆菌感染可扰乱肠道微生物群的稳态,破坏肠道微环境[6]。研究表明,HNa会通过改变大肠杆菌细胞膜通透性、抑制对数生长期的细胞分裂、使细胞内部出现空泡等抑制大肠杆菌生长[31]。研究表明,饲粮中添加HNa降低了大肠杆菌感染仔猪的腹泻率和死亡率,改变了肠道微生物组成,降低了肠道致病性大肠杆菌的丰度,增加了乳酸菌的丰度[10]。对肉仔鸡的研究也表明,饲粮中添加腐殖质增加了肠道有益菌群的丰度,减少了肠道寄生虫的增殖[32]。为了进一步验证HNa对大肠杆菌的抑制作用,我们分析了各组小鼠粪便中大肠杆菌数量,发现ETEC+HNa组小鼠粪便大肠杆菌数量显著低于ETEC组,表明HNa有效抑制了大肠杆菌的增殖。由于HNa具有很强的吸附能力,因此,除了抑制大肠杆菌增殖外还可以有效吸附大肠杆菌产生的毒素,减轻肠道损伤。
4 结论本试验条件下,HNa可以通过抑制肠道组织炎性小体的激活、肠道上皮细胞凋亡、大肠杆菌定殖以及上调肠道紧密连接、黏附连接和MUC-2的mRNA和蛋白表达等途径缓解ETEC K88感染引起的小鼠肠道损伤。
| [1] |
JANG J, HUR H G, SADOWSKY M J, et al. Environmental Escherichia coli: ecology and public health implications—a review[J]. Journal of Applied Microbiology, 2017, 123(3): 570-581. DOI:10.1111/jam.13468 |
| [2] |
YU H T, WANG Y M, ZENG X F, et al. Therapeutic administration of the recombinant antimicrobial peptide microcin J25 effectively enhances host defenses against gut inflammation and epithelial barrier injury induced by enterotoxigenic Escherichia coli infection[J]. The FASEB Journal, 2020, 34(1): 1018-1037. DOI:10.1096/fj.201901717R |
| [3] |
VIENNOIS E, BRETIN A, DUBÉ P E, et al. Dietary emulsifiers directly impact adherent-invasive E.coli gene expression to drive chronic intestinal inflammation[J]. Cell Reports, 2020, 33(1): 108229. DOI:10.1016/j.celrep.2020.108229 |
| [4] |
REN W K, YIN J, XIAO H, et al. Intestinal microbiota-derived GABA mediates interleukin-17 expression during enterotoxigenic Escherichia coli infection[J]. Frontiers in Immunology, 2016, 7: 685. |
| [5] |
BECKER S L, LI Q Y, BURROUGH E R, et al. Effects of an F18 enterotoxigenic Escherichia coli challenge on growth performance, immunological status, and gastrointestinal structure of weaned pigs and the potential protective effect of direct-fed microbial blends[J]. Journal of Animal Science, 2020, 98(5): skaa113. DOI:10.1093/jas/skaa113 |
| [6] |
ZHANG H W, HUA R, ZHANG B X, et al. Cathelicidin-derived PR39 protects enterohemorrhagic Escherichia coli O157∶H7 challenged mice by improving epithelial function and balancing the microbiota in the intestine[J]. Scientific Reports, 2019, 9(1): 9456. DOI:10.1038/s41598-019-45913-6 |
| [7] |
PAVLOVSKA I, KLAVINA A, AUCE A, et al. Assessment of sapropel use for pharmaceutical products according to legislation, pollution parameters, and concentration of biologically active substances[J]. Scientific Reports, 2020, 10(1): 21527. DOI:10.1038/s41598-020-78498-6 |
| [8] |
JI Y Y, ZHANG A J, CHEN X B, et al. Sodium humate accelerates cutaneous wound healing by activating TGF-β/Smads signaling pathway in rats[J]. Acta Pharmaceutica Sinica B, 2016, 6(2): 132-140. DOI:10.1016/j.apsb.2016.01.009 |
| [9] |
MURBACH T S, GLÁVITS R, ENDRES J R, et al. A toxicological evaluation of a fulvic and humic acids preparation[J]. Toxicology Reports, 2020, 7: 1242-1254. DOI:10.1016/j.toxrep.2020.08.030 |
| [10] |
KAEVSKA M, LORENCOVA A, VIDENSKA P, et al. Effect of sodium humate and zinc oxide used in prophylaxis of post-weaning diarrhoea on faecal microbiota composition in weaned piglets[J]. Veterinární Medicína, 2016, 61(6): 328-336. |
| [11] |
WANG Q, YING J F, ZOU P, et al. Effects of dietary supplementation of humic acid sodium and zinc oxide on growth performance, immune status and antioxidant capacity of weaned piglets[J]. Animals, 2020, 10(11): 2104. DOI:10.3390/ani10112104 |
| [12] |
王栋, 金圣子, 杜垣逸, 等. 牛源致病性大肠杆菌的敏感药物筛选及腐殖酸钠的抑菌试验[J]. 中国畜牧兽医, 2020, 47(10): 3361-3370. WANG D, JIN S Z, DU Y Y, et al. Screening of sensitive drugs for bovine pathogenic Escherichia coli and bacteriostatic test of sodium humate[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(10): 3361-3370 (in Chinese). |
| [13] |
SABAT G, ROSE P, HICKEY W J, et al. Selective and sensitive method for PCR amplification of Escherichia coli 16S rRNA genes in soil[J]. Applied and Environmental Microbiology, 2000, 66(2): 844-849. DOI:10.1128/AEM.66.2.844-849.2000 |
| [14] |
CLEUSIX V, LACROIX C, DASEN G, et al. Comparative study of a new quantitative real-time PCR targeting the xylulose-5-phosphate/fructose-6-phosphate phosphoketolase bifidobacterial gene (xfp) in faecal samples with two fluorescence in situ hybridization methods[J]. Journal of Applied Microbiology, 2010, 108(1): 181-193. DOI:10.1111/j.1365-2672.2009.04408.x |
| [15] |
WANG W, CHEN L P, ZHOU R, et al. Increased proportions of Bifidobacterium and the Lactobacillus group and loss of butyrate-producing bacteria in inflammatory bowel disease[J]. Journal of Clinical Microbiology, 2014, 52(2): 398-406. DOI:10.1128/JCM.01500-13 |
| [16] |
LEDWABA S E, COSTA D V S, BOLICK D T, et al. Enteropathogenic Escherichia coli infection induces diarrhea, intestinal damage, metabolic alterations, and increased intestinal permeability in a murine model[J]. Frontiers in Cellular and Infection Microbiology, 2020, 10: 595266. DOI:10.3389/fcimb.2020.595266 |
| [17] |
WANG Y Y E, ZOU Y, WANG J, et al. The protective effects of 2'-fucosyllactose against E. coli O157 infection are mediated by the regulation of gut microbiota and the inhibition of pathogen adhesion[J]. Nutrients, 2020, 12(5): 1284. DOI:10.3390/nu12051284 |
| [18] |
YASAR S, GOKCIMEN A, ALTUNTAS I, et al. Performance and ileal histomorphology of rats treated with humic acid preparations[J]. Journal of Animal Physiology and Animal Nutrition, 2002, 86(7/8): 257-264. |
| [19] |
CHEN S B, LIU H B, LI Z J, et al. Epithelial PBLD attenuates intestinal inflammatory response and improves intestinal barrier function by inhibiting NF-κB signaling[J]. Cell Death & Disease, 2021, 12(6): 563. |
| [20] |
LIU Y L, XU Q, WANG Y, et al. Necroptosis is active and contributes to intestinal injury in a piglet model with lipopolysaccharide challenge[J]. Cell Death & Disease, 2021, 12(1): 62. |
| [21] |
TRCKOVA M, LORENCOVA A, HAZOVA K, et al. Prophylaxis of post-weaning diarrhoea in piglets by zinc oxide and sodium humate[J]. Veterinární Medicína, 2015, 60(7): 351-360. |
| [22] |
CLEMENTS A, YOUNG J C, CONSTANTINOU N, et al. Infection strategies of enteric pathogenic Escherichia coli[J]. Gut Microbes, 2012, 3(2): 71-87. DOI:10.4161/gmic.19182 |
| [23] |
QIAO J Y, SUN Z Y, LIANG D M, et al. Lactobacillus salivarius alleviates inflammation via NF-κB signaling in ETEC K88-induced IPEC-J2 cells[J]. Journal of Animal Science and Biotechnology, 2020, 11: 76. DOI:10.1186/s40104-020-00488-5 |
| [24] |
BAUER C, DUEWELL P, MAYER C, et al. Colitis induced in mice with dextran sulfate sodium (DSS) is mediated by the NLRP3 inflammasome[J]. Gut, 2010, 59(9): 1192-1199. DOI:10.1136/gut.2009.197822 |
| [25] |
LIU L, DONG Y, YE M, et al. The pathogenic role of NLRP3 inflammasome activation in inflammatory bowel diseases of both mice and humans[J]. Journal of Crohn's & Colitis, 2017, 11(6): 737-750. |
| [26] |
NIU X F, ZANG L L, LI W Q, et al. Anti-inflammatory effect of yam glycoprotein on lipopolysaccharide-induced acute lung injury via the NLRP3 and NF-κB/TLR4 signaling pathway[J]. International Immunopharmacology, 2020, 81: 106024. DOI:10.1016/j.intimp.2019.106024 |
| [27] |
ZHEN Y, ZHANG H. NLRP3 inflammasome and inflammatory bowel disease[J]. Frontiers in Immunology, 2019, 10: 276. DOI:10.3389/fimmu.2019.00276 |
| [28] |
CROXEN M A, FINLAY B B. Molecular mechanisms of Escherichia coli pathogenicity[J]. Nature Reviews Microbiology, 2010, 8(1): 26-38. DOI:10.1038/nrmicro2265 |
| [29] |
BRANDTS I, BALASCH J C, GONÇALVES A P, et al. Immuno-modulatory effects of nanoplastics and humic acids in the European seabass (Dicentrarchus labrax)[J]. Journal of Hazardous Materials, 2021, 414: 125562. DOI:10.1016/j.jhazmat.2021.125562 |
| [30] |
FUJIWARA H, DOCAMPO M D, RIWES M, et al. Microbial metabolite sensor GPR43 controls severity of experimental GVHD[J]. Nature Communications, 2018, 9(1): 3674. DOI:10.1038/s41467-018-06048-w |
| [31] |
娜仁高娃, 安晓萍, 齐景伟, 等. 腐殖酸钠对大肠杆菌的抑制作用研究[J]. 中国畜牧兽医, 2014, 41(8): 228-231. NARENGAOWA, AN X P, QI J W, et al. Study on bacteriostatic action of sodium humate on Escherichia coli[J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(8): 228-231 (in Chinese). |
| [32] |
DOMÍNGUEZ-NEGRETE A, GÓMEZ-ROSALES S, ANGELES M D L, et al. Effect of the addition of humic substances as growth promoter in broiler chickens under two feeding regimens[J]. Animals, 2019, 9(12): 1101. DOI:10.3390/ani9121101 |




