2. 国家水禽产业技术体系营养与饲料功能研究室, 青岛 266109;
3. 山东省食品质量安全控制工程技术研究中心, 青岛 266109;
4. 青岛市食品质量安全风险评估工程研究中心, 青岛 266109
2. Nutrition and Feed Function Laboratory of National Waterfowl Industrial Technical System, Qingdao 266109, China;
3. Shandong Food Quality and Safety Control Engineering Technology Research Center, Qingdao 266109, China;
4. Qingdao Food Quality Safety Risk Assessment Engineering Research Center, Qingdao 266109, China
油脂可以为人类提供能量、必需脂肪酸和脂溶性维生素,是人类食物的基本成分,是一种重要的营养素[1]。近几年来,我国患肥胖及相关代谢性疾病的人数迅速上升,其中油脂的摄入过量是造成这类现象的重要因素之一。与此同时,宠物犬、猫肥胖也已经成为全球日益严重的问题,影响宠物的生长和繁殖,引发疾病,减少宠物的寿命,然而许多宠物主人没有意识到他们的宠物超重和健康风险。在我们日常饮食中所用的油脂以含有12个以上碳原子的长链脂肪酸(LCFAs)构成的长链不饱和甘油三酯(LCTs)为主[2],摄入过多会增加血液中甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)及低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)含量,最终导致心脑血管疾病、肥胖症、脂肪肝、癌症等慢性病的发生[3]。
甘油二酯结构与TG相似,但代谢和消化途径不同,甘油二酯是油脂的天然成分,也是油脂在体内代谢的中间产物。甘油二酯具有安全营养、加工适应性好、人体相容性高等优点,是以食用油为原料制备的一类多功能添加剂,有关研究表明其具有良好的降低血脂、减轻体重、减少体脂等作用,而且食用安全,因而受到广泛关注[4]。甘油二酯代替食用油不仅符合人们对低热量健康食品的要求,而且不影响食用口感,还能够有效抑制体重增加。周君[5]证明了甘油二酯具有减少内脏脂肪、降低血脂以及控制体重增加等功能。Takatoshi等[6]发现甘油二酯能够减少小鼠体内脂肪积聚,从而起到控制体重增长的作用。Tomonobu等[7]发现甘油二酯有改善餐后血脂的功效。Soni等[8]、Ijiri等[9]及Chengelis等[10]对甘油二酯的毒性及致癌性的研究发现,甘油二酯对人体是安全的,不增加人体患癌风险。
脂质是机体内进行各种稳态、生理和细胞过程所必需的重要成分[11]。人体许多重大健康问题都是脂质代谢失调导致的,如肥胖和非酒精性脂肪肝。脂质组学是一种新型的组学策略,可以在分子水平上测定脂质组成和鉴定脂质生物标志物来研究脂质代谢。通过对各种脂质进行全面、系统的定量分析,来确定脂类作为信号分子的作用及其对代谢途径的调控,阐明物质与代谢之间的相互作用[12]。
本研究利用鸭油、鸭油甘油二酯对肥胖大鼠进行灌胃处理,通过对大鼠的体重、体脂、血清生化指标、脂质代谢组学等指标测定分析,研究鸭油甘油二酯对肥胖模型大鼠体重、脂肪沉积量和脂质代谢指标的影响,探索鸭油甘油二酯对大鼠机体脂肪沉积规律和代谢机理,为进一步探明鸭油甘油二酯降脂功能提供科学依据,为鸭油产品的深度开发提供技术支撑。
1 材料与方法 1.1 试验材料和仪器鸭油(从超市购买),鸭油甘油二酯(按照专利号ZL201610061434.1方法进行制备,纯度达到86%)。TC、TG、LDL-C、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)含量测定试剂盒购于南京建成生物工程研究所。主要仪器包括高速离心机、电子分析天平、皮尺、注射器、分光光度计、离心浓缩仪、涡旋混合器、超声清洗仪等。
1.2 试验设计与方法试验选择80只体重相近的4周龄雄性SD大鼠,经过7 d适应期饲养后,进行2个阶段试验。造模阶段:将80只大鼠随机分为2个组,对照组每组4个重复,每个重复5只;造模组每组12个重复,每个重复5只。对照组大鼠自由采食基础饲粮,造模组大鼠自由采食脂肪含量为60%的高脂饲粮,连续饲养28 d。修复干预阶段:将造模组中60只肥胖大鼠随机分为3组(模型对照组、鸭油组、鸭油甘油二酯组),每组4个重复,每个重复5只。模型对照组以2 mL蒸馏水灌胃,每天灌胃1次,用高脂饲粮连续喂养30 d;鸭油组和鸭油甘油二酯组分别用2 mL鸭油和2 mL鸭油甘油二酯进行灌胃,每天灌胃1次,用基础饲粮连续喂养30 d;对照组以2 mL蒸馏水灌胃,每天灌胃1次,用基础饲粮连续喂养30 d。试验设计见表 1。
|
|
表 1 试验设计 Table 1 Experiment design |
试验饲粮均购于北京某饲料有限公司,试验饲粮组成及营养水平见表 2。
|
|
表 2 基础饲粮和高脂饲粮组成及营养水平(风干基础) Table 2 Composition and nutrient levels of basal diet and high-fat diet (air-dry basis) |
试验期间,大鼠自由采食、饮水(去离子水),室内温度(22±2) ℃,相对湿度(55±5)%,室内通风良好。每天观察大鼠的精神状态,记录采食量和饮水量,并且每周称量1次体重。
1.4 样品采集和指标测定试验结束后,对大鼠禁食24 h后,测量体重、体长,计算Lee’s指数,对每组的大鼠进行取样分析。采取眼球取血,3 000 r/min离心10 min,取血清-80 ℃保存。严格按照试剂盒说明书操作步骤,检测血清TG、TC、HDL-C、LDL-C含量。脊椎脱臼法处死大鼠后,分离肝脏、心脏、脾脏、肾脏、睾丸等器官,置于冷生理盐水中洗净后用滤纸吸干其表面液体进行称重,计算肝体比、心体比、脾体比、肾体比、睾体比。相关计算公式如下:
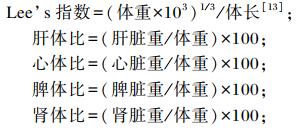
|
将称量后的肝脏取肝尖部位存放于冻存管中,用液氮速冻,-80 ℃保存。肝脏脂质代谢组学测定:从肝脏中提取总脂,参考Feng等[12]的方法。数据采集仪器系统主要包括超高效液相色谱(ultra performance liquid chromatography,UPLC)和串联质谱(tandem mass spectrometry,MS/MS),分析条件和详细的工作参数参考Feng等[12]。
1.5 数据分析试验数据采用Origin 8.6和SPSS 17.0软件,采用单因素方差分析(one-way ANOVA)和LSD法进行差异显著性分析,试验数据用平均值±标准差表示,P>0.05为差异不显著,P < 0.05为差异显著,P < 0.01为差异极显著。
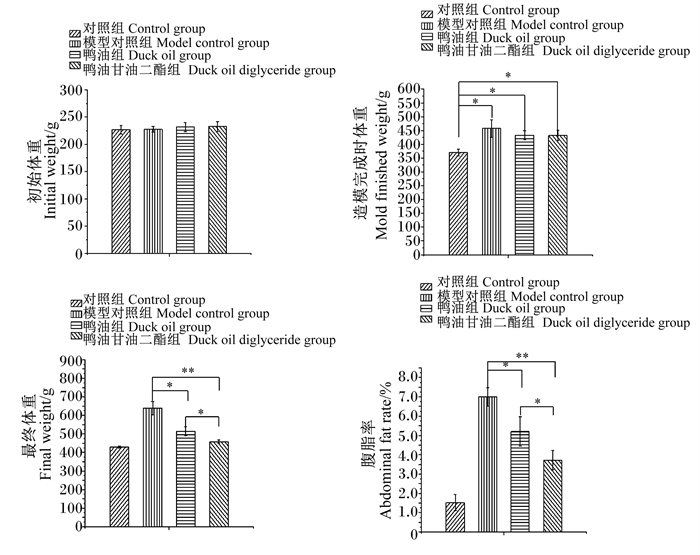
2 结果与分析 2.1 鸭油甘油二酯对肥胖大鼠体重和体脂的影响从图 1可以看出,各组之间大鼠初始体重无显著差异(P>0.05)。造模完成时,与对照组相比,其他各组的体重显著升高(P<0.05),表明造模成功。试验结束时,与模型对照组相比,鸭油组最终体重显著降低(P<0.05),鸭油甘油二酯组最终体重极显著降低(P<0.01);与鸭油组相比,鸭油甘油二酯组最终体重显著降低(P<0.05)。与模型对照组相比,鸭油组腹脂率显著降低(P<0.05),鸭油甘油二酯组腹脂率极显著降低(P<0.01);与鸭油组相比,鸭油甘油二酯组腹脂率显著降低(P<0.05)。以上结果表明,鸭油甘油二酯可以控制大鼠体重增长,降低体脂率。
|
*表示差异显著(P<0.05),* *表示差异极显著(P<0.01)。下图同。 * represents significant difference (P < 0.05), * * represents extremely significant difference (P < 0.01). The same as below. 图 1 肥胖大鼠的体重和体脂 Fig. 1 Body weight and body fat of obese rats |
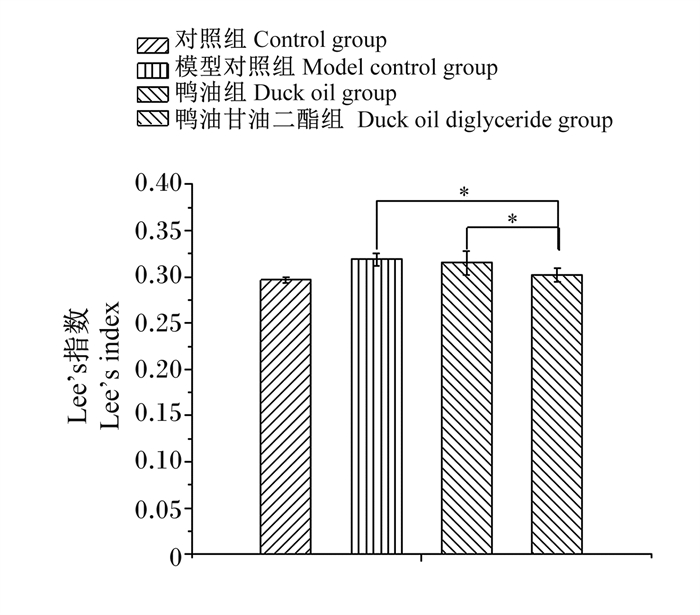
从图 2可以看出,与模型对照组相比,鸭油组Lee’s指数无显著差异(P>0.05),鸭油甘油二酯组Lee’s指数显著降低(P<0.05);与鸭油组相比,鸭油甘油二酯组Lee’s指数显著降低(P<0.05)。以上结果表明,鸭油甘油二酯对Lee’s指数有影响,可以控制体型发育。
|
图 2 肥胖大鼠Lee’s指数 Fig. 2 Lee's index of obese rats |
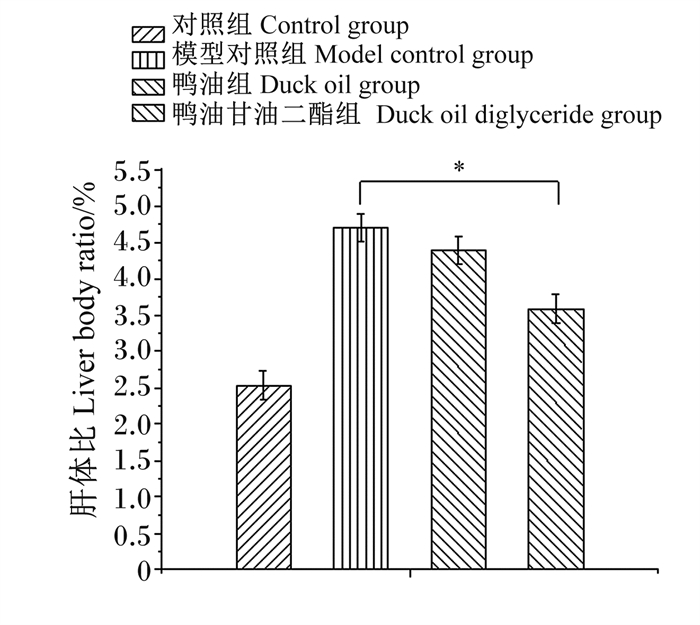
从图 3可以看出,与模型对照组相比,鸭油组肝体比无显著差异(P>0.05),鸭油甘油二酯组肝体比显著升高(P<0.05)。从表 3可以看出,与模型对照组相比,鸭油组和鸭油甘油二酯组心体比、脾体比、肾体比、睾体比无显著差异(P>0.05)。以上结果表明,鸭油甘油二酯对心脏、脾脏、肾脏、睾丸等器官生长发育不会产生影响,安全性好;鸭油甘油二酯避免了肝脏的肥大。
|
图 3 肥胖大鼠肝体比 Fig. 3 Liver body ratio of obese rats |
|
|
表 3 肥胖大鼠脏体比 Table 3 Visceral body ratio of obese rats |
从图 4可以看出,模型对照组的大鼠出现血脂异常,其血清TG、TC、LDL-C含量较对照组显著升高(P<0.05),血清HDL-C含量有所降低(P>0.05)。与模型对照组相比,鸭油甘油二酯组血清TG、TC含量极显著降低(P<0.01),血清LDL-C含量显著降低(P<0.05),血清HDL-C含量差异不显著(P>0.05)。与鸭油组相比,鸭油甘油二酯组血清TG、TC、LDL-C含量显著降低(P<0.05),血清HDL-C含量差异不显著(P>0.05)。以上结果表明,鸭油甘油二酯能够降低大鼠血清TC、TG、LDL含量,提高血清HDL-C含量,降低血脂水平,从而维护脂类代谢正常进行。
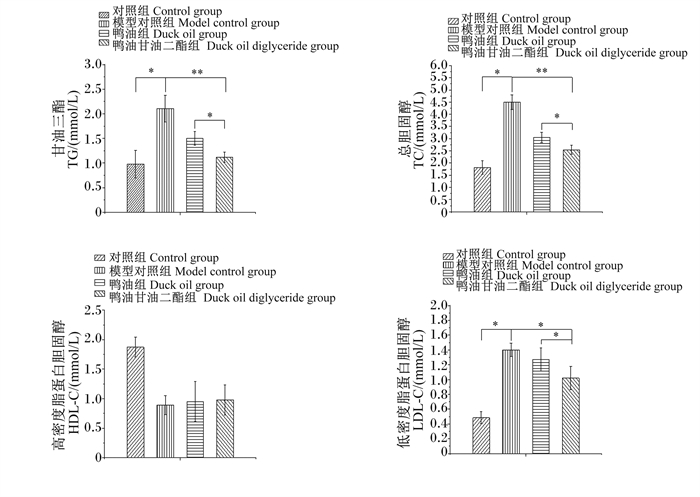
|
图 4 肥胖大鼠的血清生化指标 Fig. 4 Serum biochemical indexes of obese rats |
为了进一步研究鸭油甘油二酯对肥胖大鼠脂质代谢的影响,本试验基于脂质组学方法分析了脂质组成的差异。从图 5-A和图 5-B可以看出,对照组和模型对照组之间分离,而模型对照组和鸭油甘油二酯组分离,这表明鸭油甘油二酯的补充改善了脂质代谢的紊乱。为了寻找差异代谢物,采用正交偏最小二乘判别分析(OPLS-DA)提取自变量(X)和因变量(Y)中的成分,然后计算各成分之间的相关性,获得了多元OPLS-DA模型,其验证参数分别为对照组和模型对照组的适合度(R2X=0.726和R2Y=1.000)和可预测性(Q2=0.960)、模型对照组和鸭油甘油二酯组的适合度(R2X=0.643和R2Y=0.996)和可预测性(Q2=0.792)。结果表明,OPLS-DA模型具有良好的拟合度,可作为一种预测模型,用于全面评估脂质组学特征的变化。在对照组和模型对照组以及模型对照组和鸭油甘油二酯组(图 5-C和图 5-D)中观察到OPLS-DA评分图的清晰分离,以上结果表明模型对照组的脂质代谢紊乱,但可通过鸭油甘油二酯的添加减弱脂质代谢紊乱。
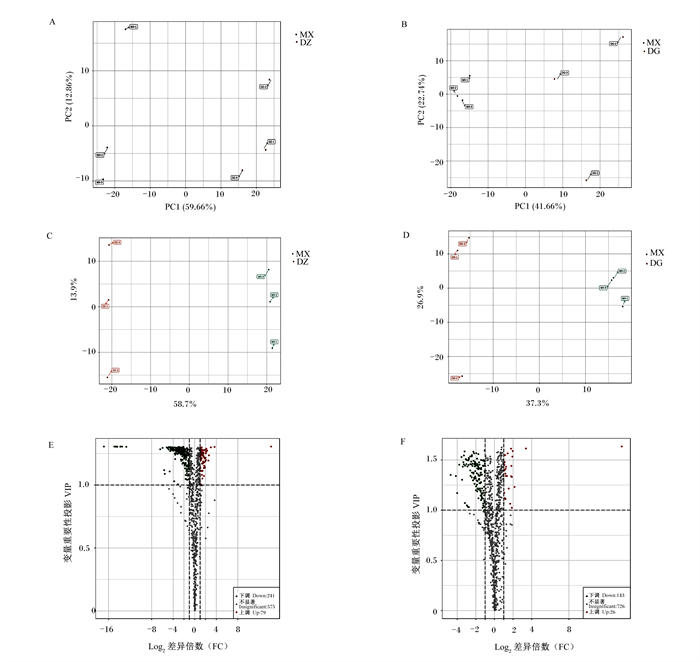
|
DZ:对照组control group;MX:模型对照组model control group;DG:鸭油甘油二酯组duck oil diglyceride group。下图同the same as below。 图A、图B:主成分分析。PC1表示第1主成分,PC2表示第2主成分。图C、图D:正交偏最小二乘判别分析。横坐标表示预测成分得分值,横坐标方向可以看出组间的差距;纵坐标表示正交成分得分值,纵坐标方向可以看出组内的差距。图E、图F:火山分析。图中的每1个点表示1种代谢物,其中绿色的点代表下调差异代谢物,红色的点代表上调差异代谢物,灰色的点代表检测到但差异不显著的代谢物;横坐标表示某代谢物在2组样品中相对含量差异倍数的对数值(log2FC),横坐标绝对值越大,说明该物质在2组样品间的相对含量差异越大。 Figure A and figure B: principal component analysis. PC1 represents the first principal component, PC2 represents the second principal component. Figure C and figure D: orthogonal partial least squares discriminant analysis. The abscissa represents the prediction component score value, the abscissa direction can see the gap between groups; the ordinate represents the orthogonal component score value, the ordinate direction can see the gap within groups. Figure E and figure F: volcano analysis. Figure each point represents a metabolite, in which the green point represents the down-regulated differential metabolite, the red point represents the up-regulated differential metabolite, and the gray point represents the metabolite detected but not significantly different; the abscissa represents a metabolite in the two the logarithmic value (log2FC) of the relative content difference between the two groups of samples, the larger the absolute value of the abscissa, the greater the relative content difference of the substance between the two groups of samples. 图 5 对照组与模型对照组、模型对照组与鸭油甘油二酯组的脂类差异 Fig. 5 Lipid differences between control group and model control group, and between model control group and duck oil diglyceride group |
如火山分析图所示(图 5-E和图 5-F),筛选出不同的脂质生物标记候选物。使用差异倍数(FC)≥2或≤0.5和变量重要性投影(VIP)≥1的标准,模型对照组与对照组相比,2组之间检测出320种差异代谢物,其中上调了79种代谢产物,下调了241种代谢产物。模型对照组与鸭油甘油二酯组相比,2组之间检测出169种差异代谢物,其中上调了26种代谢产物,下调了143种代谢产物。其中,显著(P<0.05)下调的脂类主要集中在甘油脂类。
为了进一步研究脂质生物标志物是否与鸭油甘油二酯的生物活性相关,对脂质组成的差异进行分析。在肝脏组织中共鉴定出895种脂类代谢物,其中包括249种TG,70种甘油二酯,24种游离脂肪酸(FFA),28种神经酰胺(CER),21种胆固醇酯(CE),106种磷脂酰胆碱(PC),114种磷脂酰乙醇胺(PE)和其他物质。从图 6-A可以看出,模型对照组的肝脏TG、甘油二酯、FFA、CE、酰基肉碱(CAR)、油菜素甾醇脂(CASE)含量显著升高(P < 0.05),表明大鼠的脂质代谢严重紊乱。从图 6-B可以看出,甘油二酯组的肝脏TG、PC、CE、甘油二酯、CAR、溶血磷脂酰胆碱(LPC)和FFA含量显著降低(P < 0.05)。由此可见,高脂饲粮引起的脂质代谢紊乱在鸭油甘油二酯治疗后得到部分改善。
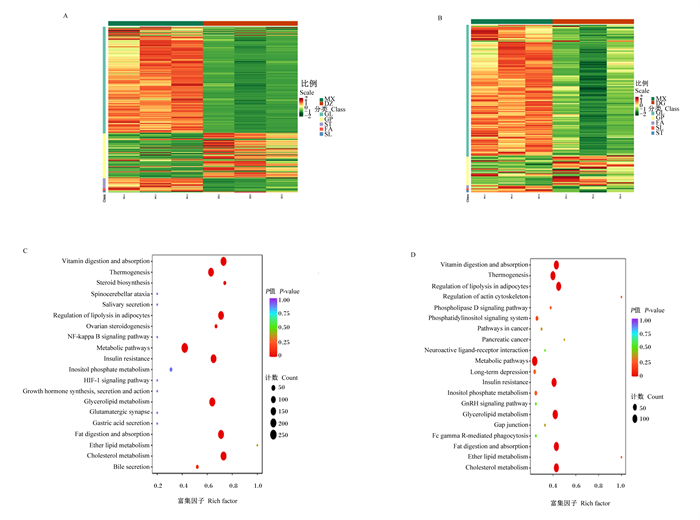
|
GL:甘油脂类glycerolipids;GP:甘油磷脂类glycerophospholipids;ST:甾醇脂类sterol lipids;FA:脂肪酰类fatty acyl;SL:鞘脂类sphingolipids;Vitamin digestion and absorption:维生素的消化和吸收;Thermogenesis:生热作用;Steroid biosynthesis:类固醇生物合成;Spinocerebellar ataxia:脊髓小脑的共济失调;Salivary secretion:唾液分泌;Regulation of lipolysis in adipocytes:脂肪细胞中脂肪分解的调节;Ovarian steroidogenesis:卵巢类固醇生成;NF-kappa B signaling pathway:核因子-κB信号通路;Metabolic pathways:代谢途径;Insulin resistance:胰岛素抵抗;Inositol phosphate metabolism:磷酸肌醇代谢;HIF-1 signaling pathway:HIF-1信号通路;Growth hormone synthesis, secretion and action:生长激素的合成、分泌和作用;Glycerolipid metabolism:甘油酯类代谢;Glutamatergic synapse:谷氨酸能系统;Gastric acid secretion:胃酸分泌;Fat digestion and absorption:脂肪消化吸收;Ether lipid metabolism:醚脂质代谢;Cholesterol metabolism:胆固醇代谢;Bile secretion:胆汁分泌;Regulation of actin cytoskeleton:肌动蛋白细胞骨架的调节;Phospholipase D signaling pathway:磷脂酶D信号通路;Phosphatidylinositol signaling system:磷脂酰肌醇信号系统;Pathways in cancer:癌症途径;Pancreatic cancer:胰腺癌;Neuroactive ligand-receptor interaction:刺激神经组织的中的交互;Long-term depression:长期抑制作用;GnRH signaling pathway:促性腺激素信号通路;Gap junction:细胞间隙链接;Fc gamma R-mediated phagocytosis:FcγR介导的吞噬作用。 图 6 脂类聚类分析和KEGG富集分析 Fig. 6 Lipid cluster analysis and KEGG enrichment analysis |
对模型对照组与对照组以及模型对照组与鸭油甘油二酯组进行差异脂质分析。与对照组相比,模型对照组241种脂质异常增加,其中包括183种TG,17种甘油二酯、CE,5种PC,4种FFA,3种LPC,2种PE、溶血磷脂酰乙醇胺(LPE)、CASE,1种磷脂酰丝氨酸(PS)、磷脂酰甘油(PG)、单甘油酯(MG)、糖鞘脂(HexCer)、CAR、半单磷酸甘油酯(BMP)。与模型对照组相比,鸭油甘油二酯组部分脂质显著降低(P < 0.05)。
通过对路径分析可以为不同脂类可能参与的生化和信号传导途径提供一些线索。从图 6-C和图 6-D可以看出,与对照组相比,模型对照组的大鼠明显被破坏了脂肪细胞的甘油酯代谢、固醇代谢、脂肪消化吸收、生热和脂肪分解调节途径。而甘油二酯改善了脂肪细胞的甘油酯代谢、产热作用和脂肪分解调节途径、磷脂酶D的信号通路、胆固醇代谢。以上结果表明,鸭油甘油二酯可以修复相关代谢途径。
此外,在模型对照组和对照组以及模型对照组和鸭油甘油二酯组之间选择了13个重要的脂质,从表 4可以看出,这13种脂质的含量较高。这些结果表明,13种脂质,包括10种TG,2种CEs和1种FFA,可能是负责鸭油甘油二酯降脂作用的潜在生物标志物。
|
|
表 4 潜在的脂质生物标志物 Table 4 Potential lipid biomarkers |
高脂食物是造成肥胖的关键,张洁等[14]研究发现,藿香可以起到减肥的作用,前人对甘油二酯的降脂作用也做过研究,但对于鸭油甘油二酯的降脂方面的作用和机理研究还处于空白阶段,通过脂质组学研究饮食和生物代谢之间的作用,可以很好地解释它们之间的相互作用[15]。本研究中,我们结合了体重、腹脂率、脏体比、血清生化指标和脂质代谢组学来分析研究鸭油甘油二酯对肥胖大鼠的影响以及潜在的机制。
3.1 鸭油甘油二酯对肥胖大鼠体重和体脂的影响长期摄入甘油二酯能够控制体重增加,并减少内脏脂肪含量[16]。而很多疾病的发生都是由于脂肪在体内蓄积造成的,例如高血脂、高血压等。王峰[17]研究发现,1, 3甘油二酯替代普通油脂可明显降低体重。有研究表明,肥胖人群摄入甘油二酯6周至6个月,能够有效的降低体重,减少皮下脂肪以及内脏脂肪[18]。本试验结果得出,与模型对照组相比,鸭油甘油二酯组的体重、腹脂率均显著降低,与前人研究结果一致。
3.2 鸭油甘油二酯对肥胖大鼠Lee’s指数的影响世界卫生组织将Lee’s指数作为评价成年人胖瘦程度的计量指标之一[19],Lee’s指数反映了生物体的肥胖情况。彭燕群等[20]研究表明,Lee’s指数是反映大鼠肥胖程度的重要指标。程爱佳等[21]研究表明,肥胖与Lee’s指数有着密切的联系,且Lee’s指数与脂肪含量呈正相关。本试验结果得出,鸭油甘油二酯能够降低Lee’s指数,控制体型发育,符合Lee’s指数与脂肪含量呈正相关,与前人研究结果一致。
3.3 鸭油甘油二酯对肥胖大鼠脏体比的影响作为试验动物重要的生物学特性指标之一,脏器的相对大小在一定程度上可说明其功能的强弱和试验动物的生理状况[22]。李熠阳[23]研究发现,甘油二酯对小鼠的脏器没有影响。本试验结果得出,鸭油甘油二酯对心脏、脾脏、肾脏、睾丸等器官生长发育无显著影响,与前人研究结果一致。周慧娟[24]研究发现,肝脏的脂质生成、转化和代谢负担加重会在一定程度上使肝脏系数增大,当这种负担超过肝脏本身的代谢能力后,则会使脂质过多沉积于肝脏,造成肝体肥大。本试验中,鸭油甘油二酯可以减少肝脏脂质积累,使肝体比下降,有效避免肝体肥大。
3.4 鸭油甘油二酯对肥胖大鼠血清生化指标的影响血清生化指标作为动物健康与否的基础指标,在疾病诊断和治疗过程中具有重要的参考价值[25]。本试验结果发现,鸭油甘油二酯可以降低血脂水平,维护脂类代谢正常进行。孟祥河[26]研究发现,甘油二酯能够降低大鼠血清TC、TG含量,提高血清HDL-C含量,这与本试验结果一致,其原因可能是鸭油甘油二酯无法参与正常的脂类代谢过程,从而降低大鼠血清TC、TG、LDL-C含量,提高血清HDL-C含量。
3.5 鸭油甘油二酯对肥胖大鼠肝脏脂质代谢的影响肝脏是人体最重要的能量代谢器官,通过调节脂肪酸、TG、胆固醇等脂类合成和分解代谢来维持脂质稳态[27]。Gorden等[28]研究发现,甘油二酯、TG、FFA含量异常增加是肝脏异常的标志。高胆固醇血症被认为是胆固醇代谢的标志[29],CE与胆固醇稳态失调有着密切的联系[30]。Zeng等[31]研究发现,肥胖患者的癌症风险显著增加,而PC的代谢异常是癌症的标志之一。本试验结果发现,鸭油甘油二酯可以改善高脂饮食诱导的脂质合成和分解代谢之间的失衡。FFA的储存不仅促进TG在肝细胞内的异常积累,而且转化为脂质中间体(甘油二酯、CER等),破坏细胞功能,导致脂毒性,从而发展成肝脂肪变性,而鸭油甘油二酯的摄入有效减少了肝脏中FFA、甘油二酯等产物的积累,降低肝脂肪变性风险。通过本试验结果分析,鸭油甘油二酯降低肝脏中FFA、甘油二酯等产物的积累的原因是鸭油甘油二酯参与脂肪细胞的甘油酯代谢、产热作用和脂肪分解调节途径、磷脂酶D的信号通路、胆固醇代谢等代谢通路。
4 结论鸭油甘油二酯能够起到减肥降脂、控制体型发育、降低血脂水平、维护脂类代谢正常进行的作用。并且进一步表明了鸭油甘油二酯影响脂质代谢与抑制FFA、甘油二酯、TG等有关,改善了脂肪分解调节途径等相关代谢通路。
| [1] |
赵勇. 油脂的营养与健康研究——评《油脂营养健康: 厨中百味油为贵》[J]. 中国油脂, 2020, 45(12): 155. ZHAO Y. Studies on nutrition and health of oils and fats-comment on "nutrition and health of oil and fat: the most expensive oil in kitchen"[J]. China Oils and Fats, 2020, 45(12): 155 (in Chinese). |
| [2] |
MATSUO T, TAKEUCHI H. Effects of structured medium- and long-chain triacylglycerols in diets with various levels of fat on body fat accumulation in rats[J]. British Journal of Nutrition, 2004, 91(2): 219-225. DOI:10.1079/BJN20031041 |
| [3] |
郑淑容. 我国居民油脂摄入现状及对健康的影响[J]. 中国食物与营养, 2012, 18(9): 84-88. ZHENG S R. Situation of dietary fat intake in China and its effect on health[J]. Food and Nutrition in China, 2012, 18(9): 84-88 (in Chinese). DOI:10.3969/j.issn.1006-9577.2012.09.022 |
| [4] |
刘亚楠, 王宝维, 葛文华, 等. 鸭油甘油二酯与维生素D3协同对肥胖SD大鼠器官指数、血液25羟基维生素D3含量、胫骨发育指标及肝脏维生素D受体和过氧化酶体增殖物激活受体α基因表达量的影响[J]. 动物营养学报, 2020, 32(1): 472-480. LIU Y N, WANG B W, GE W H, et al. Effects of combination of duck oil diglyceride and vitamin D3 on organ indexes, blood 25 hydroxyl vitamin D3 content, tibia development indexes and liver vitamin d receptor and peroxisome proliferators-activated receptors α gene expressions of obese SD rats[J]. Chinese Journal of Animal Nutrition, 2020, 32(1): 472-480 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.01.055 |
| [5] |
周君. 甘油二酯的制备与高效液相色谱的检测技术分析[J]. 当代化工研究, 2018(2): 10-11. ZHOU J. Preparation of diglycerides and analysis of detection technique by high performance liquid chromatography[J]. Modern Chemical Research, 2018(2): 10-11 (in Chinese). DOI:10.3969/j.issn.1672-8114.2018.02.007 |
| [6] |
TAKATOSHI M, MELA D J, WESTERTERP-PLANTENGA M S, et al. Diacylglycerols affect substrate oxidation and appetite in mice[J]. Journal of Lipid Research, 2001, 42(3): 372-378. DOI:10.1016/S0022-2275(20)31661-8 |
| [7] |
TOMONOBU K, HASE T, TOKIMITSU I. Dietary diacylglycerol in a typical meal suppresses postprandial increases in serum lipid levels compared with dietary triacylglycerol[J]. Nutrition, 2006, 22(2): 128-135. DOI:10.1016/j.nut.2005.04.016 |
| [8] |
SONI M G, KIMURA H, BURDOCK G A. Chronic study of diacylglycerol oil in rats[J]. Food and Chemical Toxicology, 2001, 39(4): 317-329. DOI:10.1016/S0278-6915(00)00140-X |
| [9] |
IJIRI Y, NAEMURA A, YAMASHITA T, et al. Dietary diacylglycerol extenuates arterial thrombosis in apoE and LDLR deficient mice[J]. Thrombosis Research, 2006, 117(4): 411-417. DOI:10.1016/j.thromres.2005.04.001 |
| [10] |
CHENGELIS C P, KIRKPATRICK J B, BRUNER R H, et al. A 24-month dietary carcinogenicity study of DAG (diacylglycerol) in rats[J]. Food and Chemical Toxicology, 2006, 44(1): 98-121. DOI:10.1016/j.fct.2005.06.006 |
| [11] |
ASSINI J M, MULVIHILL E E, HUFF M W. Citrus flavonoids and lipid metabolism[J]. Current Opinion in Lipidology, 2013, 24(1): 34-40. DOI:10.1097/MOL.0b013e32835c07fd |
| [12] |
FENG K L, LAN Y Q, ZHU X A, et al. Hepatic lipidomics analysis reveals the antiobesity and cholesterol-lowering effects of tangeretin in high-fat diet-fed rats[J]. Journal of Agricultural and Food Chemistry, 2020, 68(22): 6142-6153. DOI:10.1021/acs.jafc.0c01778 |
| [13] |
刘亚楠. 鸭油甘油二酯/VD3协同对大鼠脂类代谢和肠道生理影响[D]. 硕士学位论文. 青岛: 青岛农业大学, 2020. LIU Y N. Duck oil diglyceride/VD3 synergistic effect on lipid metabolism and intestinal physiology in rats[D]. Master, s Thesis. Qingdao: Qingdao Agricultural University, 2020. (in Chinese) |
| [14] |
张洁, 孙慧娟, 严小军, 等. 藿香对营养性肥胖大鼠降脂的作用及其代谢组学研究[J]. 世界科学技术-中医药现代化, 2019, 21(10): 2081-2087. ZHANG J, SUN H J, YAN X J, et al. Study on the lipid-lowering effect and mechanism of musk on nutritional obese rats[J]. World Science and Technology-Modernization of Traditional Chinese Medicine, 2019, 21(10): 2081-2087 (in Chinese). |
| [15] |
MURPHY S A, NICOLAOU A. Lipidomics applications in health, disease and nutrition research[J]. Molecular Nutrition and Food Research, 2013, 57(8): 1336-1346. DOI:10.1002/mnfr.201200863 |
| [16] |
ZHONG N J, GUI Z Y, XU L, et al. Solvent-free enzymatic synthesis of 1, 3-diacylglycerols by direct esterification of glycerol with saturated fatty acids[J]. Lipids in Health and Disease, 2013, 12: 65. DOI:10.1186/1476-511X-12-65 |
| [17] |
王峰. 1, 3-甘油二酯乳脂对SD大鼠脂肪代谢的影响及其机制研究[D]. 硕士学位论文. 合肥: 安徽农业大学, 2013. WANG F. Effects of1, 3-DG in milk fat on fat metabiolism of SD rats and its mechanisms[D]. Master's Thesis. Hefei: Anhui Agricultural University, 2013. (in Chinese) |
| [18] |
罗佳宪. 大豆油基甘油二酯食用油的应用与生理功能研究[D]. 硕士学位论文. 广州: 华南理工大学, 2020. LUO J X. Study on application and physiological function of soybean oil-based diacylglycerol edible oil[D]. Master's Thesis. Guangzhou: South China University of Technology, 2020. (in Chinese) |
| [19] |
闫雪彦. 甘油二酯对大鼠血脂和抗氧化水平影响的实验研究[D]. 硕士学位论文. 青岛: 青岛大学, 2011. YAN X Y. Study of diacylglycerol's effect on the blood fat and antioxidation of rats[D]. Master's Thesis. Qingdao: Qingdao University, 2011. (in Chinese) |
| [20] |
彭燕群, 陈珍珍, 翁锡全, 等. 低氧环境运动对营养性肥胖大鼠心肌细胞自噬相关蛋白表达的影响[J]. 中国病理生理杂志, 2021, 37(6): 1027-1034. PENG Y Q, CHEN Z Z, WENG X Q, et al. Effects of hypoxic environmental exercise on expression of autophagy-related proteins in myocardial cells of nutritionally obese rats[J]. Chinese Journal of Pathophysiology, 2021, 37(6): 1027-1034 (in Chinese). DOI:10.3969/j.issn.1000-4718.2021.06.009 |
| [21] |
程爱佳, 李光华, 韩梅. 有氧运动对高脂肥胖大鼠心肌自由基代谢及胸主动脉血管eNOS mRNA表达水平的影响[J]. 科技风, 2021(28): 142-145. CHENG A J, LI G H, HAN M. Effects of aerobic exercise on free radical metabolism and eNOS mRNA expression in thoracic aorta of high-fat obese rats[J]. Technology Wind, 2021(28): 142-145 (in Chinese). |
| [22] |
唐丽, 郭志强, 雷岷, 等. 酵母培养物对肉兔生产性能、脏器指数和血液生化指标的影响[J]. 中国饲料, 2019(13): 38-41. TANG L, GUO Z Q, LEI M, et al. Effects of yeast culture on productive performance, slaughter performance, viscera indices and blood biochemistry of meat rabbit[J]. China Feed, 2019(13): 38-41 (in Chinese). |
| [23] |
李熠阳. 甘油二酯对试验小鼠生理机能与肠道微生物的影响[D]. 硕士学位论文. 长沙: 湖南农业大学, 2012. LI Y Y. Effect of diacylglycerol on physiological functions and intestinal microorganisms in rats[D]. Master's Thesis. Changsha: Hunan Agricultural University, 2012. (in Chinese) |
| [24] |
周慧娟. 高脂膳食对肝脏脂代谢的影响及其机理研究[D]. 硕士学位论文. 长沙: 湖南农业大学, 2018. ZHOU H J. The study of high fat diet on hepatic lipid metabolism on mice and its mechanism[D]. Master's Thesis. Changsha: Hunan Agricultural University, 2018. (in Chinese) |
| [25] |
马万鹏, 李斌, 王菊梅, 等. 新疆双峰驼生理生化指标的测定[J]. 动物医学进展, 2021, 42(9): 12-18. MA W P, LI B, WANG J M, et al. Determination of physiological and biochemical indexes of bactrian camels in Xinjiang[J]. Progress in Veterinary Medicine, 2021, 42(9): 12-18 (in Chinese). DOI:10.3969/j.issn.1007-5038.2021.09.003 |
| [26] |
孟祥河. 功能性甘油二酯的酶促酯化合成及其减肥功能的研究[D]. 博士学位论文. 无锡: 江南大学, 2004. MENG X H. Studies on enzymatic synthesis of functional diacylglycerol and its antiobesity characteristics[D]. Ph. D. Thesis. Wuxi: Jiangnan University, 2004. (in Chinese) |
| [27] |
MASAKI H, KIM N, NAKAMURA H, et al. Long-chain fatty acid triglyceride (TG) metabolism disorder impairs male fertility: a study using adipose triglyceride lipase deficient mice[J]. Molecular Human Reproduction, 2017, 23(7): 452-460. DOI:10.1093/molehr/gax031 |
| [28] |
GORDEN D L, MYERS D S, IVANOVA P T, et al. Biomarkers of NAFLD progression: a lipidomics approach to an epidemic[J]. Journal of Lipid Research, 2015, 56(3): 722-736. DOI:10.1194/jlr.P056002 |
| [29] |
BONACA M P, NAULT P, GIUGLIANO R P, et al. Low-density lipoprotein cholesterol lowering with evolocumab and outcomes in patients with peripheral artery disease: insights from the fourier trial (further cardiovascular outcomes research with pcsk9 inhibition in subjects with elevated risk)[J]. Circulation, 2018, 137(4): 338-350. DOI:10.1161/CIRCULATIONAHA.117.032235 |
| [30] |
LI J, REN S C, PIAO H L, et al. Integration of lipidomics and transcriptomics unravels aberrant lipid metabolism and defines cholesteryl oleate as potential biomarker of prostate cancer[J]. Scientific Reports, 2016, 6: 20984. DOI:10.1038/srep20984 |
| [31] |
ZENG H W, ISHAQ S L, LIU Z H, et al. Colonic aberrant crypt formation accompanies an increase of opportunistic pathogenic bacteria in C57BL/6 mice fed a high-fat diet[J]. The Journal of Nutritional Biochemistry, 2018, 54: 18-27. DOI:10.1016/j.jnutbio.2017.11.001 |




