2. 南京农业大学动物 科技学院, 动物科学类国家级实验教学中心, 南京 210095;
3. 南京致润生物科技有限公司, 南京 211200
2. National Demonstration Center for Experiment Animal Science Education, College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;
3. Nanjing Zhirun Biotechnology Company Limited, Nanjing 211200, China
我国是大豆消费大国,每年加工大豆产生的大豆皮产量可达1 200万t。大豆皮中粗纤维含量(34%)较高,木质素含量(< 2%)较低,可消化率较高[1],可作为潜在的畜禽饲料中的能量饲料。但由于大豆皮中高含量的粗纤维和抗营养因子,如脲酶、胰蛋白酶抑制因子、大豆抗原蛋白等,限制了其在动物生产中的利用[2]。目前提高大豆皮营养价值的处理方法主要有物理法和化学法,其中物理法成本较高,化学法易造成酸碱的残留。有研究表明,微生物发酵可有效降解饲料纤维并消除抗营养因子[3],但目前利用微生物发酵大豆皮的研究还较少。乳酸杆菌、芽孢杆菌和酵母菌是目前常用的发酵菌种,其中,乳酸杆菌发酵可产生乳酸,降低pH,抑制病原菌生长,防止饲料霉变[4],还能降解抗营养因子,产生细菌素等活性物质[5];芽孢杆菌发酵可分泌纤维素酶等,降解纤维素和半纤维素[6];酵母菌发酵可将纤维类物质转化为菌体蛋白,从而提高饲料营养价值[7]。微生物发酵时补充碳源、氮源可显著促进菌株生长,提高发酵效果[8-9]。但目前关于发酵大豆皮所选取的发酵菌株种类尚没有明确标准,导致大豆皮的发酵效果得不到保证。
本试验选取实验室保藏的乳酸杆菌、芽孢杆菌和酵母菌各4株,分别测定其生长特性,筛选适宜的菌株作为候选菌株,分别用乳酸杆菌、芽孢杆菌和酵母菌单一菌株和复合菌株发酵大豆皮,比较单一菌株和复合菌株发酵对大豆皮营养价值的改善效果;在此基础上,于发酵基质中补充碳源(麸皮)和氮源(硝酸铵、氯化铵、尿素),进一步分析大豆皮的营养成分,评价发酵效果,为大豆皮在养殖生产中的利用奠定基础。
1 材料与方法 1.1 试验原料大豆皮、麸皮、尿素均由江苏省南通市某合作社提供,大豆皮、麸皮粉碎后过40目筛备用。
1.2 试验菌株乳酸杆菌:粪肠球菌JN4(Enterococcus faecalis JN4)、干酪乳杆菌334(Lactobacillus casei 334)、植物乳杆菌RS1(Lactobacillus plantarum RS1)和植物乳杆菌LY19(Lactobacillus plantarum LY19)为本实验室前期自行分离保存。
芽孢杆菌:枯草芽孢杆菌KC1(Bacillus subtilis KC1)、纳豆芽孢杆菌ND1(Bacillus natto ND1)和枯草芽孢杆菌KC2(Bacillus subtilis KC2)为本实验室前期自行分离保存,枯草芽孢杆菌6633(Bacillus subtilis 6633)购自中国工业微生物菌种保藏管理中心。
酵母菌:酿酒酵母菌SC(Saccharomyces cerevisiae SC)、产朊假丝酵母菌CR1(Candida utilis CR1)和酿酒酵母菌NJ(Saccharomyces cerevisiae NJ)为本实验室前期自行分离保存,产朊假丝酵母菌CR2(Candida utilis CR2)购自中国工业微生物菌种保藏管理中心。
1.3 菌株的活化和筛选将-20 ℃保存的乳酸杆菌、芽孢杆菌和酵母菌各4株按1%(体积比)接种量分别接种于MRS、LB和YPD培养基(青岛海博生物有限公司),37 ℃培养24 h进行活化,之后每3 h取样,测定培养液的600 nm处吸光度(OD600)值、pH、活菌数、乳酸产量(芽孢杆菌)、滤纸酶活性(芽孢杆菌)和菌体蛋白产量(酵母菌),挑选出适宜的单一菌株用于后续试验。
1.4 单一菌株和复合菌株发酵大豆皮将10 g大豆皮、20 mL水加入到160 mL发酵瓶中,混匀后1×105 Pa灭菌15 min,作为大豆皮培养基。随后将活化的乳酸杆菌、芽孢杆菌和酵母菌单一菌株分别以3%(体积质量比,1×108 CFU/mL)接种量接种至大豆皮培养基中,为单一菌株发酵组;再将乳酸杆菌、芽孢杆菌和酵母菌等比例混合后按照3%的接种量接种至大豆皮中,为复合菌株发酵组。每组发酵瓶中密封前均有正常空气,先进行有氧发酵,瓶中氧气耗尽后进行厌氧发酵,每组设置3个重复,37 ℃发酵48 h,发酵结束后检测产气量、pH、乳酸产量和活菌数。
1.5 补充碳源和氮源发酵大豆皮补充碳源(麸皮):将10 g大豆皮、20 mL水加入160 mL发酵瓶中,试验分5组,试验组分别添加0、5%、10%和20%的麸皮,空白组为未经任何处理的大豆皮原料,混匀后1×105 Pa灭菌15 min后备用;乳酸杆菌、芽孢杆菌和酵母菌等比例混合后按照3%的接种量接种至试验组的大豆皮培养基中,37 ℃发酵48 h,通气条件同1.4,发酵结束检测菌株的生长发酵特性,分析大豆皮的营养成分,确定麸皮的适宜添加量用于后续试验。
补充氮源(硝酸铵、氯化铵、尿素):将10 g大豆皮、20 mL水加入160 mL发酵瓶中并添加一定量的麸皮(由上一步的结果确定),不同氮源组分别添加1%硝酸铵、1%氯化铵和1%尿素,对照组不添加任何氮源,空白组为未经任何处理的大豆皮原料;混匀后1×105 Pa灭菌15 min后备用;乳酸杆菌、芽孢杆菌和酵母菌等比例混合后按照3%的接种量接种至不同氮源组和对照组的大豆皮培养基中,37 ℃发酵48 h,通气条件同1.4,发酵结束检测菌株的生长发酵特性,并分析大豆皮的营养成分。
1.6 测定指标与方法采用乳酸试剂盒(A019-2-1,南京建成生物工程研究所)测定乳酸产量;采用考马斯亮蓝比色法[10]测定菌体蛋白产量;根据Theodorou等[11]方法测定产气量并以累积产气量表示;采用稀释涂布平板法[12]检测活菌数;采用凯氏定氮法[13]测定粗蛋白质、真蛋白质含量;采用滤袋法[13]测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量;采用滴定法测定脲酶活性;采用酶联免疫吸附测定(ELISA)试剂盒(南京奥青生物技术有限公司,型号分别为ANG-E55247P、ANG-E55248P)测定抗原蛋白(大豆球蛋白和β-伴大豆球蛋白)含量。
1.7 统计分析采用GraphPad Prism 7.0软件作图,通过SPSS 22.0统计软件进行单因素方差分析(one-way ANOVA),采用Tukey’s-b法进行显著性检验,数据以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析 2.1 单一菌株的生长特性由图 1可见,植物乳杆菌LY19在24 h时活菌数和乳酸产量均最高,显著高于粪肠球菌JN4(P<0.05),pH较低。由图 2可见,纳豆芽孢杆菌ND1在24 h时活菌数、乳酸产量和滤纸酶活性均最高,显著高于其他芽孢杆菌(P<0.05),pH最低。由图 3可见,酿酒酵母菌NJ在24 h时活菌数显著高于酿酒酵母菌SC和产朊假丝酵母CR1(P<0.05),且菌体蛋白产量显著高于其他酵母菌(P<0.05)。因此,选择植物乳杆菌LY19、纳豆芽孢杆菌ND1和酿酒酵母菌NJ用于后续大豆皮的发酵试验。
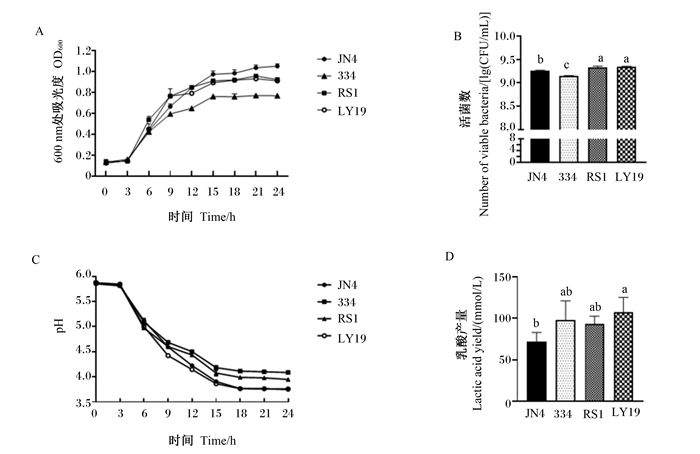
|
A:生长曲线growth curve;B:活菌数number of viable bacteria;C:pH;D:乳酸产量lactic acid yield。JN4:粪肠球菌JN4 Enterococcus faecalis JN4;334:干酪乳杆菌334 Lactobacillus casei 334;RS1:植物乳杆菌RS1 Lactobacillus plantarum RS1;LY19:植物乳杆菌LY19 Lactobacillus plantarum LY19。 数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。 Value columns with the same small letter mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 1 乳酸杆菌生长特性 Fig. 1 Growth characteristics of Lactobacillus |
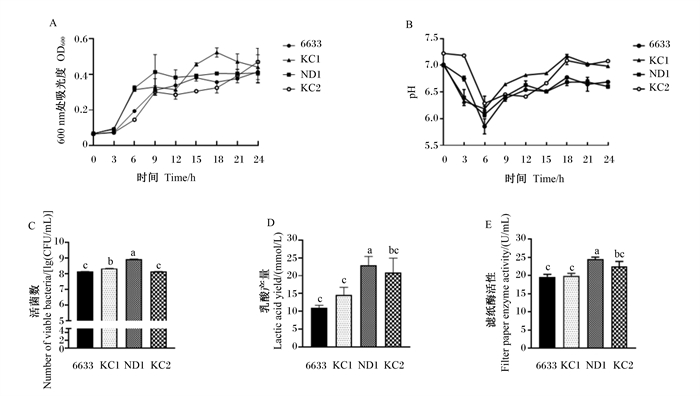
|
A:生长曲线growth curve;B:pH;C:活菌数number of viable bacteria;D:乳酸产量lactic acid yield,E:滤纸酶活性filter paper enzyme activity。6633:枯草芽孢杆菌6633 Bacillus subtilis 6633;KC1:枯草芽孢杆菌KC1 Bacillus subtilis KC1;ND1:纳豆芽孢杆菌ND1 Bacillus natto ND1;KC2:枯草芽孢杆菌KC2 Bacillus subtilis KC2。 图 2 芽孢杆菌生长特性 Fig. 2 Growth characteristics of Bacillus |
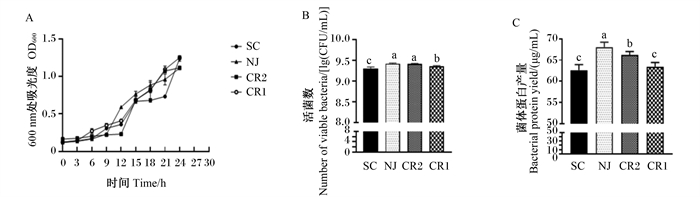
|
A:生长曲线growth curve;B:活菌数number of viable bacteria;C:菌体蛋白产量bacterial protein yield。SC:酿酒酵母菌SC Saccharomyces cerevisiae SC;NJ:酿酒酵母菌NJ Saccharomyces cerevisiae NJ;CR2:产朊假丝酵母菌CR2 Candida utilis CR2;CR1:产朊假丝酵母菌CR1 Candida utilis CR1。 图 3 酵母菌生长特性 Fig. 3 Growth characteristics of yeast |
由表 1可知,复合菌株发酵大豆皮的产气量显著高于各单一菌株发酵(P<0.05),pH显著低于各单一菌株发酵(P<0.05),乳酸产量仅显著高于单一菌株纳豆芽孢杆菌ND1发酵(P<0.05)。复合菌株发酵大豆皮的活菌数显著高于单一菌株植物乳杆菌LY19和纳豆芽孢杆菌ND1发酵(P<0.05),但与单一菌株酿酒酵母NJ发酵无显著差异(P>0.05)。这表明复合菌株发酵效果优于单一菌株发酵,因此选择复合菌株发酵用于后续试验。
|
|
表 1 单一菌株和复合菌株发酵大豆皮的特性 Table 1 Characteristics of fermented soybean hulls by single strain and compound strains |
由表 2可知,添加麸皮能促进菌株对大豆皮的发酵,与添加0麸皮组相比,添加5%、10%、20%麸皮组的产气量及乳酸杆菌、芽孢杆菌、酵母菌活菌数均显著提高(P<0.05),pH显著降低(P<0.05)。由表 3可知,与空白组相比,添加10%麸皮组的粗蛋白质含量提高了19.98%(P<0.05),真蛋白质含量提高了22.43%(P<0.05),中性洗涤纤维含量降低了11.43%(P<0.05),酸性洗涤纤维含量降低了14.17%(P<0.05)。与空白组和添加0麸皮组相比,添加10%麸皮组的脲酶活性显著下降(P<0.05),球蛋白和β-伴大豆球蛋白降解率显著提高(P<0.05)。因此,选择添加10%麸皮作为发酵大豆皮时的碳源用于后续试验。
|
|
表 2 添加麸皮对发酵大豆皮发酵特性的影响 Table 2 Effects of bran addition on fermentation characteristics of fermented soybean hulls |
|
|
表 3 添加麸皮对发酵大豆皮营养成分的影响 Table 3 Effects of bran addition on nutritional composition of fermented soybean hulls |
由表 4可知,添加不同氮源提高了菌株的发酵特性,与对照组相比,添加硝酸铵、氯化铵和尿素组的乳酸杆菌、芽孢杆菌、酵母菌活菌数显著提高(P<0.05),添加氯化铵和尿素组的产气量、pH、乳酸产量均显著提高(P<0.05)。由表 5可知,与空白组和对照组相比,添加硝酸铵、氯化铵和尿素组的粗蛋白质含量显著提高(P<0.05),中性洗涤纤维、酸性洗涤纤维含量显著降低(P<0.05),脲酶活性显著降低(P<0.05),球蛋白和β-伴大豆球蛋白降解率显著提高(P<0.05);添加尿素组的真蛋白含量显著提高(P<0.05)。因此,选择尿素作为氮源添加到发酵大豆皮中。
|
|
表 4 不同氮源对发酵大豆皮发酵特性的影响 Table 4 Effects of different nitrogen sources on fermentation characteristics of fermented soybean hulls |
|
|
表 5 不同氮源对发酵大豆皮营养成分的影响 Table 5 Effects of different nitrogen resources on nutritional composition of fermented soybean hulls |
目前用于发酵的菌株种类繁多且生理作用不同,因此首先要进行发酵菌株的筛选。筛选乳酸杆菌的重要指标之一就是乳酸产量,因此本研究根据乳酸杆菌的乳酸产量等指标发现植物乳杆菌LY19在24 h时乳酸产量达到107.24 mmol/L,pH最低为3.76,且活菌数最多,表明植物乳杆菌LY19具有良好的生长特性,因此选择植物乳杆菌LY19作为发酵菌株。芽孢杆菌可产生纤维素酶降解纤维,本试验根据滤纸酶活性等指标发现纳豆芽孢杆菌ND1产生的滤纸酶活性达24.51 FPU/mL。国立东等[14]从发酵豆豉中分离到的芽孢杆菌产纤维素酶活性为21.14 U/mL,与本研究结果相似,因此选择纳豆芽孢杆菌ND1作为发酵菌株。酵母菌可以通过自身繁殖产生菌体蛋白[15],本研究发现酿酒酵母菌NJ的菌体蛋白产量高于其他酵母菌,且酿酒酵母菌NJ的活菌数及OD600值较高,因此选择酿酒酵母菌NJ作为发酵菌株。
3.2 复合菌株发酵大豆皮的效果单菌株作用单一,使用单一菌株发酵大豆皮效果往往难以达到理想状态。Refstie等[16]研究表明,单独用乳酸杆菌发酵豆粕对植酸的降解作用不明显,而有研究表明复合菌株之间可能存在共生协同关系,能帮助微生物更好地适应复杂的环境系统[17]。本研究中,复合菌株发酵大豆皮的产气量、pH、活菌数等均优于植物乳杆菌、纳豆芽孢杆菌和酿酒酵母菌单独发酵,其原因可能与3株菌株之间存在共生协同关系,有助于微生物适应环境有关[18]。植物乳杆菌LY19发酵产生乳酸,可降低大豆皮的pH而抑制病原微生物生长;纳豆芽孢杆菌ND1能够降低大豆皮中的脲酶,并产生维素酶降解大豆皮中的纤维生成单糖;而酿酒酵母菌NJ则可以利用芽孢杆菌产生的单糖进行生长,产生菌体蛋白,提高大豆皮中蛋白质含量。此外,纳豆芽孢杆菌ND1和酿酒酵母菌NJ发酵消耗大量氧气,进而为植物乳杆菌LY19生长提供厌氧环境。基于此,3株菌株在大豆皮发酵过程中共同作用从而提高了发酵效果。Zhang等[19]用乳酸杆菌、枯草芽孢杆菌和酿酒酵母菌复合发酵豆粕,发现可以去除豆粕中的蛋白酶抑制剂等抗营养因子,从而提高豆粕的饲用价值。胡永娜等[20]采用枯草芽孢杆菌、产朊假丝酵母和粪肠球菌混合发酵菜籽粕,结果发现,菜籽粕中的异硫氰酸酯和唑烷硫酮等抗营养因子的降解率高达80%以上。这与本研究复合菌株发酵大豆皮效果优于单一菌株的结果一致,表明复合菌株发酵大豆皮效果优于单一菌株发酵大豆皮。
3.3 大豆皮发酵效果的优化前期研究表明,复合菌株发酵大豆皮的效果优于单一菌株发酵,为了进一步提高复合菌株发酵大豆皮的效果,更好地改善大豆皮的营养价值,可通过添加碳源如麸皮来促进菌株的生长。麸皮中约含有20%可溶性纤维,可被微生物利用促进增殖。童鑫等[21]用酿酒酵母和嗜酸乳杆菌发酵枣渣时加入碳源、氮源和无机盐,显著提高了枣渣的蛋白质含量。本研究中,添加10%麸皮促进了菌株在大豆皮中的生长和发酵,大豆皮的粗蛋白质含量提高了19.98%,真蛋白质含量提高了22.43%,中性洗涤纤维含量降低了11.43%,酸性洗涤纤维含量降低了14.17%;同时,抗营养因子脲酶活性降至0.15 U/g,抗原蛋白降解率提高,可见添加麸皮后大豆皮品质有一定的提高,这与张开磊等[22]的研究结果一致。此外,氮源也是微生物生长发酵所必需的物质,因此在添加麸皮的基础上又添加了不同种类的氮源来进一步促进发酵效果。本研究中,添加不同种类的氮源(硝酸铵、氯化铵和尿素)提高了菌株的发酵特性,并且大豆皮的粗蛋白质、真蛋白质含量提高,中性洗涤纤维、酸性洗涤纤维含量降低,抗营养因子含量也降低。这表明添加不同种类的氮源促进了复合菌株的生长,从而提高了发酵效果,蛋白质含量的增加可能是酵母菌菌体利用额外添加氮源合成自身蛋白质的绝对增长[23]。陈广银等[24]研究发现,在厌氧发酵麦秆过程中添加不同氮源(尿素、氯化铵、硝酸钾)提高了微生物活性,主要体现在厌氧微生物的产气能力和产气速率提高,促进了微生物对麦秆纤维素和半纤维素的降解,且添加尿素的效果最好,这与本研究结果一致。本研究中,添加1%尿素作为发酵大豆皮的氮源时,粗蛋白质含量提高了34.09%,中性洗涤纤维含量降低了16.38%,酸性洗涤纤维含量降低了16.11%,球蛋白和β-伴大豆球蛋白降解率分别提高了23.29%和24.20%,脲酶活性降低至0.01 U/g。因此,选择添加1%尿素作为发酵大豆皮的氮源效果较好。
4 结论植物乳杆菌LY19、纳豆芽孢杆菌ND1和酿酒酵母NJ复合菌株具有发酵大豆皮的潜力;通过单因素试验,优化了复合菌株发酵大豆皮的条件,即添加10%麸皮和1%尿素,在料水比1 ∶ 2、发酵时间48 h、发酵温度37 ℃的条件下,复合菌株能降低大豆皮中纤维(中性洗涤纤维、酸性洗涤纤维)含量,降低脲酶活性,提高球蛋白和β-伴大豆球蛋白降解率,改善其营养价值。
| [1] |
ALJUOBORI A, ABDULLAH N, ZULKIFLI I, et al. Lactobacillus salivarius fermentation reduced glucosinolate and fibre in canola meal[J]. Journal of Food Research, 2014, 3(5): 2014. |
| [2] |
王继强, 张波. 一种新的饲料资源——大豆皮[J]. 饲料研究, 2003(11): 24-25. WANG J Q, ZHANG B. Soybean hulls, a new raw material for feed[J]. Feed Research, 2003(11): 24-25 (in Chinese). DOI:10.3969/j.issn.1002-2813.2003.11.007 |
| [3] |
WORAPRAYOTE W, MALILA Y, SORAPUKDEE S, et al. Bacteriocins from lactic acid bacteria and their applications in meat and meat products[J]. Meat Science, 2016, 120: 118-132. DOI:10.1016/j.meatsci.2016.04.004 |
| [4] |
KOO B, KIM J W, NYACHOTI C M. Nutrient and energy digestibility, and microbial metabolites in weaned pigs fed diets containing Lactobacillus-fermented wheat[J]. Animal Feed Science and Technology, 2018, 241: 27-37. DOI:10.1016/j.anifeedsci.2018.04.007 |
| [5] |
JOSHI V K, SANDHU D K. Preparation and evaluation of an animal feed byproduct produced by solid-state fermentation of apple pomace[J]. Bioresource Technology, 1996, 56(2/3): 251-255. |
| [6] |
HERES L, ENGEL B, VAN KNAPEN F, et al. Fermented liquid feed reduces susceptibility of broilers for Salmonella enteritidis[J]. Poultry Science, 2003, 82(4): 603-611. DOI:10.1093/ps/82.4.603 |
| [7] |
PACHECO M T, CABALLERO-CORDOBA G M, SGARBIERI V C. Composition and nutritive value of yeast biomass and yeast protein concentrates[J]. Journal of Nutritional Science and Vitaminology, 1997, 43(6): 601-612. DOI:10.3177/jnsv.43.601 |
| [8] |
SHI C Y, HE J, YU J, et al. Solid state fermentation of rapeseed cake with Aspergillus niger for degrading glucosinolates and upgrading nutritional value[J]. Journal of Animal Science and Biotechnology, 2015, 6(1): 13. DOI:10.1186/s40104-015-0015-2 |
| [9] |
马茹霞. 氮源对玉米秸秆沼气发酵过程及微生物群落的影响[D]. 硕士学位论文. 大庆: 黑龙江八一农垦大学, 2017. MA R X. Effects of nitrogen on the methane fermentation process of maize straw and microbial community[D]. Master's Thesis. Daqing: Heilongjiang Bayi Agricultural University, 2017. (in Chinese) |
| [10] |
MAKKAR H P, SHARMA O P, DAWRA R K, et al. Simple determination of microbial protein in rumen liquor[J]. Journal of Dairy Science, 1982, 65(11): 2170-2173. DOI:10.3168/jds.S0022-0302(82)82477-6 |
| [11] |
THEODOROU M K, WILLIAMS B A, DHANOA M S, et al. A simple gas-production method using a pressure transducer to determine the fermentation kinetics of ruminant feeds[J]. Animal Feed Science and Technology, 1994, 48(3/4): 185-197. |
| [12] |
叶磊, 杨学敏. 微生物检测技术[M]. 北京: 化学工业出版社, 2009. YE L, YANG X M. Microbiological detection technology[M]. Beijing: Chemical Industry Press, 2009 (in Chinese). |
| [13] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业大学出版社, 2007. ZHANG L Y. Feed analysis and feed quality detection technology[M]. 3rd ed. Beijing: China Agricultural University Press, 2007 (in Chinese). |
| [14] |
国立东, 王永春, 于纯淼, 等. 一株高产纤维素酶的解淀粉芽孢杆菌分离及产酶条件优化[J]. 中国食品添加剂, 2020, 31(7): 53-60. GUO L D, WANG Y C, YU C M, et al. Isolation of a high yield cellulase Bacillus amyloliquefaciens strain and its enzyme production optimization[J]. China Food Additives, 2020, 31(7): 53-60 (in Chinese). |
| [15] |
BARBOSA C, MENDES-FAIA A, MENDES-FERREIRA A. The Nitrogen source impacts major volatile compounds released by Saccharomyces cerevisiae during alcoholic fermentation[J]. International Journal of Food Microbiology, 2012, 160(2): 87-93. DOI:10.1016/j.ijfoodmicro.2012.10.003 |
| [16] |
REFSTIE S, SAHLSTRÖM S, BRÅTHEN E, et al. Lactic acid fermentation eliminates indigestible carbohydrates and antinutritional factors in soybean meal for Atlantic salmon (Salmo salar)[J]. Aquaculture, 2005, 246(1/4): 331-345. |
| [17] |
叶丙奎. 混菌固态发酵对饲料营养价值及生长育肥猪生产性能的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2009. SHE B K. Effects of mixed culture solid-state fermentation on feed nutritive value and performance of growthing-finishing pigs[D]. Master's Thesis. Yangling: Northwest A&F University, 2009. (in Chinese) |
| [18] |
MUGULA J K, NARVHUS J A, SØRHAUG T. Use of starter cultures of lactic acid bacteria and yeasts in the preparation of togwa, a Tanzanian fermented food[J]. International Journal of Food Microbiology, 2003, 83(3): 307-318. DOI:10.1016/S0168-1605(02)00386-0 |
| [19] |
ZHANG Y T, YU B, LU Y H, et al. Optimization of the fermentation conditions to reduce anti-nutritive factors in soybean meal[J]. Journal of Food Processing and Preservation, 2017, 41(5). |
| [20] |
胡永娜, 李爱科, 王之盛, 等. 微生物固态发酵菜籽粕营养特性的研究[J]. 中国粮油学报, 2012, 27(3): 76-80. HU Y N, LI A K, WANG Z S, et al. Study on the nutritional character of rapeseed meal by microbial solid state fermentation[J]. Journal of the Chinese Cereals and Oils Association, 2012, 27(3): 76-80 (in Chinese). DOI:10.3969/j.issn.1003-0174.2012.03.017 |
| [21] |
童鑫, 徐庆阳. 固态联合发酵生产枣渣生物饲料的工艺研究[J]. 发酵科技通讯, 2019, 48(3): 137-140. TONG X, XU Q Y. Study on combined solid state fermentation for production of jujube residue biological feed[J]. Bulletin of Fermentation Science and Technology, 2019, 48(3): 137-140 (in Chinese). |
| [22] |
张开磊, 王宝维, 葛文华, 等. 降解大豆皮纤维优势复合菌群筛选及产品营养价值评定[J]. 中国畜牧杂志, 2015, 51(9): 42-48. ZHANG K L, WANG B W, GE W H, et al. Screening of dominant complex bacteria for degrading soybean skin fiber and evaluation of nutritional value[J]. Chinese Journal of Animal Science, 2015, 51(9): 42-48 (in Chinese). DOI:10.3969/j.issn.0258-7033.2015.09.010 |
| [23] |
GAO L M, CHI Z M, SHENG J, et al. Single-cell protein production from Jerusalem artichoke extract by a recently isolated marine yeast Cryptococcus aureus G7a and its nutritive analysis[J]. Applied Microbiology and Biotechnology, 2007, 77(4): 825-832. DOI:10.1007/s00253-007-1210-7 |
| [24] |
陈广银, 郑正, 常志州, 等. 不同氮源对麦秆厌氧消化过程的影响[J]. 中国环境科学, 2011, 31(1): 73-77. CHEN G Y, ZHENG Z, CHANG Z Z, et al. Effects of nitrogen sources on anaerobic digestion process of wheat straw[J]. China Environmental Science, 2011, 31(1): 73-77 (in Chinese). |




