2. 伊利苏州乳业有限责任公司, 苏州 215028;
3. 安徽五粮泰生物工程股份有限公司, 六安 237000
2. Yili Suzhou Dairy Co., Ltd., Suzhou 215028, China;
3. Fisugar Peptide Biology Engineering Co., Ltd., Liuan 237000, China
随着我国畜牧产业的快速增长,饲料的需求不断增大,其中优质的蛋白质饲料成为限制我国畜牧业快速发展的关键因素之一,尤其是中美贸易关系的变化,使得蛋白质饲料紧缺的问题更加突出[1]。棉籽粕中蛋白质含量高达40%以上[2],是一种优质的蛋白质饲料,我国作为世界产棉大国,棉花年产量高达600万t以上[3],拥有丰富的棉籽粕资源。因此,棉籽粕的开发利用是解决我国蛋白质饲料资源短缺的有效途径之一,但棉籽粕在动物饲料中的利用率仅为30%[4],其中棉酚是畜禽饲料中使用棉籽粕的主要限制性因素[5]。棉酚包括游离棉酚(free gossypol,FG)和结合棉酚(bound gossypol,BG),FG易与饲料(食品)中的蛋白质、糖类、矿物质等营养成分结合形成BG[6],难以被机体吸收利用,大大降低了饲料(食品)的营养价值,同时会产生不良风味,从而降低口感,影响动物采食量[7]。棉酚摄入后会损害人和动物的生殖系统,抑制精子生成,影响精子存活率,扰乱雌性动物发情周期,引起子宫萎缩,影响妊娠[8-10]。
目前针对棉籽粕中棉酚的清除方法主要有物理、化学以及微生物发酵法,其中物理和化学法主要是利用加压及热处理[11]、有机溶剂萃取[12]以及添加硫酸亚铁(Fe2SO4)、过氧化氢(H2O2)、氢氧化钙[Ca(OH)2]、尿素(CH4N2O)等方式[13],使棉酚与棉籽蛋白、二价铁离子(Fe2+)结合,将棉籽粕中的棉酚溶解在异丙醇、丙酮等有机溶剂中,或将棉酚氧化、碱化、氨化等,最终使棉籽粕中棉酚含量降低,但物理和化学法均会在不同程度上导致棉籽粕的营养价值流失或引入新的污染物,并存在能耗大、成本高、环境污染等问题。因此,绿色环保、成本低、效果好、安全的微生物发酵法成为清除棉酚的研究重点[14-15]。研究显示,黑曲霉(Asperqillus niger)、热带假丝酵母菌(Candida tropicalis)、黄曲霉(Aspergillus flavus)、枯草芽孢杆菌(Bacillus subtilis)等微生物具有清除棉酚的作用[16-19],同时棉酚对好氧芽孢杆菌、乳酸菌等具有抑制作用[20],且对革兰氏阳性菌的抑制效果要强于革兰氏阴性菌[21]。关于乳酸菌在棉籽粕脱酚的研究鲜有报道。本试验以此为出发点,欲筛选、驯化1株符合《饲料添加剂品种目录(2013)》中规定的乳酸菌,并对其生物特性进行研究,以期获得1株适于棉籽粕生物发酵脱毒的优良菌株。
1 材料与方法 1.1 试验材料 1.1.1 样品采集腐殖质土壤样品:2020年2月中旬于安徽农业大学大杨店棉花种植试验田(31°58′N,117°24′E)采集,去除残落层,采集腐殖质层,用于目标菌株的分离。
棉籽粕样品:牛、羊饲料原料专用棉饼(产地新疆哈密),从石家庄松妙贸易有限公司采购,用于棉籽粕发酵试验。
标准菌株:戊糖片球菌ATCC33316(安徽五粮泰生物工程股份有限公司惠赠)、金黄色葡萄球菌ATCC25923和大肠杆菌ATCC8739(兽医病理生物学与疫病防控安徽省重点实验室惠赠)。
1.1.2 培养基MRS培养基:按20 g/L添加琼脂粉制备MRS固体培养基,按0.5%添加醋酸棉酚(AG,纯度≥98%,陕西慈缘生物技术有限公司)制备MRS液体培养基。
1.2 试验方法 1.2.1 菌种选育富集:按样品∶ MRS液体培养基=1 g ∶ 10 mL,将样品浸没在MRS液体培养基中,充分振荡,常温培养24 h。
筛选:取样液经稀释后涂布于AG浓度为0.2 mg/dL的MRS固体培养基平板中,在37 ℃的条件下,厌氧培养1~7 d。待菌落长出后,分别挑取不同菌落形态的菌株,进行分离纯化,将纯化菌株接种至0.2 mg/dL的MRS液体培养基中,37 ℃静置培养24 h。
驯化:取上述纯化菌株接种至AG浓度为0.2 mg/dL的MRS固体培养基平板中,并按0.1 mg/dL的添加量逐步提高AG浓度至0.5 mg/dL。
1.2.2 菌种的鉴定形态学鉴定:观察已纯化后的单个菌落形态,经革兰氏染色后镜检,选取革兰氏阳性菌株。
生理生化鉴定:参照《伯杰氏细菌鉴定手册》[22]进行生理生化试验,并使用杜氏小管进行产气试验;参照Nayak等[23]的方法对菌株溶血特性进行分析,取稳定期菌种,接种至0.5%羊血的血平板,于37 ℃条件下培养48 h,通过观察菌落周围是否有溶血环,若出现,则具有溶血性,反之则没有溶血性。
分子生物学鉴定:取稳定期菌液进行基因组DNA提取,以基因组DNA为模板对其16S rDNA序列进行PCR扩增,采用细菌16S rDNA通用引物,序列为:1492R(5’-RGYTACCTTGTTACGACTT-3’)和27F(5’-AGRGTTYGATYMTGGCTCAG-3’)(上海凌恩生物科技有限公司合成)。PCR扩增体系20 μL:5×FastPfu Buffer 4 μL,2.5 mmol/L dNTPs 2 μL,上游引物(5 μmol/L)0.8 μL,下游引物(5 μmol/L)0.8 μL,DNA模板10 ng,FastPfu Polymerase 0.4 μL,用ddH2O补至20 μL。PCR反应程序为:95 ℃预变性5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 min,35次循环;最后72 ℃ 10 min,将PCR扩增产物在1%琼脂糖凝胶上进行电泳检测,回收所需PCR产物并送至上海凌恩生物科技有限公司进行16S rDNA测序鉴定,将测序结果在GenBank数据库中进行BLAST分析,应用MEGA 7.0软件构建系统发育树。
1.2.3 菌株生长特性的测定按菌液2%的接种量接种于MRS液体培养基中,37 ℃连续培养,每2 h取样,连续取样10次,测定600 nm处吸光度(OD600)值,绘制生长曲线,并测定pH。
1.2.4 菌株耐热性能的测定取稳定期菌液,4 000×g离心5 min,用无菌磷酸盐缓冲液(PBS)洗涤菌体沉淀3次后等体积重悬,分别于37、40、45、50、55 ℃条件下静置培养30 min,以处理前的菌液作为对照,采用平板菌落法统计活菌数,计算每个处理温度下的菌体存活率。
1.2.5 菌株抑菌特性的测定以金黄色葡萄球菌ATCC25923、大肠杆菌ATCC8739作为指示菌,对选育菌株进行抑菌试验。取稳定期各菌液,并调节浓度至1×106 CFU/mL,用无菌拭子蘸取指示菌液涂布于MRS固体培养基平板中,用打孔器(直径8 mm)在每个培养基上打出3个孔[24],每孔注入20 μL供试菌菌液。37 ℃培养10~16 h后观察并测量抑菌圈直径(抑菌圈直径不包括打孔器直径)。
1.2.6 菌株发酵棉籽粕取稳定期OD600值=1.0的菌液,用PBS配制成2%的种子液;将干燥的棉籽粕经粉碎过40目筛,取等量棉籽粕分为试验组、空白组、标准株组。试验组按棉籽粕∶种子液=1 g ∶ 1 mL添加种子液,空白组添加等量无菌水;标准株组以戊糖片球菌ATCC33316作为模式菌株等量添加。各组均在37 ℃恒温、密闭、避光的条件下静置发酵7 d。
1.2.7 棉酚清除率的测定将上述经发酵处理的样品进行冷冻干燥、研磨,采用ISO法对FG、总棉酚(TG)含量进行测定。根据公式计算BG含量以及BG、FG清除率[25]。

|
发酵结束后,分别按DB15/T 1458—2018[26]、GB/T 6435—2014[27]、GB/T 6432—2018[28]、GB/T 6438—2007[29]、GB/T 20806—2006[30]和NY/T 1459—2007[31]方法测定样品的pH及干物质(DM)、粗蛋白质(CP)、粗灰分(Ash)、中性洗涤纤维(NDF)、酸性洗涤纤维含量(ADF)含量。
1.3 数据统计分析采用SPSS 17.0软件进行数据统计分析,采用one-way ANOVA程序进行单因素方差分析。试验数据用Origin 7.5软件作图分析。结果以平均值±标准差(mean±SD)表示,P < 0.05表示差异显著。
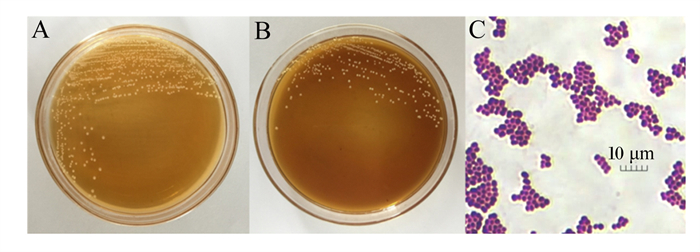
2 结果与分析 2.1 菌株形态学及生理生化鉴定经平板初筛和抑菌评估复筛,分离获得1株供试菌株,命名为WTC1,由图 1可见,WTC1在MRS培养基及含0.5% AG的MRS培养基上生长良好,菌落呈乳白色,凸起,湿润,圆形,边缘整齐,直径为(3±1) mm。革兰氏染色呈紫红色阳性球菌,无芽孢。WTC1生理生化鉴定结果见表 1,该菌可以在有氧环境下生长,无触酶反应,葡萄糖不产气,无溶血反应,可以利用纤维二糖、麦芽糖、甘露醇、乳糖、蔗糖等常规糖,但不可利用山梨醇。结合镜检及生理生化特征,初步确定WTC1为球状乳酸菌。
|
A:MRS培养基MRS medium;B:含0.5%AG的MRS培养基MRS medium containing 0.5% AG;C:革兰氏染色结果Gram staining result。 图 1 菌株选育及革兰氏染色结果 Fig. 1 Results of bacterial screening and Gram staining |
|
|
表 1 WTC1生理生化鉴定结果 Table 1 Physiological and biochemical identification results of WTC1 |
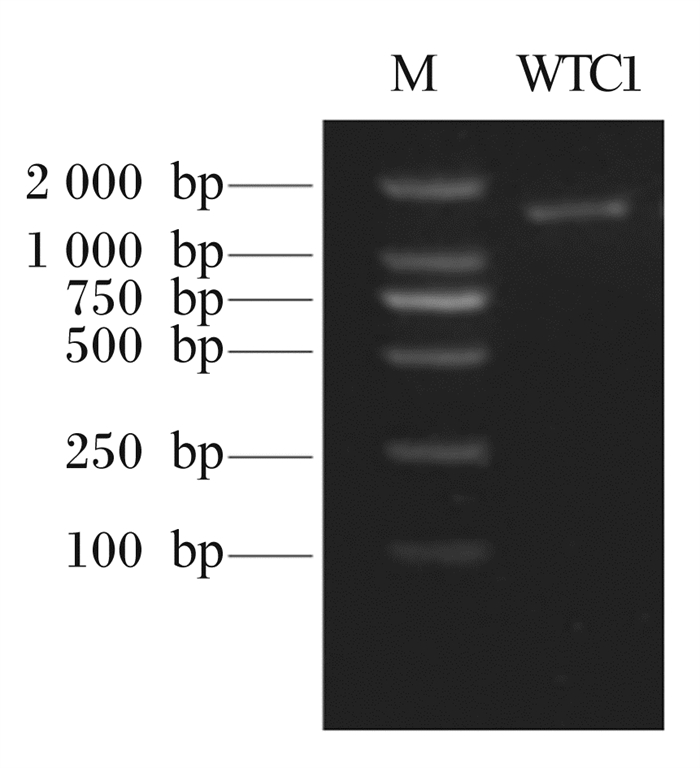
对WTC1进行16S rDNA测序鉴定后,获得大小为1 490 bp的片段(图 2),将测序结果在NCBI上进行BLAST比对分析,显示该菌株与戊糖片球菌基因序列同源性为99.06%~99.46%,取部分相似序列,利用MEGA 7.0软件构建系统发育进化,结果如图 3所示,结合菌株形态学观察、生理生化鉴定结果,综合分析WTC1为戊糖片球菌,并将纯化高活性菌株进行保藏。
|
M:标记marker。 图 2 WTC1 16S rDNA PCR扩增电泳结果 Fig. 2 PCR amplification electrophoresis result of WTC1 16S rDNA |

|
Pediococcus pentosaceus strain:戊糖片球菌菌株。 图 3 WTC1系统进化发育树 Fig. 3 WTC1 phylogenetic tree |
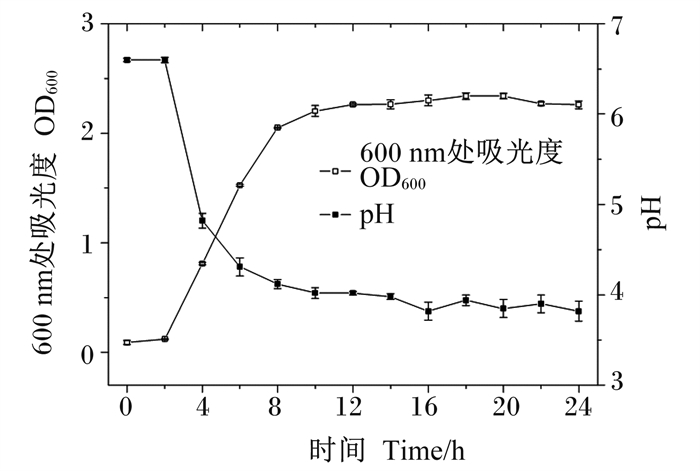
根据测试结果,取平均值,以时间为横坐标,分别以OD600值、pH为纵坐标,绘制生长曲线、pH变化曲线,结果如图 4。在0~2 h,WTC1处于延滞期,菌体量无明显增长;在2~8 h,菌体进入旺盛的对数生长期,菌体量呈现几何型增长;在8~24 h,菌体量增长减缓进入稳定期。在0~2 h,菌液pH维持在6.2左右,在2~6 h,菌液pH大幅下,8 h后菌液pH下降幅度趋于平缓,最终维持在3.8左右。由此可知,该菌株的生长与pH密切相关,菌株在生长期快速增殖,分泌大量有机酸,使pH降低;在稳定期pH趋于恒定,停止增殖。
|
图 4 WTC1生长曲线与pH曲线 Fig. 4 Growth curve and pH curve of WTC1 |
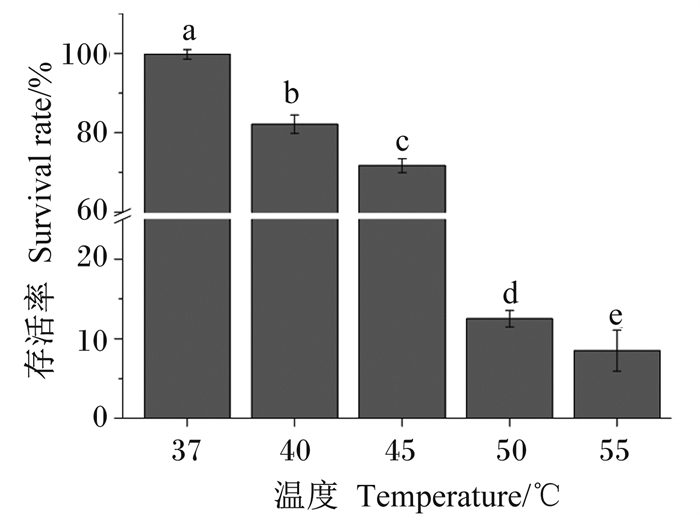
由图 5可见,WTC1在试验设定范围内均有细胞存活,但存活率随试验温度升高而下降,各组间存在显著差异(P < 0.05),其中37 ℃时存活率最高,为99.72%;50 ℃时存活率低至12.51%;37~45 ℃时存活率均大于70%。
|
数据柱标不同小写字母表示差异显著(P<0.05)。图 7同。 Value columns with different small letters mean significant difference (P < 0.05). The same as Fig. 7. 图 5 WTC1在不同温度下存活率 Fig. 5 Survival rate of WTC1 under different temperatures |
|
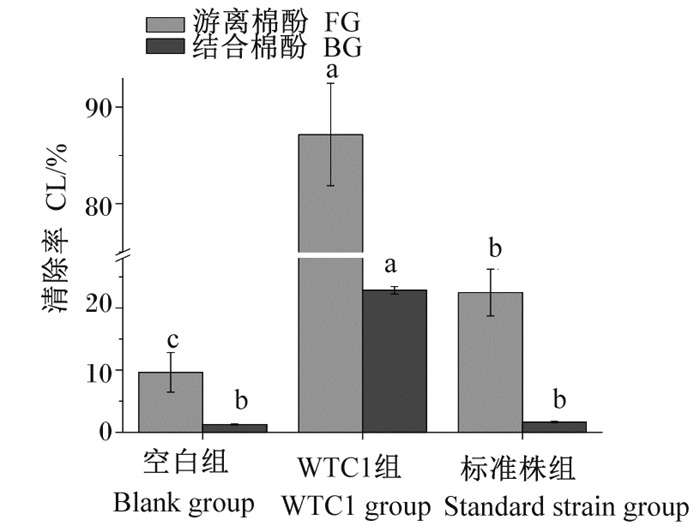
图 7 不同处理棉籽粕中FG、BG清除率 Fig. 7 Clearance rates of FG and BG in different treatments of cottonseed meal |
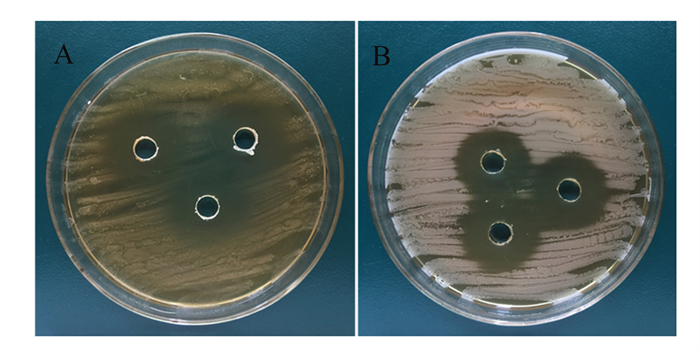
由表 2和图 6可见,WTC1对金黄色葡萄球菌和大肠杆菌具有较好的抑制作用。
|
|
表 2 WTC1抑菌性能 Table 2 WTC1 bacteriostatic ability |
|
A:金黄色葡萄球菌S. aureus;B:大肠杆菌E. coli。 图 6 WTC1抑菌效果 Fig. 6 WTC1 bacteriostatic effect |
由图 7可见,经发酵处理后,FG和BG含量均有不同程度地减少。其中,WTC1组FG和BG清除率分别为87.15%、22.83%,均显著高于空白组和标准株组(P < 0.05);标准株组FD清除率为22.47%,显著高于空白组(P < 0.05);标准株组和空白组BG清除率分别为1.64%、1.26%,无显著差异(P>0.05)。
2.7 WTC1发酵对棉籽粕发酵品质的影响由表 3可见,与空白组相比,WTC1组和标准株组pH和中性洗涤纤维含量均显著降低(P < 0.05),干物质和粗蛋白质含量显著增加(P < 0.05),其余指标无显著差异(P>0.05)。WTC1组和标准株组之间发酵品质指标无显著差异(P>0.05)。
|
|
表 3 WTC1发酵对棉籽粕发酵品质的影响 Table 3 Effects of WTC1 fermentation on fermentation quality of cottonseed meal |
戊糖片球菌是《饲料添加剂品种目录(2013)》中规定可添加使用的微生物菌种,饲料经戊糖片球菌发酵后pH降低,可抑制发酵饲料其他杂菌生长,降低发酵饲料干物质损失,同时提高发酵饲料营养品质[32]。戊糖片球菌广泛应用于家禽、反刍动物的饲喂及畜禽生产中[33-34]。本研究从环境中选育获取的戊糖片球菌对棉酚有较强的耐受性,无溶血现象,安全性高,符合预期目标,具有较高的研究和应用价值。
丰富的有机酸可以通过降低胃肠道pH,抑制有害微生物繁殖,促进有益菌的增殖,激发食欲,促进动物采食量,缓解腹泻等问题[35-36]。经抑菌试验验证,WTC1对金黄色葡萄球菌、大肠杆菌具有良好的抑制作用,这与前人的研究结果[37]一致,经MRS培养液培养WTC1 8 h可将溶液pH维持在3.8,在发酵棉籽粕中WTC1可将发酵体系pH维持在4.2,且与商品菌株的发酵pH及相关营养成分无差异,表明本试验所获菌种可满足饲料发酵的相关需求。
棉酚性质活泼,稳定性差,会缓慢降解[38-39],在发酵过程中,棉酚的自然降解会引起棉籽粕中FG、BG含量的变化,同时棉籽粕中原有微生物也有可能分泌相关物质引起FG和BG含量的变化,最终体现在空白组FG和BG含量减少。通过设置空白组,可排除棉酚自身降解及棉籽粕原有微生物对测试结果的干扰。标准株组FG清除率显著高于空白组,而BG清除率与空白组没有显著差异,但WTC1组FG和BG清除率显著高于空白组和标准株组,表明戊糖片球菌具有清除FG的作用。已有研究筛选出嗜酸乳杆菌、乳酸菌BLCC2-0092、植物乳杆菌LR002等适于棉籽粕发酵的优良乳酸菌菌种[40-42],与芽孢杆菌、酵母菌等菌种复配后发酵棉籽粕中可清除60%~92%的FG,但没有对BG的清除作用进行报道。本试验所获得的戊糖片球菌菌株对FG清除率达87.15%,显著高于标准株,同时可清除22.83%的BG,更加适于棉籽粕生物发酵清除FG和BG。
4 结论本试验分离获得1株具有清除FG和BG双重作用的戊糖片球菌,丰富了棉籽粕发酵脱毒的乳酸菌种类,该菌株无溶血现象,安全性高,可在较短时间内快速增殖,使发酵体系pH降至3.8,45 ℃以内存活率均大于70%,同时对大肠杆菌、金黄色葡萄球菌具有抑制作用,经棉籽粕发酵试验,可将FG含量减少87.15%,且对棉籽粕营养品质有改善作用,可满足饲料发酵工业对菌种的需求,用于棉籽粕生物发酵。
| [1] |
魏莲清, 牛俊丽, 张文举, 等. 发酵棉粕的营养特性及其在肉鸡生产中的应用[J]. 现代畜牧兽医, 2019(12): 22-28. WEI L Q, NIU J L, ZHANG W J, et al. Nutritional characteristics of fermented cottonseed meal and its substitution in broiler production[J]. Modern Journal of Animal Husbandry and Veterinary Medicine, 2019(12): 22-28 (in Chinese). |
| [2] |
罗远琴, 胡倩, 芦岩, 等. 枯草芽孢杆菌、酿酒酵母及其复合菌发酵棉粕营养成分变化的研究[J]. 中国畜牧兽医, 2020, 47(2): 452-459. LUO Y Q, HU Q, LU Y, et al. Studies on nutrient composition of cotton meal fermented by Bacillus subtilis-1, Saccharomyces cerevisiae and their compound bacteria[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(2): 452-459 (in Chinese). |
| [3] |
国家统计局. 中国统计年鉴—2019[M]. 北京: 中国统计出版社, 2019. National Bureau of Statistics. China statistical yearbook-2019[M]. Beijing: China Statistics Press, 2019 (in Chinese). |
| [4] |
周媛媛, 朱泉, 陈生琴, 等. 瘤胃微生物发酵棉粕对肉鸭生产性能的影响[J]. 中国油脂, 2016, 41(7): 24-28. ZHOU Y Y, ZHU Q, CHEN S Q, et al. Impact of cottonseed meal fermented by rumen microorganisms on production performance of meat ducks[J]. China Oils and Fats, 2016, 41(7): 24-28 (in Chinese). DOI:10.3969/j.issn.1003-7969.2016.07.006 |
| [5] |
NAGALAKSHMI D, RAMA RAO S V, PANDA A K, et al. Cottonseed meal in poultry diets: a review[J]. The Journal of Poultry Science, 2007, 44(2): 119-134. DOI:10.2141/jpsa.44.119 |
| [6] |
BADIGANNAVAR A, MYERS G O. Genetic diversity, population structure and marker trait associations for seed quality traits in cotton (Gossypium hirsutum)[J]. Journal of Genetics, 2015, 94(1): 87-94. DOI:10.1007/s12041-015-0489-x |
| [7] |
GILANI G S, COCKELL K A, SEPEHR E. Effects of antinutritional factors on protein digestibility and amino acid availability in foods[J]. Journal of AOAC International, 2005, 88(3): 967-987. DOI:10.1093/jaoac/88.3.967 |
| [8] |
NOORI ALI I, FAKHRILDIN M B M R, AL-OBAIDI S A R. Effect of aqueous and alcoholic extracts of cottonseed on some parameters of sperms and reproductive performance of albino mice[J]. Journal of Al-Nahrain University, 2010, 13(4): 151-158. DOI:10.22401/JNUS.13.4.20 |
| [9] |
RANDEL R D, CHASE C C J, WYSE S J. Effects of gossypol and cottonseed products on reproduction of mammals[J]. Journal of Animal Science, 1992, 70(5): 1628-1638. DOI:10.2527/1992.7051628x |
| [10] |
DODOU K, ANDERSON R J, SMALL D A P, et al. Investigations on gossypol: past and present developments[J]. Expert Opinion on Investigational Drugs, 2005, 14(11): 1419-1434. DOI:10.1517/13543784.14.11.1419 |
| [11] |
曲连发, 王定杰, 王生民. 湿热处理对棉籽饼粕脱毒作用试验[J]. 中国畜禽种业, 2016, 12(10): 31-32. QU L F, WANG D J, WANG S M. Experiment on detoxification of cottonseed meal by moist heat treatment[J]. The Chinese Livestock and Poultry Breeding, 2016, 12(10): 31-32 (in Chinese). DOI:10.3969/j.issn.1673-4556.2016.10.022 |
| [12] |
赵大伟, 劳泰财, 叶强, 等. 棉酚的特性与棉籽粕脱毒方法的研究进展[J]. 广东饲料, 2015, 24(6): 37-40. ZHAO D W, LAO T C, YE Q, et al. Research progress on the properties of gossypol and detoxification methods of cottonseed meal[J]. Guangdong Feed, 2015, 24(6): 37-40 (in Chinese). DOI:10.3969/j.issn.1005-8613.2015.06.011 |
| [13] |
王倩, 张力莉, 赵婷, 等. 不同处理方式对棉籽粕中游离棉酚和常规养分含量的影响[J]. 饲料研究, 2015(2): 50-53. WANG Q, ZHANG L L, ZHAO T, et al. Effects of different treatments on contents of free gossypol and conventional nutrients in cottonseed meal[J]. Feed Research, 2015(2): 50-53 (in Chinese). |
| [14] |
DAI C H, ZHANG L P, MA H L, et al. Ultrasound-assisted detoxification of free gossypol from cottonseed meal[J]. Journal of Food Process Engineering, 2017, 40(1): e12265. DOI:10.1111/jfpe.12265 |
| [15] |
韩伟, 李晓敏, 刘倩, 等. 微生物固态发酵和酶解工艺处理棉粕的研究[J]. 中国油脂, 2017, 42(1): 112-115. HAN W, LI X M, LIU Q, et al. Treatment of cottonseed meal by solid-state fermentation and enzymatic hydrolysis[J]. China Oils and Fats, 2017, 42(1): 112-115 (in Chinese). DOI:10.3969/j.issn.1003-7969.2017.01.027 |
| [16] |
YANG X, SUN J Y, GUO J L, et al. Identification and proteomic analysis of a novel gossypol-degrading fungal strain[J]. Journal of the Science of Food and Agriculture, 2012, 92(4): 943-951. DOI:10.1002/jsfa.4675 |
| [17] |
MAGESHWARAN V, SHARMA V, CHINNKAR M, et al. Biodegradation of gossypol by mixed fungal cultures in minimal medium[J]. Applied Biochemistry and Microbiology, 2018, 54(3): 301-308. DOI:10.1134/S0003683818030092 |
| [18] |
杨霞, 翁晓燕, 郭建林, 等. 棉酚降解菌株的分离、筛选及鉴定[J]. 棉花学报, 2010, 22(6): 539-546. YANG X, WENG X Y, GUO J L, et al. Screening and identification of gossypol-degraded strains isolated from a soil microcosm[J]. Cotton Science, 2010, 22(6): 539-546 (in Chinese). DOI:10.3969/j.issn.1002-7807.2010.06.005 |
| [19] |
ZHANG Y H, ZHANG Z Y, DAI L, et al. Isolation and characterization of a novel gossypol-degrading bacteria Bacillus subtilis strain rumen Bacillus subtilis[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(1): 63-70. DOI:10.5713/ajas.17.0018 |
| [20] |
MARGALITH P. Inhibitory effect of gossypol on microorganisms[J]. Applied Microbiology, 1967, 15(4): 952-953. DOI:10.1128/am.15.4.952-953.1967 |
| [21] |
VADEHRA D V, KALLA N R, SAXENA M. Antimicrobial activity of gossypol acetic acid[J]. Ircs Medical Science Biochemistry, 1985, 13(1): 10-11. |
| [22] |
布坎南 R. E., 吉本斯 N. E.. 伯杰细菌鉴定手册[M]. 9版. 北京: 科学出版社, 1995. BUCHANAN R E, GIBBONS N E. Bergey's manual of determinative bacteriology[M]. 9 ed. Beijing: Science Press, 1995 (in Chinese). |
| [23] |
NAYAK S K, MUKHERJEE S C. Screening of gastrointestinal bacteria of Indian major carps for a candidate probiotic species for aquaculture practices[J]. Aquaculture Research, 2011, 42(7): 1034-1041. DOI:10.1111/j.1365-2109.2010.02686.x |
| [24] |
满文曾, 胡容, 封嗣中, 等. 产广谱细菌素芽孢菌筛选与鉴定[J]. 安徽农业科学, 2020, 48(1): 173-175, 185. MAN W Z, HU R, FENG S Z, et al. Screening and identification of Bacillus strain producing bacteriocin[J]. Journal of Anhui Agricultural Sciences, 2020, 48(1): 173-175, 185 (in Chinese). DOI:10.3969/j.issn.0517-6611.2020.01.052 |
| [25] |
张琛, 许慧卿, 崔桂友, 等. 纳豆芽孢杆菌Bacillus natto 16-1对小麦粉中呕吐毒素的脱毒机制[J]. 食品与机械, 2019, 35(3): 8-14. ZHANG C, XU H Q, CUI G Y, et al. Removal mechanisms of deoxynivalenol by Bacillus natto 16-1 in wheat flour[J]. Food & Machinery, 2019, 35(3): 8-14 (in Chinese). |
| [26] |
内蒙古自治区质量技术监督局. 青贮饲料pH值、有机酸、氨态氮测定方法: DB15/T 1458—2018[S]. 内蒙古: 内蒙古自治区质量技术监督局, 2018. Bureau of Quality and Technical Supervision of Inner Mongolia Autonomous Region. Determination of pH value, organic acid and ammonium nitrogen in silage: DB15/T 1458—2018[S]. Inner Mongolia: Bureau of Quality and Technical Supervision of Inner Mongolia Autonomous Region, 2018. (in Chinese) |
| [27] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中水分的测定: GB/T 6435—2014[S]. 北京: 中国标准出版社, 2014. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, China National Standardization Administration Committee. Determination of moisture in feed: GB/T 6435—2014[S]. Beijing: China Standards Press, 2014. (in Chinese) |
| [28] |
国家市场监督管理总局, 国家标准化管理委员会. 饲料中粗蛋白的测定凯氏定氮法: GB/T 6432—2018[S]. 北京: 中国标准出版社, 2018. State Administration for Market Regulation, Standardization Administration. Determination of crude protein in feeds-Kjeldahl method: GB/T 6432—2018[S]. Beijing: China Standards Press, 2018. (in Chinese) |
| [29] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中粗灰分的测定: GB/T 6438—2007[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, China National Standardization Administration Committee. Animal feeding stuffs-determination of crude ash: GB/T 6438—2007[S]. Beijing: China Standards Press, 2007. (in Chinese) |
| [30] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中中性洗涤纤维(NDF)的测定: GB/T 20806—2006[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, China National Standardization Administration Committee. Determination of neutral detergent fiber in feedstuffs: GB/T 20806—2006[S]. Beijing: China Standards Press, 2007. (in Chinese) |
| [31] |
中华人民共和国农业部. 饲料中酸性洗涤纤维的测定: NY/T 1459—2007[S]. 北京: 农业出版社, 2007. Ministry of Agriculture of the People's Republic of China. Determination of acid detergent fiber in feedstuff (ADF): NY/T 1459—2007[S]. Beijing: Agriculture Press, 2007. (in Chinese) |
| [32] |
江迪, 田朋姣, 李荣荣, 等. 添加戊糖片球菌对苜蓿TMR发酵品质及有氧稳定性的影响[J]. 草学, 2018(增刊1): 69-71. JIANG D, TIAN P J, LI R R, et al. Effect of Pediococcus pentosaceus on fermentation and aerobic stability of alfalfa TMR[J]. Journal of Grassland and Forage Science, 2018(S1): 69-71 (in Chinese). |
| [33] |
王浩, 许丽, 王文梅, 等. 戊糖片球菌对肉仔鸡生长性能、肉品质及抗氧化指标的影响[J]. 中国家禽, 2013, 35(12): 28-32. WANG H, XU L, WANG W M, et al. Effect of Pediococcus pentosaceus on growth performance, meat quality and antioxidant indices of broilers[J]. China Poultry, 2013, 35(12): 28-32 (in Chinese). DOI:10.3969/j.issn.1004-6364.2013.12.008 |
| [34] |
徐凤, 张焕容, 汤承, 等. 一株山羊源戊糖片球菌的益生作用研究[J]. 中国预防兽医学报, 2018, 40(7): 586-591. XU F, ZHANG H R, TANG C, et al. Probiotic potentials of a Pediococcus pentosaceus strain from goat[J]. Chinese Journal of Preventive Veterinary Medicine, 2018, 40(7): 586-591 (in Chinese). |
| [35] |
夏明亮, 程璐. 微生物发酵配合饲料对断奶仔猪生产性能的影响[J]. 粮食与饲料工业, 2019(4): 36-38. XIA M L, CHENG L. Effects of microbial fermentation compound feed on production performance of weaning pigs[J]. Cereal & Feed Industry, 2019(4): 36-38 (in Chinese). |
| [36] |
陈勇, 甄莉. 有机酸在饲料中的应用[J]. 中国饲料, 2004(9): 30-31, 33. CHEN Y, ZHEN L. Application of organic acid in feed[J]. China Feed, 2004(9): 30-31, 33 (in Chinese). DOI:10.3969/j.issn.1004-3314.2004.09.012 |
| [37] |
黄福青, 冯利霞, 张志鸿, 等. 发酵柚子皮戊糖片球菌的分离及生物学特性分析[J]. 中国微生态学杂志, 2018, 30(9): 993-998. HUANG F Q, FENG L X, ZHANG Z H, et al. Isolation and biological characteristics of Pediococcus pentosaceus strains from fermented pomelo peel[J]. Chinese Journal of Microecology, 2018, 30(9): 993-998 (in Chinese). |
| [38] |
JAROSZEWSKI J W, STRØM-HANSEN T, HANSEN L L. Optical stability of gossypol[J]. Chirality, 1992, 4(4): 216-221. DOI:10.1002/chir.530040403 |
| [39] |
NOMEIR A A, ABOU-DONIA M B. Gossypol: high-performance liquid chromatographic analysis and stability in various solvents[J]. Journal of the American Oil Chemists' Society, 1982, 59(12): 546-549. DOI:10.1007/BF02636320 |
| [40] |
吴妍妍, 张文举, 胡猛, 等. 嗜酸乳杆菌生物饲料发酵参数的优化[J]. 黑龙江畜牧兽医, 2013(7): 81-84. WU Y Y, ZHANG W J, HU M, et al. Optimization of fermentation parameters of Lactobacillus acidophilus biological feed[J]. Heilongjiang Animal Science and Veterinary Medicine, 2013(7): 81-84 (in Chinese). |
| [41] |
亓秀晔, 谢全喜, 于佳民, 等. 高效降解棉籽粕中游离棉酚菌株的筛选及复配发酵方式的优化[J]. 中国粮油学报, 2019, 34(1): 99-106. QI X Y, XIE Q X, YU J M, et al. Screening of free gossypol strain in high efficient degrading cottonseed meal and the optimization of compound fermentation[J]. Journal of the Chinese Cereals and Oils Association, 2019, 34(1): 99-106 (in Chinese). |
| [42] |
舒文秀. 棉酚脱毒菌的筛选鉴定及其棉籽粕发酵试验研究[D]. 硕士学位论文. 兰州: 西北民族大学, 2021. SHU W X. Screening and identification of gossypol detoxification bacteria experimental study on fermentation of cottonseed meal[D]. Master's Thesis. Lanzhou: Northwest Minzu University, 2021. (in Chinese) |




