2. 福建省绿色食品发展中心, 福州 350003
2. Fujian Green Food Development Center, Fuzhou 350003, China
N-乙酰半胱氨酸(N-acetylcysteine,NAC)是半胱氨酸的N-乙酰衍生物,也为内源性抗氧化剂谷胱甘肽(GSH)的前体物质[1-2], 存在于青葱、大蒜、韭菜、洋葱等葱属植物中,尤其在洋葱中含量较高(每千克含45 mg NAC)。自20世纪60年代以来,因其能够促进黏液高分子质量糖蛋白中二硫键的断裂,促使黏液黏度降低,NAC被广泛认为是一种优秀的黏液溶解剂,并用于治疗慢性阻塞性肺病、囊性纤维肿等各种呼吸道疾病[3]。20世纪70年代以后,研究发现,NAC具有良好的抗氧化和清除自由基的特性,在临床上可作为治疗乙酰氨基酚过量的解毒剂[4]。此外,NAC还具有良好的安全特性,据临床研究报道,每天口服使用8 000 mg NAC不会使人体产生显著不良反应[5],这为其作为畜禽饲料添加剂的安全性提供了可靠的数据。如今,在全面“禁抗”的大背景下,中草药制剂和其他功能性饲料添加剂在畜禽生产上的应用成为新的研究热点。许多学者发现,NAC在维护畜禽肠道健康[6]、缓解机体氧化应激[7]、提高畜禽繁殖性能[8]等方面具有潜在作用。因此,本文就国内外研究现状总结了NAC的生理功能及其在畜禽生产中的应用,以期为NAC在畜禽生产实践方面提供理论依据,为NAC作为新型饲料添加剂提供参考。
1 NAC的分子结构特性、理化特性及生产方式 1.1 NAC的分子结构特性及理化特性NAC是分子式为C5H9NO3S的白色结晶性粉末,化学结构包括巯基(—SH)、羧基(—COOH)以及与氨基(—NH2)连接的乙酰基(—COCH3),结构式如图 1所示。NAC易溶于水和乙醇,熔点为109~111 ℃,相对分子质量为163.20,pKa=3.24,是一种弱有机酸,有类似蒜的臭气,味酸,有吸湿性。NAC是内源性氨基酸半胱氨酸的N-乙酰衍生物,乙酰基使其抗氧化性更稳定,结构中含有活跃的巯基,可作为细胞内的巯基供体。
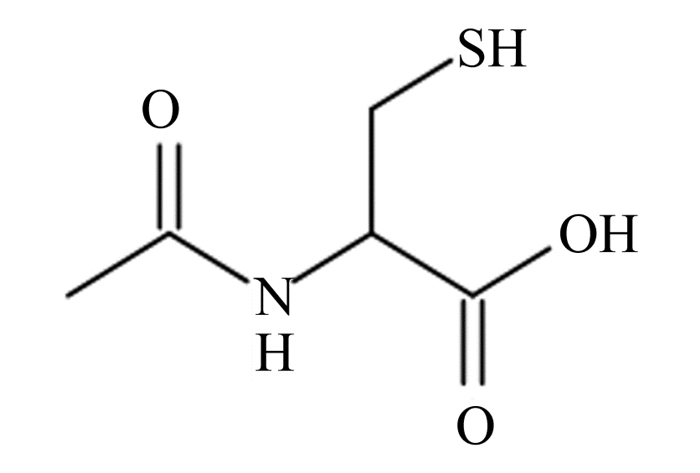
|
图 1 NAC的结构 Fig. 1 Structure of NAC |
NAC一般通过化学合成的方式进行工业化生产,以L-胱氨酸作为底物,打开其双硫键对其氨基进行乙酰化,分为还原和乙酰化2个步骤,根据2个步骤的先后顺序,产生了2种主要的合成方法:1)先还原后乙酰化(图 2);2)先乙酰化后还原(图 3)[9]。
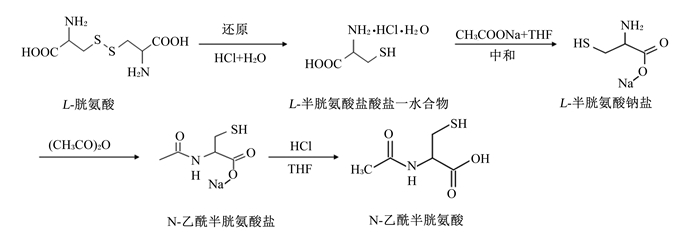
|
图 2 先还原后乙酰化合成路线图 Fig. 2 Process of reduction followed by acetylation[9] |
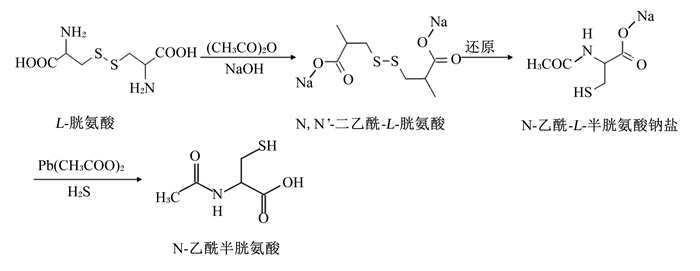
|
图 3 先乙酰化后还原合成路线图 Fig. 3 Process of acetylation followed by reduction[9] |
在生物系统中作为电子受体的分子被称为“氧化剂”或“自由基”,当自由基如活性氧(ROS)和活性氮(RNS)等的产生超过细胞抗氧化能力时,就会发生细胞内氧化应激。过度的氧化应激会损伤蛋白质、脂质(细胞膜)、DNA等生物分子,甚至引起细胞死亡[10],从而导致许多畜禽疾病的发生。此外,自由基还会与多不饱和脂肪酸结构中的不饱和双键发生反应产生脂肪酸过氧基,甚至还可以攻击脂肪酸侧链,引发其他脂质自由基的产生,脂质过氧化的最终产物具有细胞毒性和诱变性。NAC作为抗氧化剂,可通过直接或间接2种途径发挥其抗氧化功能。NAC可通过其结构中的游离巯基提供1个电子与各种自由基结合发生反应,或通过给出1个或2个电子作为亲核试剂来实现其直接抗氧化活性。Balaji等[11]研究表明,NAC能通过结构中的巯基还原高铁血红蛋白,提高红细胞的抗氧化能力。
NAC的间接抗氧化作用是通过促进机体内GSH的生物合成来有效减少自由基的累积效应实现的,合成途径见图 4所示。GSH是机体内最丰富的非蛋白硫醇,也是细胞内主要抗氧化剂之一,除了能直接与活性物质反应外,还充当各种抗氧化酶的辅助因子或底物[12]。细胞内的半胱氨酸浓度较低,因此它是机体应对氧化应激时GSH合成速率的限制因素[13]。研究表明,NAC口服后在小肠中被迅速吸收,血浆浓度可在30 min至1 h内达到峰值[14]。而后通过肝脏代谢在氨基酰化酶-1催化下发生脱乙酰化生成半胱氨酸,半胱氨酸与谷氨酸、甘氨酸在γ-谷氨酰半胱氨酸合成酶和GSH合成酶的共同催化下合成GSH[15],GSH则通过膜转运蛋白释放到血浆中。Esmat等[16]试验表明,NAC能够逆转丙烯腈处理后引起的大鼠大脑中GSH含量的降低,降低脂质过氧化物丙二醛(MDA)含量,进而缓解丙烯腈的神经毒性。
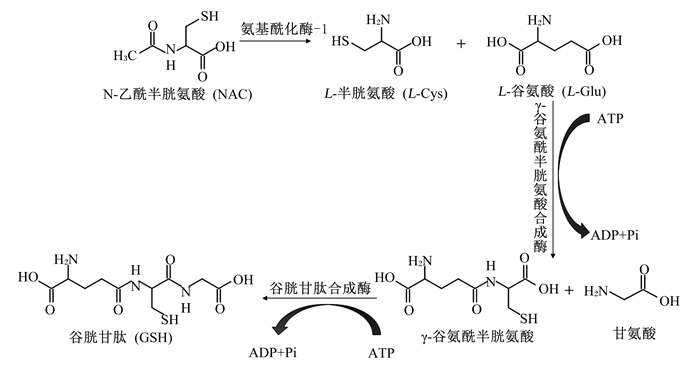
|
图 4 GSH的合成途径 Fig. 4 Synthesis pathway of GSH[15] |
此外,NAC也可通过其游离的巯基与具有细胞毒性的金属离子如镉离子、铅离子、汞离子等结合,形成易于排出体外的螯合物。Martin等[17]报道,静脉注射NAC对于人急性砷中毒的治疗效果优于肌肉注射重金属中毒解毒剂2, 3-二巯基-1-丙醇。且Flora等[18]试验表明,在砷中毒的小鼠饮用水中添加NAC,能显著缓解肝脏和大脑中砷诱导的氧化应激,并迅速降低软组织中砷的含量。
2.2 抗炎及免疫调节功能炎症是机体免疫系统为降低感染引起的组织损伤所释放的细胞因子,其带来的不良影响产生的一系列生理反应。研究表明,炎症与多个信号通路的转导有关,NAC可对炎症通路起调节作用[19]。核转录因子-κB(nuclear factor-kappa B,NF-κB)通常与细胞质中的抑制蛋白IκB-α结合成三聚体复合物,被磷酸化入核后能够介导炎症反应中一系列基因的表达,促进炎性细胞因子如肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)等分泌[20],还可调节B淋巴细胞和T淋巴细胞的成熟[21]。TNF-α是NF-κB信号通路的上游调节分子,NAC可通过调节TNF-α与TNF受体1和TNF受体2的相互作用,降低TNF-α与其受体的亲和力,干扰NF-κB信号通路;此外,NAC还可通过去除ROS,抑制IκB激酶β(IKKβ)和NF-κB的核易位来阻止NF-κB的活化,从而抑制其下游细胞因子的基因表达水平[1](图 3)。研究表明,白细胞介素-8(IL-8)、IL-6和TNF-α在感染A型、B型流感病毒或呼吸道合胞病毒的肺泡Ⅱ型细胞中的表达和释放水平可被NAC显著抑制[22]。此外,研究表明,NAC还可调控磷脂酰肌醇3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋(PI3K/Akt/mTOR)信号通路进而调节机体免疫力,mTOR是PI3K/Akt通路下游的关键激酶,可调节肿瘤细胞增殖、生长、存活和血管生成[23]。Chen等[24]研究发现,NAC能够抑制Akt/mTOR途径所涉及的所有蛋白质的磷酸化,阻断PI3K/Akt/mTOR炎症信号通路,从而增强自然杀伤细胞的抗肿瘤活性,提高机体免疫力。此外,NAC还可通过增加细胞内硫醇的含量,促进辅助性T细胞向2型分化,产生辅助性T细胞2(Th2)从而抑制炎症反应。辅助性T细胞1(Th1)主要释放TNF-α和白细胞介素-12(IL-12)(促炎细胞因子),而Th2细胞分泌IL-10(抑炎细胞因子)[25]。
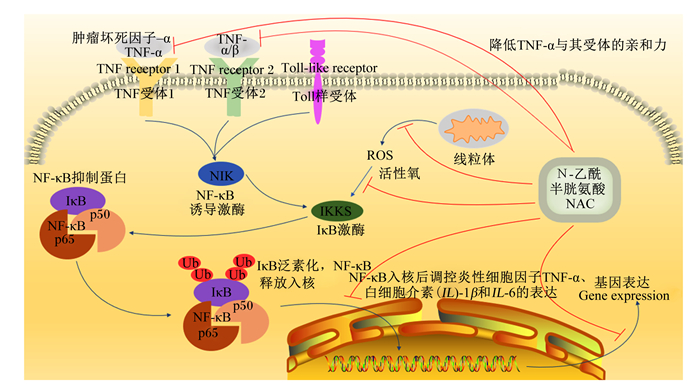
|
图 5 NAC调控NF-κB信号通路示意图 Fig. 5 Schematic diagram of NAC regulating NF-κB signaling pathway[1] |
NAC具有良好的抗菌能力,能够干扰革兰氏阳性和革兰氏阴性细菌生物膜的形成并破坏已形成的细菌生物膜。Eroshenko等[26]发现,在痤疮丙酸杆菌和表皮葡萄球菌混合培养基中加入12.5 mg/mL NAC能够显著抑制细菌生物膜的形成和生长,当NAC浓度为25 mg/mL时,细菌生物膜的生长减少了50%以上。此外,NAC还与抗生素具有协同作用。El-Feky等[27]研究发现,NAC能够通过降解生物膜的胞外多糖基质提高环丙沙星的治疗效果,抑制大肠杆菌的黏附和生长。然而,NAC的抗菌机制在很大程度上仍未知,因此值得进一步对其进行研究,以充分了解NAC在抵御细菌感染方面的潜力。此前有人提出,NAC的抗菌活性可能与以下原因有关:1)阻止细菌细胞对半胱氨酸的利用;2)结构中的巯基与细菌生物膜蛋白的相互作用;3)调节细胞内氧化还原平衡对细胞代谢和细胞内信号转导的影响;4)影响细菌生物膜矩阵结构(例如,通过与钙和镁的螯合或与细菌生物膜中的关键成分的相互作用)[28-29]。此外,Li等[30]指出,作为弱有机酸NAC诱导的pH变化对其抗生物膜活性具有重要作用,但pH不是NAC破坏生物膜的唯一因素,NAC具有通过影响细菌或破坏细菌胞外聚合物或共同影响两者来改变生物膜完整性的其他特性,从而导致生物膜的分解,且乙酰基和羧基在NAC生物膜分解能力中起重要作用。
2.4 调节脂肪代谢诸多体外研究表明,NAC能够降低金属硫蛋白以及各种脂肪合成的相关标志物,如脂肪酸结合蛋白4、转酮醇酶和脂滴包被蛋白(Perilipin)等的含量。Chang等[31]用10 mmol/L NAC处理3T3-L1前脂肪细胞,发现NAC能够减少ROS形成并通过抑制CCAAT增强子结合蛋白α(C/EBPα)和过氧化物增殖激活受体α(PPARα)的表达来抑制脂肪生成。Lee等[32]研究表明,NAC能够显著减少游离脂肪酸诱导的Perilipin表达,抑制脂肪细胞分化。此外,NAC还可通过调节胰岛素信号转导途径的关键分子,磷脂酰肌醇-3-激酶活性和胰岛素受体基质-1磷酸化,缓解胰岛素抵抗,进而调控脂肪代谢。Xiao等[33]试验结果显示,NAC能够有效地抑制暴饮暴食小鼠肝脏中脂肪的积累,并认为这可能与其能够抑制激素敏感脂肪酶的磷酸化有关。以上结果表明,NAC可能也对畜禽脂肪代谢起一定促进作用,并能够抑制畜禽体内脂肪的沉积。
3 NAC在畜禽生产中的应用 3.1 鸡NAC对鸡影响的研究主要集中于改善生产性能、缓解应激等方面。赵熠群等[34]发现,蛋鸡饲粮中添加NAC能够显著降低热应激时蛋鸡血清中MDA含量,且效果与NAC含量呈一定剂量依赖关系,0.5% NAC能够显著提高蛋鸡血清中SOD活性以及GSH含量,对蛋黄色泽没有显著影响但能减轻蛋鸡热应激带来的鸡蛋哈夫单位下降这一不良影响,且能够一定程度上缓解热应激造成的产蛋率下降,降低料蛋比。Valvidia等[35]报道指出,NAC对黄曲霉毒素B1引起的肉鸡生产性能降低、肝肾损害具有保护作用,且饲粮中单独添加800 mg/kg NAC对肉仔鸡的饲料消耗、转化率或血清生化指标无负面影响,也不会诱发肝脏或肾脏的组织损伤。王惠云等[36]研究指出,饲粮中添加0.1% NAC可以改善冷应激条件下肉鸡的肠道组织形态,降低空肠、回肠隐窝深度(CD),CD可反映肠道干细胞活性和功能,隐窝越浅,细胞成熟度越好,分泌功能越好;同时可以提高肠绒毛高度和隐窝深度的比值(VH/CD),而VH/CD常与动物的生长速度呈正相关。杨淑霞等[37]试验结果也表明,饲粮添加0.1% NAC可以提高热应激条件下肉鸡的平均日采食量和平均日增重,降低热休克蛋白70和血红素氧化酶mRNA相对表达水平,改善肠绒毛形态,提高胰蛋白酶含量,维持肉鸡肠道健康,从而提高其生长性能。贺绍君等[38]研究发现,饮水中添加0.2% NAC可有效缓解热应激状态下肉鸡肾脏功能的损伤,从而使其发挥正常的排泄功能,降低血清尿酸、肌酐及尿素含量。冯倩倩等[39]报道指出,在蛋白质水平降低4.5个百分点的肉仔鸡饲粮中添加0.15%半胱氨酸能改善肉仔鸡生长阶段的日增重、采食量以及饲料转化率、氮留存率,而NAC作为半胱氨酸稳定的前体物质,其在低蛋白质饲粮中的作用值得深入研究。
此外,NAC对延长鸡精液的低温保存时间、提升精子活力有一定作用。邱自贵等[40]探究了NAC对安卡红种公鸡精液低温保存过程中的生存能力和精子畸形率的影响,发现稀释剂中添加NAC可以极显著延长鸡精液低温保存时间,添加0.013 mol/L NAC的保存效果优于0.002 6 mol/L,但对精子畸形率均无显著影响。李洁等[41]的研究结果也表明,0.25和0.50 mmol/L NAC可以显著提高种公鸡精子生存指数及延长精子的存活时间,但当浓度超过1 mmol/L时则会对精子生存指数和存活时间产生负面影响。
3.2 鸭关于NAC在鸭生产应用上的研究较少。杨书慧等[42]试验表明,饲粮中添加500、1 000 mg/kg NAC均可降低肉鸭回肠二磷酸腺苷含量、空肠和回肠单磷酸腺苷(AMP)和腺苷池水平以及空肠AMP与三磷酸腺苷(ATP)的比值,提高空肠腺苷酸能荷(AEC),说明NAC能够提高肉鸭空肠的能量储备,NAC还可降低空肠MDA和过氧化氢(H2O2)含量,增加空肠、回肠过氧化氢酶(CAT)的活性,提升肉鸭抗氧化能力,且高剂量的NAC作用效果更好,猜测NAC可能是通过下调AMP依赖的蛋白激酶-α1(AMPK-α1)、缺氧诱导因子-1α(HIF-1α)和黄嘌呤氧化还原酶(XOR)的表达水平实现对回肠的能量代谢和抗氧化力的改善作用。谭灵琳等[43]研究表明,与对照组相比,饲粮添加0.1% NAC可显著减低肉鸭料重比,提高肉鸭肝脏抗氧化能力。以上结果表明,在肉鸭饲粮添加NAC能够提升其抗氧化能力,并在一定程度上改善机体能量代谢。体外试验证明,NAC对于脂肪代谢也具有一定的调节作用,其能够抑制脂肪沉积[44],且在现代肉鸭生产中,经选育所得的现代肉鸭优良品种在生长速度加快的同时,也出现了体脂尤其是皮下脂肪沉积过多的问题,因此NAC对肉鸭脂肪代谢的影响有待进一步研究,以便使其能更好地应用于现代肉鸭生产中。
3.3 猪国内现代化大规模的母猪生产已逐步采用仔猪超早期断奶技术,有的猪场甚至提前至10日龄。但仔猪超早期断奶后常出现肠道微生物系统失调、免疫力降低、抗病力弱等应激现象进而导致仔猪生长性能下降。周佳等[45]研究发现,NAC灌胃可显著提高超早期断奶仔猪的平均日增重,恢复肠道屏障功能,提高氨基酸吸收利用率。Wang等[46]探究了NAC在抗营养因子β-伴大豆球蛋白(β-CG)的存在下对仔猪肠道功能的影响,发现NAC可使β-CG处理后的仔猪腹泻率降低46.2%,并降低仔猪空肠中H2O2与MDA的含量,但增加了紧密连接蛋白闭合蛋白-1(Claudin-1)和肠脂肪酸结合蛋白(iFABP)的丰度,同时提高了CAT和谷胱甘肽过氧化物酶(GSH-Px)的活性,并缓解β-CG对肠VH、VH/CD造成的不良影响,NAC还增加了仔猪血浆中瓜氨酸和D-木糖的含量,以及空肠中转运蛋白的含量,表明NAC可增强仔猪肠道代谢活动和吸收功能。李少华等[47]试验表明,与对照组相比,饲粮添加500 mg/kg NAC显著降低断奶仔猪料重比,并降低断奶仔猪血清中MDA和H2O2含量,提高GSH-Px和SOD的活性,同时增加了血清中免疫球蛋白M(IgM)的含量,提高抗氧化能力和免疫力,从而缓解断奶应激。
卵巢颗粒细胞能够与卵母细胞进行的信号传导,对卵母细胞的生长与成熟的调控起重要作用。卵巢颗粒细胞同时能分泌孕酮和雌二醇等类固醇激素,这对雌性动物正常生理节律和妊娠过程起十分重要的调控作用。研究发现,体外补充NAC有利于体外培养猪卵巢颗粒细胞的生长与增殖,显著提高孕酮和雌二醇的分泌量[48]。热应激会损害卵母细胞的成熟,降低猪卵母细胞的发育能力和胚胎发育。NAC可保护猪卵母细胞免受热应激的侵害,并改善胚胎发育能力[49]。另有报道指出,补充1.5 mmol/L NAC可改善体外培养猪卵母细胞生长、增殖和成熟[50]。体外试验研究表明,当妊娠和哺乳母猪长期摄入被玉米赤霉烯酮污染的饲粮时,会使健康的卵泡数量减少,损害猪卵母细胞的成熟,诱导氧化应激反应,影响卵母细胞的相关基因表达,从而导致卵母细胞过早的耗竭,并降低繁殖性能,而NAC可以在一定程度上逆转玉米赤霉烯酮产生的生殖毒性[51]。
3.4 反刍动物NAC在反刍动物上的研究主要关注于其对繁殖性能及生产性能的影响。宋天增等[52]探究NAC对藏山羊公羊诱导同期发情率与妊娠前期血清雌二醇和孕酮含量的影响,发现在妊娠前期饲粮中添加0.05% NAC能提高藏山羊母羊被公羊诱导发情效果与外周血液中雌二醇和孕酮含量。Luo等[8]研究发现,饲粮添加0.07% NAC可提高妊娠早期山羊胚胎的存活率,其可能的机制为NAC可使妊娠母羊血清中一氧化氮(NO)产量增加,提高子宫内膜抗炎途径中涉及的一些基因的转录水平,从而促进胚胎的存活和生长。Xu等[53]鉴定发现,磷脂酰肌醇特异性磷酯酶CΒ3(PLCB3)是与窝产仔数相关的基因,且近年来研究表明,基质金属蛋白酶2(MMP2)基因对于动物繁殖性能有一定影响[54]。唐文等[55]研究表明,饲粮中添加0.07% NAC会降低PLCB3基因在性腺器官中的表达量,并提高MMP2基因表达量,进而影响努比亚山羊的繁殖性能。此外,NAC还可提高冷冻公畜精子的质量,在稀释液中添加1.0 mmol/L NAC能提高精子有效存活时间、总存活时间和48 h精子的顶体完整率,显著改善绵羊精液的低温保存效果[56]。以上研究结果均表明,NAC对公畜和母畜的繁殖性能均有一定影响,其可提高母畜诱导发情的效果,促进早期胚胎的存活和生长,使公畜精液在低温保存过程中免受ROS引起的氧化性损伤,但具体影响机制有待进一步研究。
4 小结综上所述,NAC具有抗氧化、抗炎、抗菌及调节脂肪代谢等生理功能,且NAC作为硫醇分子极其稳定,价格低廉,具有广阔的应用前景。但由于其极强的疏水性,NAC在口服给药时显示出低生物利用率这一现象。NAC摄入后能够到达血浆和组织的浓度较低,生物利用率仅为6%~10%,因此,如何提高NAC的生物利用率有待进一步研究。且NAC和其他饲料添加剂或营养因子进行联合使用的研究甚少,无法明确其与其他饲料成分是否存在拮抗作用与协同作用。NAC在畜禽应用上的研究对象主要为肉鸡与猪,而在其他动物上的研究应用较少,且目前NAC的作用机制尚存争议,因此应继续对NAC的作用机制进行研究,以便其能更好地应用于畜禽生产之中。
| [1] |
WANG Y L, KIM R, HWANG S H J, et al. Analysis of interleukin 8 secretion by a stem-cell-derived human-intestinal-epithelial-monolayer platform[J]. Analytical Chemistry, 2018, 90(19): 11523-11530. DOI:10.1021/acs.analchem.8b02835 |
| [2] |
ŠALAMON Š, KRAMAR B, MAROLT T P, et al. Medical and dietary uses of N-acetylcysteine[J]. Antioxidants, 2019, 8(5): 111. DOI:10.3390/antiox8050111 |
| [3] |
LIN X, WEI M M, SONG F Y, et al. N-acetylcysteine (NAC) attenuating apoptosis and autophagy in RAW264.7 cells in response to incubation with mycolic acid from bovine Mycobacterium tuberculosis complex[J]. Polish Journal of Microbiology, 2020, 69(2): 223-229. DOI:10.33073/pjm-2020-026 |
| [4] |
WOODHEAD K, FOEX B A. BET 1:in paracetamol overdose, is oral N-acetylcysteine as effective as intravenous N-acetylcysteine?[J]. Emergency Medicine Journal, 2018, 35(10): 643-645. |
| [5] |
ZHANG Q W, JU Y R, MA Y, et al. N-acetylcysteine improves oxidative stress and inflammatory response in patients with community acquired pneumonia: a randomized controlled trial[J]. Medicine, 2018, 97(45): e13087. DOI:10.1097/MD.0000000000013087 |
| [6] |
LEE S I, KANG K S. N-acetylcysteine modulates lipopolysaccharide-induced intestinal dysfunction[J]. Scientific Reports, 2019, 9(1): 1004. DOI:10.1038/s41598-018-37296-x |
| [7] |
RAGHU G, BERK M, CAMPOCHIARO P A, et al. The multifaceted therapeutic role of N-acetylcysteine (NAC) in disorders characterized by oxidative stress[J]. Current Neuropharmacology, 2021, 19(8): 1202-1224. DOI:10.2174/1570159X19666201230144109 |
| [8] |
LUO J H, AO Z, DUAN Z Q, et al. Effects of N-acetylcysteine on the reproductive performance, oxidative stress and RNA sequencing of Nubian goats[J]. Veterinary Medicine and Science, 2021, 7(1): 156-163. DOI:10.1002/vms3.338 |
| [9] |
张成耀. 由L-胱氨酸直接制备N-乙酰-L-半胱氨酸的工程研究[D]. 硕士学位论文. 长春: 吉林大学, 2021: 18-20. ZHANG C Y. Research on the direct preparation from L-cystine to N-acetyl-L-cysteine[D]. Master's Thesis. Changchun: Jilin University, 2021: 18-20. (in Chinese) |
| [10] |
PEI Y P, LIU H, YANG Y, et al. Biological activities and potential oral applications of N-acetylcysteine: progress and prospects[J]. Oxidative Medicine and Cellular Longevity, 2018, 2018: 2835787. |
| [11] |
BALAJI S N, TRIVEDI V. Suicidal inactivation of methemoglobin by generation of thiyl radical: insight into NAC mediated protection in RBC[J]. Current Molecular Medicine, 2013, 13(6): 1000-1009. DOI:10.2174/15665240113139990054 |
| [12] |
ALDINI G, ALTOMARE A, BARON G, et al. N-acetylcysteine as an antioxidant and disulphide breaking agent: the reasons why[J]. Free Radical Research, 2018, 52(7): 751-762. DOI:10.1080/10715762.2018.1468564 |
| [13] |
HIGASHI Y, ARATAKE T, SHIMIZU T, et al. Protective role of glutathione in the hippocampus after brain ischemia[J]. International Journal of Molecular Sciences, 2021, 22(15): 7765. DOI:10.3390/ijms22157765 |
| [14] |
DE CARO L, GHIZZI A, COSTA R, et al. Pharmacokinetics and bioavailability of oral acetylcysteine in healthy volunteers[J]. Arzneimittelforschung, 1989, 39(3): 382-386. |
| [15] |
BALAMURUGAN T S T, HUANG C H, CHANG P C, et al. Electrochemical molecular switch for the selective profiling of cysteine in live cells and whole blood and for the quantification of aminoacylase-1[J]. Analytical Chemistry, 2018, 90(21): 12631-12638. DOI:10.1021/acs.analchem.8b02799 |
| [16] |
ESMAT A, EL-DEMERDASH E, EL-MESALLAMY H, et al. Toxicity and oxidative stress of acrylonitrile in rat primary glial cells: preventive effects of N-acetylcysteine[J]. Toxicology Letters, 2007, 171(3): 111-118. DOI:10.1016/j.toxlet.2007.05.001 |
| [17] |
MARTIN D S, WILLIS S E, CLINE D M. N-acetylcysteine in the treatment of human arsenic poisoning[J]. The Journal of the American Board of Family Practice, 1990, 3(4): 293-296. |
| [18] |
FLORA S J. Arsenic-induced oxidative stress and its reversibility following combined administration of N-acetylcysteine and meso 2, 3-dimercaptosuccinic acid in rats[J]. Clinical and Experimental Pharmacology & Physiology, 1999, 26(11): 865-869. |
| [19] |
YEUNG Y T, AZIZ F, GUERRERO-CASTILLA A, et al. Signaling pathways in inflammation and anti-inflammatory therapies[J]. Current Pharmaceutical Design, 2018, 24(14): 1449-1484. DOI:10.2174/1381612824666180327165604 |
| [20] |
CSONTOS C, REZMAN B, FOLDI V, et al. Effect of N-acetylcysteine treatment on oxidative stress and inflammation after severe burn[J]. Burns, 2012, 38(3): 428-437. DOI:10.1016/j.burns.2011.09.011 |
| [21] |
KAR MAHAPATRA S, BHATTACHARJEE S, CHAKRABORTY S P, et al. Alteration of immune functions and Th1/Th2 cytokine balance in nicotine-induced murine macrophages: immunomodulatory role of eugenol and N-acetylcysteine[J]. International Immunopharmacology, 2011, 11(4): 485-495. DOI:10.1016/j.intimp.2010.12.020 |
| [22] |
MATA M, MORCILLO E, GIMENO C, et al. N-acetyl-L-cysteine (NAC) inhibit mucin synthesis and pro-inflammatory mediators in alveolar type Ⅱ epithelial cells infected with influenza virus A and B and with respiratory syncytial virus (RSV)[J]. Biochemical Pharmacology, 2011, 82(5): 548-555. DOI:10.1016/j.bcp.2011.05.014 |
| [23] |
AOKI M, FUJISHITA T. Oncogenic roles of the PI3K/AKT/mTOR axis[J]. Current Topics in Microbiology and Immunology, 2017, 407: 153-189. |
| [24] |
CHEN S J, REN Q, ZHANG J F, et al. N-acetyl-L-cysteine protects against cadmium-induced neuronal apoptosis by inhibiting ROS-dependent activation of Akt/mTOR pathway in mouse brain[J]. Neuropathology and Applied Neurobiology, 2014, 40(6): 759-777. |
| [25] |
MICHAILIDIS Y, KARAGOUNIS L G, TERZIS G, et al. Thiol-based antioxidant supplementation alters human skeletal muscle signaling and attenuates its inflammatory response and recovery after intense eccentric exercise[J]. The American Journal of Clinical Nutrition, 2013, 98(1): 233-245. DOI:10.3945/ajcn.112.049163 |
| [26] |
EROSHENKO D, POLYUDOVA T, KOROBOV V. N-acetylcysteine inhibits growth, adhesion and biofilm formation of gram-positive skin pathogens[J]. Microbial Pathogenesis, 2017, 105: 145-152. |
| [27] |
EL-FEKY M A, EL-REHEWY M S, HASSAN M A, et al. Effect of ciprofloxacin and N-acetylcysteine on bacterial adherence and biofilm formation on ureteral stent surfaces[J]. Polish Journal of Microbiology, 2009, 58(3): 261-267. |
| [28] |
OLSON D H, BURRILL J S, KUZMICIC J, et al. Down regulation of peroxiredoxin-3 in 3T3-L1 adipocytes leads to oxidation of Rictor in the mammalian-target of rapamycin complex 2 (mTORC2)[J]. Biochemical and Biophysical Research Communications, 2017, 493(3): 1311-1317. DOI:10.1016/j.bbrc.2017.09.171 |
| [29] |
ZHAO T M, LIU Y N. N-acetylcysteine inhibit biofilms produced by Pseudomonas aeruginosa[J]. BMC Microbiology, 2010, 10: 140. DOI:10.1186/1471-2180-10-140 |
| [30] |
LI X, KIM J, WU J B, et al. N-Acetyl-cysteine and mechanisms involved in resolution of chronic wound biofilm[J]. Journal of Diabetes Research, 2020, 2020: 9589507. |
| [31] |
CHANG Y C, YU Y H, SHEW J Y, et al. Deficiency of NPGPx, an oxidative stress sensor, leads to obesity in mice and human[J]. EMBO Molecular Medicine, 2013, 5(8): 1165-1179. DOI:10.1002/emmm.201302679 |
| [32] |
LEE R, JUNG I, PARK M, et al. Real-time monitoring of adipocyte differentiation using a capacitance sensor array[J]. Lab on a Chip, 2013, 13(17): 3410-3416. |
| [33] |
XIAO M, YANG R, GUAN M J, et al. [Protective effects of N-acetyl-L-cysteine against binge drinking-induced fatty liver in mice][J]. Chinese Journal of Industrial Hygiene and Occupational Diseases, 2018, 36(3): 169-173. |
| [34] |
赵熠群, 顾剑新, 陈国. N-乙酰半胱氨酸对热应激蛋鸡生产指标及抗氧化指标的影响[J]. 畜牧与兽医, 2018, 50(2): 31-35. ZHAO Y Q, GU J X, CHEN G. Effects of N-acetylcysteine on production and antioxidant indexes in heat stressed laying hens[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(2): 31-35 (in Chinese). |
| [35] |
VALDIVIA A G, MARTÍNEZ A, DAMIÁN F J, et al. Efficacy of N-acetylcysteine to reduce the effects of aflatoxin B1 intoxication in broiler chickens[J]. Poultry Science, 2001, 80(6): 727-734. |
| [36] |
王惠云, 廖满, 王蕾, 等. N-乙酰半胱氨酸和冷应激对肉鸡肠道组织形态、能量代谢和抗氧化能力的影响[J]. 中国畜牧杂志, 2018, 54(2): 52-59. WANG H Y, LIAO M, WANG L, et al. Effects of N-acetylcysteine and cold stress on intestinal morphology, energy status and antioxidant capacity in broilers[J]. Chinese Journal of Animal Science, 2018, 54(2): 52-59 (in Chinese). |
| [37] |
杨淑霞, 线萍, 关樁慧. N-乙酰半胱氨酸对热应激条件下肉仔鸡生长性能、肠道能量和抗氧化状态及空肠形态的影响[J]. 中国饲料, 2018(10): 19-24. YANG S X, XIAN P, GUAN Z H. Effects of supplementation of N-acetylcysteine on growth performance, intestinal energy and antioxidation status, and intestinal morphology of broilers under heat-stressed[J]. China Feed, 2018(10): 19-24 (in Chinese). |
| [38] |
贺绍君, 李静, 刘德义. N-乙酰半胱氨酸对慢性热应激肉鸡肾脏功能损伤的缓解作用[J]. 黑龙江畜牧兽医, 2017(24): 158-160. HE S J, LI J, LIU D Y. Alleviated effects of N-acetylcysteine on renal function injury in heat stressed broilers[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(24): 158-160 (in Chinese). |
| [39] |
冯倩倩, 王晶, 武书庚, 等. 低蛋白质饲粮中添加半胱氨酸对肉仔鸡生长性能、胴体组成、血清生化指标及氮代谢的影响[J]. 动物营养学报, 2021, 33(6): 3259-3270. FENG Q Q, WANG J, WU S G, et al. Effects of cysteine supplementation in low protein diet on growth performance, carcass composition, serum biochemical parameters and nitrogen metabolism of broilers[J]. Chinese Journal of Animal Nutrition, 2021, 33(6): 3259-3270 (in Chinese). |
| [40] |
邱自贵, 赵万乐, 陈二平, 等. 含N-乙酰半胱氨酸稀释液对鸡精液低温保存效果的影响[J]. 畜牧与饲料科学, 2016, 37(8): 27-29, 34. QIU Z G, ZHAO W L, CHEN E P, et al. Effect of addition of N-acetyl-cysteine in the extender on cryo-preservation quality of chicken semen[J]. Animal Husbandry and Feed Science, 2016, 37(8): 27-29, 34 (in Chinese). |
| [41] |
李洁, 董瑞生, 王建福, 等. 稀释液中添加不同抗氧化剂对鸡精液保存的影响[J]. 甘肃畜牧兽医, 2019, 49(1): 39-44. LI J, DONG R S, WANG J F, et al. Effects of different antioxidants on the preservation of chicken semen in diluent[J]. Gansu Animal and Veterinary Sciences, 2019, 49(1): 39-44 (in Chinese). |
| [42] |
杨书慧, 毕云天, 程强, 等. N-乙酰半胱氨酸对樱桃谷鸭肠道能量代谢和抗氧化功能的影响[J]. 中国畜牧杂志, 2020, 56(4): 122-127. YANG S H, BI Y T, CHENG Q, et al. Effects of N-acetyl-cysteine on intestinal energy metabolism and antioxidant function of cherry valley duck[J]. Chinese Journal of Animal Science, 2020, 56(4): 122-127 (in Chinese). |
| [43] |
谭灵琳, 侯永清, 易丹, 等. N-乙酰半胱氨酸对肉鸭肝脏能量代谢状况及组织抗氧化指标的影响[J]. 中国畜牧杂志, 2015, 51(17): 53-58. TAN L L, HOU Y Q, YI D, et al. Effects of N-actylcysteine on liver energy metabolic status and antioxidative capacity of ducks[J]. Chinese Journal of Animal Science, 2015, 51(17): 53-58 (in Chinese). |
| [44] |
YANG J P, SHIN J H, SEO S H, et al. Effects of antioxidants in reducing accumulation of fat in hepatocyte[J]. International Journal of Molecular Sciences, 2018, 19(9): 2563. |
| [45] |
周佳, 李鹏, 程强, 等. N-乙酰半胱氨酸灌胃对超早期断奶仔猪血浆中游离氨基酸及小肠形态结构与功能的影响[J]. 中国畜牧杂志, 2018, 54(4): 50-54. ZHOU J, LI P, CHENG Q, et al. Effects of intragastric administration of N-acetylcysteine on plasma free amino acid composition and intestinal structure and function in ultral-early weaned pigs[J]. Chinese Journal of Animal Science, 2018, 54(4): 50-54 (in Chinese). |
| [46] |
WANG H Y, LI C C, PENG M, et al. N-acetylcysteine improves intestinal function and attenuates intestinal autophagy in piglets challenged with β-conglycinin[J]. Scientific Reports, 2021, 11(1): 1261. |
| [47] |
李少华, 罗振, 罗文丽, 等. 不同抗氧化剂对断奶仔猪生产性能、抗氧化能力和免疫能力的影响[J]. 猪业科学, 2017, 34(3): 87-89. LI S H, LUO Z, LUO W L, et al. Effects of different antioxidants on production performance, antioxidant capacity and immunity of weaned piglets[J]. Swine Industry Science, 2017, 34(3): 87-89 (in Chinese). |
| [48] |
郭晓飞, 张金龙, 李义海, 等. 添加N-乙酰半胱氨酸对猪卵巢颗粒细胞体外培养的影响[J]. 黑龙江畜牧兽医, 2020(23): 59-62. GUO X F, ZHANG J L, LI Y H, et al. Effects of N-acetylcysteine on porcine ovarian granulosa cell culture in vitro[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020(23): 59-62 (in Chinese). |
| [49] |
HU X, CHENG L H, WANG X D, et al. N-acetyl-L-cysteine protects porcine oocytes undergoing meiotic resumption from heat stress[J]. Reproductive Toxicology, 2020, 91: 27-34. |
| [50] |
WHITAKER B D, KNIGHT J W. Effects of N-acetyl-cysteine and N-acetyl-cysteine-amide supplementation on in vitro matured porcine oocytes[J]. Reproduction in Domestic Animals, 2010, 45(5): 755-759. |
| [51] |
LAI F N, MA J Y, LIU J C, et al. The influence of N-acetyl-L-cysteine on damage of porcine oocyte exposed to zearalenone in vitro[J]. Toxicology and Applied Pharmacology, 2015, 289(2): 341-348. |
| [52] |
宋天增, 巴贵, 次仁德吉, 等. N-乙酰半胱氨酸对藏山羊母羊被公羊诱导发情效果与妊娠前期外周血液雌二醇和孕酮浓度的影响[J]. 西藏农业科技, 2020, 42(3): 1-4. SONG T Z, BA G, CIRENDEJI, et al. Effects of NAC on induction of estrus synchronization in 2-year-old ewes by ram and levels of peripheral blood estradiol and progesterone of Tibetan goats during pre pregnancy[J]. Tibet Journal of Agricultural Sciences, 2020, 42(3): 1-4 (in Chinese). |
| [53] |
XU S S, GAO L, XIE X L, et al. Genome-wide association analyses highlight the potential for different genetic mechanisms for litter size among sheep breeds[J]. Frontiers in Genetics, 2018, 9: 118. |
| [54] |
YAN Y, FANG L L, LI Y X, et al. Association of MMP2 and MMP9 gene polymorphisms with the recurrent spontaneous abortion: a meta-analysis[J]. Gene, 2021, 767: 145173. |
| [55] |
唐文, 骆金红, 敖叶, 等. N-乙酰半胱氨酸对努比亚山羊PLCB3和MMP2基因表达的影响[J]. 黑龙江畜牧兽医, 2020(13): 12-16, 21. TANG W, LUO J H, AO Y, et al. Effect of N-acetylcysteine on PLCB3, MMP2 gene expression in Nubian goats[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020(13): 12-16, 21 (in Chinese). |
| [56] |
李春阳, 蔡元, 臧荣鑫, 等. N-乙酰半胱氨酸对绵羊精液低温保存效果的影响[J]. 黑龙江畜牧兽医, 2020(13): 59-61, 67. LI C Y, CAI Y, ZANG R X, et al. Effect of adding N-acetylcysteine on low temperature preservation of sheep semen[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020(13): 59-61, 67 (in Chinese). |




