2. 河北农业大学动物科学技术学院, 保定 071000
2. College of Animal Science and Technology, Hebei Agricultural University, Baoding 071000, China
花椒(Zanthoxylum bungeanum Maxim.)是芸香科、花椒属中的落叶灌木或小乔木,别名为大椒、秦椒、蜀椒或山椒,在我国各地均有分布,其干燥成熟果皮是我国传统的香辛料之一[1]。《本草纲目》中记载花椒“性温、味苦,散寒除湿,解郁结,消宿食,通三焦,温脾胃,补右肾命门,杀蛔虫,止泄泻”。我国是花椒第一大生产国,栽培面积已达100万hm2,花椒作为传统香辛料在食品工业被广泛应用。研究表明,饲粮中添加0.3%花椒粉可以改善蛋品质量[2],但其对蛋鸡生产性能的影响尚未见报道。花椒主要活性成分为花椒精油、酚类、黄酮、生物碱和木脂素等[3],具有通络活血、降血脂以及降胆固醇等重要生理调节功能[4],但其在蛋鸡生产中的应用效果还有待验证。因此,本研究旨在探讨蛋鸡饲粮中添加花椒粉对蛋鸡生产性能、蛋品质、血浆生化指标和盲肠菌群的影响,为花椒作为一种新型饲粮原料的研究与开发利用提供科学的数据参考。
1 材料与方法 1.1 试验材料本试验采用原产地域保护产品——韩城大红袍花椒,其挥发油含量保证值≥6.0%,醚溶解物含量保证值≥8.88%(国家质量监督检验检疫总局公告2004年第114号,2004-08-31);其中,挥发油主要成分包括柠檬烯、(R)-4-甲基-1-异丙基-3-环己烯-1-醇、β-月桂烯、γ-松油烯、β-水芹烯和芳樟醇等。花椒采购自河北省保定市涿州市香辛料市场,粉碎后过20目筛备用。
1.2 试验设计试验采用单因素试验设计,选取50周龄“京粉1号”蛋鸡30只[初始产蛋率差异不显著(P>0.05)],随机分为对照组和试验组,每组15个重复,每个重复1只鸡。对照组饲喂玉米-豆粕型基础饲粮,试验组饲喂在基础饲粮基础上添加0.5%花椒粉的饲粮。试验预试期1周,正试期8周。基础饲粮参照《鸡饲养标准》(NY/T 33—2004)配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of the basal diet (as fed-basis) |
饲养试验在中国农业大学涿州试验基地进行,采用封闭式鸡舍,3层阶梯式笼养,每只鸡于每天07:30饲喂,饲喂量为110 g/d,乳头饮水器自由饮水,每周末截料称重1次。鸡舍内采用纵向负压式通风,温度为18~25 ℃,相对湿度为50%~60%,每日光照16 h,光照强度16 lx。
1.4 检测指标及方法 1.4.1 生产性能和蛋品质以重复为单位,每天准确记录产蛋数和蛋重,计算产蛋率、平均日产蛋量和平均蛋重;于每周末统计1次耗料量,计算平均日采食量和料蛋比。计算公式如下:

|
在第58周龄的最后3 d,收集所有鸡蛋用于蛋品质测定(30枚/组),包括蛋重、蛋壳颜色(钝、中、锐)、蛋壳强度、蛋壳厚度(钝、中、锐)和哈夫单位等。用蛋壳厚度测定仪(ESTG-1)测定蛋壳厚度,用蛋壳强度测定仪测定蛋壳强度,用全自动蛋品质分析仪测定哈夫单位和蛋重(以上仪器均购自Oka Technology公司),用蛋壳颜色测量仪(QCR)测定蛋壳颜色(钝、中、锐)。
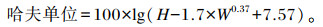
|
式中:H为浓蛋白高度(mm);W为蛋重(g)。
1.4.2 血浆指标饲养试验结束时,每个组随机选择6只接近于平均体重的蛋鸡,供水禁饲12 h后,翅静脉采血于肝素钠抗凝管中,3 500 r/min、离心15 min制备血浆样品,于-20 ℃保存。血浆生化指标[谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)活性,总蛋白(total protein,TP)、白蛋白(albumin,ALB)和球蛋白(globulin,GLB)含量]以及白球比(albumin to globulin ratio,AGR)]和血浆免疫指标[免疫球蛋白A(IgA)、免疫球蛋白G(IgG)和免疫球蛋白M(IgM)含量]均采用南京建成生物工程研究所生产的试剂盒测定;血浆细胞因子[白细胞介素-10(IL-10)和肿瘤坏死因子-α(TNF-α)]含量采取酶标仪进行酶联免疫吸附试验法测定。
1.4.3 盲肠菌群16S rDNA测序试验结束当天,在盲肠盲端使用载玻片取出肠段内容物于冻存管中,立即投入液氮速冻,然后置于-80 ℃保存。DNA提取、PCR扩增及Ion S5 XL测序由北京诺禾致源生物信息科技有限公司协助完成,生物信息学分析是根据北京诺禾致源股份有限公司给出的原始序列、有效序列等信息,进行操作分类单元(OTU)聚类与注释和微生物多样性分析。
1.5 数据统计分析试验数据使用Excel 2016进行整理汇总,采用SPSS 26.0软件对数据进行单因素方差分析(one-way ANOVA),采用t检验比较组间差异显著性,结果用平均值和均值标准误(SEM)表示,以P < 0.05和0.05≤P < 0.10分别作为差异显著和具有显著性趋势的判断标准。组间微生物群落采用相似性分析(ANOSIM)和多反应置换程序(MRPP)等进行差异显著性检验,组间差异物种分析采取t检验和LEfSe等方法。
2 结果与分析 2.1 花椒粉对蛋鸡生产性能和蛋品质的影响由表 2可知,与对照组相比,试验组蛋鸡料蛋比显著降低(P < 0.05),其他生产性能指标无显著差异(P>0.05)。与对照组相比,试验组蛋壳颜色有提高趋势(P=0.08),蛋壳强度有降低趋势(P=0.08)。
|
|
表 2 花椒粉对蛋鸡生产性能和蛋品质的影响 Table 2 Effects of zanthoxylum powder on performance and egg quality of laying hens |
由表 3可知,与对照组相比,试验组蛋鸡血浆ALB含量显著提高(P < 0.05),血浆AGR显著提高(P < 0.05),其他血浆生化指标无显著差异(P>0.05)。
|
|
表 3 花椒粉对蛋鸡血浆生化指标的影响 Table 3 Effects of zanthoxylum powder on plasma biochemical indices of laying hens |
由表 4可知,与对照组相比,试验组蛋鸡血浆IgA与IgM含量有降低趋势(P=0.09),血浆IgG含量无显著差异(P>0.05);试验组蛋鸡血浆TNF-α和IL-10含量无显著差异(P>0.05)。
|
|
表 4 花椒粉对蛋鸡血浆免疫指标和细胞因子含量的影响 Table 4 Effects of zanthoxylum powder on plasma immune indices and cytokine contents of laying hens |
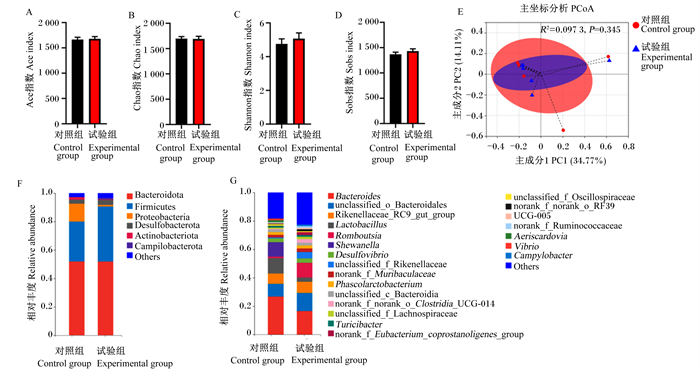
由图 1可知,与对照组相比,试验组蛋鸡盲肠菌群α多样性中的Ace指数(图 1-A)、Chao指数(图 1-B)、Shannon指数(图 1-C)和Sobs指数(图 1-D)差异均不显著(P>0.05)。主坐标分析(PCoA,图 1-E)显示,用于反映盲肠菌群结构的β多样性中,试验组与对照组无显著差异(P>0.05)。
|
Bacteroidota:拟杆菌门;Firmicutes:厚壁菌门;Proteobacteria:变形菌门;Desulfobacterota:脱硫菌门;Actinobacteriota:放线菌门;Others:其他;Bacteroides:拟杆菌属;unclassified_o_Bacteroidales:未分类拟杆菌目;Rikenellaceae_RC9_gut_group:理研菌科RC9肠道群;Lactobacillus:乳杆菌属;Shewanella:希瓦氏菌属;Desulfovibrio:脱硫弧菌属;unclassified_f_Rikenellaceae:未分类理研菌科;Phascolarctobacterium:考拉杆菌属;unclassified_c_Bacteroidia:未分类拟杆菌纲;unclassified_f_Lachnospiraceae:未分类毛螺菌科;unclassified_f_Oscillospiraceae:未分类颤螺菌科;Vibrio:弧菌属;Campylobacter:弯曲菌属。 图 1 花椒粉对蛋鸡盲肠菌群组成的影响 Fig. 1 Effects of zanthoxylum powder on cecal microflora composition of laying hens |
在门水平上(图 1-F),与对照组相比,试验组蛋鸡盲肠菌群中厚壁菌门(Firmicutes)/拟杆菌门(Bacteroidota)值升高,变形菌门(Proteobacteria)和放线菌门(Actinobacteriota)相对丰度明显降低。在属水平上(图 1-G),与对照组相比,试验组蛋鸡盲肠菌群中未分类拟杆菌目(unclassified_o_Bacteroidales)和Romboutsia相对丰度升高,乳杆菌属(Lactobacillus)相对丰度降低。
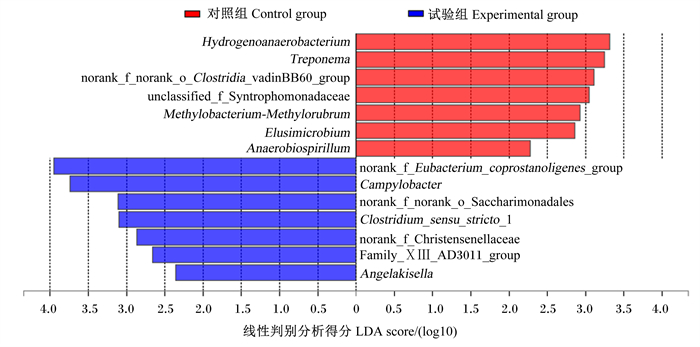
2.5 蛋鸡盲肠优势菌群差异物种分析由图 2可知,与试验组相比,对照组蛋鸡盲肠差异优势菌主要富集有Hydrogenoanaerobacterium、密螺旋体属(Treponema)、norank_f_norank_o_Clostridia_vadinBB60_group、未分类互营单胞菌科(unclassified_f_Syntrophomonadaceae)、Methylobacterium-Methylorubrum、Elusimicrobium和厌氧螺菌属(Anaerobiospirillum)。与对照组相比,试验组蛋鸡盲肠差异优势菌主要富集了norank_f_Eubacterium_coprostanoligenes_group、弯曲菌属(Campylobacter)、norank_f_norank_o_Saccharimonadales、严格梭菌属1(Clostridium_sensu_stricto_1)、norank_f_Christensenellaceae、Family_ⅩⅢ_AD3011_group和Angelakisella。
|
Treponema:密螺旋体属;unclassified_f_Syntrophomonadaceae:未分类互营单胞菌科;Anaerobiospirillum:厌氧螺菌属;Campylobacter:弯曲菌属;Clostridium_sensu_stricto_1:严格梭菌属1。 图 2 蛋鸡盲肠优势菌群差异物种分析 Fig. 2 Analysis of different species of dominant microflora in cecum of laying hens |
本试验结果显示,与对照组相比,试验组蛋鸡料蛋比显著降低。有关花椒粉对鸡生产性能的影响还未见文献报道。但有研究表明,花椒籽粉能够提高蛋鸡平均蛋重和产蛋量等[5]。而花椒籽是成熟的花椒果实采收后,与果皮分离之后的花椒种子,是花椒的主要副产物[6]。李会洲等[7]、张玉海[8]研究表明,在基础饲粮中添加5%花椒籽粉对蛋鸡产蛋性能有显著提高作用。在本研究中,采用的是花椒果皮粉碎后的产品,其对蛋鸡生产性能的改善,可能与花椒中含有的挥发油和醇类化合物等活性成分的生物学作用有关。花椒果皮、花椒籽的活性成分存在极大差异。王学辉[9]报道,花椒籽中挥发性油主要成分是一种天然的驱虫剂亚乙基二磷酸四乙酯,含量高达74.22%,其他成分还包括少量的左旋香桧烯、4-甲基-1-环己烯、1, 8-桉叶素以及2-羟基-4, 6-二甲氧基苯乙酮等。黄森等[10]报道,花椒果皮的挥发性油含量最多的是柠檬烯,含量高达25.58%,其他还有(R)-4-甲基-1-异丙基-3-环己烯-1-醇(13.38%)、β-月桂烯(6.92%)、γ-松油烯(4.76%)、β-水芹烯(3.81%)和芳樟醇(3.35%)等。因此,二者的生物活性可能存在很大差异。由此可见,蛋鸡生产性能的整体改善,可能归因于花椒中含有的活性成分如烯烃类挥发油和醇类化合物、酰胺等活性物质,它们可能是通过影响鸡只的肠道、肝脏和生殖内分泌系统来改善机体性能,从而提高生产性能。
蛋壳颜色是由沉积在蛋壳外表面的色素含量决定的,构成蛋壳颜色的色素成分主要包括原卟啉-Ⅸ、胆绿素-Ⅸ以及胆绿素的锌螯合物等[11]。有研究报道,饲粮中铁含量对于蛋壳颜色具有显著影响,其作用机理可能是通过影响原卟啉-Ⅸ/血红素的生成和转运发挥作用[12]。白建[2]报道,饲粮添加0.3%花椒粉可以改善罗曼褐鸡蛋的蛋壳颜色,这与本研究结果一致。其原因可能是花椒中的活性物质促进了肠道对铁的吸收,或者改善了蛋壳腺上皮细胞分泌原卟啉-Ⅸ的机能,但具体机制有待进一步研究。本研究结果还显示,试验组蛋壳强度较对照组有降低趋势,可能是由于试验组蛋鸡产蛋性能如产蛋率、平均日产蛋量和平均蛋重较对照组有所提高,蛋鸡在高生产性能条件下,对饲粮中的钙等矿物质水平的需求会更高,而在基础饲粮中添加0.5%花椒粉的试验饲粮,不能满足蛋鸡较高生产性能时对钙等的营养需求(根据本试验料蛋比等数据计算,对照组、试验组每生产1 kg鸡蛋摄入的钙含量分别为76.2和70.8 g,试验组约为对照组的93%),因此建议配制含有花椒粉的饲粮时应该适当增加饲粮钙含量。
3.2 花椒粉对蛋鸡血浆生化指标的影响ALB是血清蛋白质的主要成分之一,其含量与炎症过程呈负相关[13]。低蛋白血症历来是营养不良的一个重要指标,被视为炎症的生物标志物[14]。本试验中,试验组蛋鸡血浆ALB含量较对照组显著提高,这表明试验组蛋鸡的蛋白质代谢更加旺盛,具有较低炎症水平。研究表明,GLB和AGR是肝功能测试中的重要生物标志物[15]。血清GLB含量在炎症过程中随之增加[16]。本试验中,试验组蛋鸡血浆GLB含量低于对照组,表明机体内环境处于良好的平衡状态,这意味着免疫器官不需要分泌过多的免疫球蛋白来防止抗原入侵机体细胞。
3.3 花椒粉对蛋鸡血浆免疫指标和细胞因子含量的影响Shimizu等[17]认为AGR作为重要的一类炎症标志物,较高AGR有利于机体对抗炎症。在本试验中,饲粮添加0.5%花椒粉使得蛋鸡血浆AGR显著升高,血浆免疫球蛋白(IgA、IgG和IgM)含量均有所降低。这表明花椒粉能够增强蛋鸡自身的抗应激能力,减少机体免疫器官免疫球蛋白的过多分泌,增加产蛋鸡体内ALB的分泌量,从而使鸡只的产蛋性能得以改善。本研究结果还显示,试验组蛋鸡血浆TNF-α含量低于对照组,这与韦琳等[18]的研究结果基本相符,花椒精油能通过降低小鼠体内TNF-α含量发挥抗炎作用。
3.4 花椒粉对蛋鸡盲肠菌群的影响 3.4.1 花椒粉对蛋鸡盲肠菌群组成的影响肠道菌群是由数百种不同微生物组成的复杂群落,肠道微生物在调节宿主肠道健康、营养消化和免疫功能方面均发挥着重要作用[19]。因此,肠道菌群在维持肠道健康方面起着至关重要的作用,并影响鸡只生产性能的表现。大量研究表明,花椒精油、花椒多酚和生物碱等具有较强的抗菌活性[20];花椒油能够促进大鼠肠道健康[21],花椒麻味素和生物碱可以改善鼠肠道稳态[22],提示花椒中多种成分均具有调节肠道菌群平衡的功效。本研究结果表明,在门水平上,试验组蛋鸡盲肠菌群中厚壁菌门/拟杆菌门值升高。研究表明,成年蛋鸡在门水平上的代表性微生物群落为厚壁菌门,其次是拟杆菌门等[23]。此外,有研究报道,拟杆菌门与鸡只的脂肪积累有关,不利于机体健康[24]。本试验与上述研究结果相符。本研究结果还显示,试验组蛋鸡盲肠菌群中变形菌门和放线菌门相对丰度下降。有研究证实,变形菌门中含有较多致病菌,对动物健康和生产性能会造成负面影响[25];并且放线菌门中菌属多数为致病菌,不利于肠道菌群多样性及肠道稳态。在属水平上,与对照组相比,试验组蛋鸡盲肠菌群中未分类拟杆菌目和Romboutsia相对丰度水平升高,乳杆菌属相对丰度下降。菌群相关性分析表明,未分类拟杆菌目与蛋鸡生产性能显著呈正相关[26]。Romboutsia作为一种可用的肠道生物标志物,在维持宿主健康方面起着关键作用[27]。此外,乳酸杆菌在超重或肥胖个体中大量存在,与血清超敏C反应蛋白(hs-CRP)呈正相关,提示存在有“低度”炎症[28]。综上所述,试验组蛋鸡盲肠菌群中厚壁菌门、未分类拟杆菌目和Romboutsia相对丰度升高,变形菌门和乳杆菌属相对丰度降低,有利于蛋鸡维持肠道稳态与宿主代谢。
3.4.2 花椒粉对蛋鸡盲肠菌群差异物种的影响本研究结果显示,对照组蛋鸡盲肠差异优势菌主要富集有Hydrogenoanaerobacterium、密螺旋体属、norank_f_norank_o_Clostridia_vadinBB60_group、未分类互营单胞菌科、Methylobacterium-Methylorubrum、Elusimicrobium和厌氧螺菌属,试验组蛋鸡盲肠差异优势菌主要富集了norank_f_Eubacterium_coprostanoligenes_group、弯曲菌属、norank_f_norank_o_Saccharimonadales、严格梭菌属1、norank_f_Christensenellaceae、Family_ⅩⅢ_AD3011_group和Angelakisella。研究表明,密螺旋体属被称为“隐形病原体”,因为它的外膜脱落,大部分由非免疫原性跨膜蛋白组成[29]。厌氧螺菌属是一种潜在致病菌,可能会导致健康受损的成年人患腹泻病[30]。厚壁菌门中的Hydrogenoanaerobacterium与体重和平均日增重呈正相关关系,容易导致一系列疾病[31]。未分类互营单胞菌科、Methylobacterium-Methylorubrum和Elusimicrobium均为潜在致病菌,不利于蛋鸡肠道菌群多样性和肠道健康[31]。由此可见,这些有害的差异优势菌群富集于对照组蛋鸡盲肠中,不利于生产后期蛋鸡生产性能的发挥。同时,研究表明,norank_f_Eubacterium_coprostanoligenes_group具有抗氧化和抗癌效果,有助于肠道营养代谢[32]。弯曲菌属是变形菌门的一种,对肠道健康有害[33]。norank_f_norank_o_Saccharimonadales能够改善大鼠肠道健康[34]。菌群相关性分析表明,norank_f_Christensenellaceae与蛋鸡产蛋性能呈显著正相关,有助于宿主肠道健康[35]。Family_ⅩⅢ_AD3011_group是一种有益菌,能够减少机体炎症并改善年轻男性肠道微生物群[36]。而Angelakisella能够调节肠道微生物群中短链脂肪酸的产生,为宿主提供能量[37]。由此可见,试验组蛋鸡盲肠富集了弯曲菌属这一类致病菌,同时富集了norank_f_Eubacterium_coprostanoligenes_group、norank_f_norank_o_Saccharimonadales、norank_f_Christensenellaceae、Family_ⅩⅢ_AD3011_group和Angelakisella这一类肠道有益菌,并且试验组富集的有益菌作为主要的优势菌群,其多样性和相对丰度明显高于致病菌,但是由于这些致病菌的存在,它们能够与肠道有益菌竞争宿主营养物质吸收,使宿主生产潜力不能得以充分发挥。然而,相比于对照组盲肠中所富集的大多数致病菌而言,试验组蛋鸡盲肠富集的大多数均为有益菌,有益于生产性能的发挥。因此,蛋鸡基础饲粮中添加0.5%花椒粉,有助于减少肠道致病菌,提高蛋鸡盲肠有益菌群的丰度水平。
4 结论在本试验条件下,饲粮中添加0.5%花椒粉改善了蛋鸡盲肠菌群组成的多样性和结构,增强了机体利用蛋白质的能力和抗炎能力,提高了蛋鸡生产性能和蛋品质。
| [1] |
娄京荣. 花椒化学成分及药理活性研究[D]. 硕士学位论文. 济南: 济南大学, 2019. LOU J R. The study on the pharmacological activities and chemical constituents from barks of Zanthoxylum bungeanum Maxim[D]. Master's Thesis. Jinan: University of Jinan, 2019. (in Chinese) |
| [2] |
白建. 日粮添加花椒粉对鸡蛋品质的影响[J]. 中国家禽, 2013, 35(10): 46-48. BAI J. Effect of adding pepper powder to diet on egg quality[J]. China Poultry, 2013, 35(10): 46-48 (in Chinese). DOI:10.3969/j.issn.1004-6364.2013.10.014 |
| [3] |
周孟焦, 史芳芳, 陈凯, 等. 花椒药用价值研究进展[J]. 农产品加工, 2020(1): 65-67, 72. ZHOU M J, SHI F F, CHEN K, et al. Research progress of the medicinal value of Zanthoxylum bungeanum Maxim[J]. Farm Products Processing, 2020(1): 65-67, 72 (in Chinese). |
| [4] |
袁娟丽, 王四旺. 花椒的化学成分及其药效学研究[J]. 现代生物医学进展, 2010, 10(3): 552-554. YUAN J L, WANG S W. Study on chemical composition and pharmacodynamics of Zanthoxylum[J]. Progress in Modern Biomedicine, 2010, 10(3): 552-554 (in Chinese). |
| [5] |
付兴周, 路志芳, 申海燕, 等. 日粮添加花椒籽粉对蛋鸡生产性能及蛋品质的影响[J]. 中国家禽, 2016, 38(3): 30-34. FU X Z, LU Z F, SHEN H Y, et al. Effect of prickly ash seed powder on production performance and egg quality of laying hens[J]. China Poultry, 2016, 38(3): 30-34 (in Chinese). |
| [6] |
吴素蕊, 阚建全, 刘春芬. 花椒的活性成分与应用研究[J]. 中国食品添加剂, 2004(2): 75-78. WU S R, KAN J Q, LIU C F. Research on the bioactivity constiuents and application[J]. China Food Additives, 2004(2): 75-78 (in Chinese). DOI:10.3969/j.issn.1006-2513.2004.02.019 |
| [7] |
李会洲, 李生金. 高寒地区商品蛋鸡饲料中添加花椒籽试验[J]. 甘肃畜牧兽医, 2013, 43(10): 46-47. LI H Z, LI S J. Experiment on adding Zanthoxylum bungeanum seeds to the feed of commercial laying hens in alpine region[J]. Gansu Animal and Veterinary Sciences, 2013, 43(10): 46-47 (in Chinese). DOI:10.3969/j.issn.1006-799X.2013.10.031 |
| [8] |
张玉海. 日粮中添加花椒籽对蛋鸡生产性能及鸡蛋风味的影响[J]. 黑龙江畜牧兽医, 2011(12): 41-42. ZHANG Y H. Effects of Zanthoxylum bungeanum seeds on performance and egg flavor of laying hens[J]. Heilongjiang Animal Science and Veterinary Medicine, 2011(12): 41-42 (in Chinese). |
| [9] |
王学辉. 花椒籽仁中脂肪酸及挥发性成分的分析研究[J]. 农业机械, 2011(22): 60-62. WANG X H. Analysis of fatty acids and volatile components in Zanthoxylum bungeanum seeds[J]. Farm Machinery, 2011(22): 60-62 (in Chinese). |
| [10] |
黄森, 刘拉平, 贾礼. 韩城大红袍花椒挥发油化学成分的GC-MS分析[J]. 中国农学通报, 2006, 22(10): 334-336. HUANG S, LIU L P, JIA L. Analysis of chemical constituents of volatile oil from Zanthoxylum bungeanum maxim in Hancheng by GC-MS[J]. Chinese Agricultural Science Bulletin, 2006, 22(10): 334-336 (in Chinese). DOI:10.3969/j.issn.1000-6850.2006.10.080 |
| [11] |
周光玉. 蛋壳颜色、成分和结构与蛋壳质量关系的研究[D]. 硕士学位论文. 扬州: 扬州大学, 2010. ZHOU G Y. The reserach on relationship between eggshell color, composition, structure and eggshell quality[D]. Master's Thesis. Yangzhou: Yangzhou University, 2010. (in Chinese) |
| [12] |
QIU K, MA Y B, OBIANWUNA U E, et al. Application of selenium conjugated to animal protein in laying hens' diet for the production of selenium-enriched eggs[J]. Foods, 2021, 10(6): 1224. DOI:10.3390/foods10061224 |
| [13] |
ZENG M R, LIU Y, LIU F Y, et al. Association between albumin-to-globulin ratio and long-term mortality in patients with chronic kidney disease: a cohort study[J]. International Urology and Nephrology, 2020, 52(6): 1103-1115. DOI:10.1007/s11255-020-02453-7 |
| [14] |
HUANG W, SUN Y, XING Y L, et al. Functional impairment and serum albumin predict in-hospital mortality in nonagenarians with acute infection: a retrospective cohort study[J]. BMC Geriatrics, 2019, 19(1): 269. DOI:10.1186/s12877-019-1301-1 |
| [15] |
WANG H H, ZHOU H K, JIANG R D, et al. Globulin, the albumin-to-globulin ratio, and fibrinogen perform well in the diagnosis of Periprosthetic joint infection[J]. BMC Musculoskeletal Disorders, 2021, 22(1): 583. DOI:10.1186/s12891-021-04463-7 |
| [16] |
LI K, FU W R, BO Y C, et al. Effect of albumin-globulin score and albumin to globulin ratio on survival in patients with heart failure: a retrospective cohort study in China[J]. BMJ Open, 2018, 8(7): e022960. DOI:10.1136/bmjopen-2018-022960 |
| [17] |
SHIMIZU T, ISHIZUKA M, SUZUKI T, et al. The preoperative globulin-to-albumin ratio, a novel inflammation-based prognostic system, predicts survival after potentially curative liver resection for patients with hepatocellular carcinoma[J]. Journal of Surgical Oncology, 2017, 116(8): 1166-1175. DOI:10.1002/jso.24772 |
| [18] |
韦琳, 宗伟, 曾庆鸿, 等. 花椒抗炎镇痛网络药理学分析及实验验证研究[J]. 中国中药杂志, 2021, 46(12): 3034-3042. WEI L, ZONG W, ZENG Q H, et al. Network pharmacological analysis and experimental verification of anti-inflammatory and analgesic effect of Zanthoxyli pericarpium[J]. China Journal of Chinese Materia Medica, 2021, 46(12): 3034-3042 (in Chinese). |
| [19] |
VALDES A M, WALTER J, SEGAL E, et al. Role of the gut microbiota in nutrition and health[J]. BMJ, 2018, 361: k2179. |
| [20] |
赵二劳, 徐未芳, 刘乐, 等. 花椒抑菌作用研究进展[J]. 中国调味品, 2019, 44(3): 185-188. ZHAO E L, XU W F, LIU L, et al. Research progress of the bacteriostasis of Zanthoxylum bungeanum[J]. China Condiment, 2019, 44(3): 185-188 (in Chinese). |
| [21] |
刘芸, 吕娇, 任文瑾, 等. 花椒精非挥发性成分对大鼠肠道健康的影响[J]. 食品工业科技, 2014, 35(9): 338-342. LIU Y, LV J, REN W J, et al. Effect of the non-volatile parts of Zanthoxylum essential oil on intestinal health in rats[J]. Science and Technology of Food Industry, 2014, 35(9): 338-342 (in Chinese). |
| [22] |
叶敏, 张磊, 王倩倩, 等. 辣椒总碱与花椒麻味素不同质量比对高脂模型大鼠肠道健康的影响[J]. 食品科学, 2014, 35(21): 190-195. YE M, ZHANG L, WANG Q Q, et al. Intestinal health effect of capsaicin and sanshool in female sprague-dawley hyperlipidemia rats[J]. Food Science, 2014, 35(21): 190-195 (in Chinese). DOI:10.7506/spkx1002-6630-201421037 |
| [23] |
DONG X Y, AZZAM M M M, ZOU X T. Effects of dietary threonine supplementation on intestinal barrier function and gut microbiota of laying hens[J]. Poultry Science, 2017, 96(10): 3654-3663. DOI:10.3382/ps/pex185 |
| [24] |
PAOLA M D, FILIPPO C D, CAVALIERI D, et al. PP90 impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa[J]. Digestive and Liver Disease, 2011, 43(S5): S445-S446. |
| [25] |
HOLT H M, GAHRN-HANSEN B, BRUUN B. Shewanella algae and Shewanella putrefaciens: clinical and microbiological characteristics[J]. Clinical Microbiology and Infection, 2005, 11(5): 347-352. DOI:10.1111/j.1469-0691.2005.01108.x |
| [26] |
GUO Y X, HUANG S M, ZHAO L H, et al. Pine (Pinus massoniana Lamb.) needle extract supplementation improves performance, egg quality, serum parameters, and the gut microbiome in laying hens[J]. Frontiers in Nutrition, 2022, 9: 810462. DOI:10.3389/fnut.2022.810462 |
| [27] |
MANGIFESTA M, MANCABELLI L, MILANI C, et al. Mucosal microbiota of intestinal polyps reveals putative biomarkers of colorectal cancer[J]. Scientific Reports, 2018, 8(1): 13974. DOI:10.1038/s41598-018-32413-2 |
| [28] |
BERVOETS L, VAN HOORENBEECK K, KORTLEVEN I, et al. Differences in gut microbiota composition between obese and lean children: a cross-sectional study[J]. Gut Pathogens, 2013, 5(1): 10. DOI:10.1186/1757-4749-5-10 |
| [29] |
周慧颖, 叶俊杰. 人类免疫缺陷病毒和梅毒螺旋体双重感染眼部表现及治疗的研究进展[J]. 中华眼科杂志, 2021, 57(11): 865-870. ZHOU H Y, YE J J. Research progress of ocular manifestations and treatments of human immunodeficiency virus and syphilis co-infection[J]. Chinese Journal of Ophthalmology, 2021, 57(11): 865-870 (in Chinese). DOI:10.3760/cma.j.cn112142-20210127-00055 |
| [30] |
TSAI Y T, LEE K M, LU P L, et al. First case report of Anaerobiospirillum succiniciproducens bacteremia in an HIV-infected patient in Taiwan-molecular identification from a positive blood culture bottle[J]. Anaerobe, 2021, 69: 102327. DOI:10.1016/j.anaerobe.2021.102327 |
| [31] |
ZHANG S, ZHONG G, SHAO D, et al. Dietary supplementation with Bacillus subtilis promotes growth performance of broilers by altering the dominant microbial community[J]. Poultry Science, 2021, 100(3): 100935. DOI:10.1016/j.psj.2020.12.032 |
| [32] |
LI L, BUHMAN K K, HARTMAN P A, et al. Hypocholesterolemic effect of Eubacterium coprostanoligenes ATCC 51222 in rabbits[J]. Letters in Applied Microbiology, 1995, 20(3): 137-140. DOI:10.1111/j.1472-765X.1995.tb00410.x |
| [33] |
ROKOSZ N, RASTAWICKI W, WOŁKOWICZ T. [Microbiological diagnosis of infections caused by Campylobacter jejuni and Campylobacter coli in humans][J]. Postepy Higieny i Medycyny Doswiadczalnej, 2014, 68: 48-56. DOI:10.5604/17322693.1086079 |
| [34] |
ZHAO Y, YAN Y M, ZHOU W T, et al. Effects of polysaccharides from bee collected pollen of Chinese wolfberry on immune response and gut microbiota composition in cyclophosphamide-treated mice[J]. Journal of Functional Foods, 2020, 72: 104057. DOI:10.1016/j.jff.2020.104057 |
| [35] |
MA M L, GENG S J, LIU M L, et al. Effects of different methionine levels in low protein diets on production performance, reproductive system, metabolism, and gut microbiota in laying hens[J]. Frontiers in Nutrition, 2021, 8: 739676. |
| [36] |
BURTON K J, ROSIKIEWICZ M, PIMENTEL G, et al. Probiotic yogurt and acidified milk similarly reduce postprandial inflammation and both alter the gut microbiota of healthy, young men[J]. British Journal of Nutrition, 2017, 117(9): 1312-1322. |
| [37] |
MAILHE M, RICABONI D, VITTON V, et al. Angelakisella massiliensis' gen. nov., sp. nov., a new bacterial species isolated from human ileum[J]. New Microbes and New Infections, 2017, 16: 51-53. |




