2. 海南省农业科学院畜牧兽医研究所, 海口 571100;
3. 海南省热带动物繁育与疫病研究重点实验室, 海口 570203
2. Institute of Animal Science and Veterinary Medicine, Hainan Academy of Agricultural Sciences, Haikou 571100;
3. Key Laboratory of Tropical Animal Breeding and Disease Research, Haikou 570203, China
我国南方夏季湿热,环境温控设备降温除湿效果有限,积极采用饲养管理和营养调控手段缓解家禽热应激、提高家禽养殖效益是当前研究方向和热点之一。山香圆属植物来源于省沽油科,作为民间用药历史悠久,被收录入2015年版《中国药典》,山香圆叶为山香圆属植物的主要药用部位,其主要化学成分为黄酮类、酚酸类和多糖类,其性寒味苦,具有抗菌、消炎、镇痛、抗氧化、增强免疫等药理活性,能够清热解毒、利咽消肿、活血止痛,临床上被用于咽喉炎、扁桃体炎、扁桃体脓肿、上呼吸道感染、气管炎等治疗系统[1-4]。研究表明,山香圆能够提高小鼠的应激适应性(提高体表痛阈,抑制毛细血管通透性),从而缓解人为应激模型下小鼠的疼痛反应和充血肿胀[5]。其有效成分山香圆叶黄酮等能够调节小鼠的血清炎症因子含量,缓解小鼠的炎症反应[6-7],能够调节T细胞亚群的比例,提高血清免疫球蛋白G(IgG)含量,从而提高小鼠的体液免疫功能[8]。此外,山香圆属植物的抑菌效果非常显著,可以有效降低小鼠腹腔感染金黄色葡萄球菌后的死亡率[9]。山香圆叶提取物(Turpiniae folium extract, TFE)是将干燥山香圆叶提取纯化后的产物,其活性成分含量高,添加剂量小[10-11],药用效果确切,但未见其在家禽生产,尤其是缓解家禽热应激方面的应用研究。TFE作为潜在的抗应激产品,在缓解文昌鸡热应激上具有一定的研究价值和意义。因此,本试验旨在研究饲粮中添加TFE对夏季湿热条件下文昌鸡生长性能、屠宰性能、血清抗氧化和免疫功能、肠道组织形态学结构和肠道微生态的影响,为TFE在夏季文昌鸡生产上的应用提供科学依据。
1 材料与方法 1.1 试验材料山香圆叶采自江西省农业科学院高安基地,经干燥粉碎后过80目筛,采用乙醇进行提取(料液比为1 ∶ 50,提取时间为1.5 h,提取温度为70 ℃),浓缩,喷雾干燥(由西安某生物工程有限公司代提取加工)获得淡黄褐色粉状TFE,提取物含总黄酮119.75 mg/g,总多糖10.15 g/100 g,多酚100.90 mg/g。
1.2 试验设计与试验饲粮选取同一饲养条件下饲养至84日龄的健康、体重接近的文昌鸡母鸡240羽,随机分为4组,分别饲喂在基础饲粮中添加0(对照)、0.02%、0.04%、0.08% TFE的饲粮,每组6个重复,每个重复10羽。基础饲粮参考《文昌鸡饲养管理技术规程》(DB46/T 44—2011)[12]配制,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验在江西省农业科学院畜牧兽医研究所试验鸡场进行,开始于2021年7月2日,结束于2021年8月6日。试验鸡采用网上分栏笼养,自由采食和饮水。鸡舍自然通风,试验鸡严格按常规管理程序管理和正常免疫程序进行免疫接种。每日记录舍内不同的4个位置(门口、舍内、风机、湿帘)的最低和最高温度、湿度,记录死亡鸡只个数。试验期为35 d,试验期间鸡舍温度最高为38 ℃,相对湿度最高为94%,温湿指数最高为90.12。试验期鸡舍平均温度为30.42 ℃、平均相对湿度为77.37%、平均温湿指数为83.10。试验期间温湿指数始终大于80,因此文昌鸡均处于热应激状态。试验期间鸡舍温度、湿度情况见图 1。
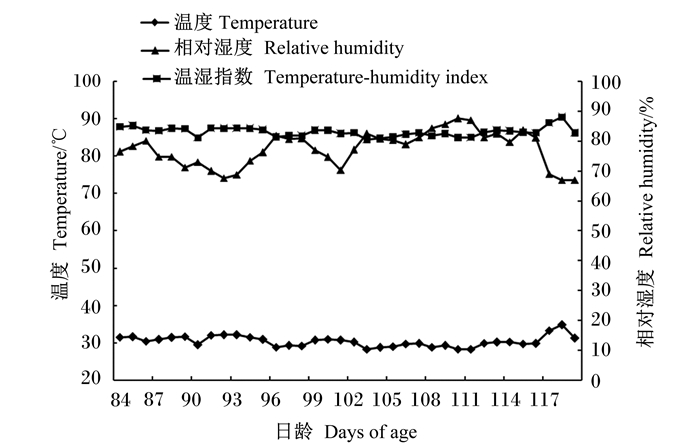
|
图 1 试验期间鸡舍内温度和湿度 Fig. 1 Temperature and humidity in chicken house during experiment period |
试验期间,每周以重复为单位记录喂料量和剩料量。试验开始和结束时,文昌鸡禁食12 h后进行称重,以此计算试验鸡的平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。
1.4.2 血清生化指标试验结束时,鸡只禁食12 h,各重复挑选健康、体重接近平均体重的文昌鸡2羽,翅静脉采集5 mL血样,3 000 r/min离心15 min制备血清,-20 ℃保存待测。
血清抗氧化指标:血清中谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)活性,总抗氧化能力(T-AOC)和丙二醛(MDA)含量采用南京建成生物研究所的试剂盒测定,所用仪器为华卫德朗DR-200BS酶标仪(无锡华卫德朗仪器有限公司)。
血清免疫指标:血清免疫球蛋白A(IgA)、IgG、免疫球蛋白M(IgM)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、白细胞介素-1β(IL-1β)含量采用南京建成生物研究所试剂盒测定,所用仪器为迈瑞BS-420全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司)。血清热应激蛋白70(HSP70)和胰岛素(INS)含量采用北京华英生物技术研究所试剂盒测定,所用仪器为华卫德朗DR-200BS酶标仪(无锡华卫德朗仪器有限公司)。
其他血清生化指标:血清中总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、总胆固醇(TC)、甘油三酯(TG)、葡萄糖(GLU)含量采用比色法进行检测,试验盒购自中生北控股份有限公司,所用仪器为迈瑞BS-420全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司)。
1.4.3 屠宰性能指标屠宰前试验鸡禁食12 h,只供饮水,从各重复随机选取2只生长发育正常、体况健康、接近平均体重的试验鸡进行屠宰,宰前称活重后放血,浸烫脱毛,洗净沥干,参照《家禽生产性能名词术语和度量统计方法》(NY/T 823—2020)[13]计算屠体率、半净膛率、全净膛率、胸肌率、腿肌率、腹脂率。剥离肌胃、腺胃、心脏、脾脏、肺等器官,用滤纸吸去血液,剥离脂肪称重,用1 mg灵敏度的电子称重并计算器官指数。
器官指数(%)=100×器官重/宰前空腹体重。
1.4.4 肠道组织形态学指标试验结束时,每重复选择2只文昌鸡屠宰,剖开腹部,分离出肠道,迅速截取3 cm左右空肠肠段用生理盐水把肠道内容物冲洗干净,放到4%甲醛溶液中固定,经过冲水、梯度酒精脱水、二甲苯透明、石蜡包埋等处理后,以5 μm的厚度切片,常规苏木精-伊红(HE)染色。用光学显微镜(Nikon Eclipse CI,Nikon公司)观察绒毛形态,使用Image-pro plus 6.0软件(Media Cybernetics公司)测量绒毛高度(VH)和隐窝深度(CD),并计算绒毛高度与隐窝深度比值(VH/CD)。
1.4.5 肠道微生物区系试验结束时,每重复选择2只文昌鸡屠宰,剖开腹部,分离出肠道,用灭菌细线将盲肠结扎,确保肠道内容物充足,剪下结扎的盲肠段,立即将内容物转入2 mL灭菌冻存管中,置于-80 ℃冰箱保存,待测。根据TruSeqⓇ DNA PCR-Free Sample Preparation Kit (Illumina公司, 美国)试剂盒构建文库,用特异性引物(338F/806R)扩增16S rDNA的V3~V4区。引物序列338F: 5’-ACTCCTACGGGAGGCAGCAG-3’;806R: 5’-GGACTACHVGGGTWTCTAAT-3’。文库的质量通过Qubit@ 2.0荧光计(Thermo Scientific)和安捷伦生物分析仪2100系统进行评估。在Illumina NovaSeq平台上对文库进行测序,得到250 bp的配对末端序列。建库和测序工作由北京诺禾致源生物信息科技有限公司完成。
1.5 数据统计分析用Excel 2013对数据进行预处理,采用SPSS 21.0统计软件对试验数据进行单因素方差分析和Duncan氏多重比较。以P < 0.05作为差异显著的判断标准,以0.05≤P < 0.10作为有显著趋势的判断标准。结果以平均值(mean)和均值标准误(SEM)表示。
2 结果 2.1 TFE对文昌鸡生长性能的影响由表 2可知,各组文昌鸡初始体重无显著差异(P>0.05),经过35 d的饲养试验,各组终末体重、ADFI无显著差异(P>0.05)。与对照组相比,试验组F/G呈下降趋势(0.05≤P < 0.10)。TFE添加组ADG显著高于对照组(P < 0.05),且随着饲粮TFE添加水平的增加,呈显著线性(P=0.004)和二次曲线(P=0.001)变化。
|
|
表 2 TFE对文昌鸡生长性能的影响 Table 2 Effects of TFE on growth performance of Wenchang chicken |
由表 3可知,与对照组相比,试验组血清TP含量呈上升趋势(0.05≤P < 0.10)。与对照组相比,饲粮添加0.04%和0.08%的TFE显著降低了血清GLU含量(P < 0.05),且GLU含量与饲粮TFE添加水平呈线性(P=0.027)和二次曲线(P=0.014)相关。各组间血清ALB、GLB、TC、TG含量均无显著差异(P>0.05)。
|
|
表 3 TFE对文昌鸡血清代谢指标的影响 Table 3 Effects of TFE on serum metabolic indexes of Wenchang chicken |
由表 4可知,随着饲粮TFE添加水平的增加,血清IgA、IgG含量呈显著线性(P=0.001, P=0.001)和二次曲线(P=0.006, P=0.001)变化。与对照组相比,试验组血清IgM含量呈升高趋势(0.05≤P < 0.10)。与对照组相比,饲粮添加0.04%和0.08%的TFE显著提高了血清IgA、IgG含量(P < 0.05)。
|
|
表 4 TFE对文昌鸡血清免疫指标的影响 Table 4 Effects of TFE on serum immune indexes of Wenchang chicken |
由表 5可知,随着饲粮TFE添加水平的增加,血清IL-10含量呈显著线性(P=0.002)和二次曲线(P=0.006)变化,血清IL-1β、IL-6和TNF-α含量呈显著线性(P=0.004, P=0.005, P=0.011)和二次曲线(P=0.009, P=0.005, P=0.016)变化。与对照组相比,不同添加水平的TFE均显著降低了血清IL-6含量(P < 0.05),0.04%和0.08%的TFE显著提高了血清IL-10含量(P < 0.05),显著降低了血清IL-1β、TNF-α含量(P < 0.05)。
|
|
表 5 TFE对文昌鸡血清炎症因子含量的影响 Table 5 Effects of TFE on serum inflammatory factor contents of Wenchang chicken |
由表 6可知,随着饲粮TFE添加水平的增加,血清T-AOC、SOD和GSH-Px活性呈显著线性(P=0.006, P=0.015, P=0.010)和二次曲线(P=0.009, P=0.028, P=0.015)变化,血清MDA含量呈显著线性(P=0.007)和二次曲线(P=0.010)变化。与对照组相比,饲粮添加0.04%和0.08%显著提高血清T-AOC、SOD和GSH-Px活性(P < 0.05),显著降低血清MDA含量(P < 0.05)。
|
|
表 6 TFE对文昌鸡血清抗氧化指标的影响 Table 6 Effects of TFE on serum antioxidative indexes of Wenchang chicken |
由表 7可知,随着饲粮额TFE添加水平增加,血清HSP70含量呈显著线性(P=0.009)和二次曲线(P=0.021)变化,血清INS含量呈线性上升趋势(0.05≤P < 0.10)。与对照组相比,饲粮添加0.04%和0.08%的TFE显著降低血清HSP70含量(P < 0.05)。
|
|
表 7 TFE对文昌鸡血清热应激蛋白和胰岛素含量的影响 Table 7 Effects of TFE on serum heat stress protein and insulin contents of Wenchang chicken |
由表 8可知,各组间屠宰率、全净膛率、半净膛率、腹脂率、腿肌率、肌胃指数、腺胃指数、心脏指数、肝脏指数和肺指数无显著差异(P>0.05)。不同添加水平的TFE均显著提高了脾脏指数(P < 0.05),且随饲粮TFE添加水平的增长,呈显著二次曲线变化(P=0.043)。
|
|
表 8 TFE对文昌鸡屠宰性能的影响 Table 8 Effects of TFE on slaughter performance of Wenchang chicken |
由表 9可知,随着饲粮TFE添加水平的增加,空肠VH和VH/CD呈显著线性(P=0.013, P=0.009)和二次曲线(P=0.015, P=0.010)变化。0.04%和0.08% TFE添加组空肠VH和VH/CD显著高于对照组(P < 0.05)。饲粮添加TFE对空肠CD无显著影响(P>0.05)。
|
|
表 9 TFE对文昌鸡空肠组织形态的影响 Table 9 Effects of TFE on jejunum morphology of Wenchang chicken |
由表 10可知,在门水平上,盲肠内容物中微生物主要是拟杆菌门和厚壁菌门,占90%左右。随着饲粮TFE添加水平的增加,盲肠变形菌门相对丰度呈显著线性(P=0.016)和二次曲线(P=0.011)变化。与对照组相比,0.04%和0.08% TFE组的盲肠梭杆菌门相对丰度显著下降(P < 0.05),饲粮添加0.08% TFE显著提高了盲肠厚壁菌门相对丰度(P < 0.05)。各组间盲肠中其他菌门相对丰度无显著差异(P>0.05)。
|
|
表 10 TFE对文昌鸡盲肠菌群在门水平上的相对丰度的影响 Table 10 Effects of TFE on relative abundance of microflora in cecum at phylum level of Wenchang chicken |
由表 11可知,盲肠内容物菌群中主要菌属为拟杆菌属和理研菌科RC9肠道群,占盲肠内容物属水平相对丰度的50%左右,表中列出的为相对丰度较高的10个菌属。与对照组相比,饲粮添加0.04%和0.08% TFE显著降低了盲肠内容物中普雷沃氏菌科_UCG-001的相对丰度(P < 0.05),0.08% TFE组盲肠乳酸菌属相对丰度显著高于其他各组(P < 0.05),试验组双歧杆菌属相对丰度呈增加趋势(0.05≤P < 0.10)。各组间盲肠中其他菌属相对丰度无显著差异(P>0.05)。
|
|
表 11 TFE对文昌鸡盲肠菌群在属水平上相对丰度的影响 Table 11 Effects of TFE on relative abundance of microflora in cecum at genus level of Wenchang chicken |
以TFE的添加水平为自变量X(0.00≤X≤0.80),以ANOVA有显著的指标为因变量Y,进行二次回归分析,并计算TFE最适添加水平,结果如表 12所示。选取上述指标的最适添加水平的平均值0.067%作为84~119日龄夏季文昌鸡饲粮中TFE的最适添加水平。
|
|
表 12 基于回归模型参数的胰岛素最适添加水平 Table 12 Optimal supplementation level of TFE based on regression model parameters |
文昌鸡为中国海南省地方家禽品种,其体型短小,单位体重体表面积相对较大,加之海南省热带季风岛屿气候条件,使文昌鸡对炎热的适应性和高温耐受力较强[14]。整个试验期舍内平均温度在30 ℃以上,温湿指数在80以上,文昌鸡处于慢性热应激状态。在热应激暴露过程中,家禽会改变行为(饮水和张口呼吸增加,采食和运动减少)和生理稳态(如通过体液和神经调节作用来抑制胰岛素的分泌)来减少热增耗和代谢产热量,采食量减少导致生长所需营养物质摄入不足,家禽需要消耗自身存储的体脂、体蛋白质等,增重随之下降,饲料利用率降低[15],INS含量的减少使机体血糖保持较高的水平,这些都是机体将能量由生长转移用于生存,为适应热应激而减少产热的表现形式[16-17]。同时,热应激会降低鸡肠道消化酶的活性,扰乱肠道微生态,导致肉鸡消化和吸收功能下降,生长性能下降[18]。TFE中的活性成分黄酮、多糖、酚类等被证实具有提高动物耐热、生长和生产性能的效果[19-20],本试验结果表明,TFE对ADFI无显著影响,但能够显著提高文昌鸡的ADG,与前人研究发现植物提取物能够改善热应激引起的生长性能下降、提高热应激肉鸡的试验末重和增重的结果[21-22]基本一致,说明TFE对湿热条件下文昌鸡生长性能的改善不是通过增加摄入而是通过减少消耗、增加营养物质沉积实现的。随着饲粮AFE添加水平的增加,文昌鸡血清TP含量呈增加趋势,血清GLU含量显著降低,血清INS含量升高。血清TP含量可以反映机体蛋白质的吸收状况,INS是蛋白质、碳水化合物和脂肪代谢的关键激素,能刺激氨基酸和蛋白质的合成,减少脂肪细胞的脂肪分解,增加脂肪酸的同化,增加GLU的利用[23]。这说明TFE能够在一定程度上促进蛋白质沉积,减少脂肪分解,并通过调节血清INS含量降低糖异生途径强度,减少能量消耗[24],TFE对INS的调节机制尚不明确,有待进一步研究。作为应激反应的一个标志性元素,HSP70在热应激动物体内表达被激活,并大量释放在血液中[25]。本试验条件下,TFE能够显著降低文昌鸡血清HSP70含量,说明TFE能够有效缓解文昌鸡在湿热条件下的应激反应,可能原因是TFE提高了文昌鸡的耐热性能。
在本试验中,TFE对文昌鸡湿热条件下生长性能的改善效果以及TFE对文昌鸡血清免疫、抗氧化指标和肠道微生物的影响均呈现线性和二次相关关系,并且以0.04%和0.08%添加水平效果更优,说明TFE主要是通过提高文昌鸡免疫功能,降低文昌鸡氧化应激,调节肠道菌群来保持文昌鸡在湿热条件下的健康状态,从而促进营养物质吸收和沉积。本实验室前期研究结果提示,在舍温适宜条件下,0.03%~0.06% TFE可以显著降低文昌鸡F/G,而本试验条件下0.08% TFE在一定程度上降低F/G,与对照组无显著差异,可见TFE在湿热条件下发挥促生长效果需要的添加水平更高。
3.2 TFE对文昌鸡血清免疫、抗氧化功能的影响热应激能影响家禽的免疫器官和细胞因子,对家禽的体液免疫、细胞免疫和肠道免疫等免疫系统产生负面影响[26]。IgA、IgG和IgM是反映机体免疫应答的重要指标,其中以IgG在血清中含量最多,是机体主要的抗体,IgA在血清中含量仅次于IgG,IgM是体液免疫反应中最早产生的免疫球蛋白,其含量较少,主要由脾脏和B淋巴细胞产生[27]。家禽脾脏分布着大量的淋巴细胞及淋巴小体,是最大的淋巴器官和重要的外周免疫器官[28]。免疫器官指数是反映机体免疫状况的重要参数,一般认为免疫器官指数升高能够增强免疫力,相反若是受免疫抑制如热应激等的影响,免疫器官指数则降低。本试验条件下,TFE显著提高了血清IgA和IgG含量,与张磊等[8]研究的山香圆黄酮可以提高免疫低下小鼠血清IgG含量的结果基本一致,可见,TFE中的黄酮是发挥免疫调节功能的主要活性成分。Lei等[29]研究表明,山香圆叶能够促进脾细胞增殖,从而提高动物脾脏指数。本试验中文昌鸡脾脏指数随着饲粮中TFE添加水平的增加而增大,与吕梦云[30]研究结果基本一致。随着饲粮TFE添加水平的增加,血清IgM含量呈增加趋势,说明TFE在增加脾脏指数的同时也促进了脾脏的分泌功能。本试验结果提示,TFE可通过提高血清免疫球蛋白含量和免疫器官指数改善湿热条件下文昌鸡免疫功能。
热应激情况下,氧自由基会攻击肠绒毛和组织黏膜,诱发肠道和组织炎症[31]。文昌鸡为了散热会加快呼吸频率,容易引起呼吸道疾病(呼吸碱中毒)等,炎症和疾病会引起机体免疫力进一步下降,诱发机体释放各种炎症介质,产生炎症反应。促炎症细胞因子如IL-1β、IL-6和TNF-α是先天免疫应答后引起代谢级联改变的主要因子,在多种炎症反应中发挥重要作用,并与炎症的严重程度密切相关,IL-10是一种细胞因子合成抑制因子,可下调炎症反应强度[32]。在本试验中,随着饲粮添加TFE水平的增加,血清促炎因子IL-1β、IL-6和TNF-α含量降低,抗炎因子水平IL-10含量增加,与陈世华等[6]的研究结果基本一致。这说明TFE调节机体发生了反馈性的炎症因子改变,减少了促炎因子分泌,提高了抗炎因子水平,缓解了湿热环境对文昌鸡机体造成的炎症损伤。
热应激会引起畜禽代谢增强,破坏自由基平衡,导致活性氧的过量积累和细胞氧化损伤[33],抑制线粒体呼吸链活动,导致抗氧化酶体系活性降低,MDA大量生成[34]。体内的抗氧化酶系统(T-AOC、SOD、GSH-Px)等可清除自由基,减少过氧化产物生成[35]。本试验结果显示,TFE提高了文昌鸡血清T-AOC、SOD、GSH-Px活性,降低了脂质过氧化产物MDA含量,表明TFE能够增强机体抗氧化酶系统活性,抑制脂质过氧化反应,有利于维持氧化还原平衡,缓解文昌鸡在湿热条件下的组织氧化应激。黄酮、多酚等是一种天然的抗氧化剂,其苯环上的羟基能够清除氧自由基,TFE的抗氧化效果可能得益于其丰富的黄酮和多酚含量[36]。
3.3 TFE对文昌鸡屠宰性能的影响屠宰性能的主要影响因素是动物的品种和饲粮营养组成[37]。本试验中TFE添加水平与血清TG含量有一定线性关系,并且在一定程度上降低了文昌鸡的腹脂率,但均无显著差异,与周萍芳[38]报道的苜蓿黄酮提取物对麻鸡的腹脂率有降低作用和吕梦云等[30]报道的葛藤黄酮提取物可降低肉鸡的腹脂率结果不一致,可能是不同植物提取物总黄酮组成和含量不同以及禽品种和饲养周期不同的原因。
3.4 TFE对文昌鸡肠道组织形态和菌群的影响小肠上皮细胞隐窝和绒毛组成常用于反映肠道形态结构完整性及功能强弱。肠道极易受热应激影响,产生大量自由基并通过脂质过氧化作用损害肠道上皮细胞,使肠道绒毛萎缩,VH降低,CD增加,VH/CD降低[39],影响营养物质的消化和吸收,导致生长性能下降。本试验中,TFE可增加文昌鸡抗氧化酶系统活性,缓解肠道局部氧化应激引起的肠道损伤,从而增加肠道VH和VH/CD,有利于维持肠道形态结构的完整性,促进营养物质吸收,提高文昌鸡生长性能。
肠道微生态平衡对于维持文昌鸡肠道黏膜形态和正常生理功能具有重要意义。热应激会影响文昌鸡肠道菌群结构,降低文昌鸡肠道内乳酸杆菌和双歧杆菌的数量,提高大肠杆菌和梭杆菌的数量[40]。盲肠是微生物定植几率最高的肠道部位[25],因此本试验研究了TFE对文昌鸡盲肠微生物的影响,结果表明,文昌鸡盲肠微生物结构在门水平上主要以拟杆菌门、厚壁菌门、变形菌门、互养菌门为主,相对丰度占90%以上,为绝对优势菌群。TFE提高了文昌鸡盲肠厚壁菌门、乳酸菌属的相对丰度,双歧杆菌属相对丰度随着饲粮TFE添加水平的增加呈上升趋势。厚壁菌门发酵能力较强,可以促进机体脂肪的沉积,能够发酵产生短链脂肪酸用,于维持机体肠道健康[41-42]。乳酸菌属和双歧杆菌属是动物肠道的有益菌属,菌体内含有大量的消化酶和SOD,能促进机体营养物质的消化,增强肠道宿主的抗氧化能力,同时参与多种维生素的合成、吸收和利用,发酵单糖或者双糖产生乳酸和乙酸等降低肠道pH,通过生物拮抗作用调节肠道微生态[43-45],维持动物机体健康和免疫调节功能。TFE降低了变形菌门、梭杆菌门和普雷沃氏菌科_UCG-001相对丰度。变形菌门相对丰度与消化不良有一定关系[46],梭杆菌门为条件性致病菌,可导致溃疡性结肠炎,溃疡性肠道中变形菌门和梭杆菌门相对丰度均处于较高水平[47]。普雷沃氏菌科_UCG-001为条件致病菌,与机体促炎功能有关,它的定植会导致微生物群代谢变化,使肠道通透性增加从而加剧肠道炎症[48]。因此,本试验结果提示,TFE能够通过促进文昌鸡肠道有益菌的增殖,抑制有害菌或条件治病菌生长来调节肠道微生物菌群,改善肠道形态,缓解湿热环境导致的文昌鸡肠道菌群失调。
4 结论① 饲粮中添加TFE能提高ADG,改善湿热条件下文昌鸡生长性能。
② 饲粮中添加TFE有助于提高湿热条件下文昌鸡免疫和抗氧化功能,缓解机体炎症反应。
③ 饲粮中添加TFE提高了文昌鸡肠道VH和VH/CD,增加了肠道有益菌相对丰度,降低了有害菌和条件致病菌相对丰度,有利于维持肠道绒毛结构完整性,调节肠道微生物菌群。
④ 在本试验条件下,文昌鸡饲粮中TFE的最适添加水平为0.067%。
| [1] |
肖春荣, 涂林锋, 张睿增, 等. 山香圆属植物的化学成分及药理活性研究进展[J]. 中国中药杂志, 2019, 44(7): 1295-1304. XIAO C R, TU L F, ZHANG R Z, et al. Research progress on chemical constituents and biological activities from Turpinia species[J]. China Journal of Chinese Materia Medica, 2019, 44(7): 1295-1304 (in Chinese). |
| [2] |
彭君. 山香圆颗粒联合头孢克洛颗粒治疗小儿急性支气管炎的临床疗效及其对炎性因子的影响[J]. 临床合理用药杂志, 2021, 14(24): 132-134. PENG J. Clinical efficacy of Turpinia granule combined with cefaclor granule in the treatment of acute bronchitis in children and its effect on inflammatory factors[J]. Chinese Journal of Clinical Rational Drug Use, 2021, 14(24): 132-134 (in Chinese). |
| [3] |
匡蕾, 肖春荣, 涂林锋, 等. 山香圆叶化学成分的研究[J]. 中药材, 2019, 42(11): 2570-2573. KUANG L, XIAO C R, TU L F, et al. Chemical constituents from the leaves of Turpinia arguta[J]. Journal of Chinese Medicinal Materials, 2019, 42(11): 2570-2573 (in Chinese). |
| [4] |
LIU X, ZHAN H, QIAO Z, et al. Chemometric analysis based on HPLC multi-wavelength fingerprints for prediction of antioxidant components in Turpiniae folium[J]. Chemometrics and Intelligent Laboratory Systems, 2016, 152: 54-61. DOI:10.1016/j.chemolab.2016.01.006 |
| [5] |
詹怡飞, 张建军, 陈娇婷, 等. 山香圆含片镇痛作用研究[J]. 时珍国医国药, 2005, 16(5): 389-390. ZHAN Y F, ZHANG J J, CHEN J T, et al. Studies on the analgesia effect of Shanxiangyuan baccal tablet[J]. Lishizhen Medicine and Materia Medica Research, 2005, 16(5): 389-390 (in Chinese). DOI:10.3969/j.issn.1008-0805.2005.05.013 |
| [6] |
陈世华, 董德刚, 王思佳, 等. 山香圆总黄酮对慢性咽炎模型大鼠NF-κB、IκBα表达的影响[J]. 江西师范大学学报(自然科学版), 2020, 44(3): 259-262. CHEN S H, DONG D G, WANG S J, et al. The effect of total flavonoids from Turpinia arguta seem on NF-κB and IκBα expression in chronic pharyngitis model rats[J]. Journal of Jiangxi Normal University(Natural Sciences Edition), 2020, 44(3): 259-262 (in Chinese). |
| [7] |
张磊, 李俊, 余世春, 等. 山香圆总黄酮的抗炎作用[J]. 安徽医科大学学报, 2003, 38(3): 185-188. ZHANG L, LI J, YU S C, et al. Anti-inflammatory activity of TFS in experimental models[J]. Acta Universitatis Medicinalis Anhui, 2003, 38(3): 185-188 (in Chinese). DOI:10.3969/j.issn.1000-1492.2003.03.007 |
| [8] |
张磊, 李俊, 余世春, 等. 山香圆总黄酮对免疫功能低下小鼠免疫功能的影响[J]. 安徽医科大学学报, 2006, 41(5): 539-543. ZHANG L, LI J, YU S C, et al. The effects of total flavonoids of Turpinia arguta on the immune function of immunosuppressed mice induced by cyclophosphamide[J]. Acta Universitatis Medicinalis Anhui, 2006, 41(5): 539-543 (in Chinese). DOI:10.3969/j.issn.1000-1492.2006.05.019 |
| [9] |
詹怡飞, 张建军, 毛友昌, 等. 山香圆含片抗菌作用的试验研究[J]. 江西中医学院学报, 2005, 17(2): 55. ZHAN Y F, ZHANG J J, MAO Y C, et al. Experimental study on antibacterial effect of Turpinia buccal tablet[J]. Journal of Jiangxi University of Traditional Chinese Medicine, 2005, 17(2): 55 (in Chinese). DOI:10.3969/j.issn.1005-9431.2005.02.026 |
| [10] |
ZHAO L J, XIA B H, LIN M L, et al. Optimization of ultrasound-assisted enzymatic polysaccharide extraction from Turpiniae folium based on response surface methodology[J]. Digital Chinese Medicine, 2018, 1(3): 239-246. DOI:10.1016/S2589-3777(19)30031-X |
| [11] |
吴珊, 李小芳, 舒予, 等. 正交优化-微波辅助提取山香圆叶总黄酮的工艺研究[J]. 成都中医药大学学报, 2014, 37(2): 15-17. WU S, LI X F, SHU Y, et al. Optimization of microwave-ultrasound assisted extraction of flavonoids from leaves of Turpiniae folium by orthogonal design[J]. Journal of Chengdu University of Traditional Chinese Medicine, 2014, 37(2): 15-17 (in Chinese). |
| [12] |
海南省质量技术监督局. 文昌鸡饲养管理技术规程: DB46/T 44—2011[S]. 海口: 海南省质量技术监督局, 2011. Hainan Provincial Quality and Technical Supervision Bureau. Technical regulations for breeding and management of Wenchang chickens: DB46/T 44—2011[S]. Haikou: Hainan Provincial Quality and Technical Supervision Bureau, 2011. (in Chinese) |
| [13] |
中华人民共和国农业农村部. 家禽生产性能名词术语和度量计算方法: NY/T 823—2020[S]. 北京: 中国农业出版社, 2020. Ministry of Agriculture and Rural Areas of the People's Republic of China. Performance terminology and measurements for poultry: NY/T 823—2020[S]. Beijing: China Agriculture Press, 2020. (in Chinese) |
| [14] |
耿照玉, 张云芳. 海南文昌鸡若干种质特征和遗传多样性研究[J]. 应用生态学报, 2003, 14(4): 562-564. GENG Z Y, ZHANG Y F. Germplasm characteristics and genetic diversity of Wenchang fowl[J]. Chinese Journal of Applied Ecology, 2003, 14(4): 562-564 (in Chinese). DOI:10.3321/j.issn:1001-9332.2003.04.018 |
| [15] |
张德祥, 罗庆斌, 赖晓丹, 等. 慢性热应激对不同品种肉鸡生长发育的影响[J]. 中国家禽, 2016, 38(15): 37-42. ZHANG D X, LUO Q B, LAI X D, et al. Effect of chronic heat stress on growth in different broiler chickens[J]. China Poultry, 2016, 38(15): 37-42 (in Chinese). |
| [16] |
SANDS J S, SMITH M O. Effects of dietary manganese proteinate or chromium picolinate supplementation on plasma insulin, glucagon, glucose and serum lipids in broiler chickens reared under thermoneutral or heat stress conditions[J]. International Journal of Poultry Science, 2002, 1(5): 145-149. DOI:10.3923/ijps.2002.145.149 |
| [17] |
SIMAR D, JACQUES A, CAILLAUD C. Heat shock proteins induction reduces stress kinases activation, potentially improving insulin signalling in monocytes from obese subjects[J]. Cell Stress & Chaperones, 2012, 17(5): 615-621. |
| [18] |
宋志华, 程康, 张婧菲, 等. 酶解青蒿对热应激肉鸡消化功能的影响[J]. 南京农业大学学报, 2018, 41(1): 126-131. SONG Z H, CHENG K, ZHANG J F, et al. Effects of dietary enzymatically treated Artemisia annua supplementation on digestion function of the heat-stressed broilers[J]. Journal of Nanjing Agricultural University, 2018, 41(1): 126-131 (in Chinese). |
| [19] |
秦红, 王帅, 陈昱筱, 等. 维生素C和黄芪多糖对热应激蛋鸡蛋品质及肠道健康的影响[J]. 中国粮油学报, 2019, 34(9): 88-95. QIN H, WANG S, CHEN Y X, et al. Effects of vitamin C and Astragalus polysaccharides on egg quality and intestinal health of laying hens under heat stress[J]. Journal of the Chinese Cereals and Oils Association, 2019, 34(9): 88-95 (in Chinese). DOI:10.3969/j.issn.1003-0174.2019.09.015 |
| [20] |
STARČEVIĆ K, KRSTULOVIĆ L, BROZIĆ D, et al. Production performance, meat composition and oxidative susceptibility in broiler chicken fed with different phenolic compounds[J]. Journal of the Science of Food and Agriculture, 2015, 95(6): 1172-1178. DOI:10.1002/jsfa.6805 |
| [21] |
LIU L L, HE J H, XIE H B, et al. Resveratrol induces antioxidant and heat shock protein mRNA expression in response to heat stress in black-boned chickens[J]. Poultry Science, 2014, 93(1): 54-62. DOI:10.3382/ps.2013-03423 |
| [22] |
杨霞, 李勤奋, 赵建国, 等. 木薯叶乙醇提取物对热应激下文昌鸡生产性能及血清抗氧化性能的影响[J]. 黑龙江畜牧兽医, 2020(4): 82-86. YANG X, LI Q F, ZHAO J G, et al. Effects of cassava leaf ethanolic extracts on growth performance and antioxidation of Wenchang chickens under heat stress[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020(4): 82-86 (in Chinese). |
| [23] |
SAHIN K, KÜÇÜK O, SAHIN N. Effects of dietary chromium picolinate supplementation on performance and plasma concentrations of insulin and corticosterone in laying hens under low ambient temperature[J]. Journal of Animal Physiology and Animal Nutrition, 2001, 85(5/6): 142-147. |
| [24] |
LARA L J, ROSTAGNO M H. Impact of heat stress on poultry production[J]. Animals, 2013, 3(2): 356-369. DOI:10.3390/ani3020356 |
| [25] |
SHI D Y, BAI L, QU Q, et al. Impact of gut microbiota structure in heat-stressed broilers[J]. Poultry Science, 2019, 98(6): 2405-2413. DOI:10.3382/ps/pez026 |
| [26] |
BARTLETT J R, SMITH M O. Effects of different levels of zinc on the performance and immunocompetence of broilers under heat stress[J]. Poultry Science, 2003, 82(10): 1580-1588. DOI:10.1093/ps/82.10.1580 |
| [27] |
李国军. 酵母对脂多糖诱导黄羽肉鸡急性炎症反应的影响[D]. 硕士学位论文. 长沙: 湖南农业大学, 2016: 39-41. LI G J. Effects of yeast on lipopolysaccharide-induced acute inflammatory response in yellow broilers[D]. Master's Thesis. Changsha: Hunan Agricultural University, 2016: 39-41. (in Chinese) |
| [28] |
HE S P, YU Q F, HE Y J, et al. Dietary resveratrol supplementation inhibits heat stress-induced high-activated innate immunity and inflammatory response in spleen of yellow-feather broilers[J]. Poultry Science, 2019, 98(12): 6378-6387. DOI:10.3382/ps/pez471 |
| [29] |
ZHANG L, LI J, YU S C, et al. Therapeutic effects and mechanisms of total flavonoids of Turpinia arguta Seen on adjuvant arthritis in rats[J]. Journal of Ethnopharmacology, 2008, 116(1): 167-172. DOI:10.1016/j.jep.2007.11.027 |
| [30] |
吕梦云. 葛藤黄酮提取物对肉鸡生产性能和脂肪代谢的影响[D]. 硕士学位论文. 南昌: 江西农业大学, 2017: 12-37. LYU M Y. Effects of kudzu vine flavonoids extract on growth performance and lipid metabolism of broilers[D]. Master's Thesis. Nanchang: Jiangxi Agricultural University, 2017: 12-37. (in Chinese) |
| [31] |
QUINTEIRO-FILHO W M, RODRIGUES M V, RIBEIRO A, et al. Acute heat stress impairs performance parameters and induces mild intestinal enteritis in broiler chickens: role of acute hypothalamic-pituitary-adrenal axis activation[J]. Journal of Animal Science, 2012, 90(6): 1986-1994. DOI:10.2527/jas.2011-3949 |
| [32] |
张柏林, 杨乾, 刘宁, 等. 饲粮添加L-谷氨酰胺对脂多糖刺激肉鸡血浆生化指标、免疫性能、肠道炎症因子表达及黏膜免疫的影响[J]. 动物营养学报, 2020, 32(6): 2611-2623. ZHANG B L, YANG Q, LIU N, et al. Effects of dietary L-glutamine supplementation on plasma biochemical parameters, immune performance, intestinal inflammatory factors expression and mucosal immune of broilers challenged by lipopolysaccharide[J]. Chinese Journal of Animal Nutrition, 2020, 32(6): 2611-2623 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.06.020 |
| [33] |
SURAI P F, KOCHISH I I, FISININ V I, et al. Antioxidant defence systems and oxidative stress in poultry biology: an update[J]. Antioxidants, 2019, 8(7): 235. DOI:10.3390/antiox8070235 |
| [34] |
YANG L, TAN G Y, FU Y Q, et al. Effects of acute heat stress and subsequent stress removal on function of hepatic mitochondrial respiration, ROS production and lipid peroxidation in broiler chickens[J]. Comparative Biochemistry and Physiology: Toxicology & Pharmacology, 2010, 151(2): 204-208. |
| [35] |
ZHANG Y W, LUO H L, CHANG Y F, et al. Effects of liquorice extract on the activity and gene expression level of antioxidant enzymes in longissimus dorsi muscle of Tan lamb[J]. Small Ruminant Research, 2017, 154: 23-28. DOI:10.1016/j.smallrumres.2017.06.012 |
| [36] |
SALAMI S A, MAJOKA M A, SAHA S, et al. Efficacy of dietary antioxidants on broiler oxidative stress, performance and meat quality: science and market[J]. Avian Biology Research, 2015, 8(2): 65-78. DOI:10.3184/175815515X14291701859483 |
| [37] |
BOZKURT M, KUCUKYILMAZ K, CATLI A U, et al. Growth performance and slaughter characteristics of broiler chickens fed with antibiotic, mannan oligosaccharide and dextran oligosaccharide supplemented diets[J]. International Journal of Poultry Science, 2008, 7(10): 969-977. DOI:10.3923/ijps.2008.969.977 |
| [38] |
周萍芳. 苜蓿黄酮提取物对麻鸡生产性能及脂肪沉积的影响[D]. 硕士学位论文. 南昌: 江西农业大学, 2011: 28-35. ZHOU P F. Effects of crude extracts of alfalfa flavone on growth performance and lipid deposit of broilers[D]. Master's Thesis. Nanchang: Jiangxi Agricultural University, 2011: 28-35. (in Chinese) |
| [39] |
HE X F, LU Z, MA B B, et al. Effects of chronic heat exposure on growth performance, intestinal epithelial histology, appetite-related hormones and genes expression in broilers[J]. Journal of the Science of Food and Agriculture, 2018, 98(12): 4471-4478. DOI:10.1002/jsfa.8971 |
| [40] |
SONG J, XIAO K, KE Y L, et al. Effect of a probiotic mixture on intestinal microflora, morphology, and barrier integrity of broilers subjected to heat stress[J]. Poultry Science, 2014, 93(3): 581-588. DOI:10.3382/ps.2013-03455 |
| [41] |
BRULC J M, ANTONOPOULOS D A, MILLER M E B, et al. Gene-centric metagenomics of the fiber-adherent bovine rumen microbiome reveals forage specific glycoside hydrolases[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(6): 1948-1953. DOI:10.1073/pnas.0806191105 |
| [42] |
ZHANG J C, GUO Z, XUE Z S, et al. A phylo-functional core of gut microbiota in healthy young Chinese cohorts across lifestyles, geography and ethnicities[J]. The ISME Journal, 2015, 9(9): 1979-1990. DOI:10.1038/ismej.2015.11 |
| [43] |
于钊瑞, 赵鑫, 邱峰. 双歧杆菌、乳杆菌和芽孢杆菌产细菌素和多糖研究进展[J]. 食品工业科技, 2021, 42(24): 396-406. YU Z R, ZHAO X, QIU F. Bacteriocins and polysaccharides from Bifidobacterium, Lactobacillus and Bacillus[J]. Science and Technology of Food Industry, 2021, 42(24): 396-406 (in Chinese). |
| [44] |
孙寒雪, 刘雅丽, 曾涛, 等. 包被丁酸钠或蝉花多糖对种鸽哺育期减重、血清免疫球蛋白含量、肠道组织形态及回肠菌群的影响[J]. 动物营养学报, 2021, 33(10): 5955-5964. SUN H X, LIU Y L, ZENG T, et al. Effects of coated sodium butyrate or cordyceps cicadae polysaccharide on weight loss during lactation, serum immunoglobulin contents, intestinal morphology and ileal microflora of breeding pigeons[J]. Chinese Journal of Animal Nutrition, 2021, 33(10): 5955-5964 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.10.054 |
| [45] |
蒋磊, 刘敏. 817肉鸡肠道乳酸菌及生理特性研究[J]. 畜禽业, 2019, 30(3): 6-7, 9. JIANG L, LIU M. Study on intestinal Lactobacillus and physiological characteristics of 817 broilers[J]. Livestock and Poultry Industry, 2019, 30(3): 6-7, 9 (in Chinese). |
| [46] |
陈瑜, 刘婉薇, 李良芳, 等. 功能性消化不良患者唾液菌群的研究[J]. 重庆医学, 2017, 46(13): 1789-1791, 1796. CHEN Y, LIU W W, LI L F, et al. Analysis on saliva microbiome in patients with functional dyspepsia[J]. Chongqing Medicine, 2017, 46(13): 1789-1791, 1796 (in Chinese). DOI:10.3969/j.issn.1671-8348.2017.13.020 |
| [47] |
余今菁, 李欢, 胡邱宇, 等. 基于高通量测序技术的溃疡性结肠炎患者肠道菌群多样性研究[J]. 华中科技大学学报(医学版), 2018, 47(4): 460-465. YU J J, LI H, HU Q Y, et al. Research on gut microbiota diversity in patients with ulcerative colitis by high-throughput sequencing[J]. Acta Medicinae Universitatis Scientiae et Technologiae Huazhong (Medical Edition), 2018, 47(4): 460-465 (in Chinese). DOI:10.3870/j.issn.1672-0741.2018.04.015 |
| [48] |
LEY R E. Gut microbiota in 2015:Prevotella in the gut: choose carefully[J]. Nature Reviews: Gastroenterology & Hepatology, 2016, 13(2): 69-70. |




