2. 宁波大学食品与药学学院, 宁波 315800
2. College of Food and Pharmaceutical Sciences, Ningbo University, Ningbo 315800, China
我国是肉鸭生产和消费大国,2020年肉鸭出栏量为40.72亿羽[1]。肉鸭品种主要包括北京鸭、樱桃谷鸭、番鸭等,其中番鸭原产于中南美洲的热带森林,17世纪传入中国,成为水禽养殖业中的重要品种[2]。相较于其他肉鸭品种,番鸭具有较强的觅食能力和抗热耐寒能力[3]。番鸭的瘦肉含量为产肉量的82%~85%[4],具有较高的经济价值[5]。家禽肠道中有大量的微生物生存,能调控机体的生长发育、免疫和抗应激等[6-7]。真菌(fungus)是肠道微生物的重要组成部分,是具有真核和细胞壁的异养生物,在《真菌词典》(2010年版)中记录在册的真菌种类约10万种[8-9]。但与肠道细菌相比,真菌的菌群结构较简单、相对丰度较低[10]。真菌在人体肠道微生物中的占比不到1%,却是重要组成部分,与抗生素相关性腹泻(antibiotic-associated diarrhea,AAD)和炎症性肠病(inflammatory bowel disease,IBD)等疾病的发病机制有关,同时在维持肠道微生态稳态和机体健康方面发挥着重要作用[11]。白色念球菌属、毛霉菌属(Mucor)、念珠菌属等真菌会引发禽类的真菌性炎症,从而造成养殖业的损失[12-13]。部分酵母菌可能与家禽体内的假单胞菌、克雷伯氏菌和沙门氏菌等病原体结合,刺激免疫系统,从而减少病原体[14]。只有清楚家禽各生长阶段的真菌菌群变化,才能提前对一些疾病采取预防措施,最大程度地降低损失。目前,大多关于鸭肠道微生物的研究是针对肠道中的细菌开展的,对于鸭肠道中真菌的研究尚未见报道。因此,本试验以番鸭为研究对象,揭示其肠道中真菌菌群结构及其发育性变化,扩展对番鸭肠道中真菌菌群多样性的认识,进一步为番鸭肠道真菌与生长发育关系的研究奠定理论基础。
1 材料与方法 1.1 试验设计与饲养管理番鸭由浙江省兰溪市禾旺禽业专业合作社提供,在浙江省农业科学院动物实验房进行试验。试验选用1日龄健康番鸭70只,体重为(49.28±1.45) g,在相同环境下饲养70 d。分别在番鸭1、3、7、14、28、42和70日龄时,每组随机选取6只番鸭,测定体重后屠宰取盲肠内容物,提取盲肠内容物中真菌DNA用于真菌菌群结构测序分析。
番鸭在3日龄内需昼夜24 h光照,28日龄后进行自然光照,同时利用红外线灯加热保温。1~3日龄舍温30~33 ℃,3日龄后舍温每天降0.5 ℃,14~21日龄舍温在21 ℃左右,之后逐日降至室温[15]。常规饲养管理,自由饮水和采食。饲粮为全价配合饲料(产品标准编号:Q31/0117000507C003)[16],饲粮营养水平见表 1。
|
|
表 1 饲粮营养水平(干物质基础) Table 1 Nutrient levels of diets (DM basis) |
采用QIAGEN试剂盒提取番鸭盲肠内容物微生物组DNA。以提取的DNA为模板,用内转录间隔区(ITS)2的上游引物(5′-GTGAATCATCGAATCTTTGAA-3′)和下游引物(5′-TCCTCCGCTTATTGATATGC-3′)对番鸭盲肠内容物真菌DNA进行PCR扩增,对PCR产物进行测序分析。
1.2.2 生物信息学分析采用Illumina测序技术对番鸭盲肠内容物中真菌ITS的ITS2区域进行测序,再用QIIME软件对序列进行质控和过滤,得到高质量的DNA序列[17]。根据相似性不小于97%的原则将通过质控的有效序列聚类成为操作分类单元(operational taxonomic unit,OTU)[18],并利用QIIME软件计算香农指数(Shannon index)、Chao1指数(Chao1 index)和辛普森指数(Simpson index)。基于分类学信息,分别在门、属水平上进行番鸭盲肠内容物真菌菌群结构的统计与分析。
1.3 数据统计分析采用SPSS 25.0软件对数据进行统计分析,运用单因素方差分析(one-way ANOVA)进行分析并使用LSD法进行多重比较,结果以“平均值±标准误”表示,P < 0.05为差异显著。
2 结果与分析 2.1 不同日龄番鸭的体重变化番鸭在70日龄内体重变化明显,体重逐渐增加(图 1)。通过分析番鸭体重变化的趋势发现,1~7日龄,相对生长速度缓慢;7~14日龄,相对生长速度加快;14~70日龄,相对生长速度明显加快(图 2)。
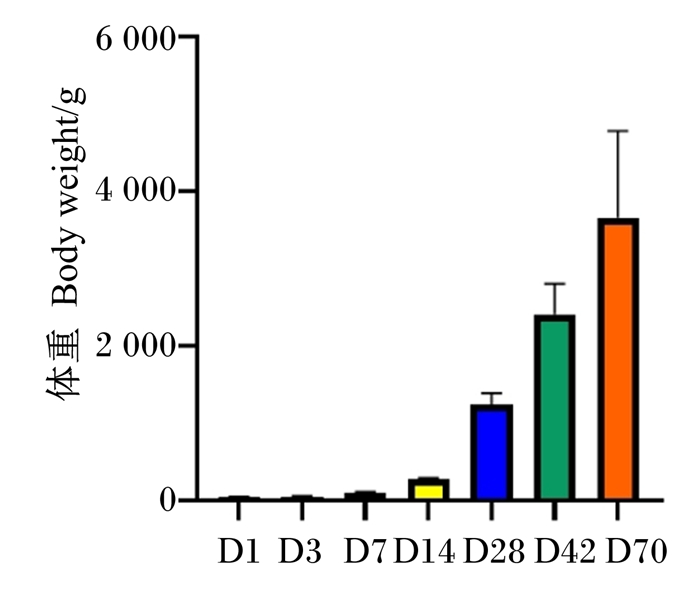
|
D1:1日龄1 day of age;D3:3日龄3 days of age;D7:7日龄7 days of age;D14:14日龄14 days of age;D28:28日龄28 days of age;D42:42日龄42 days of age;D70:70日龄70 days of age。下图同the same as below。 图 1 不同日龄番鸭体重变化 Fig. 1 Change of body weight of Muscovy ducks at different days of age |
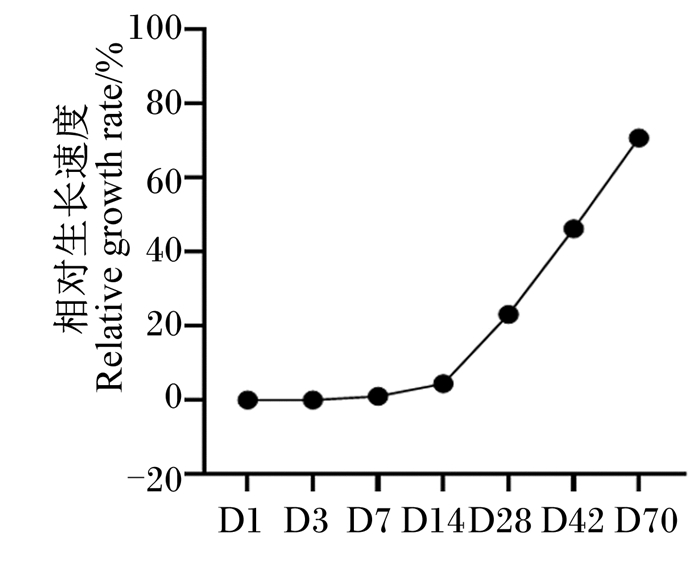
|
图 2 不同日龄番鸭相对生长速度 Fig. 2 Relative growth rate of Muscovy ducks at different days of age |
由表 2可知,番鸭盲肠真菌香农指数和辛普森指数在42日龄时最高,显著高于3、7、14、28日龄(P<0.05);Chao1指数在42日龄时最低,显著低于1、3、7日龄(P<0.05)。
|
|
表 2 不同日龄番鸭盲肠真菌菌群α多样性指数 Table 2 α diversity indexes of cecal mycobiome of Muscovy ducks at different days of age |
为了明确比较番鸭盲肠真菌微生物之间的相似性,进行了基于微生物组基因图谱的β多样性分析,并使用PCoA可视化。图 3显示番鸭在1、3、7日龄时盲肠菌群结构相近;28日龄时盲肠菌群结构向14日龄时盲肠菌群结构靠拢;42日龄时盲肠菌群结构相对于其他日龄的布较离散,说明42日龄与其他日龄之间菌群组成差异较大;70日龄时盲肠菌群结构与其他日龄的分布更加离散,说明70日龄与其他日龄之间菌群组成差异更大。由此可知,不同日龄番鸭盲肠菌群结构存在较大差异。
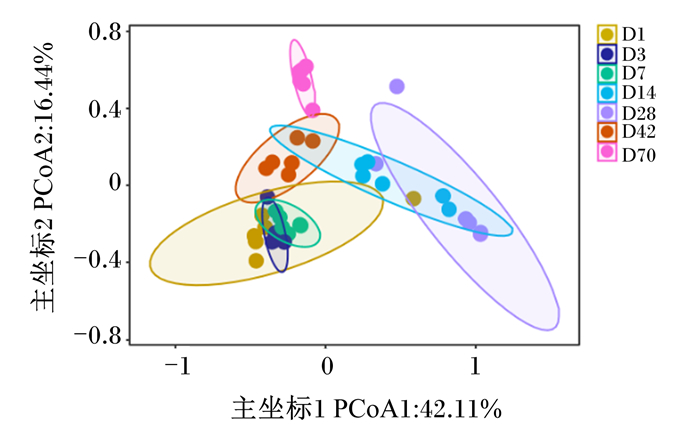
|
图 3 不同日龄番鸭盲肠真菌菌群结构PCoA Fig. 3 PCoA of cecal mycobiome structure of Muscovy ducks at different days of age |
通过对不同分类学水平上的真菌相对丰度进行进化树分析发现,不同日龄番鸭盲肠真菌相对丰度不同(图 4)。
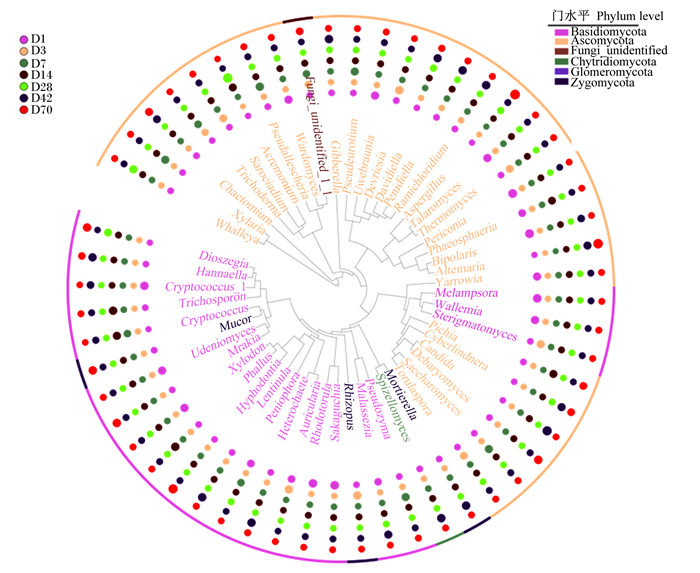
|
进化树显示了番鸭盲肠真菌微生物在门水平和属水平的相对丰度变化。最外面的环按门着色,里面的环和标签按门选择性着色。圈最外侧的点代表在不同日龄中不同菌属的相对丰度大小。 Ascomycota:子囊菌门;Basidiomycota:担子菌门;Zygomycota:接合菌门;Chytridiomycota:壶菌门;Glomeromycota:球囊菌门。Hannaella:汉纳酵母菌属;Trichosporon:毛芽孢子菌属;Cryptococcus:隐球菌属;Mucor:毛霉菌属;Mrakia:木拉克酵母属;Xylodon:木齿菌属;Hyphodontia:丝齿菌属;Lentinula:香菇菌属;Peniophora:隔孢伏革菌属;Heterochaete:刺皮菌属;Auricularia:木耳菌属;Rhodotorula:红酵母菌属;Rhizopus:根霉菌属;Malassezia:马拉色菌;Spizellomyces:壶菌属;Mortierella:被孢霉菌属;Torulaspora:圆孢菌属;Saccharomyces:酵母菌属;Debaryomyces:德巴利酵母属;Candida:念球菌属;Cyberlindnera:假丝酵母菌属;Pichia:毕赤酵母菌属;Sterigmatomyces:梗孢酵母菌属;Wallemia:节担菌属;Melampsora:栅锈菌属;Yarrowia:耶罗维亚酵母菌属;Altemaria:交链孢霉菌属;Bipolaris:二极孢菌属;Phaeosphaeria:球腔菌属;Periconia:黑团孢菌属;Thermomyces:嗜热丝孢菌属;Talaromyces:篮状菌属;Aspergillus:曲霉菌属;Ramichloridium:枝氯霉属;Davidiella:小戴维霉属;Pseudocercospora:假尾孢菌属;Gibberella:赤霉菌属;Wardomyces:沃德霉属;Pseudallescheria:假埃希氏菌属;Acremonium:顶孢菌属;Sarociadium:帚枝霉属;Trichoderma:木霉菌属;Chaetomium:毛壳菌属;Xylaria:炭角菌属。 The phylogenetic tree was to show the changes in the relative abundance of mycobiome in cecum of Muscovy ducks at the phylum and genus levels. The outermost circle was colored by phylum, and the inner circle and labels were selective colored by phylum. The outermost point of the circle represented the relative abundance of different genera at different days of age. 图 4 番鸭盲肠真菌菌群结构进化树 Fig. 4 Phylogenetic tree of cecal mycobiome structure of Muscovy ducks |
为探究番鸭盲肠真菌在不同分类学水平上的物种组成比例情况和群落结构,分析了门和属水平盲肠真菌菌群结构的组成及变化。图 5总结了门水平上代表性真菌微生物相对丰度的变化,在饲喂的70 d内,番鸭盲肠真菌菌群结构主要由子囊菌门(Ascomycota)与担子菌门(Basidiomycota)组成,2个菌门占比95%以上,为门水平上优势菌门。子囊菌门相对丰度在1~14日龄内从77.5%上升至93.39%,14~70日龄下降至42.05%,其中以14日龄的相对丰度最高;担子菌门的相对丰度在1~14日龄内从18.38%下降至6.22%,14~70日龄上升至54.85%。
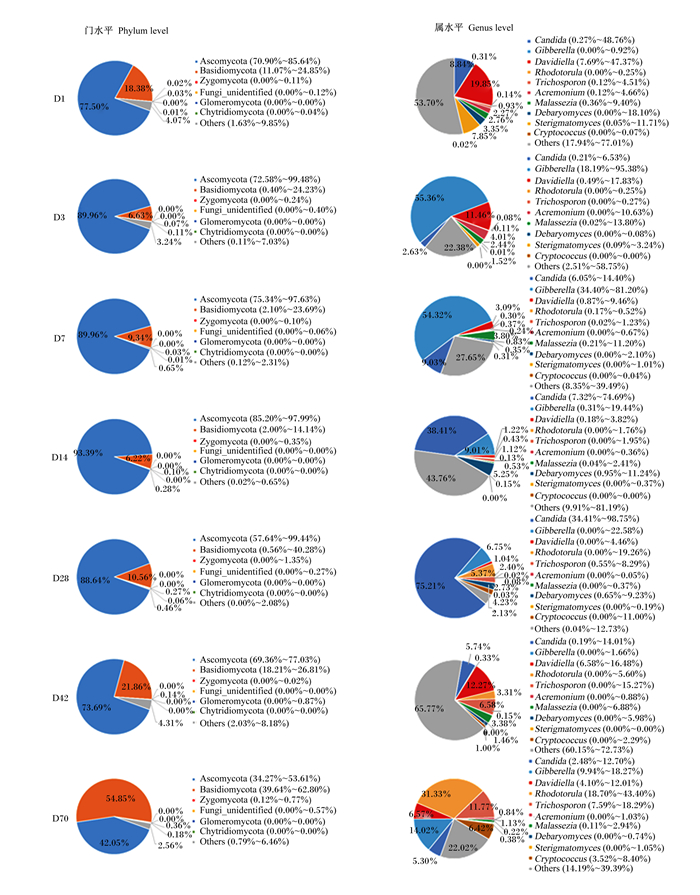
|
Ascomycota:子囊菌门;Basidiomycota:担子菌门;Zygomycota:接合菌门;Chytridiomycota:壶菌门;Glomeromycota:球囊菌门;Candida:念球菌属;Gibberella:赤霉菌属;Davidiella:小戴维霉属;Rhodotorula:红酵母菌属;Trichosporon:毛芽孢子菌属;Malassezia:马拉色菌属;Debaryomyces:德巴利酵母属;Sterigmatomyces:梗孢酵母菌属;Cryptococcus:隐球菌属;Acremonium:顶孢菌属;Others:其他。 图 5 不同日龄番鸭在门水平和属水平的盲肠真菌菌群结构 Fig. 5 Cecal mycobiome structure of Muscovy ducks at different days of age at phylum and genus levels |
图 5总结了属水平上真菌微生物相对丰度的变化,1日龄时,番鸭盲肠菌群主要由小戴维霉属(Davidiella)和念球菌属(Candida)组成;3日龄时,赤霉菌属(Gibberella)和小戴维霉属为盲肠优势菌属;7~14日龄时,念球菌属和赤霉菌属为盲肠优势菌属;28日龄时,念球菌属成为盲肠第1优势菌属;42日龄时,赤霉菌属和念球菌属不再是盲肠优势菌属,小戴维霉属和毛芽孢子菌属(Trichosporon)的相对丰度增加;70日龄时番鸭盲肠微生物以红酵母菌属(Rhodotorula)、毛芽孢子菌属和赤霉菌属为优势菌属,其中红酵母菌属的相对丰度明显增加。德巴利酵母属(Debaryomyces)在1~14日龄相对其他日龄占比较大,14日龄后相对丰度逐渐降低。
2.4 不同日龄番鸭真菌菌群发育性变化 2.4.1 番鸭盲肠中真菌菌群结构差异分析为探究番鸭盲肠真菌在属水平上相对丰度的差异性,进行了效应大小测量(LEfSe)分析。结果显示,15、10、6、21、6、16和24个特征分别在1、3、7、14、28、42和70日龄中显著不同(P<0.05),表明7组之间的分类存在明显差异。在属水平上,70日龄时的红酵母菌属和毛霉菌属,7日龄时的马拉色菌属(Malassezia),42日龄时的链格孢属(Alternaria),3日龄时的赤霉菌属,28日龄时的念球菌属,14日龄时的毕赤酵母属(Pichia)和节担菌属(Wallemia),1日龄时的小戴维霉属和梗孢酵母属(Sterigmatomyces)相对丰度富集并且显著不同(P<0.05)(图 6)。
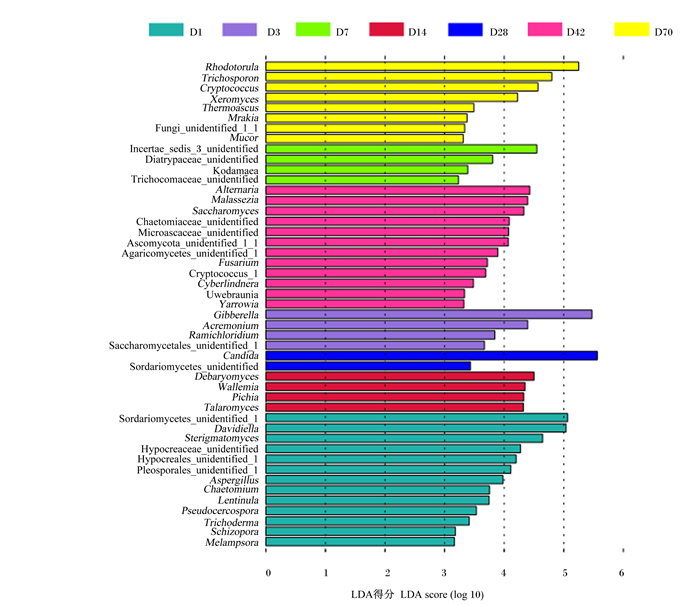
|
纵轴为属水平菌种的名称。颜色对应不同日龄,线性判别分析(LDA)与效应大小测量(LEfSe)相结合揭示了不同日龄之间的一系列特征。 Rhodotorula:红酵母菌属;Trichosporon:毛芽孢子菌属;Cryptococcus:隐球菌属;Xeromyces:耐干霉菌;Thermoascus:嗜热子囊菌属;Mrakia:木拉克酵母属;Mucor:毛霉菌属;Alternaria:链格孢属;Malassezia:马拉色菌属;Saccharomyces:酵母菌属;Fusarium:镰刀菌属;Cyberlindnera:假丝酵母菌属;Yarrowia:耶罗维亚酵母菌属;Gibberella:赤霉菌属;Acremonium:支顶孢菌属;Ramichloridium:枝氯霉属;Candida:念球菌属;Debaryomyces:德巴利酵母属;Wallemia:节担菌属;Pichia:毕赤酵母属;Talaromyces:篮状菌属;Davidiella:小戴维霉属;Sterigmatomyces:梗孢酵母属;Aspergillus:曲霉菌属;Chaetomium:毛壳菌属;Lentinula:香菇菌属;Pseudocercospora:假尾孢菌属;Trichoderma:木霉菌属;Schizopora:裂孔菌属;Melampsora:栅锈菌属。 The vertical axis represented names of different genera. The colors corresponded to different ages, and linear discriminant analysis (LDA) combined with effect size measurements (LEfSe) revealed a series of characteristics among different days of age. 图 6 不同日龄番鸭盲肠菌群LEfSe分析 Fig. 6 LEfSe analysis of cecal flora of Muscovy ducks at different days of age |
为进一步探究番鸭真菌在属水平上的结构和相对丰度的差异,将LEfSe分析所得差异菌属进行热图分析。结果表明,番鸭盲肠真菌微生物出现明显的属间差异。尽管拥有相同的主要菌群,但它们的相对丰度差异很大。在70 d的饲喂过程中,随着番鸭的生长发育,其盲肠中红酵母菌属、隐球菌属(Cryptococcus)和念球菌属的相对丰度显著增加(P<0.05),赤霉菌属和小戴维霉属的相对丰度显著降低(P<0.05)(图 7)。
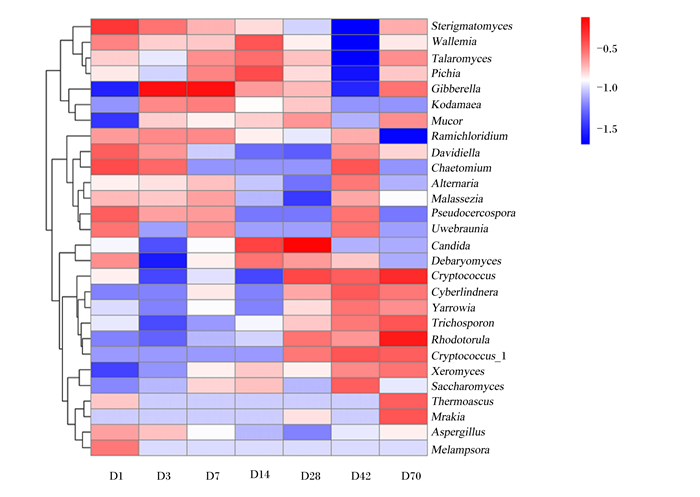
|
纵坐标代表菌属聚类,一行代表一个菌属。色阶代表菌属表达相对丰度,红色代表相对丰度升高,蓝色代表相对丰度降低。 Rhodotorula:红酵母菌属;Trichosporon:毛芽孢子菌属;Cryptococcus:隐球菌属;Xeromyces:耐干霉菌;Thermoascus:嗜热子囊菌属;Mrakia:木拉克酵母属;Mucor:毛霉菌属;Alternaria:链格孢属;Malassezia:马拉色菌属;Saccharomyces:酵母菌属;Cyberlindnera:假丝酵母菌属;Yarrowia:耶罗维亚酵母菌属;Gibberella:赤霉菌属;Ramichloridium:枝氯霉属;Candida:念球菌属;Debaryomyces:德巴利酵母属;Wallemia:节担菌属;Pichia:毕赤酵母属;Talaromyces:篮状菌属;Davidiella:小戴维霉属;Sterigmatomyces:梗孢酵母菌属;Aspergillus:曲霉菌属;Chaetomium:毛壳菌属;Pseudocercospora:假尾孢菌属;Kodamaea:柯达酵母属;Melampsora:栅锈菌属。 The vertical axis represented the genus clusters, and one row represented one genus. The color scale represented the relative abundance of genera expression, the red represented the relative abundance increased, and the blue represented the relative abundance decreased. 图 7 不同日龄番鸭盲肠菌群分布热图 Fig. 7 Heatmap of cecal flora distribution of Muscovy ducks at different days of age |
为衡量番鸭盲肠属水平上的真菌菌群结构和体重密切程度,通过Spearman相关分析从高相对丰度的真菌中筛选后,进行了相关性分析。其中,毛芽孢子菌属、耐干霉菌属(Xeromyces)和红酵母菌属相对丰度与体重的相关关系较强,而木拉克酵母菌属(Mrakia)、圆孢菌属(Torulaspora)和宙斯沸耳菌属(Dioszegia)相对丰度与体重的相关关系较弱(图 8)。
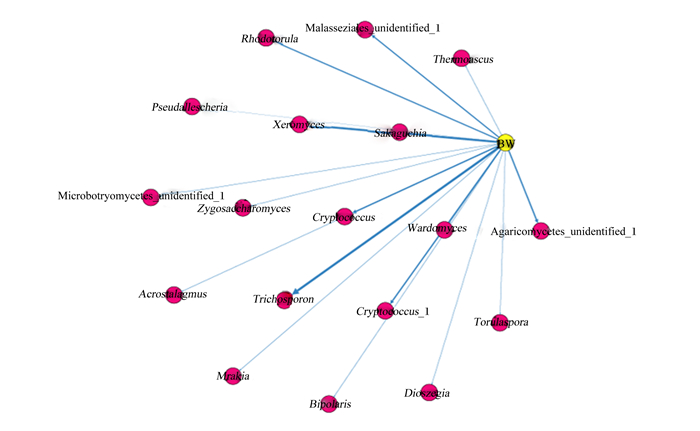
|
黄色点代表体重,红色点代表真菌菌属。线粗细代表相关关系强弱,越粗代表相关绝对值越大;点的数量代表相关对象个数多少。 Wardomyces:沃德霉属;Zygosaccharomyces:接合酵母菌属;Rhodotorula:红酵母菌属;Trichosporon:毛芽孢子菌属;Cryptococcus:隐球菌属;Sakaguchia:坂口菌属;Xeromyces:耐干霉菌;Torulaspora:圆孢菌属;Mrakia:木拉克酵母菌属;Bipolaris:二极孢菌属;Thermoascus:嗜热子囊菌属;Acrostalagmus:笋顶孢菌属;Pseudallescheria:假埃希氏菌属;Dioszegia:宙斯沸耳菌属。 Yellow spot represented the body weight, and the red spots represented the fungi genus. The thickness of the line represented the strength of the correlation, and the thicker the line, the greater the absolute value of the correlation; the number of spots represented the number of related objects. 图 8 番鸭盲肠真菌菌群与体重相关性网络图 Fig. 8 Correlation network diagram of caecal mycobiome and body weight of Muscovy ducks |
人类和动物肠道中最常见的真菌属有酵母菌属、念珠菌属、曲霉属、枝孢菌属、青霉菌属、马拉色菌属和金黄色葡萄球菌属等[19-20]。肠道真菌可以促进机体营养物质的吸收和消耗,并通过产生酶和维生素来帮助消化[21]。最近在小鼠和人上的研究已经强调了真菌在肠道内稳态和系统免疫中的关键作用,例如酵母布拉氏酵母菌作为益生菌被广泛用作预防和治疗肠道并发症[22-23]。在早期断奶仔猪的饲粮中添加酿酒酵母(Saccharomyces cerevisiae)可有效提高断奶仔猪的肠道发育和全身免疫力[24]。研究表明,肠道真菌生态失调与感染性肠炎(infective colitis,IC)和IBD等肠道疾病的发生有着密切的关系[25]。Shuai等[26]通过对不同年龄段人群的肠道真菌分析后,发现肠道真菌组成主要由年龄决定,并随时间变化稳定。在本试验中,我们揭示了不同日龄番鸭盲肠真菌菌群结构及相对丰度变化。本研究中,α多样性分析表明,番鸭盲肠真菌香农指数和辛普森指数大致呈先降低,在42日龄时升高后再降低,番鸭盲肠内真菌Chao1指数呈先降低后升高的趋势[16],结果说明了番鸭盲肠真菌菌群多样性随日龄增长逐渐升高。温雪婷等[16]研究发现,在肉鸡中最高体重组的真菌菌群多样性最高,与本研究结果一致。Wang等[27]对牦牛所有发育阶段的真菌群落变化研究发现,真菌群落相对丰度和多样性的α指数随着年龄的增长而显着增加。担子菌门和子囊菌门一起被归入Dikarya分支[28],代表了真菌界的主要门。通过对番鸭盲肠菌群结构分析发现,在门水平上,子囊菌门与担子菌门为主要优势菌门,2个菌门占比在95%以上,与Robinson等[11]研究结果一致。子囊菌门是迄今为止真菌界最大的群体[29-30]。本研究表明在番鸭的生长发育过程中,子囊菌门一直处于优势菌门的地位,但在70日龄时,相对丰度显著降低并且占比低于担子菌门。在属水平上,念球菌属、赤霉菌属是番鸭盲肠中相对丰度最高的菌属。本研究结果表明,42~70日龄的盲肠真菌菌群结构与1~28日龄的盲肠真菌菌群结构差异较大。Roemer等[31]研究发现,免疫功能低下的个体极易被念球菌属所感染,随着番鸭的生长发育,其免疫系统也在不断的完善。因此通过饼图可知,42日龄时中赤霉菌属和念球菌属不再是盲肠优势菌属,且小戴维霉属和毛芽孢子菌属的相对丰度增加。70日龄时盲肠微生物以红酵母菌属、毛芽孢子菌属和赤霉菌属为优势菌属,其中红酵母菌属的相对丰度明显增加。蛋鸡饲养研究证实[30],红酵母固态发酵产物是一种非常有效的微生物蛋黄增色剂,这说明红酵母属对禽蛋质量和产业发展起着重要的作用。有研究表明,毛孢子菌与临床疾病有关,如猫的皮炎、鼻炎和膀胱炎等[31]。在本研究中,德巴利酵母属在1和14日龄相对其他日龄占比较大,14日龄后相对丰度显著降低。有研究表明,汉氏德巴利氏酵母(Debaryomyces hansenii)可以通过细胞分化和增殖提高存活率、生长性能,刺激消化功能和增强免疫系统的能力[32]。
通过热图可知,随着日龄的增长,曲霉菌属(Aspergillus)的相对丰度降低,红酵母菌属的相对丰度升高。有研究证实,曲霉菌属会引发肠道真菌性炎症和曲霉菌性肺炎,其相对丰度会随着机体体重的增加而降低[33-35], 与本研究结果一致。通过相关关系图可知,红酵母菌属的相对丰度与体重可能存在相关性,但仍需试验进一步验证。孔庆辉等[36]研究发现,随着藏仔猪的生长发育,酵母菌科的相对丰度升高,与本试验研究结果相近。发育过程中,大多数优势真菌的相对丰度结构会表现出“波动”的动态模式[37]。在属水平上,42~70周龄的番鸭盲肠中真菌的相对丰度大于其他日龄,这说明随着番鸭发育时间的增加,其盲肠真菌的相对丰度也会不断增长。相关性研究也进一步说明了不同真菌成分可能影响番鸭的体重,揭示了其在番鸭生长过程中扮演的重要角色。综上所述可知,番鸭盲肠中的真菌种类丰富多样。本试验初步探讨了番鸭盲肠真菌的结构组成,其优势菌属和核心菌群及其功能的验证还需要进一步的探究。
4 结论① 番鸭盲肠真菌菌群多样性随日龄增长逐渐升高。
② 在门水平上,不同日龄的盲肠优势菌门均为子囊菌门与担子菌门;在属水平上,盲肠菌群结构呈发育性变化。3~7日龄时,盲肠优势菌属为赤霉菌属、念球菌属和小戴维霉属;14~28日龄时,优势菌属为赤霉菌属和念球菌属;70日龄时,以红酵母菌属、毛芽孢子菌属和赤霉菌属为优势菌属。
③ 红酵母菌属的相对丰度与体重可能存在相关性,未来仍需通过验证试验进一步确认。
| [1] |
侯水生, 周正奎. 肉鸭种业的昨天及今天和明天[J]. 中国畜牧业, 2021(18): 23-26. HOU S S, ZHOU Z K. Past, now and future of meat duck breeding industry[J]. China Animal Industry, 2021(18): 23-26 (in Chinese). DOI:10.3969/j.issn.2095-2473.2021.18.013 |
| [2] |
王长康, 李昂, 郑嫩珠. 番鸭血液生化指标与产蛋性能的关系[J]. 福建农业大学学报, 2001, 30(4): 510-513. WANG C K, LI A, ZHENG N Z. Relationships between blood biochemical indices and egg-laying performances in Muscovy ducks[J]. Journal of Fujian Agricultural University, 2001, 30(4): 510-513 (in Chinese). |
| [3] |
李富军. 番鸭的生理特点与饲养管理要点[J]. 养殖技术顾问, 2012(8): 19. LI F J. Physiological characteristics and main points of feeding and management of Muscovy ducks[J]. Technical Advisor for Animal Husbandry, 2012(8): 19 (in Chinese). DOI:10.3969/j.issn.1673-1921.2012.08.015 |
| [4] |
赵庆福, 刘淑玲, 冯东环. 番鸭的饲养技术[J]. 饲料研究, 1999(2): 40. ZHAO Q F, LIU S L, FENG D H. Breeding technology of Muscovy duck[J]. Feed Research, 1999(2): 40 (in Chinese). |
| [5] |
YE P F, GE K, LI M, et al. Egg-laying and brooding stage-specific hormonal response and transcriptional regulation in pituitary of Muscovy duck (Cairina moschata)[J]. Poultry Science, 2019, 98(11): 5287-5296. DOI:10.3382/ps/pez433 |
| [6] |
YANG H, LYU W T, LU L Z, et al. Biogeography of microbiome and short-chain fatty acids in the gastrointestinal tract of duck[J]. Poultry Science, 2020, 99(8): 4016-4027. DOI:10.1016/j.psj.2020.03.040 |
| [7] |
LYU W T, LIU X T, LU L Z, et al. Cecal microbiota modulates fat deposition in Muscovy ducks[J]. Frontiers in Veterinary Science, 2021, 8: 609348. DOI:10.3389/fvets.2021.609348 |
| [8] |
金城. 真菌——一个尚待认知的微生物世界[J]. 菌物研究, 2019, 17(4): 184. JIN C. Fungi-a yet-to-be-understood microbial world[J]. Journal of Fungal Research, 2019, 17(4): 184 (in Chinese). |
| [9] |
KÖHLER J R, HUBE B, PUCCIA R, et al. Fungi that infect humans[J]. Microbiology Spectrum, 2017, 5(3): FUNK-0014-2016. |
| [10] |
HALLEN-ADAMS H E, KACHMAN S D, KIM J, et al. Fungi inhabiting the healthy human gastrointestinal tract: a diverse and dynamic community[J]. Fungal Ecology, 2015, 15: 9-17. DOI:10.1016/j.funeco.2015.01.006 |
| [11] |
ROBINSON K, XIAO Y P, JOHNSON T J, et al. Chicken intestinal mycobiome: initial characterization and its response to bacitracin methylene disalicylate[J]. Applied and Environmental Microbiology, 2020, 86(13): e00304-e00320. |
| [12] |
朱文华, 吴本俨. 肠道真菌与消化系统疾病关系研究进展[J]. 中华老年多器官疾病杂志, 2017, 16(2): 152-156. ZHU W H, WU B Y. Research progress of relationship between intestinal fungi and gastrointestinal diseases[J]. Chinese Journal of Multiple Organ Diseases in the Elderly, 2017, 16(2): 152-156 (in Chinese). |
| [13] |
刘丽丽. 肉鸡白色念珠菌病的诊疗措施[J]. 当代畜禽养殖业, 2019(11): 28-29. LIU L L. Diagnosis and treatment of candidiasis in broilers[J]. Modern Livestock and Poultry Breeding Industry, 2019(11): 28-29 (in Chinese). DOI:10.3969/j.issn.1005-5959.2019.11.016 |
| [14] |
URUBSCHUROV V, JANCZYK P, PIEPER R, et al. Biological diversity of yeasts in the gastrointestinal tract of weaned piglets kept under different farm conditions[J]. FEMS Yeast Research, 2010, 8(8): 1349-1356. |
| [15] |
刘慧娟, 杨秋. 种番鸭饲养管理要点[J]. 河南农业, 2011(2): 50. LIU H J, YANG Q. Main points of breeding and management of Muscovy duck[J]. Henan Agriculture, 2011(2): 50 (in Chinese). |
| [16] |
温雪婷. 番鸭与北京鸭肌肉风味物质及盲肠菌群发育性变化研究[D]. 硕士学位论文. 杭州: 浙江农林大学, 2020. WEN X T. Study on the differences in flavor components and cecal microbiota between Muscovy and Peking duck during development[D]. Master's Thesis. Hangzhou: Zhejiang A & F University, 2020. (in Chinese) |
| [17] |
CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [18] |
EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998. DOI:10.1038/nmeth.2604 |
| [19] |
LIMON J J, SKALSKI J H, UNDERHILL D M. Commensal fungi in health and disease[J]. Cell Host & Microbe, 2017, 22(2): 156-165. |
| [20] |
NASH A K, AUCHTUNG T A, WONG M C, et al. The gut mycobiome of the human microbiome project healthy cohort[J]. Microbiome, 2017, 5(1): 153. DOI:10.1186/s40168-017-0373-4 |
| [21] |
HOFFMANN C, DOLLIVE S, GRUNBERG S, et al. Archaea and fungi of the human gut microbiome: correlations with diet and bacterial residents[J]. PLoS One, 2013, 8(6): e66019. DOI:10.1371/journal.pone.0066019 |
| [22] |
HATOUM R, LABRIE S, FLISS I. Antimicrobial and probiotic properties of yeasts: from fundamental to novel applications[J]. Frontiers in Microbiology, 2012, 3: 421. |
| [23] |
VAN TILBURG BERNARDES E, PETTERSEN V K, GUTIERREZ M W, et al. Intestinal fungi are causally implicated in microbiome assembly and immune development in mice[J]. Nature Communications, 2020, 11(1): 2577. DOI:10.1038/s41467-020-16431-1 |
| [24] |
JIANG Z Y, WEI S Y, WANG Z L, et al. Effects of different forms of yeast Saccharomyces cerevisiae on growth performance, ntestinal development, and systemic immunity in early-weaned piglets[J]. Journal of Animal Science and Biotechnology, 2015, 6: 47. DOI:10.1186/s40104-015-0046-8 |
| [25] |
牛海静, 苏秉忠. 消化道真菌及其相关疾病研究进展[J]. 中国真菌学杂志, 2015, 10(6): 377-379, 384. NIU H J, SU B Z. Progress of fungi in gut and the related diseases[J]. Chinese Journal of Mycology, 2015, 10(6): 377-379, 384 (in Chinese). DOI:10.3969/j.issn.1673-3827.2015.06.021 |
| [26] |
SHUAI M L, FU Y Q, ZHONG H L, et al. Mapping the human gut mycobiome in middle-aged and elderly adults: multiomics insights and implications for host metabolic health[J/OL]. Gut: gutjnl-gu2021. (2022-01-11)[2022-02-15]. https://pubmed.ncbi.nlm.nih.gov/35017200/. DOI: 10.1136/gutjnl-2021-326298.
|
| [27] |
WANG Y P, FU Y H, HE Y Y, et al. Longitudinal characterization of the gut bacterial and fungal communities in yaks[J]. Journal of Fungi, 2021, 7(7): 559. DOI:10.3390/jof7070559 |
| [28] |
温雪婷, 朱江群, 朱建芬, 等. 不同生长速率肉鸡肠道真菌结构分析[J]. 浙江农业科学, 2019, 60(1): 137-140. WEN X T, ZHU J Q, ZHU J F, et al. Structure of intestinal fungal flora in broilers with different growth rates[J]. Journal of Zhejiang Agricultural Sciences, 2019, 60(1): 137-140 (in Chinese). |
| [29] |
JAMES T Y, KAUFF F, SCHOCH C L, et al. Reconstructing the early evolution of fungi using a six-gene phylogeny[J]. Nature, 2006, 443(7113): 818-822. DOI:10.1038/nature05110 |
| [30] |
BEIMFORDE C, FELDBERG K, NYLINDER S, et al. Estimating the phanerozoic history of the Ascomycota lineages: combining fossil and molecular data[J]. Molecular Phylogenetics and Evolution, 2014, 78: 386-398. |
| [31] |
ROEMER T, KRYSAN D J. Antifungal drug development: challenges, unmet clinical needs, and new approaches[J]. Cold Spring Harbor Perspectives in Medicine, 2014, 4(5): a019703. DOI:10.1101/cshperspect.a019703 |
| [32] |
谢爱娣. 利用农副产品红酵母固态发酵生产增色饲料的研究与应用[D]. 硕士学位论文. 武汉: 湖北工业大学, 2007. XIE A D. Study on production and application of feed colorant by Rhodotorula sp. from farm and sideline products through solid-state fermentation[D]. Master's Thesis. Wuhan: Hubei University of Technology, 2007. (in Chinese) |
| [33] |
COLOMBO A L, PADOVAN A C B, CHAVES G M. Current knowledge of Trichosporon spp. and trichosporonosis[J]. Clinical Microbiology Reviews, 2011, 24(4): 682-700. |
| [34] |
ANGULO M, REYES-BECERRIL M, MEDINA-CÓRDOVA N, et al. Probiotic and nutritional effects of Debaryomyces hansenii on animals[J]. Applied Microbiology and Biotechnology, 2020, 104(18): 7689-7699. |
| [35] |
MAR RODRÍGUEZ M, PÉREZ D, JAVIER CHAVES F, et al. Erratum: obesity changes the human gut mycobiome[J]. Scientific Reports, 2016, 6: 21679. |
| [36] |
孔庆辉, 刘瑶, 索朗斯珠, 等. 藏仔猪粪便真菌菌群多样性分析[J]. 菌物学报, 2020, 39(7): 1241-1249. KONG Q H, LIU Y, SUO L S Z, et al. Fungal diversity in Tibetan piglet fecal samples[J]. Mycosystema, 2020, 39(7): 1241-1249 (in Chinese). |
| [37] |
ZHANG Z Q, JIAO S, LI X H, et al. Bacterial and fungal gut communities of Agrilus mali at different developmental stages and fed different diets[J]. Scientific Reports, 2018, 8(1): 15634. |




