2. 内蒙古农业大学草原与资源环境学院, 呼和浩特 010010;
3. 鄂尔多斯市农牧业科学研究院, 鄂尔多斯 017000
2. College of Grassland, Resources and Environment, Inner Mongolia Agricultural University, Hohhot 010010, China;
3. Ordos Academy of Agriculture and Animal Husbandry, Ordos 017000, China
短期高精料饲养是提高反刍动物育肥期生长速率的一种常用手段。为此,寻找提高饲料效率的方法是实现促进生长的有效途径。目前,在饲粮中添加具有促进生长的生物活性物质,如植物提取物、中草药、酶制剂、益生菌等是继全面禁止饲用抗生素后最有效的方法之一。
丁酸梭菌(Clostridium butyricum)是一种在胃肠道环境中具有较高耐受性的益生菌,其独立的消化酶系统可分泌多种代谢产物,其中丁酸是其最主要的代谢产物之一,可作为宿主胃肠道的能量来源[1],促进胃肠上皮组织发育并可巩固其屏障功能[2],达到促生长的目的[3]。此外,丁酸梭菌的其他代谢产物如磷壁酸因其高度黏附的特性,促进其在机体内定植;分泌酶类等提高饲粮在胃肠道的转化率;小肽类物质(细菌素)有助于促进肠道益生菌的竞争性黏附,占据黏附位点而抑制病原菌入侵[4]。丁酸梭菌可通过上述分泌物,调节体内菌群结构和组成,改善机体内环境稳态,促进家畜的生长发育[2-3, 5]。目前,有关人体和小鼠试验的研究报道,丁酸梭菌及其代谢产物具有提高抗氧化能力、缓解炎症、调节肠道免疫功能和肠道屏障功能等作用[6-7]。在动物生产中,在仔猪和家禽饲粮中添加丁酸梭菌,可改善肠道健康,进而有效提高生长性能[1-2, 8]。此外,在犊牛和羔羊饲养试验中,添加丁酸梭菌可有效提高机体的抗氧化能力和免疫功能,与单胃动物饲养试验的结果[9-10]相一致。目前,多数研究表明丁酸梭菌可在机体肠道中定植,具有改变肠道微生物区系结构、巩固肠道屏障功能以及加速新陈代谢等作用,从而改善家畜对饲粮的消化吸收且提高机体免疫力[2, 6-8]。然而, 有关丁酸梭菌在反刍动物中的具体作用效果尚不明确,特别是丁酸梭菌在其特殊的消化系统中对胃肠道中菌群的影响尚不清楚。因此,本研究旨在向育肥山羊饲粮中添加丁酸梭菌,探究其对山羊生长性能和直肠微生物区系的影响,为其在反刍动物生产中的应用提供理论依据。
1 材料与方法所有试验操作均依据东北农业大学动物保护委员会的建议和操作指南进行(NEAU-[2011]-9)。本试验于内蒙古自治区鄂尔多斯市鄂托克旗家庭牧场进行。
1.1 试验设计与饲养管理按照体重[(22.00±2.09) kg]相近原则,选取16头健康状况良好的6月龄阿尔巴斯公山羊,随机分为2组,每组8个重复。对照组饲喂基础饲粮,丁酸梭菌组饲喂在基础饲粮中添加2.0×108 CFU/kg丁酸梭菌(经由饱和脂肪包被,活菌数≥1.0×109 CFU/g)的试验饲粮。每日晨饲时将丁酸梭菌灌服至山羊口中,以确保全部摄入。试验进行精粗分饲(精粗比=65 ∶ 35),在山羊将粗饲料全部摄入后再投放精料,以确保每日饲粮的精粗比保持一致。根据山羊前1天的采食量来调节投料量,以满足每天各料槽的剩料量介于5%~10%。粗料是由燕麦和苜蓿草(5 ∶ 5)组成的混合牧草,精料为无益生菌添加的商用颗粒料(由某饲料有限公司提供)。精料组成及营养水平、混合牧草营养水平如表 1所示。预试期14 d,正试期56 d。试验山羊于1.5 m×2.0 m的围栏中单栏饲养,饲喂时间为每天06:00和18:00,试验期间所有山羊均可以自由采食和饮水。
|
|
表 1 精料组成及营养水平、混合牧草营养水平(干物质基础) Table 1 Composition and nutrient levels of the concentrate and nutrient levels of mixed forages (DM basis) |
每天准确记录山羊饲粮投入量和剩料量,计算每只山羊每天的采食量。于预试期第14天和试验第56天晨饲前称量每只山羊的体重,并记录数据,计算平均日增重(ADG)和饲料效率(FCR)。
1.2.2 饲粮营养成分、养分表观消化率及氮代谢指标每周进行饲粮样品取样,最后将样品混合后进行营养成分分析,所有样品于55 ℃烘干48 h,待回潮24 h,粉碎后过40目筛。依据AOAC(2000)方法测定干物质(DM)、粗蛋白质(CP)、粗脂肪(EE)以及粗灰分(Ash)的含量[11]。参照Van Soest等[12]方法测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)的含量,酸性不溶灰分(AIA)的含量依据《饲料中盐酸不溶灰分的测定》(GB/T 23742—2009)测定。
于试验第17~19天、第45~47天、第63~65天每日07:00和19:00待山羊排便后收集粪便。将3次收集的粪便混合后平均分2份,一份添加10%硫酸固氮用于CP含量的测定,另一份用于其他常规养分含量的测定,均置于-20 ℃保存。相关养分含量的测定方法与饲粮相同。采用AIA法计算养分表观消化率,计算公式如下:
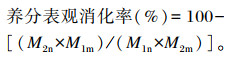
|
式中:M1m为饲粮中AIA含量(%);M2m为粪便中AIA含量(%);M1n为饲粮中某养分含量(%);M2n为粪便中养分含量(%)。
于试验第17~19天、第45~47天、第63~65天每日07:00和19:00通过刺激法采集山羊尿液。将3次收集的尿液混合均匀后平均分为2份,其中一份添加0.1%的硫酸固氮用于CP含量的测定,均置于-20 ℃保存。尿液中肌酐(CREA)含量使用商业试剂盒(南京建成生物工程研究所),按照试剂盒说明书进行操作。依据文献[13-14]方法测定肌酐含量,然后估算尿量,且设定肌酐输出量为29 mg/kg, 以此计算粪氮和尿氮,计算公式如下:

|
于试验第70天晨饲前使用负压肝素钠管在山羊颈静脉处采血,每只山羊采集15 mL。3 500×g离心15 min后将血浆分装至1.5 mL离心管中,并置于-20 ℃保存。
血浆生化指标尿素氮(UN)、CREA、葡萄糖(GLU)、总蛋白(TP)、白蛋白(ALB)、GLB、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)含量以及丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)活性由北京华英生物技术研究所协助检测,试剂盒购自北京中生北控生物科技股份有限公司,测定仪器型号为迈瑞BS-420全自动生化仪(深圳迈瑞生物医疗电子股份有限公司)。
1.2.4 直肠微生物丰度和多样性于试验期第69天,通过刺激法每组随机抽取5头山羊收集粪便,分装到冻存管后立即置于液氮中冻存,转移至实验室后置于-80 ℃冰箱保存,用于进行16S rDNA测序分析直肠微生物。使用E.Z.N.A.®粪便DNA试剂盒(D4015, Omega, Inc., 美国)提取不同样本的DNA。用无核水作空白,总DNA用50 μL的洗脱缓冲液洗脱,保存在-80 ℃,送至由杭州联川生物技术股份有限公司进行测序。根据16S rDNA的扩增片段V3~V4区设计通用引物序列:341F(5′-CCTACGGGNGGCWGCAG-3′,805R(5′-GACTACHVGGGTATCTAATCC-3′),在引物的5′端对每个样本进行条形码标记,并对通用引物进行测序。PCR扩增在总体积25 μL的反应混合液中进行,其中包含25 ng模板DNA, 12.5 μL PCR预混物,每个引物2.5 μL, PCR级水调节体积。PCR扩增原核16S片段的条件:初始变性98 ℃保温30 s; 98 ℃变性10 s,54 ℃退火30 s,72 ℃延伸45 s,循环32次; 最后在72 ℃下拉伸10 min。扩增后PCR产物经2%琼脂糖凝胶电泳验证。在整个DNA提取过程中,使用的是超纯水,而不是样品溶液,以排除假阳性PCR结果作为阴性对照的可能性,PCR产物由AMPure XT beads(Beckman Coulter Genomics, Danvers, 美国)纯化,Qubit(Invitrogen, 美国)定量。扩增子池用于测序,扩增子文库的大小和数量分别在Agilent 2100生物分析仪(Agilent, 美国)和Illumina(Kapa Biosciences, Woburn, 美国)的文库定量试剂盒上进行评估。在NovaSeq PE250平台上对库进行排序。
16S rDNA测序样品在Illumina NovaSeq平台上按照制造商的建议进行测序,由LC-Bio提供。根据样品独特的条形码,将配对端序列分配给样品,并将建库引入的barcode和引物序列去除。使用FLASH合并匹配端读取。根据fqtrim(v0.94),在特定的过滤条件下对原始读数据进行质量过滤,以获得高质量的clean标签。使用Vsearch软件对嵌合序列进行过滤(v2.3.4)。利用DADA2进行解调,得到特征表和特征序列。多样性和多样性通过归一化到相同的随机序列来计算。然后根据SILVA(release132)分类器,利用每个样本的相对丰度对特征丰度进行归一化。Alpha多样性用于分析样本物种多样性的复杂性,Chao1、Observedspecies、Goodscoverage、Shannon、Simpson指数是用QIIME2计算出来的。Beta多样性由QIIME2计算,R包绘制。采用Blast进行序列比对,每个代表性序列用SILVA数据库对特征序列进行注释。其他的图是也使用R包实现(v3.5.2)。
1.3 数据处理本试验中生长性能、养分表观消化率、血浆生化指标数据均先用Excel 2019进行整理,再通过SPSS 25统计软件中的ANOVA程序进行单因素方差分析,试验结果以平均值和标准误(SE)表示。P<0.01为差异极显著,P<0.05为差异显著,0.05<P<0.10为差异具有显著趋势。
2 结果 2.1 丁酸梭菌对育肥山羊生长性能、养分表观消化率和氮代谢的影响由表 2、表 3可知,与对照组相比,添加丁酸梭菌对育肥山羊的平均日增重、总采食量以及饲料效率均无显著影响(P>0.05),对养分表观消化率和氮代谢指标也没有显著影响(P>0.05)。
|
|
表 2 丁酸梭菌对育肥山羊生长性能的影响 Table 2 Effects of C.butyricum on growth performance of fattening goats |
|
|
表 3 丁酸梭菌对育肥山羊养分表观消化率和氮代谢的影响 Table 3 Effects of C. butyricum on nutrient apparent digestibility and nitrogen metabolism of fattening goats |
由表 4可知,与对照组相比,添加丁酸梭菌可显著提高育肥期山羊血浆中GLU、TC、HDL和LDL的含量(P<0.05),对于血浆中AST活性以及TP和GLB含量有提高的趋势(0.05<P<0.10),然而,血浆UN、CREA、ALB和TG的含量以及ALT的活性在统计学上无显著差异(P>0.05)。
|
|
表 4 丁酸梭菌对育肥山羊血浆生化指标的影响 Table 4 Effects of C. butyricum on plasma biochemical indexes of fattening goats |
由表 5可知,在育肥期山羊直肠微生物门水平中,与对照组相比,添加丁酸梭菌有提高Epsilonbacteraeota相对丰度的趋势(0.05<P<0.10),而对于其他门水平微生物的相对丰度无统计学差异的影响(P>0.05)。
|
|
表 5 丁酸梭菌对育肥山羊直肠门水平微生物相对丰度的影响 Table 5 Effects of C. butyricum on relative abundance of microorganism at phylum level in rectum of fattening goats (>1.0%) |
由表 6可知,在直肠微生物属水平中,与对照组相比,添加丁酸梭菌可显著提高克里斯滕森菌科_R-7群的相对丰度(P<0.05),显著降低瘤胃菌科_UCG-014的相对丰度(P<0.05),有降低梭菌属相对丰度的趋势(0.05<P<0.10),有提高弯曲杆菌属相对丰度的趋势(0.05<P<0.10)。
|
|
表 6 丁酸梭菌对育肥山羊直肠微生物属水平相对丰度的影响 Table 6 Effects of C. butyricum on relative abundance of microorganism at genus level in rectum of fattening goats (>1.0%) |
目前,有关丁酸梭菌的研究报道,饲粮中添加丁酸梭菌可提高畜禽的生长性能。Han等[2]研究报道,仔猪饲粮中添加丁酸梭菌可增加空肠绒毛高度和隐窝深度,提高空肠对于营养物质的消化吸收,显著提高仔猪的平均日增重。同时,肉鸡[8]与蛋鸡[15]的研究结果表明,补充丁酸梭菌有助于促进肠道上皮细胞的生长发育,并显著提高家禽的饲料效率和平均日增重。此外,本实验室先前的研究表明,饲粮中添加丁酸梭菌可显著提高犊牛的平均日增重,并降低犊牛的腹泻率[9]。以上结果均得益于丁酸梭菌在进入机体胃肠道后,可分泌大量的短链脂肪酸和维生素类营养物质,且有助于提高消化酶的活性[2, 4, 16], 促进机体对营养物质的消化吸收,进而提高动物的生长性能。本试验在高精料饲粮的饲养模式下,各组山羊的生长性能无显著差异,这与Zhang等[1]和何家俊等[17]的研究结果相似,饲粮中添加丁酸梭菌对断奶仔猪和犊牛的生长性能均无显著影响。Mu等[18]研究报道,高精料饮食易影响瘤胃稳态,使部分酶活性下降以及菌群失衡,同时丁酸梭菌的活性易受到复杂环境的影响[19]。因此,这可能与瘤胃环境、饲养模式、物种以及丁酸梭菌的生物学特性有关,未来需我们结合瘤胃发酵情况进一步探究丁酸梭菌对山羊生长性能的影响。
血浆生化指标是反映机体健康状况和代谢水平的重要指标。反刍动物饲粮中碳水化合物在瘤胃中发酵,可产生大量的挥发性脂肪酸,经肝脏糖异生后转化为GLU[20]。其中反刍动物机体内各组织器官对GLU的需求主要依赖于肝脏糖异生[21]。于泌乳奶牛与奶山羊而言,在体内GLU不足的情况下,易发生能量负平衡,进而引发机体代谢紊乱和部分疾病的产生[22-23]。本试验中,饲粮添加丁酸梭菌可提高血浆中GLU的含量,这表明在高精料饲粮中添加丁酸梭菌有助于提高瘤胃内挥发性脂肪酸的转运,从而加速肝脏糖异生的过程。这与何家俊等[17]的研究结果相一致。血浆中ALT、AST活性和TP含量可反映机体对蛋白质的消化吸收以及诊断疾病,其中ALT和AST的活性是评价肝细胞坏死的重要指标。研究表明,病毒性肝炎、药物以及毒素等会引发慢性肝病,并增加血液中ALT和AST的活性[24]; TP含量高于65 g/L时,极有可能出现慢性炎症[25]。本试验结果显示,与对照组相比,饲粮添加丁酸梭菌后血浆ALT、AST活性和TP含量呈上升趋势,这表明丁酸梭菌有助于提高山羊体内蛋白质的代谢水平。然而,高精料饮食含大量可发酵的碳水化合物,在短期内易使瘤胃pH下降以及菌群失衡,加剧瘤胃内毒素的累积[26-27],并将其通过瘤胃上皮转运至血液中,影响机体正常的生理功能。这意味着生产中使用高精料快速育肥时伴有增加肝脏损害的风险。
血浆中TC、HDL和LDL是反映脂代谢的有效指标。益生菌具有降低血浆中TC含量的作用。Mohan等[28]的研究显示,在蛋鸡饲粮中添加益生菌可有效降低血浆中TC的含量。Jiang等[29]研究发现,饲喂植物乳杆菌299v的犊牛血浆中TC含量显著低于对照组,是因为乳酸菌自身可分解TC。相反,本试验中丁酸梭菌显著提高了血浆中TC、HDL和LDL的含量。此外,Sanders[30]研究表示,参与乙酰CoA合成TC过程中,甲戊酸的中间体是肝脏合成的β-羟基-β-甲基戊二酰CoA,益生菌对其具有抑制作用,这与脂肪动员酶的活性有关。因此,饲粮中添加丁酸梭菌在正常范围内可促进脂质代谢,但由于HDL与LDL之间的拮抗作用,从而未能影响育肥期山羊的生长性能。
反刍动物消化道内菌群的生命活动与其生长性能密切相关。本试验中,瘤胃球菌科_UCG-014、理研菌科_RC9肠道群以及未分类毛螺菌科等有益菌是山羊直肠中的优势菌群,这与犊牛试验的研究结果[31]相似。一些研究报道,瘤胃球菌科成员均可充分降解机体消化道内的碳水化合物,并将其转化为短链脂肪酸[32]。尽管本试验的结果显示, 添加丁酸梭菌使得瘤胃球菌科_UCG-014的相对丰富显著下降,但其在山羊直肠微生物区系中占比小,对其他瘤胃球菌科的影响略轻。Zhou等[33]研究显示,瘤胃球菌科_UCG-014相对丰度与机体内白细胞介素(IL)-1β的释放呈正相关,有增加损害机体器官及组织的风险。此外,本试验肠道中克里斯滕森菌科_R-7群的相对丰度显著增加。Li等[34]研究表明,克里斯滕森菌科_R-7群相对丰度的增加能促进肠道上皮屏障的完整性,抑制有害菌入侵。肠道组织是体内最大的免疫器官,且微生物群在促进肠道发育和功能完善方面至关重要,上述结果表明,添加丁酸梭菌与增强山羊肠道免疫功能有关,但还需进一步验证。然而,育肥期山羊直肠中梭菌属的相对丰度有下降的趋势,与单胃动物的研究结果不一致,Zhang等[1]在仔猪饲粮中添加丁酸梭菌不会改变粪便梭菌或丁酸梭菌的含量,这可能与丁酸梭菌在瘤胃内作用有关。本试验结果表示,直肠中弯曲杆菌属的相对丰度有增加的趋势。据相关研究报道,弯曲杆菌属是引起肠道细菌性肠炎的常见菌之一[35-36]。直肠中有害菌增殖,竞争肠道养分,影响益生菌在肠道中的相对丰度。因此,我们还需结合丁酸梭菌在山羊瘤胃中的代谢状况以及对于瘤胃菌群的影响,进一步阐明丁酸梭菌对山羊生长性能的影响。
4 结论综上所述,高精料饲粮中添加丁酸梭菌可有效提高山羊血浆中GLU和HDL的含量,并可通过上调有益菌的相对丰度改善直肠微生物区系结构,但丁酸梭菌对育肥期山羊的生长性能无显著影响。
| [1] |
ZHANG J, CHEN X Y, LIU P, et al. Dietary Clostridium butyricum induces a phased shift in fecal microbiota structure and increases the acetic acid-producing bacteria in a weaned piglet model[J]. Journal of Agricultural and Food Chemistry, 2018, 66(20): 5157-5166. DOI:10.1021/acs.jafc.8b01253 |
| [2] |
HAN Y S, TANG C H, LI Y, et al. Effects of dietary supplementation with Clostridium butyricum on growth performance, serum immunity, intestinal morphology, and microbiota as an antibiotic alternative in weaned piglets[J]. Animals, 2020, 10(12): 2287. DOI:10.3390/ani10122287 |
| [3] |
CAI L Y, YU J K, HARTANTO R, et al. Dietary supplementation with Saccharomyces cerevisiae, Clostridium butyricum and their combination ameliorate rumen fermentation and growth performance of heat-stressed goats[J]. Animals, 2021, 11(7): 2116. DOI:10.3390/ani11072116 |
| [4] |
王腾浩. 新型丁酸梭菌筛选及其对断奶仔猪生长性能和肠道功能影响的研究[D]. 博士学位论文. 杭州: 浙江大学, 2015. WANG T H. Screening of a novel Clostridium butyricum and its administration on growth performance and gut function in weaning piglets[D]. Ph. D. Thesis. Hangzhou: Zhejiang University, 2015. (in Chinese) |
| [5] |
ZHANG C R, YU Q Y, WANG J H, et al. Effects of dietary supplementation with Clostridium butyricum on growth performance, apparent digestibility, blood metabolites, ruminal fermentation and bacterial communities of fattening goats[J]. Frontiers in Nutrition, 2022, 9: 888191. DOI:10.3389/fnut.2022.888191 |
| [6] |
SEKI H, SHIOHARA M, MATSUMURA T, et al. Prevention of antibiotic-associated diarrhea in children by Clostridium butyricum MIYAIRI[J]. Pediatrics International, 2003, 45(1): 86-90. DOI:10.1046/j.1442-200X.2003.01671.x |
| [7] |
HAGIHARA M, KUROKI Y, ARIYOSHI T, et al. Clostridium butyricum modulates the microbiome to protect intestinal barrier function in mice with antibiotic-induced dysbiosis[J]. iScience, 2020, 23(1): 100772. DOI:10.1016/j.isci.2019.100772 |
| [8] |
XU L P, SUN X L, WAN X H, et al. Dietary supplementation with Clostridium butyricum improves growth performance of broilers by regulating intestinal microbiota and mucosal epithelial cells[J]. Animal Nutrition, 2021, 7(4): 1105-1114. DOI:10.1016/j.aninu.2021.01.009 |
| [9] |
李文茜. 丁酸梭菌对犊牛及育成牛生长性能、血液指标和瘤胃发酵的影响[D]. 硕士学位论文. 哈尔滨: 东北农业大学, 2019. LI W X. Effects of Clostridium butyricum on growth performance, blood index and rumen fermentation in calves and bred cattle[D]. Master's Thesis. Harbin: Northeast Agricultural University, 2019. (in Chinese) |
| [10] |
陈浅, 董瑷榕, 陈菊红, 等. 不同精粗比日粮中添加丁酸梭菌对断奶羔羊生长性能、血清指标及经济效益的影响[J]. 饲料工业, 2020, 41(23): 6-14. CHEN J, DONG A R, CHEN J H, et al. Effects of adding Clostridium butyricum to diets with different concentrate to forage ratios on growth performance, serum indexes and economic benefits of weaned lambs[J]. Feed Industry, 2020, 41(23): 6-14 (in Chinese). |
| [11] |
AO AC. Official methods of analysis[M]. 14th ed.Arlington, VA: Association of Official Analytical Chemists, 1984: 152-169.
|
| [12] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [13] |
VALADARES R F, BRODERICK G A, VALADARES FILHO S C, et al. Effect of replacing alfalfa silage with high moisture corn on ruminal protein synthesis estimated from excretion of total purine derivatives[J]. Journal of Dairy Science, 1999, 82(12): 2686-2696. DOI:10.3168/jds.S0022-0302(99)75525-6 |
| [14] |
LEONARDI C, STEVENSON M, ARMENTANO L E. Effect of two levels of crude protein and methionine supplementation on performance of dairy cows[J]. Journal of Dairy Science, 2003, 86(12): 4033-4042. DOI:10.3168/jds.S0022-0302(03)74014-4 |
| [15] |
WANG W W, WANG J, ZHANG H J, et al. Effects of Clostridium butyricum on production performance and intestinal absorption function of laying hens in the late phase of production[J]. Animal Feed Science and Technology, 2020, 264: 114476. DOI:10.1016/j.anifeedsci.2020.114476 |
| [16] |
LIANG J, RAZA S H A, KOU S S, et al. Effect of Clostridium butyricum on plasma immune function, antioxidant activity and metabolomics of weaned piglets[J]. Livestock Science, 2020, 241: 104267. DOI:10.1016/j.livsci.2020.104267 |
| [17] |
何家俊, 吴汉葵, 杨昕涧, 等. 丁酸梭菌对犊牛生长性能和血清生化、抗氧化、免疫指标及粪便微生物数量的影响[J]. 动物营养学报, 2021, 33(9): 5076-5085. HE J J, WU H K, YANG X J, et al. Effects of Clostridium butyricum on growth performance, serum biochemical, antioxidant, immune indexes and fecal microorganism number of calves[J]. Chinese Journal of Animal Nutrition, 2021, 33(9): 5076-5085 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.09.028 |
| [18] |
MU C T, YANG W J, WANG P J, et al. Effects of high-concentrate diet supplemented with grape seed proanthocyanidins on growth performance, liver function, meat quality, and antioxidant activity in finishing lambs[J]. Animal Feed Science and Technology, 2020, 266: 114518. DOI:10.1016/j.anifeedsci.2020.114518 |
| [19] |
SCHÖNHERR-HELLEC S, KLEIN G, DELANNOY J, et al. Comparative phenotypic analysis of "Clostridium neonatale" and Clostridium butyricum isolates from neonates[J]. Anaerobe, 2017, 48: 76-82. DOI:10.1016/j.anaerobe.2017.07.002 |
| [20] |
SAULS-HIESTERMAN J A, BANUELOS S, ATANASOV B, et al. Physiologic responses to feeding rumen-protected glucose to lactating dairy cows[J]. Animal Reproduction Science, 2020, 216: 106346. DOI:10.1016/j.anireprosci.2020.106346 |
| [21] |
WANG Y P, CAI M, HUA D K, et al. Metabolomics reveals effects of rumen-protected glucose on metabolism of dairy cows in early lactation[J]. Animal Feed Science and Technology, 2020, 269: 114620. DOI:10.1016/j.anifeedsci.2020.114620 |
| [22] |
VAN DORLAND H A, RICHTER S, MOREL I, et al. Variation in hepatic regulation of metabolism during the dry period and in early lactation in dairy cows[J]. Journal of Dairy Science, 2009, 92(5): 1924-1940. DOI:10.3168/jds.2008-1454 |
| [23] |
ZAMUNER F, CAMERON A W N, CARPENTER E K, et al. Endocrine and metabolic responses to glucose, insulin, and adrenocorticotropin infusions in early-lactation dairy goats of high and low milk yield[J]. Journal of Dairy Science, 2020, 103(12): 12045-12058. DOI:10.3168/jds.2020-18625 |
| [24] |
MCLAUGHLIN C L, BYATT J C, HEDRICK H B, et al. Performance, clinical chemistry, and carcass responses of finishing lambs to recombinant bovine somatotropin and bovine placental lactogen[J]. Journal of Animal Science, 1993, 71(12): 3307-3318. DOI:10.2527/1993.71123307x |
| [25] |
DING H, LIU W J, ERDENE K, et al. Effects of dietary supplementation with Allium mongolicum Regel extracts on growth performance, serum metabolites, immune responses, antioxidant status, and meat quality of lambs[J]. Animal Nutrition, 2021, 7(2): 530-538. DOI:10.1016/j.aninu.2021.04.001 |
| [26] |
PLAIZIER J C, KHAFIPOUR E, LI S, et al. Subacute ruminal acidosis (SARA), endotoxins and health consequences[J]. Animal Feed Science and Technology, 2012, 172(1/2): 9-21. |
| [27] |
GUO Y Q, XU X F, ZOU Y, et al. Changes in feed intake, nutrient digestion, plasma metabolites, and oxidative stress parameters in dairy cows with subacute ruminal acidosis and its regulation with pelleted beet pulp[J]. Journal of Animal Science and Biotechnology, 2013, 4(1): 31. DOI:10.1186/2049-1891-4-31 |
| [28] |
MOHAN B, KADIRVEL R, BHASKARAN M, et al. Effect of probiotic supplementation on serum/yolk cholesterol and on egg shell thickness in layers[J]. British Poultry Science, 1995, 36(5): 799-803. DOI:10.1080/00071669508417824 |
| [29] |
JIANG X, XU H J, CUI Z Q, et al. Effects of supplementation with Lactobacillus plantarum 299v on the performance, blood metabolites, rumen fermentation and bacterial communities of preweaning calves[J]. Livestock Science, 2020, 239: 104120. DOI:10.1016/j.livsci.2020.104120 |
| [30] |
SANDERS M E. Considerations for use of probiotic bacteria to modulate human health[J]. The Journal of Nutrition, 2000, 130(2S Suppl.): 384S-390S. |
| [31] |
王丽华, 徐宏建, 张全宇, 等. 不同剂量25羟基维生素D3对断奶前犊牛生长性能、营养物质表观消化率、血浆代谢物及粪便菌群的影响[J]. 动物营养学报, 2022, 34(1): 404-412. WANG L H, XU H J, ZHANG Q Y, et al. Effects of different doses of 25-hydroxyvitamin D3 on growth performance, nutrient apparent digestibility, plasma metabolites and fecal flora of pre-weaning calves[J]. Chinese Journal of Animal Nutrition, 2022, 34(1): 404-412 (in Chinese). DOI:10.3969/j.issn.1006-267x.2022.01.038 |
| [32] |
CHENG C, WEI H, PENG J. PSVⅡ-40 maternal soluble fiber diet during pregnancy influences growth performance, intestinal microbiota and intestinal permeability in piglets[J]. Journal of Animal Science, 2018, 96(Suppl.3): 329-330. |
| [33] |
ZHOU Y, ZHANG M H, LIU Q X, et al. The alterations of tracheal microbiota and inflammation caused by different levels of ammonia exposure in broiler chickens[J]. Poultry Science, 2021, 100(2): 685-696. DOI:10.1016/j.psj.2020.11.026 |
| [34] |
LI J W, FANG B, PANG G F, et al. Age- and diet-specific effects of chronic exposure to chlorpyrifos on hormones, inflammation and gut microbiota in rats[J]. Pesticide Biochemistry and Physiology, 2019, 159: 68-79. DOI:10.1016/j.pestbp.2019.05.018 |
| [35] |
NAUTA M, BOLTON D, CROTTA M, et al. An updated assessment of the effect of control options to reduce Campylobacter concentrations in broiler caeca on human health risk in the European Union[J/OL]. Microbial Risk Analysis, 2021, 100197[2021-12-05]. https://doi.org/10.1016/j.mran.2021.100197.
|
| [36] |
WVRFEL S D F R, PRATES D D F, KLEINUBING N R, et al. Comprehensive characterization reveals antimicrobial-resistant and potentially virulent Campylobacter isolates from poultry meat products in Southern Brazil[J]. LWT, 2021, 149: 111831. DOI:10.1016/j.lwt.2021.111831 |




