反刍动物生产对大气环境产生很大的影响,其摄取饲粮的总能量中有2%~15%会转化为甲烷(CH4)并排放到大气中[1],这不仅降低了饲料的利用率,同时也污染了大气。反刍动物的CH4排放量占全球温室气体排放量的16%~25%,占全球人为CH4排放量的33%,而其释放到环境中的CH4主要来自胃肠道发酵(87%来自瘤胃,13%来自大肠)[1]。
同时,生产中往往需要提高饲料利用率来降低饲料的用量以达到降低成本的目的,其中降低CH4产量可以有效利用饲料中损耗的甲烷能,提高饲料利用率。近年来,植物提取物因来源广泛、绿色无毒、生物活性较好的特点而受到人们关注,其中植物精油(EOs)因具有抗菌、抗氧化等活性而被认为是具有潜力的广泛应用于畜牧生产中的天然产物[2]。以往的体外研究发现,植物精油可以调节瘤胃微生物区系和降低反刍动物CH4产量,如Jahani-Azizabadi等[3]的研究发现,桉叶油、檀香精油、薰衣草精油等8种植物精油可以降低体外瘤胃CH4产量;Garcia等[4-5]的研究结果表明,马鞭草和印加孔雀草精油可以显著降低体外瘤胃CH4产量;Zhou等[6]的研究表明,牛至油具有降低CH4产量的效果;Lei等[7]的结果表明,混合植物精油具有调节山羊瘤胃微生物区系和降低CH4排放的效果;Lee等[8]的研究显示,植物精油可以调节瘤胃微生物群落。然而,植物精油具体是通过影响哪些微生物区系来影响瘤胃CH4产量的仍未可知。同时,由于动物体内的瘤胃微生物具有一定的适应性,体外试验研究的结果还需要在体内加以验证。
桉叶油的主要成分为1, 8-桉树脑,茴香油的主要成分为茴香脑。我国的桉叶油和茴香油产量居世界首位,二者因具有广谱抗菌、抗炎、抗氧化的活性而被广泛应用于食品和医疗业[9-12]。研究发现,桉叶油和茴香油可以通过本身的疏水性来增加细胞的渗透性,从而导致细胞成分的泄漏;同时,桉叶油具有影响细胞生物膜形成的效果,说明其可以通过影响细胞膜的结构及生理功能来实现抑菌[9, 13]。目前,研究发现,利用植物精油的抗菌活性可以调节瘤胃微生物区系及CH4产量,如Sallam等[14]发现桉叶油具有降低体外瘤胃CH4产量的潜力,另有研究发现桉叶油可以显著降低体外瘤胃CH4产量以及古菌、原虫及主要纤维分解菌的丰度[15];茴香油在体外条件下降低绵羊瘤胃产气量、提高瘤胃中内毛虫及其他原生动物总数的潜力也有见报道[16]。在上述体外研究的基础上,本试验开展了肉羊体内试验,旨在探究饲粮中添加桉叶油和茴香油对肉羊CH4产量、瘤胃微生物数量及产甲烷菌区系的影响,以期为植物精油在肉羊生产中的应用提供参考。
1 材料与方法 1.1 供试精油选择2种天然植物精油开展本试验,分别是桉叶油(纯度为80%,产地为广西)和茴香油(纯度为89%,产地为广西)。
1.2 试验动物选用体重为(64.45±8.56) kg的6只健康杜寒F1代杂交成年瘘管羊。
1.3 试验设计将6只瘘管羊随机分为3组,分别为对照组(基础饲粮,不添加植物精油)、桉叶油组[基础饲粮+500 mg/(头·d)桉叶油]、茴香油组[基础饲粮+500 mg/(头·d)茴香油],每组2只。基础饲粮依据《肉羊饲养标准》(NY/T 816—2004)配制,制作成颗粒料。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平 Table 1 Composition and nutrient levels of the basal diet |
采用3×3拉丁方设计,开展3期试验,每期22 d,其中预试期14 d,正试期8 d。试验羊只单笼饲养,每天饲喂2次,分别于08:00和18:00饲喂试验饲粮,自由采食,试验期间所有羊只自由饮水。在每日晨饲时,将试验用植物精油按照剂量添加至颗粒料表面并保证肉羊在最短时间内采食完毕。在第19~21天进行CH4产量测定,其中第19天让试验羊适应呼吸测热室,第20~21天测定气体中CH4含量;第22天取瘘管羊瘤胃食糜,用于提取DNA。
1.4 CH4产量测定试验采用美国Sable气体代谢系统,连接6个气体代谢室,可以同时测定6只羊的气体交换量。试验期间将试验羊移入呼吸测热室中,每个呼吸测热室中都配有食槽和水槽,能够保证羊只自由采食和饮水。羊只进入呼吸测热室后适应24 h,随后每隔1 h测定1次气体成分,连续2 d(第20~21天)共48 h测定CH4含量。测定后计算过程由Sable气体代谢系统的测定程序以及对应宏文件于计算机统计分析生成。根据每日每只羊的CH4排放量(L/d)计算代谢体重基础的CH4产量(L/kg W0.75)。
1.5 瘤胃微生物数量及产甲烷菌区系的检测 1.5.1 样品采集在每期试验的最后1天(第22天),晨饲前2 h从每只羊的瘤胃瘘管采集食糜,混合均匀后立即分装于3个20 mL离心管,迅速放入液氮,运回实验室-80 ℃保存,用于样本DNA提取。
1.5.2 DNA的提取参考赵丽萍等[17]的方法对样本瘤胃微生物的DNA进行提取,使用NanoDrop ND-1000分光光度计(NanoDrop Technologies, 美国)检测基因组DNA浓度和纯度。
1.5.3 绝对荧光定量PCR采用荧光定量PCR法检测样本中总细菌、总真菌、总原虫和总产甲烷菌的基因绝对含量,选用定量PCR试剂盒[ABI Prower SybrGreen qPCR Master Mix(2×),ABI公司,美国]及定量PCR仪(ABI7500型荧光定量PCR仪,ABI公司,美国)进行测定,扩增所用引物见表 2。构建大小为2 692 bp的质粒载体,构建好的质粒经测序鉴定无误后用紫外分光光度计测定质粒在260 nm处的吸光度(OD260)值,通过公式换算成拷贝数。
|
|
表 2 荧光定量PCR引物 Table 2 Primers for real-time qPCR |
16S rDNA PCR扩增所用产甲烷菌的引物与绝对荧光定量PCR一致,对产甲烷菌16S rDNA的V2~V5可变区进行扩增,再对每个样本分别加上8 bp的标签序列。每个样品的扩增均做3次重复,将同一样品的3个PCR重复产物混合后用NanoDrop2000(Thermo Fisher Scientific公司,美国)进行DNA纯度和浓度检测,DNA完整性检测方法为2%琼脂糖凝胶电泳法。参照电泳初步定量结果,将PCR产物用荧光定量系统(QuantiFluorTM-ST,Promega公司)进行检测定量,之后按照每个样本测序量的要求进行相应比例的混合,然后根据Illumina MiSeq测序平台的标准流程进行双端测序。用QIIME (version 1.17)软件对原始fastq文件进行处理,处理标准如下:1)以50 bp为一个滑动窗口,如果窗口内平均质量值低于20,则从窗口开始截去后端碱基,并过滤掉小于50 bp的序列。2)根据标签序列区分样本,标签序列允许的错配数为0,引物错配数为2,且去掉包含模糊碱基的序列。3)相互拼接上的序列之间,重叠区不得少于10 bp,且去掉无法拼接的序列。用UPARSE(version 7.1 http://drive5.com/uparse/)软件聚类生成操作分类单元(operational taxonomic units,OTUs),相似度为97%。再用UCHIME软件鉴别嵌合体序列,并将之去除。分类学比对时,用silva (SSU115)16S核糖体RNA数据库,算法为RDP Classifier(http://rdp.cme.msu.edu/),置信阈值为70%[20]。
1.6 数据统计与分析试验数据采用SAS 9.0的Mix模型进行3×3拉丁方设计的统计分析。处理(饲粮)作为固定效应,试验动物(肉羊)和试验期作为随机效应,进行方差分析和多重比较。显著性水平为P < 0.05,有显著趋势为0.05 < P≤0.10。
2 结果与分析 2.1 植物精油对肉羊CH4产量的影响饲粮中添加桉叶油和茴香油对肉羊CH4产量的影响结果见表 3。与对照组相比,饲粮中添加500 mg/(头·d)的桉叶油对肉羊CH4产量没有显著影响(P>0.05),而添加500 mg/(头·d)的茴香油有降低CH4产量的趋势(P=0.08);饲粮中添加500 mg/(头·d)的桉叶油或茴香油对肉羊以代谢体重为基础的CH4产量均无显著影响(P>0.05)。
|
|
表 3 植物精油对肉羊CH4产量的影响 Table 3 Effects of plant essential oil on CH4 production of mutton sheep |
饲粮中添加桉叶油和茴香油对肉羊瘤胃微生物数量的影响结果(表 4)显示,饲粮中添加500 mg/(头·d)的桉叶油或茴香油对肉羊瘤胃总细菌、总真菌、总原虫及总产甲烷菌数量均没有显著影响(P>0.05)。
|
|
表 4 植物精油对肉羊瘤胃微生物数量的影响 Table 4 Effects of plant essential oil on rumen microbial number of mutton sheep |
3个组共18个瘤胃食糜样品的DNA纯度和浓度均符合定量检测标准,16S rDNA基因V1~V3可变区和V6~V8可变区扩增后的琼脂糖凝胶电泳结果(图 1)显示:各泳道扩增的条带单一且清晰,个别泳道因DNA浓度较小(第5泳道)及DNA弥散至条带下方(第9、11泳道)的原因导致条带较淡。以上结果说明扩增的DNA条带符合测序标准,可进行下一步测序。
|
ck+为空白对照,1kb表示电泳Marker,1、2、11、12、15、16为对照组瘤胃食糜样品,3、4、7、8、17、18为桉叶油组瘤胃食糜样品,5、6、9、10、13、14为茴香油组瘤胃食糜样品。 ck+ was blank control, 1kb represented electrophoretic Marker, 1, 2, 11, 12, 15, 16 were rumen chyme samples in control group, 3, 4, 7, 8, 17, 18 were rumen chyme samples in eucalyptus oil group, and 5, 6, 9, 10, 13, 14 were rumen chyme samples in anise oil group. 图 1 琼脂糖凝胶电泳检测结果 Fig. 1 Results of agarose gel electrophoresis |
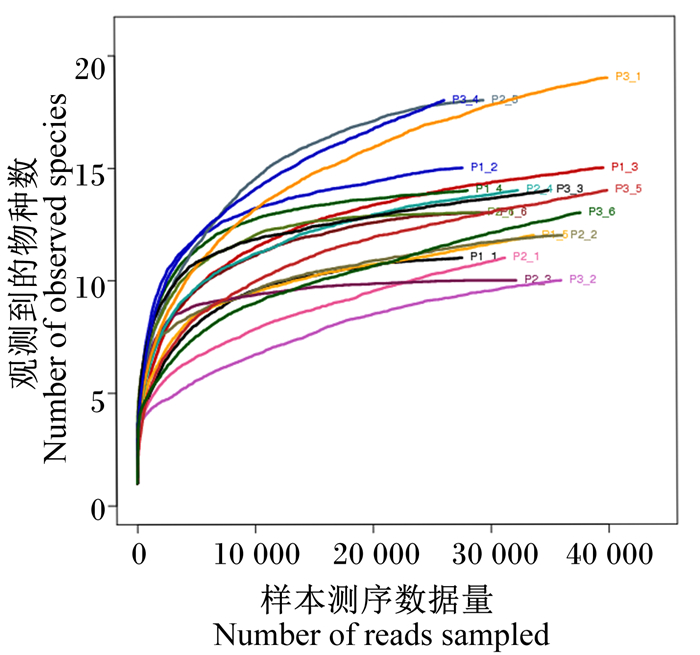
试验根据OTUs的数量(97%相似度)构建了18个瘤胃样品微生物的稀释曲线(图 2)。样本测序量为40 000个序列,说明样本测序的数据量合理。测序量在10 000以下时,样本中仍有未被检测的产甲烷菌,随着样本测序量增加至40 000,曲线趋向平坦,说明测序数据量合理,更多的数据量只会产生少量新的OTUs,样本数据量已符合产甲烷菌多样性分析的要求。
|
由字母与数字组成的编号为样本名称。下图同。 The number composed of letters and numbers was the sample name. The same as below. 图 2 瘤胃产甲烷菌OTUs稀释曲线 Fig. 2 OTUs dilution curve of methanogens in rumen |
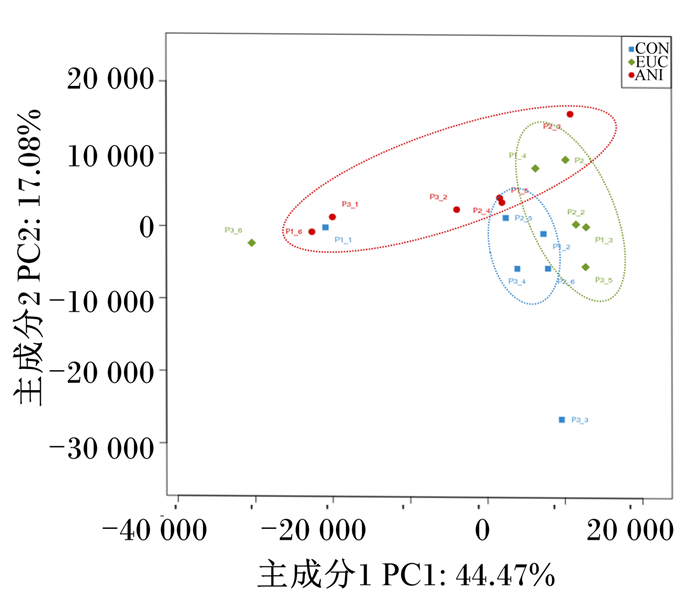
主成分分析分析(principal component analysis,PCA)是一种对数据进行简化分析的方法,常用来反映群落的β多样性。PCA图中X轴和Y轴表示2个选定的主成分轴,百分比表示主成分对样本组成差异的解释度值;X轴和Y轴的刻度是相对距离,无实际意义;不同形状及颜色的图例代表了不同处理肉羊瘤胃内采集的微生物样本。基于ANOSIM组间差异检验得出的PCA结果(图 3)显示,对照组、桉叶油组和茴香油组间的瘤胃产甲烷菌组成差异明显,说明产甲烷菌的组成会随着不同植物精油的处理而变化。
|
图中CON为对照组,EUC为桉叶油组,ANI为茴香油组。下图同。 In the figure, CON was the control group, EUC is the eucalyptus oil group, and ANI was the anise oil group. The same as below. 图 3 瘤胃产甲烷菌物种组成主成分分析 Fig. 3 Principal component analysis of species composition of methanogens in rumen |
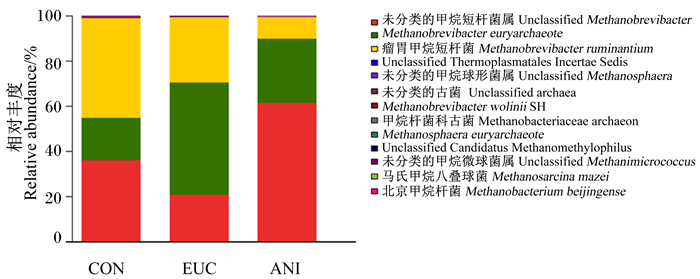
饲粮添加桉叶油和茴香油对不同产甲烷菌相对丰度的影响见图 4。3个组中的优势产甲烷菌均由未分类的甲烷短杆菌属(unclassified Methanobrevibacter)、瘤胃甲烷短杆菌(Methanobrevibacter ruminantium)和Methanobrevibacter euryarchaeote组成,占总产甲烷菌的98%(表 5);与对照组相比,桉叶油组中Methanobrevibacter euryarchaeote相对丰度显著提高(P < 0.05),unclassified Methanobrevibacter和Methanobrevibacter ruminantium相对丰度显著降低(P < 0.05);而茴香油组中unclassified Methanobrevibacter和Methanobrevibacter euryarchaeote相对丰度显著提高(P < 0.05),Methanobrevibacter ruminantium相对丰度显著降低(P < 0.05),且降低幅度在3个组中最大。
|
图 4 植物精油对肉羊瘤胃产甲烷菌丰度的影响 Fig. 4 Effects of plant essential oil on methanogens abundance in rumen of mutton sheep |
|
|
表 5 桉叶油和茴香油对肉羊瘤胃甲烷菌群在种水平相对丰度的影响 Table 5 Effects of Eucalyptus oil and fennel oil on relative abundance of methanoflora in rumen of mutton sheep at species level |
3组肉羊瘤胃产甲烷菌组成热图和样本聚类树分析结果如图 5所示,图中根据不同分组的样本之间和不同产甲烷菌之间的物种相对丰度相似性进行了聚类分析,将相对丰度大小接近的样本或产甲烷菌分配到一个分支;图中从蓝色到红色的颜色变化表示产甲烷菌的群落相对丰度由小到大的变化。3个组共检测出13个优势菌种,相对丰度最大的3个菌种分别为Methanobrevibacter ruminantium、Methanobrevibacter euryarchaeote和unclassified Methanobrevibacter;3个组内产甲烷菌的相对丰度具有较大的相似性,然而桉叶油组与对照组之间Methanobrevibacter euryarchaeote和unclassified Methanobrevibacter的相对丰度具有较大差异,茴香油组和对照组之间Methanobrevibacter ruminantium和unclassified Methanobrevibacter的相对丰度具有较大差异,其中茴香油组中Methanobrevibacter ruminantium的相对丰度低于桉叶油组和对照组。
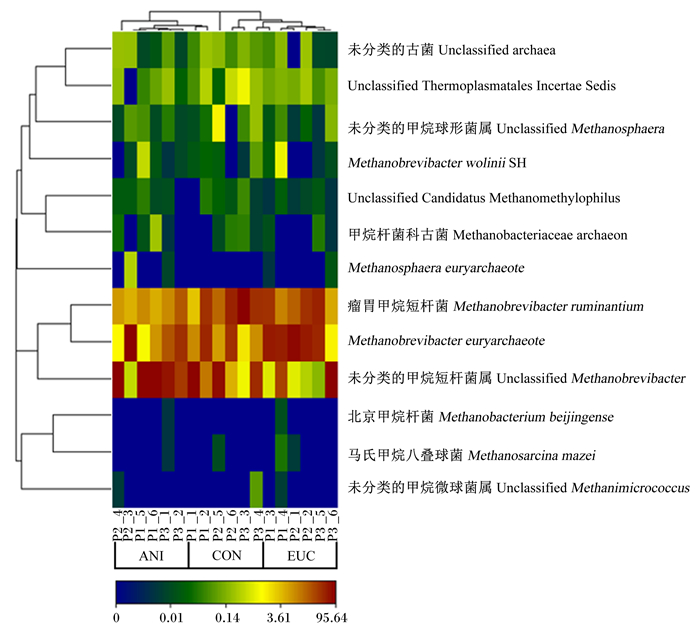
|
图 5 饲粮中添加植物精油与瘤胃产甲烷菌区系变化的相关性分析 Fig. 5 Correlation analysis between dietary plant essential oil and changes of rumen methanogen community |
CH4产量是评价反刍动物能量代谢的重要指标之一,因为CH4主要由产甲烷菌在瘤胃发酵过程中利用代谢氢产生,同时细菌、原虫以及真菌产生的代谢氢传递给产甲烷古菌,通过氢营养途径还原二氧化碳(CO2)也会生成CH4[21]。当瘤胃中代谢氢从CH4转移到挥发性脂肪酸(VFA)的量增大时,反刍动物的能量利用率及生产性能会得到提升,反刍动物对环境的不良影响(CH4的产生)也会相应降低[22]。饲粮的精粗比很大程度上会影响瘤胃CH4产量,通常高精饲粮会降低反刍动物CH4的排放[23]。本研究中,各组饲粮的精粗比均为60 ∶ 40,故CH4产量的结果主要受不同精油的影响,而不受饲粮精粗比的影响。目前,植物精油对反刍动物CH4产量的影响所得研究结果不尽相同,例如,Chaves等[24]的体外试验发现肉桂油、大蒜油和杜松子油可以显著降低瘤胃CH4产量;Ye等[25]的体外研究表明在909 kg底物中添加11 g的肉桂油和大蒜油混合物可以显著降低瘤胃CH4产量;El-Zaiat等[26]的体外试验显示了90 μg/g DM的广藿香精油降低了瘤胃CH4总产量;另有研究发现植物精油对瘤胃CH4产量没有显著影响,如Castañeda-Correa等[27]的研究显示体外单独或联合使用200 mg/L百里香酚和香芹酚对瘤胃CH4的产量没有显著影响;Kouazounde等[28]的体外研究结果表明400 mg/L的薄荷精油对瘤胃CH4产量没有显著影响。上述研究结果表明,植物精油对瘤胃CH4产量的影响可能与种类和剂量有关。在以往的研究中,桉叶油对瘤胃CH4产量的影响效果也没有一致结论,部分体外研究发现400~1 000 mg/L的桉叶油具有降低瘤胃CH4产量的效果[29-30];而另有体外研究显示100~300 mg/L的桉叶油对瘤胃CH4产量没有显著影响[31],可能是浓度较低时桉叶油不能影响CH4产量,而在高浓度时,桉叶油对CH4产量具有较好的降低效果。在茴香油的研究中,陆燕[32]的体外研究发现30 mg/L的茴香油可以降低CH4产量,表明茴香油在较低浓度下就可以降低瘤胃CH4的产量。
本实验室前期对桉叶油、山苍子油、肉桂油和茴香油4种植物精油不同浓度的体外产气试验结果发现,除桉叶油外的其他3种植物精油在高浓度(400 mg/L)时均显著降了24 h产气量和CH4产量,但同时也显著降低了体外发酵培养24 h的总VFA浓度,且总VFA浓度随植物精油浓度的增加呈线性下降的趋势,尤其是在高浓度时,下降最多的达到28.19%,而桉叶油虽然降低了24 h的CH4产量,但对总产气量和总VFA浓度没有显著影响,且在不同浓度梯度下,总VFA浓度均没有下降,甚至在数值上还有所增加,表明桉叶油在降低CH4产量的同时对体外瘤胃发酵没有产生抑制作用,这在动物生产中具有重要价值;另外,由于茴香油降低CH4产量的效果最显著,24 h体外发酵的CH4产量在浓度为400 mg/L时比对照组降低了47.75%,预测在动物生产中将具有较好的降低CH4的效果[33]。根据体外试验的结果,本实验室后续选择了桉叶油和茴香油开展体内动物试验,旨在探讨其对肉羊CH4产量和瘤胃产甲烷菌数量及组成的影响。由于动物体内微生物的活性远远高于体外发酵试验,故本试验中植物精油在肉羊中的添加剂量远远低于体外发酵试验。研究结果显示,肉羊饲粮中添加500 mg/(头·d)的桉叶油对CH4产量无显著影响,原因可能是桉叶油的添加剂量不足以达到降低体内CH4产量的效果;另外,肉羊饲粮中添加500 mg/(头·d)的茴香油有降低CH4产量的趋势,在统计学上差异不显著,可能是由于500 mg/(头·d)的茴香油添加量没有达到足够抑制产甲烷菌的效果,但每日CH4排放量降低了12.12%,在生产中仍具有一定的应用价值。
3.2 植物精油对肉羊瘤胃微生物数量的影响反刍动物CH4的产生,除了产甲烷古菌起主要作用外,瘤胃微生物中细菌、真菌、原虫等微生物之间的相互作用也是重要原因[22],瘤胃微生物的代谢活动也可以直接影响瘤胃中CH4、CO2等气体的产量[27]。利用植物精油的抗菌活性改变瘤胃微生物的数量是调控瘤胃产气量的手段之一。目前,植物精油对瘤胃微生物数量的影响研究结果并不一致,如Paraskevakis[34]的报道显示1 mL牛至油与20 g牛至干叶可以降低瘤胃总产甲烷菌的数量,而对总真菌、总原虫和部分纤维分解菌的数量均没有显著影响;而Chahaardoli等[16]的体外研究显示25 μL/mL的茴香油和茴香醇均可随浓度增加线性降低瘤胃总原虫数量。此外,植物精油是否可以通过改变瘤胃微生物数量而降低CH4产量也未见一致的研究报道,如Castañeda-Correa等[27]的研究显示体外添加200 mg/L百里香酚和香芹酚混合精油可以降低瘤胃总细菌数量,然而瘤胃CH4产量没有显著变化;而Vargas等[35]的体外研究却表明6%的向日葵精油可以显著降低瘤胃总细菌数量和瘤胃CH4产量。以上研究结果表明,不同植物精油对瘤胃微生物的影响不同,而CH4产量的降低具体受哪些瘤胃微生物区系变化的影响也需要进一步的研究。本研究结果中,添加2种植物精油对肉羊瘤胃总细菌、总真菌、总原虫和总产甲烷菌的数量均没有产生显著影响,这可能也是本试验中CH4产量没有显著变化的原因所在。分析其原因,一方面可能是植物精油的添加剂量未达到抑制微生物数量的程度,另一方面可能是瘤胃微生物具有适应性,随着植物精油添加时间的延长,微生物数量达到了新的平衡。此外,高浓度的植物精油所表现的抗菌活性常常会降低瘤胃微生物的数量,从而降低反刍动物消化代谢的效率,而本研究所采用的浓度并未影响到肉羊瘤胃微生物总数,说明这2种植物精油的添加未改变瘤胃中的发酵环境。在此前提下,茴香油在数值上对CH4产量的降低效果可能更具有生产价值。
3.3 植物精油对肉羊瘤胃产甲烷菌区系的影响产甲烷古菌主要存在于反刍动物的瘤胃和肠道下部,它们利用瘤胃发酵产生的还原力将CO2、甲酸或甲胺还原为CH4,因此,人们通常认为改变产甲烷菌区系可以很大程度影响反刍动物的CH4排放量[34]。高通量测序技术在反刍动物生产中的应用使得人们可以便捷和精准地揭示植物精油对瘤胃产甲烷菌区系的影响[36-37]。Patra等[31]的研究表明,牛至油、大蒜油和薄荷油能有效降低CH4产量,减少产甲烷菌的丰度;Kala等[38]的研究发现,给水牛饲喂由青蒿油、柠檬草油和丁香油树脂按等比例混合而成的混合精油可以降低甲烷球菌属(Methanococcus)和热原体属(Thermoplasma)的丰度,而原虫和细菌的数量变化不显著。这些结果表明,植物精油的添加具有改变瘤胃中产甲烷菌区系的效果,然而不同产甲烷菌丰度的变化是否必然导致CH4产量的变化却并没有统一的结论。在本研究中,添加500 mg/(头·d)的桉叶油或茴香油均没有改变肉牛瘤胃中总产甲烷菌的数量,而改变了unclassified Methanobrevibacter、Methanobrevibacter ruminantium和Methanobrevibacter euryarchaeote的相对丰度,该结果体现了植物精油对瘤胃产甲烷菌区系的影响。Ohene等[39]研究了肉桂醛、大蒜和杜松子油对肉羊瘤胃产甲烷古菌的影响,结果表明,植物精油处理后古生菌16S rRNA的总拷贝数没有显著变化,而斯塔曼甲烷球形菌(Methanosphaera stadtmaniae)、史密斯氏甲烷短杆菌(Methanobrevibacter smithii)和部分未命名的产甲烷古菌的多样性有增加的趋势,也表明植物精油的添加可能对产甲烷菌总数没有影响,但影响产甲烷菌区系。本研究中,产甲烷菌群PCA的结果体现了2种植物精油对瘤胃产甲烷菌群组成的影响效果,其中茴香油处理下的产甲烷菌群组成与对照组和桉叶油组不同;从产甲烷菌群相对丰度变化的结果与产甲烷菌群热图分析结果可见,茴香油组中Methanobrevibacter ruminantium的相对丰度小于其他2组。因此,我们推测茴香油在数值上降低CH4产量可能是由于其使Methanobrevibacter ruminantium数量大幅降低所致。
4 结论饲粮中添加500 mg/(头·d)的桉叶油或茴香油对肉羊瘤胃总细菌、总真菌、总原虫和总产甲烷菌的数量均没有显著影响,但茴香油在数值上降低了肉羊CH4产量。桉叶油和茴香油的添加影响了肉羊瘤胃产甲烷菌区系,其中茴香油在数值上对CH4产量的降低可能是由于其较大程度地降低了Methanobrevibacter ruminantium的数量。
| [1] |
COBELLIS G, TRABALZA-MARINUCCI M, YU Z T. Critical evaluation of essential oils as rumen modifiers in ruminant nutrition: a review[J]. Science of the Total Environment, 2016, 545/546: 556-568. DOI:10.1016/j.scitotenv.2015.12.103 |
| [2] |
JOUANY J P, MORGAVI D P. Use of 'natural' products as alternatives to antibiotic feed additives in ruminant production[J]. Animal, 2007, 1(10): 1443-1466. DOI:10.1017/S1751731107000742 |
| [3] |
JAHANI-AZIZABADI H, DURMIC Z, VADHANABHUTI J. Effect of some Australian native shrubs essential oils on in vitro rumen microbial fermentation of a high-concentrate diet[J]. Journal of Animal and Plant Sciences, 2019, 29(1): 8-15. |
| [4] |
GARCIA F, VERCOE P E, MARTÍNEZ M J, et al. Essential oils from Lippia turbinata and Tagetes minuta persistently reduce in vitro ruminal methane production in a continuous-culture system[J]. Animal Production Science, 2018, 59(4): 709-720. |
| [5] |
GARCIA F, COLOMBATTO D, BRUNETTI M A, et al. The reduction of methane production in the in vitro ruminal fermentation of different substrates is linked with the chemical composition of the essential oil[J]. Animals, 2020, 10(5): 786. DOI:10.3390/ani10050786 |
| [6] |
ZHOU R, WU J P, LANG X, et al. Effects of oregano essential oil on in vitro ruminal fermentation, methane production, and ruminal microbial community[J]. Journal of Dairy Science, 2020, 103(3): 2303-2314. DOI:10.3168/jds.2019-16611 |
| [7] |
LEI Z M, ZHANG K, LI C, et al. Ruminal metagenomic analyses of goat data reveals potential functional microbiota by supplementation with essential oil-cobalt complexes[J]. BMC Microbiology, 2019, 19(1): 30. DOI:10.1186/s12866-019-1400-3 |
| [8] |
LEE S S, KIM D H, PARADHIPTA D H V, et al. Effects of wormwood (Artemisia montana) essential oils on digestibility, fermentation indices, and microbial diversity in the rumen[J]. Microorganisms, 2020, 8(10): 1605. DOI:10.3390/microorganisms8101605 |
| [9] |
ALEKSIC SABO V, KNEZEVIC P. Antimicrobial activity of Eucalyptus camaldulensis Dehn. plant extracts and essential oils: a review[J]. Industrial Crops and Products, 2019, 132: 413-429. DOI:10.1016/j.indcrop.2019.02.051 |
| [10] |
BAYALA B, BASSOLE I H N, GNOULA C, et al. Chemical composition, antioxidant, anti-inflammatory and anti-proliferative activities of essential oils of plants from Burkina Faso[J]. Plos One, 2014, 9(3): e92122. DOI:10.1371/journal.pone.0092122 |
| [11] |
AKDEMIR EVRENDILEK G. Empirical prediction and validation of antibacterial inhibitory effects of various plant essential oils on common pathogenic bacteria[J]. International Journal of Food Microbiology, 2015, 202: 35-41. DOI:10.1016/j.ijfoodmicro.2015.02.030 |
| [12] |
KORINEK M, HANDOUSSA H, TSAI Y H, et al. Anti-inflammatory and antimicrobial volatile oils: fennel and cumin inhibit neutrophilic inflammation via regulating calcium and MAPKs[J]. Frontiers in Pharmacology, 2021, 12: 674095. DOI:10.3389/fphar.2021.674095 |
| [13] |
KSOUDA G, SELLIMI S, MERLIER F, et al. Composition, antibacterial and antioxidant activities of Pimpinella saxifraga essential oil and application to cheese preservation as coating additive[J]. Food Chemistry, 2019, 288: 47-56. DOI:10.1016/j.foodchem.2019.02.103 |
| [14] |
SALLAM S M A, BUENO I C S, BRIGIDE P, et al. Efficacy of eucalyptus oil on in vitro ruminal fermentation and methane production[M]//PAPACHRISTOU T G, PARISSI Z M, BEN SALEM H, et al. Nutritional and foraging ecology of sheep and goats. Zaragoza: CIHEAM /FAO/NAGREF, 2009: 267-272.
|
| [15] |
PATRA A K, YU Z T. Effects of essential oils on methane production and fermentation by, and abundance and diversity of, rumen microbial populations[J]. Applied and Environmental Microbiology, 2012, 78(12): 4271-4280. DOI:10.1128/AEM.00309-12 |
| [16] |
CHAHAARDOLI A, SOROOR M N, FOROUGHI A. The effects of anise (Pimpinella anisum) essential oil and extract on in vitro rumen fermentation parameters and protozoa population of sheep[J]. International Journal of Veterinary Science, 2018, 7(1): 21-27. |
| [17] |
赵丽萍. 硝酸盐对肉牛瘤胃发酵、微生物多样性、血液生化及抗氧化性能的影响[D]. 博士学位论文. 北京: 中国农业大学, 2015. ZHAO L P. Effects of nitrate on rumen fermentation, microbe diversity, blood biochemical and antioxidative ability[D]. Ph. D. Thesis. Beijing: China Agricultural University, 2015. (in Chinese) |
| [18] |
TYMENSEN L D, MCALLISTER T A. Community structure analysis of methanogens associated with rumen protozoa reveals bias in universal archaeal primers[J]. Applied and Environmental Microbiology, 2012, 78(11): 4051-4056. DOI:10.1128/AEM.07994-11 |
| [19] |
LUO Y H, WRIGHT A D, LI Y L, et al. Diversity of methanogens in the hindgut of captive white rhinoceroses, Ceratotherium simum[J]. BMC Microbiology, 2013, 13: 207. DOI:10.1186/1471-2180-13-207 |
| [20] |
AMATO K R, YEOMAN C J, KENT A, et al. Habitat degradation impacts black howler monkey (Alouatta pigra) gastrointestinal microbiomes[J]. The ISME Journal, 2013, 7(7): 1344-1353. DOI:10.1038/ismej.2013.16 |
| [21] |
LAN W, YANG C L. Ruminal methane production: associated microorganisms and the potential of applying hydrogen-utilizing bacteria for mitigation[J]. Science of the Total Environment, 2019, 654: 1270-1283. DOI:10.1016/j.scitotenv.2018.11.180 |
| [22] |
HASSAN F U, ARSHAD M A, EBEID H M, et al. Phytogenic additives can modulate rumen microbiome to mediate fermentation kinetics and methanogenesis through exploiting diet-microbe interaction[J]. Frontiers in Veterinary Science, 2020, 7: 575801. DOI:10.3389/fvets.2020.575801 |
| [23] |
李斌昌, 董利锋, 成述儒, 等. 不同精粗比日粮对反刍动物甲烷排放的调控[J]. 家畜生态学报, 2019, 40(1): 1-6. LI B C, DONG L F, CHENG S R, et al. Regulation of methane emissions from ruminants with different crude-to-ratio diets[J]. Journal of Domestic Animal Ecology, 2019, 40(1): 1-6 (in Chinese). DOI:10.3969/j.issn.1673-1182.2019.01.001 |
| [24] |
CHAVES A V, HE M L, YANG W Z, et al. Effects of essential oils on proteolytic, deaminative and methanogenic activities of mixed ruminal bacteria[J]. Canadian Journal of Animal Science, 2008, 88(1): 117-122. DOI:10.4141/CJAS07061 |
| [25] |
YE D, KARNATI S K R, WAGNER B, et al. Essential oil and monensin affect ruminal fermentation and the protozoal population in continuous culture[J]. Journal of Dairy Science, 2018, 101(6): 5069-5081. DOI:10.3168/jds.2017-13646 |
| [26] |
EL-ZAIAT H M, ABDALLA A L. Potentials of patchouli (Pogostemon cablin) essential oil on ruminal methanogenesis, feed degradability, and enzyme activities in vitro[J]. Environmental Science and Pollution Research, 2019, 26(29): 30220-30228. DOI:10.1007/s11356-019-06198-4 |
| [27] |
CASTAÑEDA-CORREA A, CORRAL-LUNA A, HUME M E, et al. Effects of thymol and carvacrol, alone or in combination, on fermentation and microbial diversity during in vitro culture of bovine rumen microbes[J]. Journal of Environmental Science and Health-Part B: Pesticides, Food Contaminants, and Agricultural Wastes, 2019, 54(3): 170-175. |
| [28] |
KOUAZOUNDE J B, JIN L, ASSOGBA F M, et al. Effects of essential oils from medicinal plants acclimated to benin on in vitro ruminal fermentation of Andropogon gayanus grass[J]. Journal of the Science of Food and Agriculture, 2015, 95(5): 1031-1038. DOI:10.1002/jsfa.6785 |
| [29] |
COBELLIS G, TRABALZA-MARINUCCI M, MARCOTULLIO M C, et al. Evaluation of different essential oils in modulating methane and ammonia production, rumen fermentation, and rumen bacteria in vitro[J]. Animal Feed Science and Technology, 2016, 215: 25-36. DOI:10.1016/j.anifeedsci.2016.02.008 |
| [30] |
DURMIC Z, MOATE P J, ECKARD R, et al. In vitro screening of selected feed additives, plant essential oils and plant extracts for rumen methane mitigation[J]. Journal of the Science of Food and Agriculture, 2014, 94(6): 1191-1196. DOI:10.1002/jsfa.6396 |
| [31] |
PATRA A, PARK T, KIM M, et al. Rumen methanogens and mitigation of methane emission by anti-methanogenic compounds and substances[J]. Journal of Animal Science and Biotechnology, 2017, 8: 13. DOI:10.1186/s40104-017-0145-9 |
| [32] |
陆燕. 植物精油对瘤胃甲烷产量生成和微生态的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2009. LU Y. Effects of plant essential oils on ruminal methanogenesis and microbial ecology[D]. Master's Thesis. Nanjing: Nanjing Agricultural University, 2009. (in Chinese) |
| [33] |
石宁, 贾淼, 李艳玲. 体外产气法研究植物精油对肉羊体外瘤胃发酵参数及甲烷产量的影响[J]. 动物营养学报, 2019, 31(1): 274-284. SHI N, JIA M, LI Y L. Effects of plant essential oil on rumen fermentation parameters and methane production of mutton sheep in vitro[J]. Chinese Journal of Animal Nutrition, 2019, 31(1): 274-284 (in Chinese). DOI:10.3969/j.issn.1006-267x.2019.01.034 |
| [34] |
PARASKEVAKIS N. Effects of dietary Greek oregano (Origanum vulgare ssp. hirtum) supplementation on rumen fermentation, enzyme profile and microbial communities in goats[J]. Journal of Animal Physiology and Animal Nutrition, 2018, 102(3): 701-705. DOI:10.1111/jpn.12812 |
| [35] |
VARGAS J E, ANDRÉS S, LÓPEZ-FERRERAS L, et al. Dietary supplemental plant oils reduce methanogenesis from anaerobic microbial fermentation in the rumen[J]. Scientific Reports, 2020, 10(1): 1613. DOI:10.1038/s41598-020-58401-z |
| [36] |
ST-PIERRE B, WRIGHT A D G. Molecular analysis of methanogenic archaea in the forestomach of the alpaca (Vicugna pacos)[J]. BMC Microbiology, 2012, 12: 1. DOI:10.1186/1471-2180-12-1 |
| [37] |
HENDERSON G, COX F, GANESH S, et al. Rumen microbial community composition varies with diet and host, but a core microbiome is found across a wide geographical range[J]. Scientific Reports, 2015, 5: 14567. DOI:10.1038/srep14567 |
| [38] |
KALA A, KAMRA D N, AGARWAL N, et al. Insights into metatranscriptome, and cazymes of buffalo rumen supplemented with blend of essential oils[J]. Indian Journal of Microbiology, 2020, 60(4): 485-493. DOI:10.1007/s12088-020-00894-3 |
| [39] |
OHENE-ADJEI S, CHAVES A V, MCALLISTER T A, et al. Evidence of increased diversity of methanogenic archaea with plant extract supplementation[J]. Microbial Ecology, 2008, 56(2): 234-242. DOI:10.1007/s00248-007-9340-0 |




