2. 新疆生产建设兵团塔里木畜牧科技 重点实验室, 阿拉尔 843300
2. Key Laboratory of Tarim Animal Husbandry Science and Technology, Alar 843300, China
人们长期使用抗生素防治动物疫病和维持畜禽机体健康,使得畜禽出现耐药病原体和药物残留[1],人们的公共健康受到威胁[2],在这种情况下,人们迫切寻找合适的益生菌作为抗生素的替代品。《饲料添加剂品种目录(2013)》允许使用的饲料级微生物菌种包括屎肠球菌(Enterococcus faecium)和枯草芽孢杆菌(Bacillus subtilis)。屎肠球菌与肠道表面黏附形成保护屏障,是肠道正常优势菌群[3],产有机酸降低肠道pH[4],维持菌群平衡[5],防治动物肠道菌群失调,用于幼畜的肠道保健[6]。枯草芽孢杆菌可产生抗逆性内生孢子,为需氧革兰氏阳性菌[7]。研究表明,添加2×1010 CFU/d屎肠球菌可以提高断奶犊牛瘤胃氨态氮(NH3-N)、乙酸以及总挥发性脂肪酸(TVFA)含量,降低瘤胃pH[8],还可以显著提高仔猪平均日增重(ADG)[9],显著降低料重比(F/G)[10];饲喂枯草芽孢杆菌可以使犊牛ADG和F/G显著提高[11]。李月明等[12]在体外产气试验中发现,添加2×1010 CFU/g枯草芽孢杆菌可以提高产气量和NH3-N含量,降低pH,提高TVFA含量。程连平等[13]发现,添加1×1010 CFU/g枯草芽孢杆菌可以显著提高羔羊瘤胃液NH3-N、乙酸、丙酸等含量。饲喂复合益生菌(枯草芽孢杆菌、粪肠球菌等)可以改善羔羊胃肠道菌群,减少羔羊的腹泻率[14];复合菌制剂(地衣芽孢杆菌、枯草芽孢杆菌和植物乳酸菌)可以提高8周龄犊牛瘤胃中的黄色瘤胃球菌和产琥珀酸丝状杆菌的数量[15]。本研究将屎肠球菌和枯草芽孢杆菌添加至绵羊饲粮中进行单菌以及复合菌添加,并比较其对绵羊生长性能、养分表观消化率、瘤胃发酵指标和瘤胃微生物区系的影响,为微生态制剂在反刍动物饲料添加剂上的应用提供科学依据,为健康绿色畜牧养殖提供思路。
1 材料与方法 1.1 试验菌株屎肠球菌F11.1G为塔里木大学畜牧科技重点实验室筛选菌株,于中国典型培养物保藏中心保藏(保藏号:M 2020793),活菌数为1×1010 CFU/g。枯草芽孢杆菌购买于某酵母股份有限公司,活菌数为2×1010 CFU/g。菌种发酵液采用专利(一种屎肠球菌粉剂的制备方法及其应用,申请号:210420)制作,配制0.5%乳糖和0.001%柠檬酸发酵液,高压后均匀混合,加入5%菌粉,于摇床中37 ℃培养24~36 h备用。根据白天天等[16]试验结果确定屎肠球菌在绵羊体内的添加活菌数为1×1010 CFU/mL,根据孙康等[17]、卢佳伟等[18]和乌日勒格[19]研究确定枯草芽孢杆菌在绵羊体内的添加活菌数为1×1010 CFU/mL,通过菌种发酵液制作及培养后调整屎肠球菌和枯草芽孢杆菌活菌数为1×1010 CFU/mL。
1.2 试验设计选取24只体重为(32.7±4.7) kg、安装瘘管的成年绵羊,随机分为4组,每组6个重复,每个重复1只。4个组分别为CK组(添加10 mL发酵液)、S组(添加10 mL屎肠球菌发酵液)、K组(添加10 mL枯草芽孢杆菌发酵液)和F组(添加5 mL屎肠球菌发酵液+5 mL枯草芽孢杆菌发酵液),于晨饲前与部分精料混合饲喂。
1.3 饲养管理及饲粮试验于2021年7月20日至2021年10月5日在塔里木大学动物科学与技术学院试验站进行。单栏饲养,每日09:00和20:00各饲喂1次(限饲1.2 kg),自由饮水。预试期15 d,正试期60 d,正试期分为2期:第1~30天为Ⅰ期和第31~60天为Ⅱ期。参考《肉羊饲养标准》(NY/T 816—2004)[20]并结合生产实际配制基础饲粮,满足绵羊维持水平,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
粪样、饲粮样采集:消化试验采用全收粪法,于第5~12天和第35~42天晨饲前收集粪样和剩料,称重备用,选取未污染粪样加入10%硫酸浸泡,保存于-20 ℃,待试验结束后,混合各试验动物7 d的粪样,烘干后粉碎过40目筛备用。
瘤胃样品采集:于第1~3天和第31~33天晨饲后连续采集0、2、4、6和8 h的瘤胃食糜,进行原虫计数及pH、NH3-N和VFA含量的测定。于第30天和第60天晨饲前1 h内采集瘤胃液,保存于-80 ℃,送至北京擎科生物科技有限公司进行16S rDNA测序。
1.5 指标测定 1.5.1 生长性能测定于试验第0(试验开始前1天)、60天晨饲前对所有绵羊进行空腹称重,分别记为初始体重和终末体重。每日饲喂前清理收集剩料并称重,计算干物质采食量(DMI)。

|
饲粮和粪样中的干物质(DM)含量采用干燥法测定;有机物(OM)含量采用灼烧法测定;粗蛋白质(CP)含量采用凯氏定氮法测定;酸性洗涤纤维(ADF)和中性洗涤纤维(NDF)含量采用酸碱消煮法测定,具体操作参照《动物营养与饲料科学实践教程》[21]进行。养分表观消化率计算公式如下:
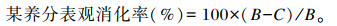
|
式中:B为饲粮中该养分的含量;C为粪样中该养分的含量。
1.5.3 瘤胃发酵指标测定原虫计数参照蒋辰宇[22]方法测定;屎肠球菌和枯草芽孢杆菌活力参照郭雪峰等[23]方法测定;pH通过希玛牌便携式pH测试笔测定;VFA含量采用赛默飞U3000高效液相色谱仪,参照苏利红等[24]方法测定;NH3-N含量采用冯宗慈等[25]方法测定。
1.5.4 瘤胃微生物区系测定微生物多样性是基于Illumina NovaSeq测序平台,利用双末端测序(paired-end)的方法,构建小片段文库进行测序。通过对Reads拼接过滤,聚类或去噪,并进行物种注释及丰度分析,可以揭示样品的物种构成;进一步进行α多样性分析、β多样性分析、显著物种差异分析等,挖掘样品之间的差异。
瘤胃微生物多样性使用Usearch软件对Reads在97.0%的相似度水平下进行聚类,获得分类操作单元(OTU)。以SILVA为参考数据库使用朴素贝叶斯分类器对特征序列进行分类学注释, 可得到每个特征对应的物种分类信息,进而在各水平(界、门、纲、目、科、属、种)统计各样品群落组成,利用QIIME软件生成不同分类水平上的物种丰度表,再利用R语言工具绘制成样品各分类学水平下的群落结构图。使用QIIME2软件,对样品α多样性指数进行评估。
1.6 数据处理试验数据采用SPSS 26.0软件one-way ANOVA程序进行单因素方差分析,并采用Duncan氏法进行多重比较,P<0.05表示差异显著。
2 结果与分析 2.1 添加屎肠球菌、枯草芽孢杆菌及其复合菌对绵羊生长性能和养分表观消化率的影响由表 2可知,Ⅰ期时,各组间养分消化率无显著差异(P>0.05),S组的ADG最高,F组的F/G最高;Ⅱ期时,S组的ADF消化率显著高于CK组和F组(P<0.05),其他各组各养分表观消化率无显著差异(P>0.05),K组的ADG最高,S组的F/G最高。
|
|
表 2 添加屎肠球菌、枯草芽孢杆菌及其复合菌对绵羊生长性能和养分表观消化率的影响 Table 2 Effects of adding Enterococcus faecium, Bacillus subtilis and their compound bacteria on growth performance and nutrient apparent digestibility of sheep |
由表 3可知,Ⅰ期时,各组pH在各阶段均随时间的增加呈先下降再上升的趋势,在2~4 h时达到最低后开始上升;K组和F组的pH始终低于CK组(P>0.05),在0~2 h和8 h时,S组的pH低于CK组(P>0.05),在8 h时,S组为最低;Ⅱ期8 h时,CK组pH低于其他各组(P>0.05)。
|
|
表 3 添加屎肠球菌、枯草芽孢杆菌及其复合菌对绵羊瘤胃发酵pH的影响 Table 3 Effects of adding Enterococcus faecium, Bacillus subtilis and their compound bacteria on rumen fermentation pH of sheep |
由表 4可知,Ⅰ期时,CK组NH3-N含量随时间的增加呈波动变化,其他各组均呈先下降再上升趋势,4~6 h时,CK组NH3-N含量高于其他各组(P>0.05);Ⅱ期时,除K组NH3-N含量随时间的增加出现波动变化外,其他各组均呈先下降再上升趋势,4 h时,CK组NH3-N含量高于其他各组,但均差异不显著(P>0.05);在各阶段,6 h时F组NH3-N含量均为最低。
|
|
表 4 添加屎肠球菌、枯草芽孢杆菌及其复合菌对绵羊瘤胃NH3-N含量的影响 Table 4 Effects of adding Enterococcus faecium, Bacillus subtilis and their compound bacteria on rumen NH3-N content of sheep |
由表 5可知,各组乙酸含量均随时间的增加呈先上升后下降的趋势,Ⅰ期,各时间点各组乙酸含量差异均不显著(P>0.05),CK组乙酸含量均为最高;Ⅱ期时,6 h时S组显著高于K组(P<0.05),但与其他各组均差异不显著(P>0.05)。
|
|
表 5 添加屎肠球菌、枯草芽孢杆菌及其复合菌对绵羊瘤胃VFA含量的影响 Table 5 Effects of adding Enterococcus faecium, Bacillus subtilis and their compound bacteria on rumen fermentation VFA contents of sheep |
在各时期各组丙酸含量均随时间的增加呈先上升再下降的趋势,Ⅰ期时,各组之间丙酸含量无显著差异(P>0.05),在Ⅱ期6 h时,S组丙酸含量显著高于K组(P<0.05),与CK组相比差异不显著(P>0.05),其他时间点各组之间差异不显著(P>0.05)。
各时期各组丁酸含量均随时间的增加呈先上升再下降的趋势,只有F组在Ⅰ期2 h时的丁酸含量低于CK组(P>0.05),Ⅱ期时,除0 h时S组、K组和6 h时S组、K组的丁酸含量低于CK组(P>0.05)外,其他各组丁酸含量均高于CK组(P>0.05)。
各时期各组戊酸含量随时间的增加呈先上升再下降的趋势,除Ⅰ期0 h时S组和4 h时F组的戊酸含量低于CK组(P>0.05)外,其他各组戊酸含量均高于CK组(P>0.05),Ⅱ期0~4 h时CK组戊酸含量均为最高,6 h时只有F组的戊酸含量高于CK组(P>0.05),8 h时CK组戊酸含量低于其他各组(P>0.05)。
各时期各组TVFA含量均随时间的增加呈先上升再下降的趋势,Ⅰ期时,各组TVFA含量无显著差异(P>0.05),在Ⅱ期时,除6 h时K组的TVFA含量显著低于其他各组(P<0.05)外,其他各时间点各组均差异不显著(P>0.05)。
Ⅰ期时,随时间的增加各时期各组乙酸/丙酸呈波动变化,各组各时间点乙酸/丙酸均差异不显著(P>0.05),Ⅱ期时,随时间的增加各组乙酸/丙酸呈先下降再上升趋势,0 h时,F组的乙酸/丙酸显著高于CK组(P<0.05),其他时间点各组均差异不显著(P>0.05)。
2.5 添加屎肠球菌、枯草芽孢杆菌及其复合菌对绵羊瘤胃原虫数量的影响由表 6可知,各时期各组原虫数量随时间的增加呈波动变化,在Ⅰ期时,CK组的原虫数量在4和8 h时高于其他各组(P>0.05);在Ⅱ期0和8 h时,CK组原虫数量低于其他各组(P>0.05)。
|
|
表 6 添加屎肠球菌、枯草芽孢杆菌及其复合菌对绵羊瘤胃原虫数量的影响 Table 6 Effects of adding Enterococcus faecium, Bacillus subtilis and their compound bacteria on number of rumen protozoa of sheep |
由表 7可知,各时期各组之间ACE指数、Chao1指数、Shannon指数、Simpson指数和PD_whole_tree指数均差异不显著(P>0.05)。Ⅰ期时,S组的ACE指数、Chao1指数和PD_whole_tree指数最高,CK组的Shannon指数最低,各组Simpson指数相同;Ⅱ期时,除S组的ACE指数和PD_whole_tree指数出现了降低趋势,S组和F组的Simpson指数保持稳定外,各组各指数均呈上升趋势。本试验样本覆盖指数达到0.99以上,反映本次测序结果可以代表瘤胃液中物种的真实情况。
|
|
表 7 添加屎肠球菌、枯草芽孢杆菌及其复合菌对绵羊瘤胃细菌多样性指数的影响 Table 7 Effects of adding Enterococcus faecium, Bacillus subtilis and their compound bacteria on rumen bacterial diversity indexes of sheep |
由表 8可知,绵羊瘤胃微生物门水平主要由拟杆菌门、厚壁菌门、Kiritimatiellaeota、变形菌门、互养菌门、螺旋体门、蓝藻门、髌骨细菌门、放线菌门、无壁菌门和一些占比较少的菌门组成。各时期各组瘤胃液样品中瘤胃细菌门水平组成存在差异,Ⅰ期时,各组中的拟杆菌门、厚壁菌门、Kiritimatiellaeota和变形菌门占有相对较高丰度,Ⅱ期时,各组中的拟杆菌门、厚壁菌门、变形菌门、互养菌门占有相对较高丰度,各期各组之间除疣微菌门外的主要优势菌门相对丰度均无显著差异(P>0.05)。
|
|
表 8 添加屎肠球菌、枯草芽孢杆菌及其复合菌对绵羊瘤胃细菌门水平组成的影响 Table 8 Effects of adding Enterococcus faecium, Bacillus subtilis and their compound bacteria on rumen bacterial phylum level composition of sheep |
由表 9可知,绵羊瘤胃微生物属水平主要由普雷沃氏菌属-1、理研菌科RC9肠道群、普雷沃氏菌科UCG-003、瘤胃球菌科UCG-005、普雷沃氏菌科UCG-001和丹毒丝菌科UCG-004和一些占比较少的菌属组成。各时期各组瘤胃液样品中瘤胃细菌属水平组成存在差异,各组在各时期共有的优势菌属为普雷沃氏菌属-1、理研菌科RC9肠道群、普雷沃氏菌科UCG-003、未分类菌属-F082、未分类拟杆菌目-RF16群。除Ⅱ期CK组、K组未分类菌属-F082相对丰度显著高于S组(P<0.05)外,各时期各组优势菌属相对丰度均无显著差异(P>0.05)。
|
|
表 9 添加屎肠球菌、枯草芽孢杆菌及其复合菌对绵羊瘤胃细菌属水平组成的影响 Table 9 Effects of adding Enterococcus faecium, Bacillus subtilis and their compound bacteria on rumen bacterial genus level composition of sheep |
乳酸菌利用饲料中的碳水化合物分解产生乳酸,乳酸利用菌可将乳酸降解为乙酸、丙酸等,提高了饲料的利用率。在Ⅰ期时发现,添加屎肠球菌和枯草芽孢杆菌可以提高绵羊ADG,与王建国等[26]在饲粮中添加微生态制剂(芽胞杆菌、乳酸菌和酵母菌等)后的结果相同,添加枯草芽孢杆菌后降低了DM摄入量和ADF摄入量,这可能是因为枯草芽孢杆菌的芽孢代谢产物中含有多肽类抗菌物质[27],绵羊采食后瘤胃内出现的多肽类抗菌物质破坏了瘤胃内微生物平衡,使营养物质的利用过程受到影响,但可能因枯草芽孢杆菌菌种来源不同,使得营养物质的利用率存在差异[28],添加量过高也可能会影响养分降解率[29]。在Ⅱ期时发现,添加屎肠球菌后可以显著提高ADF表观消化率,与添加复合菌(乳酸菌、芽孢杆菌和双歧杆菌)至青海细毛羊饲粮中[30]和饲喂荷斯坦奶牛地衣芽孢杆菌后[31]的结果一致;在本试验中,添加屎肠球菌提高了绵羊养分的摄入量和消化率,但未达到显著水平,在Ⅱ期时效果较好,我们猜测外源添加的菌株在刚进入瘤胃内环境时与瘤胃微生物有互作作用,在Ⅱ期屎肠球菌和瘤胃内微生物达成了稳定,可能与瘤胃中某一菌群的变化有关,具体原因需要进一步的研究。本研究中各组ADG均较低,可能是因为本试验中试验动物为成年瘘管羊,饲粮设计为维持水平,且试验在夏天进行,天气炎热,因此绵羊增重较慢,从而使绵羊F/G偏高。
3.2 添加屎肠球菌、枯草芽孢杆菌及其复合菌对绵羊瘤胃发酵参数的影响瘤胃pH的变化受多种因素的影响,可以衡量瘤胃内环境变化。瘤胃pH的变化可以影响瘤胃微生物对底物的利用效率,人们认为瘤胃微生物pH在5.7以上时,生长速度最快[32],也有人认为瘤胃pH变化范围一般在5.5~7.5[8],本试验中pH范围在5.98~6.78,可见各时期各组各时间点的pH均在5.7以上,在正常范围之内,可知添加屎肠球菌和枯草芽孢杆菌会降低瘤胃pH,但并不会影响瘤胃微生物的正常生长。在Ⅰ期绵羊摄入菌剂后发现pH开始下降,在4 h达到最低,这可能与屎肠球菌进入瘤胃后可迅速产生乳酸[33],枯草芽孢杆菌发酵瘤胃内饲料产生有机酸,限饲使得食糜在瘤胃内滞留,绵羊多次反刍增加食糜中碳水化合物在瘤胃中降解的比例,致使产酸量升高有关,这与TVFA含量在同时间段的升高相吻合,而在Ⅱ期则没有这种变化,可能使瘤胃内微生物适应了屎肠球菌和枯草芽孢杆菌进入瘤胃内产生的影响,达到了稳定。在本试验中,Ⅰ期0~2 h和8 h时,添加屎肠球菌后瘤胃pH出现下降,与丙酸杆菌、植物乳杆菌及其复合益生菌剂添加至公牛饲粮的结果[34]一致。
NH3-N是反映瘤胃氮代谢水平的重要指标,通过测定瘤胃中氨氮浓度可以间接反映瘤胃微生物分解饲粮粗蛋白质产生氨氮和利用氨氮合成微生物体蛋白的平衡情况[35]。在本试验中,添加屎肠球菌和枯草芽孢杆菌在0~2 h会提高瘤胃中的瘤胃液中NH3-N含量,苏勇华等[36]在多浪羊中添加枯草芽孢杆菌也得到了同样的结论。在4 h时,各组NH3-N含量最低,这可能是因为瘤胃微生物迅速利用氨合成微生物蛋白,同时与天气炎热,绵羊饮水量增加,瘤胃液被稀释有关。NH3-N含量过低时会影响合成微生物蛋白,过高表明氨的利用率较低,造成氨的损失。在8 h,S组和K组的NH3-N含量高于对照组,可能与瘤胃内可快速利用的能源耗尽,影响微生物对NH3-N的利用效率,因而导致其含量上升有关。
瘤胃VFA包括乙酸、丙酸、丁酸和戊酸等,有95%的VFA可被利用进行氧化供能或合成脂肪[37]。丁酸可合成中、短链脂肪酸,刺激瘤胃上皮发育,促进养分的消化吸收[38],丙酸是肝脏中产生葡萄糖的主要前体物质。在本试验中,添加屎肠球菌后发现丁酸、戊酸、TVFA含量和乙酸/丙酸有所提高,VFA含量增加的原因可能是因为屎肠球菌能够改善瘤胃发酵,促进碳水化合物在瘤胃中的降解[39],添加屎肠球菌和枯草芽孢杆菌后发现乙酸/丙酸降低,使得瘤胃发酵类型转变为丙酸型,与丁洪涛等[40]研究结果一致;复合菌剂组提高了乙酸/丙酸,这可能是因为复合菌剂组中的屎肠球菌和枯草芽孢杆菌之间可能有竞争作用,使复合菌组的瘤胃发酵趋向乙酸型发酵。由此可见,添加益生菌可通过改变瘤胃发酵类型,促进瘤胃发酵。
3.3 添加屎肠球菌、枯草芽孢杆菌及其复合菌对绵羊瘤胃微生物区系的影响瘤胃是反刍动物重要的消化场所,瘤胃微生物组成和结构影响着瘤胃内环境稳态和营养物质消化吸收[41]。原虫占反刍动物瘤胃微生物体积的30%~80%[42],不仅可以促进纤维和淀粉等转化成VFA,还具有吞噬细菌,减缓碳水化合物的发酵速度,增加甲烷产量的负面作用[43],因此,原虫数量应在一个适宜的范围。每毫升瘤胃内容物中的原虫数量一般为105~107个[44]。本试验中的原虫范围在1.22×106~3.05×106个/mL,可见屎肠球菌和枯草芽孢杆菌并不会对瘤胃内原虫数量产生不良影响。Ⅰ期时,添加屎肠球菌和枯草芽孢杆菌并未对瘤胃内的原虫数量产生影响。Ⅱ期时,发现添加枯草芽孢杆菌后原虫数量出现降低,可能是因为后期枯草芽孢杆菌在瘤胃稳定增殖,间接影响了原虫发酵碳水化合物的作用,进而抑制了原虫的生长,8 h时瘤胃内营养物质和氧气耗尽,枯草芽孢杆菌活力降低,原虫数量又出现上升趋势。
在本试验中,添加屎肠球菌和枯草芽孢杆菌后ACE指数、Chao1指数、Shannon指数、Simpson指数和PD_whole_tree指数并未出现显著差异,Ⅰ期时,添加屎肠球菌发现ACE指数、Chao1指数和Shannon指数出现了上升,说明屎肠球菌组的菌群丰富度增加了;K组和F组的Shannon指数在2个时期均出现了上升,这种现象可能是因为益生菌剂的摄入使其在瘤胃内大量增殖,对绵羊瘤胃微生物菌群丰度产生了影响,这与刘宇阳[45]的研究结果一致。
反刍动物瘤胃中拟杆菌门具有降解饲料中蛋白质、多糖和碳水化合物的作用,而厚壁菌门则能促使纤维降解,从而提高纤维物质利用率[46]。而变形菌门主要为革兰氏阴性菌,包含多种致病菌,如大肠杆菌、幽门螺杆菌、沙门氏菌等[47],其含量高于19%时标志着微生物群落不稳定[48]。在本试验中,各组绵羊瘤胃中的优势菌门为拟杆菌门、厚壁菌门和变形菌门等,与吴璞等[49]的小尾寒羊的瘤胃优势菌门相同;添加屎肠球菌发现提高了疣微菌门的相对丰度,添加益生菌剂增加了拟杆菌门的相对丰度,降低了变形菌门的相对丰度,与陈相如[50]在断奶羔羊的饲粮中添加复合益生菌(枯草芽孢杆菌、植物乳杆菌等)对菌门的影响一致;本试验中变形菌门的占比都在5.48%以下,所以添加屎肠球菌和枯草芽孢杆菌对瘤胃菌门无负面影响,且不影响瘤胃菌群稳定。
普雷沃氏菌属可以降解纤维素、半纤维素、蛋白质和淀粉等[51],理研菌科RC9肠道群可以有效降解可溶性多糖和不溶性纤维素[52],理研菌科菌属对维护肠道健康有重要作用[53]。解琥珀酸菌属能分解纤维素或纤维二糖为琥珀酸、乙酸和二氧化碳等[54]。各时期添加屎肠球菌和枯草芽孢杆菌后的瘤胃菌属共同为普雷沃氏菌属-1、理研菌科RC9肠道群、普雷沃氏菌科UCG-003等,各菌属相对丰度均在5%以上。Ⅰ期时,添加枯草芽孢杆菌后纤维杆菌门相对丰度上升,F组降低了普雷沃氏菌科UCG-003的相对丰度,Ⅱ期时,各组中奎因氏菌属和解琥珀杆菌属占有相对较高丰度。这说明添加屎肠球菌和枯草芽孢杆菌及其复合菌剂可以促进纤维的降解,而二者的复合菌剂则不利于营养物质消化,可能是菌剂之间的交互作用所致。Ⅱ期时,添加屎肠球菌后未分类菌属-F082的相对丰度下降,与芦岩[55]添加乳酸菌和酵母菌混合菌液进行棉杆和甜菜渣青贮的体外发酵试验后的微生物区系分析一致,屎肠球菌可能会对其产生影响。
4 结论综上所述,添加60 d屎肠球菌可以提高绵羊ADF表观消化率,降低瘤胃中未分类菌属-F082相对丰度;添加60 d枯草芽孢杆菌会降低瘤胃中乙酸、丙酸和TVFA含量;添加60 d复合益生菌剂降低了瘤胃中乙酸/丙酸。因此,屎肠球菌可以促进绵羊对营养物质的利用,调节绵羊瘤胃微生物区系菌门或菌属的相对丰度,负面作用较少。因此,屎肠球菌和枯草芽孢杆菌可作为微生态制剂饲料添加剂,应用于反刍动物健康绿色畜牧养殖中。
| [1] |
WANG Y W, DONG Z L, SONG D, et al. Effects of microencapsulated probiotics and prebiotics on growth performance, antioxidative abilities, immune functions, and caecal microflora in broiler chickens[J]. Food and Agricultural Immunology, 2018, 29(1): 859-869. DOI:10.1080/09540105.2018.1463972 |
| [2] |
AYALA D I, COOK P W, FRANCO J G, et al. A systematic approach to identify and characterize the effectiveness and safety of novel probiotic strains to control foodborne pathogens[J]. Frontiers in Microbiology, 2019, 10: 1108. DOI:10.3389/fmicb.2019.01108 |
| [3] |
蔺方瑞. 屎肠球菌BZ2所产抑菌物质的特性研究[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2017. LIN F R. The characteristics of antibacterial substance produced by Enterococcus faecizum BZ2[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2017. (in Chinese) |
| [4] |
ROSELLI M, FINAMORE A, BRITTI M S, et al. The novel porcine Lactobacillus sobrius strain protects intestinal cells from enterotoxigenic Escherichia coli K88 infection and prevents membrane barrier damage[J]. The Journal of Nutrition, 2007, 137(12): 2709-2716. DOI:10.1093/jn/137.12.2709 |
| [5] |
敖翔, 张立泰, 李元凤, 等. 不同营养水平饲粮添加屎肠球菌对断奶仔猪生长性能、养分消化率和粪便有害气体的影响[J]. 养猪, 2019(1): 14-16. AO X, ZHANG L T, LI Y F, et al. Effects of E. faecium supplementation at different nutritional levels on growth performance, nutrient digestibility and fecal harmful gases of weaned piglets[J]. Swine Production, 2019(1): 14-16 (in Chinese). DOI:10.3969/j.issn.1002-1957.2019.01.006 |
| [6] |
FERENCIK M, MIKES Z, SEMAN M, et al. Beneficial modification of the human intestinal microflora using orally administered enterococci[J]. High Tatras Slovac Republic, 2000, 46: 11-14. |
| [7] |
钟光, 王强, 沈一茹, 等. 枯草芽孢杆菌对肉鸡生长性能、抗氧化功能和肠道形态的影响[J]. 动物营养学报, 2020, 32(4): 1675-1683. ZHONG G, WANG Q, SHEN Y R, et al. Effects of Bacillus subtilis on growth performance, antioxidant function and intestinal morphology of broilers[J]. Chinese Journal of Animal Nutrition, 2020, 32(4): 1675-1683 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.04.026 |
| [8] |
聂炼, 张爱忠, 姜宁, 等. 不同益生菌对断奶犊牛生长性能及瘤胃发酵参数的影响[J]. 黑龙江畜牧兽医, 2019(24): 101-105. NIE L, ZHANG A Z, JIANG N, et al. Effects of different probiotics on growth performance and rumen fermentation parameters of weaned calves[J]. Heilongjiang Animal Science and Veterinary Medicine, 2019(24): 101-105 (in Chinese). |
| [9] |
李英英, 陈曦, 宋铁英. 屎肠球菌8296对断奶仔猪生长性能、营养物质表观消化率和血清生化指标的影响[J]. 福建农业学报, 2020, 35(3): 266-272. LI Y Y, CHEN X, SONG T Y. Effects of Enterococcus faecium on growth, nutrient digestibility and serum biochemistry of weaned piglets[J]. Fujian Journal of Agricultural Sciences, 2020, 35(3): 266-272 (in Chinese). |
| [10] |
丁爽, 郭春华, 张正帆, 等. 产乳酸菌素屎肠球菌B13对断奶仔猪生长性能、养分消化率、血清免疫指标及粪便微生物菌群的影响[J]. 畜牧兽医学报, 2017, 48(10): 1902-1911. DING S, GUO C H, ZHANG Z F, et al. Effects of Enterococcus faecium B13 yielding bacteriocin on growth performance, nutrient digestibility, serum immune indexes and fecal microbiota of weaned piglets[J]. Acta Veterinaria Et Zootechnica Sinica, 2017, 48(10): 1902-1911 (in Chinese). DOI:10.11843/j.issn.0366-6964.2017.10.013 |
| [11] |
符运勤, 刁其玉, 屠焰. 益生菌对0~52周龄中国荷斯坦后备牛生长发育的影响[J]. 中国奶牛, 2012(15): 8-12. FU Y Q, DIAO Q Y, TU Y. Effect of probiotics on growth and development of 0 to 52-week-old in Chinese Holstein replacement cattle[J]. China Dairy Cattle, 2012(15): 8-12 (in Chinese). DOI:10.3969/j.issn.1004-4264.2012.15.004 |
| [12] |
李月明, 栾嘉明, 张敏, 等. 不同浓度枯草芽孢杆菌对体外瘤胃发酵特性的影响[J]. 中国畜牧兽医, 2019, 46(4): 1031-1037. LI Y M, LUAN J M, ZHANG M, et al. Effects of Bacillus subtilis on in vitro rumen fermentation characteristics[J]. China Animal Husbandry & Veterinary Medicine, 2019, 46(4): 1031-1037 (in Chinese). |
| [13] |
程连平, 董妍丽, 舒迎霜, 等. 富硒酵母和枯草芽孢杆菌对断奶羔羊生长性能、血清指标和消化功能的影响[C]//2018年全国养羊生产与学术研讨会论文集. 兰州: 中国畜牧兽医学会养羊学分会, 2018: 75. CHENG L P, DONG Y L, SHU Y S, et al. Effects of selenium-enriched yeast and Bacillus subtilis on growth performance, serum indices, digestive function of lambs[C]//Proceedings of the 2018 National Sheep Production and Academic Symposium. Lanzhou: Sheep Breeding Branch of Chinese Society of Animal Science and Veterinary Medicine, 2018: 75. (in Chinese) |
| [14] |
范利霞. 复合微生态制剂的研制及其对反刍动物免疫机能的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2010. FAN L X. The development of composite probiotics on ruminant animals and immunity function[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2010. (in Chinese) |
| [15] |
马满鹏, 王炳, 刁其玉, 等. 益生菌在犊牛饲料中的运用[J]. 饲料工业, 2018, 39(17): 50-53. MA M P, WANG B, DIAO Q Y, et al. The application of probiotics in calf feed[J]. Feed Industry, 2018, 39(17): 50-53 (in Chinese). |
| [16] |
白天天, 崔浩然, 蒋辰宇, 等. 体外产气法比较不同活力屎肠球菌对绵羊瘤胃体外发酵的影响[J]. 动物营养学报, 2021, 33(11): 6483-6491. BAI T T, CUI H R, JIANG C Y, et al. Comparison of effects of Enterococcus faecium with different activities on rumen in vitro fermentation in sheep using in vitro gas production method[J]. Chinese Journal of Animal Nutrition, 2021, 33(11): 6483-6491 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.11.047 |
| [17] |
孙康, 刘绘汇, 范慧玉, 等. 枯草芽孢杆菌对7~28日龄羔羊生长和器官发育及肌肉脂肪酸的影响[J]. 畜牧兽医学报, 2021, 52(9): 2510-2521. SUN K, LIU H H, FAN H Y, et al. Effects of Bacillus subtilis on growth performance, organs development and muscle fatty acids in 7 to 28 days old lambs[J]. Acta Veterinaria Et Zootechnica Sinica, 2021, 52(9): 2510-2521 (in Chinese). |
| [18] |
卢佳伟, 王金刚, 高琴, 等. 不同益生菌对断奶山羊生长性能、血清生化指标以及粪便菌群的影响[J]. 动物营养学报, 2021, 33(5): 2752-2764. LU J W, WANG J G, GAO Q, et al. Effects of different probiotics on growth performance, serum biochemical indexes and fecal microflora of weaned goats[J]. Chinese Journal of Animal Nutrition, 2021, 33(5): 2752-2764 (in Chinese). |
| [19] |
乌日勒格. 日粮中添加枯草芽孢杆菌对育肥羊生长性能、血液指标及瘤胃微生物的影响[D]. 硕士学位论文. 呼和浩特: 内蒙古农业大学, 2019. WU R L G. Adding Bacillus subtilts to the diet to improve the growth performance of the finishing sheep, blood indicators and effects of rumen microbes[D]. Master's Thesis. Hohhot: Inner Mongolia Agricultural University, 2019. (in Chinese) |
| [20] |
佚名. 中华人民共和国农业行业标准——肉羊饲养标准NY/T816—2004[J]. 湖南饲料, 2006(6): 9-15. An on. Agricultural industry standard of the people's republic of China-sheep feeding standard NY/T816—2004[J]. Hunan Feed, 2006(6): 9-15 (in Chinese). |
| [21] |
钱文熙, 郭雪峰, 张苏江. 动物营养与饲料学实践教程[M]. 北京: 中国质检出版社, 2012: 22-39. QIAN W X, GUO X F, ZHANG S J. Practical course of animal nutrition and feed science[M]. Beijing: China Quality Inspection Press, 2012: 22-39 (in Chinese). |
| [22] |
蒋辰宇. 甘草酸单铵盐对绵羊瘤胃甲烷产生的关键菌群、相关代谢产物及血液生化指标的影响[D]. 硕士学位论文. 阿拉尔: 塔里木大学, 2021. JIANG C Y. The effect of glycyrrhizic acid monoammonium salt on the key bacteria, related metabolites and blood physiological indexes of methane production in sheep[D]. Master's Thesis. Alaer: Tarim University, 2021. (in Chinese) |
| [23] |
郭雪峰, 尹雪, 刘俊峰, 等. 葡萄藤叶青贮中乳酸菌的分离与鉴定[J]. 生物资源, 2019, 41(1): 75-81. GUO X F, YIN X, LIU J F, et al. Isolation and identification of lactic acid bacteria in the silage of grape vine leaves[J]. Biotic Resources, 2019, 41(1): 75-81 (in Chinese). |
| [24] |
苏利红, 曹雨莉, 李飞, 等. 高效液相色谱测定山羊瘤胃液挥发性脂肪酸条件优化的研究[J]. 动物医学进展, 2013, 34(8): 61-65. SU L H, CAO Y L, LI F, et al. Optimizing condition of high performance liquid chromatography for detecting volatile fatty acids in goat rumen fluid[J]. Progress in Veterinary Medicine, 2013, 34(8): 61-65 (in Chinese). DOI:10.3969/j.issn.1007-5038.2013.08.012 |
| [25] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010(6): 37. FENG Z C, GAO M. Improvement of colorimetric method for determination of ammonia nitrogen content in rumen fluid[J]. Animal Husbandry and Feed Science, 2010(6): 37 (in Chinese). DOI:10.3969/j.issn.1672-5190.2010.06.015 |
| [26] |
王建国, 闫素梅, 杨朋飞, 等. 微生态制剂对奶牛产奶性能及日粮营养物质消化率的影响[J]. 畜牧与饲料科学, 2011, 32(Z1): 171-173. WANG J G, YAN S M, YANG P F, et al. Effects of probiotics on milk performance and nutrient digestibility of dairy cows[J]. Animal Husbandry and Feed Science, 2011, 32(Z1): 171-173 (in Chinese). |
| [27] |
TAMEHIRO N, OKAMOTO-HOSOYA Y, OKAMOTO S, et al. Bacilysocin, a novel phospholipid antibiotic produced by Bacillus subtilis 168[J]. Antimicrobial Agents and Chemotherapy, 2002, 46(2): 315-320. DOI:10.1128/AAC.46.2.315-320.2002 |
| [28] |
张董燕, 季海峰, 徐炜玲. 益生菌对动物肠道微生物生态学影响的研究进展[J]. 中国畜牧兽医, 2007, 34(3): 15-18. ZHANG D Y, JI H F, XU W L. The effect of probiotics on the intestine microbial ecology of animals[J]. China Animal Husbandry & Veterinary Medicine, 2007, 34(3): 15-18 (in Chinese). DOI:10.3969/j.issn.1671-7236.2007.03.004 |
| [29] |
何韵秋, 刘程, 陆琴月, 等. 复合益生菌对生长期湖羊生长性能、养分表观消化率和血液生化指标的影响[J]. 中国畜牧杂志, 2020, 56(4): 110-114. HE Y Q, LIU C, LU Q Y, et al. Effects of compound probiotics on growth performance, apparent digestibility and blood parameters of growing Hu sheep[J]. Chinese Journal of Animal Science, 2020, 56(4): 110-114 (in Chinese). |
| [30] |
李光梅, 南木甲, 祁全青, 等. 微生态制剂对青海细毛羊营养物质消化率、屠宰性能和肉品质的影响[J]. 黑龙江畜牧兽医, 2015(24): 59-60, 63. LI G M, NAN M J, QI Q Q, et al. Effects of microecological agents on nutrient digestibility, slaughter performance and meat quality of Qinghai fine-wool sheep[J]. Heilongjiang Animal Science and Veterinary Medicine, 2015(24): 59-60, 63 (in Chinese). |
| [31] |
QIAO G H, SHAN A S, MA N, et al. Effect of supplemental Bacillus cultures on rumen fermentation and milk yield in Chinese Holstein cows[J]. Journal of Animal Physiology and Animal Nutrition, 2010, 94(4): 429-436. |
| [32] |
VAN HOUTERT M F J. The production and metabolism of volatile fatty acids by ruminants fed roughages: a review[J]. Animal Feed Science and Technology, 1993, 43(3/4): 189-225. |
| [33] |
李茂, 字学娟, 吕仁龙, 等. 添加乳酸菌和纤维素酶对王草青贮品质和瘤胃降解率的影响[J]. 中国畜牧杂志, 2020, 56(7): 161-165. LI M, ZI X J, LYU R L, et al. Effects of lactic acid bacteria and cellulase addition on the quality and rumen degradation rate of kinggrass silage[J]. Chinese Journal of Animal Science, 2020, 56(7): 161-165 (in Chinese). |
| [34] |
KIM S W, STANDORF D G, ROMAN-ROSARIO H, et al. Potential use of Propionibacterium acidipropionici, strain DH42, as a direct-fed microbial for cattle[J]. Journal of Animal Science, 2000, 78(Suppl.1): 292. |
| [35] |
李吉楠. 体外法研究纳豆枯草芽孢杆菌对瘤胃发酵及功能细菌数量的影响[D]. 硕士学位论文. 兰州: 甘肃农业大学, 2014. LI J N. Effect of Bacillus subtilis natto on rumen fermentation and functional bacteria in vitro[D]. Master's Thesis. Lanzhou: Gansu Agricultural University, 2010. (in Chinese) |
| [36] |
苏勇华, 方雷, 应璐, 等. 枯草芽孢杆菌对多浪羊消化率、瘤胃发酵参数及血液指标的影响[J]. 江苏农业科学, 2018, 46(8): 162-166. SU Y H, FANG L, YING L, et al. Effects of Bacillus subtilis on nutrient digestibility, rumen fermentation and blood indices of Duolang sheep[J]. Jiangsu Agricultural Sciences, 2018, 46(8): 162-166 (in Chinese). |
| [37] |
王淑玲, 王后福, 盖叶顶, 等. 反刍动物生成VFA的研究进展[J]. 中国草食动物科学, 2019, 39(5): 46-49. WANG S L, WANG H F, GAI Y D, et al. Advances in research on the production of VFA by ruminants[J]. China Herbivore Science, 2019, 39(5): 46-49 (in Chinese). DOI:10.3969/j.issn.2095-3887.2019.05.011 |
| [38] |
TAMATE H, MCGILLIARD A D, JACOBSON N L, et al. Effect of various dietaries on the anatomical development of the stomach in the calf[J]. Journal of Dairy Science, 1962, 45(3): 408-420. DOI:10.3168/jds.S0022-0302(62)89406-5 |
| [39] |
赵超, 马广明, 吕静怡, 等. 添加乳酸菌和纤维素酶对豆渣与桑叶混贮品质及体外瘤胃发酵特性的影响[J]. 动物营养学报, 2021, 33(4): 2168-2177. ZHAO C, MA G M, LV J Y, et al. Effects of adding lactic acid bacteria and cellulase on quality of mixed silage of soybean residue and mulberry leaves and rumen fermentation characteristics in vitro[J]. Chinese Journal of Animal Nutrition, 2021, 33(4): 2168-2177 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.04.036 |
| [40] |
丁洪涛, 夏冬华, 秦珊珊, 等. 枯草芽孢杆菌对奶牛体外瘤胃发酵的影响[J]. 饲料研究, 2012(1): 57-59. DING H T, XIA D H, QIN S S, et al. Effect of Bacillus subtilis on in vitro rumen fermentation of dairy cows[J]. Feed Research, 2012(1): 57-59 (in Chinese). DOI:10.3969/j.issn.1002-2813.2012.01.020 |
| [41] |
李岚捷, 成述儒, 刁其玉, 等. 不同NFC/NDF水平饲粮对犊牛瘤胃发酵参数和微生物区系多样性的影响[J]. 畜牧兽医学报, 2017, 48(12): 2347-2357. LI L J, CHENG S R, DIAO Q Y, et al. Effects of diets with different NFC/NDF levels on the rumen fermentation parameters and bacterial community in male calves[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(12): 2347-2357 (in Chinese). DOI:10.11843/j.issn.0366-6964.2017.12.014 |
| [42] |
SYLVESTER J T, KARNATI S K R, YU Z T, et al. Development of an assay to quantify rumen ciliate protozoal biomass in cows using real-time PCR[J]. The Journal of Nutrition, 2004, 134(12): 3378-3384. DOI:10.1093/jn/134.12.3378 |
| [43] |
KRUMHOLZ L R, FORSBERG C W, VEIRA D M. Association of methanogenic bacteria with rumen protozoa[J]. Canadian Journal of Microbiology, 1983, 29(6): 676-680. DOI:10.1139/m83-110 |
| [44] |
CHAJI M, MOHAMMADABADI T, AGHAEI A. Fermenting cell walls of processed sugarcane pith by ruminal bacteria, protozoa and fungi[J]. International Journal of Agriculture & Biology, 2011, 13(2): 283-286. |
| [45] |
刘宇阳. 复合益生菌制剂对波尔山羊育肥效果和胃肠道微生物的影响[D]. 硕士学位论文. 杨凌: 西北农林科技大学, 2021. LIU Y Y. Effects of compound probiotics on fattening performance and gastrointestinal microorganisms of Boer goats[D]. Master's Thesis. Yangling: Northwest A&F University, 2021. (in Chinese) |
| [46] |
TREMAROLI V, BÄCKHED F. Functional interactions between the gut microbiota and host metabolism[J]. Nature, 2012, 489(7415): 242-249. |
| [47] |
SHIN N R, WHON T W, BAE J W. Proteobacteria: microbial signature of dysbiosis in gut microbiota[J]. Trends in Biotechnology, 2015, 33(9): 496-503. |
| [48] |
AUFFRET M D, DEWHURST R J, DUTHIE C A, et al. The rumen microbiome as a reservoir of antimicrobial resistance and pathogenicity genes is directly affected by diet in beef cattle[J]. Microbiome, 2017, 5(1): 159. |
| [49] |
吴璞, 曹旭亮, 王虎成, 等. 红豆草茬地放牧对湖羊和小尾寒羊生长性能、瘤胃内环境参数及微生物区系的影响[J]. 动物营养学报, 2022, 34(3): 1730-1742. WU P, CAO X L, WANG H C, et al. Effects of grazing on stubble sainfoin pasture on growth performance, rumen environmental parameters and microflora of Hu sheep and small-tailed Han sheep[J]. Chinese Journal of Animal Nutrition, 2022, 34(3): 1730-1742 (in Chinese). |
| [50] |
陈相如. 微生态制剂对断奶羔羊胃肠道菌群、机体免疫和人工感染球虫的影响[D]. 硕士学位论文. 郑州: 河南农业大学, 2021. CHEN X R. Effects of probiotics on gastrointestinal microflora, body immunity and artificial infection of coccidia in weaned lambs[D]. Master's Thesis. Zhengzhou: Henan Agricultural University, 2021. (in Chinese) |
| [51] |
LI F Y, GUAN L L. Metatranscriptomic profiling reveals linkages between the active rumen microbiome and feed efficiency in beef cattle[J]. Applied and Environmental Microbiology, 2017, 83(9): e00061-17. |
| [52] |
ZHU Y X, WANG Z S, HU R, et al. Comparative study of the bacterial communities throughout the gastrointestinal tract in two beef cattle breeds[J]. Applied Microbiology and Biotechnology, 2021, 105(1): 313-325. |
| [53] |
COX L M, YAMANISHI S, SOHN J, et al. Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences[J]. Cell, 2014, 158(4): 705-721. |
| [54] |
AN D D, DONG X Z, DONG Z Y. Prokaryote diversity in the rumen of yak (Bos grunniens) and Jinnan cattle (Bos taurus) estimated by 16S rDNA homology analyses[J]. Anaerobe, 2005, 11(4): 207-215. |
| [55] |
芦岩. 体外产气与尼龙袋法筛选棉秆与甜菜渣混贮最佳组合的研究[D]. 硕士学位论文. 石河子: 石河子大学, 2020. LU Y. Study on screening the best combination of cotton stalk and sugar beet residue by in vitro gas production and nylon bag method[D]. Master's Thesis. Shihezi: Shihezi University, 2020. (in Chinese) |




