2. 红寺堡区天源良种羊繁育养殖有限公司, 吴忠 751900
2. Hongsibu District Tianyuan Well-Bred Sheep Breeding Co., Ltd., Wuzhong 751900, China
宁夏得天独厚的天然地理环境,培育了滩羊这一独特的绵羊优良品种,其肉质细嫩、无膻味、味道鲜美,深受消费者推崇。自2003年起,为保护和恢复荒漠化草原生产力,宁夏地区实行全区禁牧,滩羊生产方式由放牧转为舍饲,导致滩羊胴体品质和肉品质下降,严重影响了滩羊产业的健康持续发展。家畜肌内脂肪与肉质的多汁性、嫩度和风味等肉品质指标密切相关,是高档肉的重要指标[1]。而内脏和皮下脂肪占身体脂肪组织的绝大多数且食用价值较低,过度发育会影响胴体品质。因此,特异性地增加肌内脂肪含量,是改善胴体品质的有效方案。
反刍动物各部位脂肪沉积包括脂肪细胞增殖和肥大2个过程,不同部位脂肪组织的发育存在特定的时序性,在妊娠中期内脏脂肪细胞增殖最先启动,出生后内脏脂肪细胞增殖基本停止;皮下脂肪细胞的增殖稍晚,介于胎儿中晚期至出生阶段;而肌内脂肪细胞的增殖主要集中在出生前后至断奶期[2-4]。因此出生至断奶是反刍家畜肌内脂肪细胞发育的关键窗口期。在脂肪组织的形成过程中,尽管新的脂肪细胞可以终生生成,但随着动物年龄增长,脂肪干细胞和祖细胞密度逐渐降低,脂肪细胞的形成能力随之减弱[5],在肌内脂肪细胞增殖的关键窗口期,通过靶向营养调控能够提高肌内脂肪细胞增殖,为育肥期通过脂肪细胞肥大而提高肌内脂肪含量打下基础。维生素A是动物维持正常生理功能所必需的一类脂溶性维生素,经肠道摄取后约70%储存于肝脏,通过淋巴和血液运输到机体各组织器官相应靶位点发挥其生理作用[6]。维生素A在动物机体内主要以视黄醇、视黄醛和视黄酸3种衍生物的形式存在[7]。在大多数细胞中,视黄酸在与细胞视黄酸结合蛋白Ⅱ结合后被转运至细胞核,并通过配体诱导激活特定转录因子调节基因转录[8],发挥着细胞增殖、分化和稳态调节等生物学效应[9]。Peng等[10]研究发现,犊牛出生后每天口服45 000 IU维生素A,促进了犊牛2月龄时前脂肪细胞和肌肉的发育,且第45天时试验组体重显著高于对照组;另有研究表明,在犊牛出生当天肌肉注射30万IU维生素A,上调了第45天和断奶时(270日龄)背最长肌锌指蛋白423(ZFP423)和过氧化物酶体增殖物激活受体γ(PPARγ)等在转录水平的表达量,同时进一步促进了育肥牛后期肌内脂肪的生成[11]。因此,本研究以哺乳期滩羔羊为试验对象,探究维生素A对哺乳期滩羔羊生长性能、抗氧化能力、血清脂质代谢指标及肌内脂肪沉积相关基因表达的影响,为维生素A在肉羊养殖中的广泛应用提供参考。
1 材料与方法 1.1 试验设计选用健康、胎次和体重[(46.83±1.30) kg]相近的经产滩羊母羊60只,采用同期发情和人工授精处理。妊娠母羊分娩后选择出生日期、体重[(4.38±0.23) kg]相近的健康滩羔羊45只,随机分为3个组,每组3个重复(圈),每个重复5只羔羊。在正常哺乳的基础上,3组羔羊在1日龄和1月龄分别灌服0(对照组,CON组)、30 000(低剂量维生素A组,LVA组)和60 000 IU(高剂量维生素A组,HVA组)维生素A。维生素A含量为5×105 IU/g。将维生素A粉剂微粒溶入全脂牛奶中,37 ℃缓慢加热至完全溶解,倒入人工自制奶瓶,CON组仅灌服牛奶。牛奶[干物质(DM)含量12.5%、乳脂含量4.6%和乳蛋白含量3.8%]饲喂前采用巴氏杀菌器灭菌。羔羊和母羊统一编号并同栏管理。参考NRC(2007)设计母羊基础饲粮,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验羊舍为通风良好的半开放式羊舍。正试期为分娩后至羔羊断奶(70日龄)。试验母羊每天08:00和16:00分2次饲喂,自由饮水。圈舍内一侧设羔羊栏、只限羔羊自由出入,在栏内安放料槽,槽上安装横杆防止羔羊进入污染饲粮。试验羔羊统一在30日龄开始训练采食开食料,适应期3 d内羔羊自由采食,少喂勤添。33~50日龄、51~70日龄每天每只羔羊分别添加150和200 g开食料。根据羊场常规操作程序进行消毒、免疫和保健。
1.3 样品采集与指标测定 1.3.1 饲粮成分测定分别参照中华人民共和国国家标准GB/T 6435—1986、GB/T 6432—1994、GB/T 6433—2006、GB/T 6436—2002和GB/T 6437—2002推荐的方法测定饲粮中DM、粗蛋白质(CP)、粗脂肪(EE)、钙(Ca)和磷(P)含量;根据张丽英[12]编著的《饲料分析及饲料质量检测技术》测定饲粮中有机物(OM)、粗纤维(CF)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)和粗灰分(Ash)含量;利用氧弹测热仪测定饲粮样品总能(GE)后根据Valença等[13]的方法计算饲粮代谢能(ME)。饲粮ME计算公式如下:
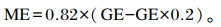
|
羔羊出生时擦干体表残留胎液后个体称重为出生重;羔羊断奶当天进行个体称重为断奶重;羔羊直立时肩胛骨最高点到地面垂直距离为体高;从肩端至坐骨结节的直线距离为体斜长;肩胛骨后缘绕胸1周的长度为胸围。
1.3.3 血清收集与分析在断奶当天,每组随机选取3只羔羊颈静脉采集血液20 mL,3 000 r/min离心15 min分离血清,将得到的血清分为2份,一份置于-20 ℃冰箱保存用于检测血清抗氧化指标和血清脂质代谢指标,另一份置于-80 ℃的黑暗环境中保存(防止类维生素A异构化和降解),用于血清中类维生素A含量的检测。
采用酶标仪和南京建成生物工程研究所生产的试剂盒测定血清总抗氧化能力(T-AOC)、丙二醛(MDA)含量以及谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性。采用全自动生化仪和深圳迈瑞生物医疗电子股份有限公司生产的试剂盒测定血清葡萄糖(GLU)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)含量。上述试验步骤均严格按照试剂盒说明书进行。
参照Kim等[14]的方法提取类维生素A,利用高效液相色谱测定视黄醇、视黄醛和视黄酸的含量。色谱条件:Luna C18液相色谱柱(150 mm×3 mm×3 mm,00G-4252-E0,Phenomenex,美国),流动相(65%甲醇水溶液),流速1.0 mL/min。视黄醇、视黄醛和视黄酸检测波长分别为325、340和385 nm,对应标准品(Sigma-Aldrich,美国)货号分别为R7632、R2500和302-79-4。
1.3.4 维生素A代谢相关酶和脂肪沉积相关基因mRNA相对表达量的测定在断奶当天,每组随机选取3只羔羊屠宰,取羔羊背最长肌样品放入液氮中保存,用于分析ZFP423和PPARγ mRNA相对表达量,同时测定参与维生素A代谢相关的3种酶的mRNA相对表达量,包括乙醇脱氢酶4(ADH4)、乙醇脱氢酶5(ADH5)和乙醛脱氢酶1A1(ALDH1A1)。采用液氮研磨硅基质吸附柱法从组织中抽提总RNA,然后用去氧核糖核酸酶(DNase)(NEB,Ipswich,MA,美国)处理去除DNA。使用HiScript 1st Strand cDNA Synthesis Kit(cDNA第1链合成试剂盒)对所提取的RNA进行逆转录合成cDNA。根据AceQ qPCR SYBR Green Master Mix (without ROX)试剂盒使用说明建立实时荧光定量PCR(qRT-PCR)体系。使用Bio-Rad CFX96仪器检测系统进行qRT-PCR试验。定量检测完毕后,采用2-ΔΔCt法测定基因的相对表达量。用甘油醛-3-磷酸脱氢酶(GAPDH)作为内参基因。引物使用Premier 5.0软件设计,引物序列见表 2。
|
|
表 2 引物序列 Table 2 Primer sequences |
试验数据使用Excel 2010记录并作初步处理,采用SAS 8.2软件进行单因素方差分析(one-way ANOVA),组间差异采用Duncan氏法进行多重比较,P < 0.05表示差异显著,0.05≤P < 0.10表示差异有显著趋势。
2 结果 2.1 维生素A对哺乳期滩羔羊生长性能的影响由表 3可知,3个组羔羊的初生重和胸围之间无显著差异(P>0.05);LVA组和HVA组羔羊的断奶重显著高于CON组(P < 0.05);LVA组和HVA组羔羊的体高和体斜长虽与CON组相比无显著差异(P>0.05),但具有提高的趋势(0.05≤P < 0.10)。
|
|
表 3 维生素A对哺乳期滩羔羊生长性能的影响 Table 3 Effects of vitamin A on growth performance of lactating Tan lambs |
由表 4可知,与CON组相比,LVA组和HVA组血清视黄酸含量显著提高(P < 0.05);HVA组血清视黄醇含量显著降低(P < 0.05)。
|
|
表 4 维生素A对哺乳期滩羔羊血清类维生素A含量的影响 Table 4 Effect of vitamin A on serum retinoid content of lactating Tan lambs |
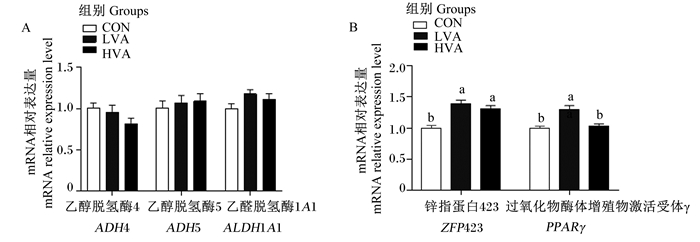
由图 1可知,与CON组相比,LVA组和HVA组羔羊背最长肌维生素A代谢相关酶(ADH4、ADH5和ALDH1A1)的mRNA相对表达量均无显著差异(P>0.05)。与CON组相比,LVA组羔羊背最长肌ZFP423和PPARγ mRNA相对表达量均显著提高(P < 0.05);HVA组羔羊背最长肌ZFP423 mRNA相对表达量显著提高(P < 0.05),但背最长肌PPARγ mRNA相对表达量无显著差异(P>0.05)。
|
数据柱形标注不同小写字母表示差异显著(P < 0.05)。 Value columns with different small letters mean significant difference (P < 0.05). 图 1 维生素A对哺乳期滩羔羊背最长肌维生素A代谢相关酶和脂肪沉积相关基因mRNA相对表达量的影响 Fig. 1 Effects of vitamin A on mRNA relative expression levels of vitamin A metabolism-related enzymes and fat deposition-related genes in longissimus dorsi of lactating Tan lambs |
由表 5可知,与CON组相比,LVA组和HVA组羔羊血清胆固醇、甘油三酯和低密度脂蛋白含量显著提高(P < 0.05),血清葡萄糖含量无显著差异(P>0.05),但具有上升的趋势(0.05≤P < 0.10)。
|
|
表 5 维生素A对哺乳期滩羔羊血清脂质代谢指标的影响 Table 5 Effects of vitamin A on serum lipid metabolism indices of lactating Tan lambs |
由表 6可知,与CON组相比,LVA组和HVA组羔羊血清T-AOC和SOD活性显著提高(P < 0.05),血清MDA含量显著降低(P < 0.05);LVA组血清GSH-Px活性显著提高(P < 0.05)。
|
|
表 6 维生素A对哺乳期滩羔羊血清抗氧化指标的影响 Table 6 Effects of vitamin A on serum antioxidant indices of lactating Tan lambs |
动物体的生长发育除受到遗传、激素水平和生长环境等众多因素影响以外,营养供给水平和肠道功能状态对动物自身生长也起到关键性作用。前人研究发现,补充维生素A可以促进肠道上皮细胞的发育,同时有助于肠道微生物稳定进而提高动物对营养物质的消化和吸收[15-17]。本试验中,哺乳期滩羔羊灌服维生素A能够显著提高其断奶重,且体高和体斜长有上升趋势,这表明维生素A的添加对羔羊生长有明显的促进作用。这可能是因为维生素A在到达肠道后,能够促进肠道杯状细胞合成肠道黏蛋白。黏蛋白是高度糖基化的蛋白,其糖基化区域含有离子化的酸性基团,使得肠道pH降低,而酸性条件有利于肠道上皮细胞发育和肠道消化酶活性提高,进而上调肠道对营养物质的利用效率[18]。此外,维生素A具有较强的抗氧化和清除机体自由基的能力,能有效提高机体免疫能力,防止不饱和脂肪酸和过氧化物对机体造成的损伤[19],减少动物应激反应,促进动物生长。
3.2 维生素A对哺乳期滩羔羊肌内脂肪沉积相关基因表达的影响ZFP423参与细胞分化、增殖和凋亡等多种重要生命过程,在真核生物中广泛表达。近年来,研究者发现含有锌指模体的转录因子在调控脂肪生成过程中发挥着关键作用。以小鼠为模型,ZFP423已被确定为脂肪生成初始阶段的关键调节因子,并进一步与PPARγ协调以调节脂肪生成[20-21]。在另一项研究中,ZFP423可调节脂肪细胞的生成已被证实[22]。研究表明,维生素A在动物体内通过其活性代谢产物视黄醇、视黄醛和视黄酸促进脂肪形成,并在成脂定型、成脂分化和脂质蓄积的每个阶段都发挥重要作用,同时视黄酸也是决定脂肪细胞中ZFP423表达的重要因素[11]。ALDH1A1能够促进视黄醛生成视黄酸,在缺乏ALDH1A1的小鼠体内ZFP423和PPARγ表达水平下调约70%[7]。
本研究中,与CON组相比,LVA组和HVA组羔羊背最长肌ZFP423 mRNA相对表达量显著提高,LVA组羔羊背最长肌PPARγ mRNA相对表达量显著提高。这表明新生滩羔羊灌服维生素A能够通过诱导ZFP423和PPARγ等脂肪沉积相关基因的表达,特异性地增强肌肉内脂肪细胞数量。理论而言,更大剂量的维生素A处理,将导致血清视黄酸含量更高,从而进一步上调ZFP423和PPARγ的表达。但在本研究中,相对于高剂量处理,低剂量维生素A处理对羔羊背最长肌ZFP423和PPARγ mRNA相对表达量的影响更显著,同时LVA组血清视黄酸含量也较高。视黄醇通过ADH4和ADH5转化为视黄醛,而视黄醛通过ALDH1A1生成视黄酸[7]。此外,本试验检测了背最长肌参与维生素A代谢相关酶基因的表达,发现各组相关酶基因表达方面无显著差异。因此,相关酶基因的表达与血清视黄酸差异无关。所以,可能由于第1次高剂量维生素A灌服使肝脏储存能力增加,导致第2次维生素A灌服后的1个月高剂量组仅有少量的维生素A用于代谢,进而降低了机体对维生素A的总代谢率[23]。这是HVA组血清视黄酸含量低于LVA组的一个可能。此外,高剂量的维生素A可加速血清视黄酸分解代谢和清除,从而导致HVA组在灌服维生素A 1个月后的血清视黄酸含量更低,这是一种“过度补偿”现象[24]。至于HVA组哺乳期滩羔羊肌内PPARγ mRNA的表达较CON组未呈现显著差异,可能是由于PPARγ mRNA表达还受其他通路的影响。
3.3 维生素A对哺乳期滩羔羊血清脂质代谢指标的影响葡萄糖被认为是评价动物机体能量状态的标志物。研究表明,脂肪酸在氧化过程中受到阻碍时,往往会打破机体固有的血糖稳定状态出现低血糖症状[25]。相反,血糖升高时,葡萄糖又可以转化为脂肪储存。本试验结果表明,LVA组和HVA组羔羊血清葡萄糖含量均高于CON组,表明维生素A可能通过影响动物机体能量代谢来调控哺乳期滩羔羊脂肪沉积。
研究表明,维生素A及其代谢产物可以通过调节动物体脂质代谢相关基因表达以及脂肪细胞体积或数量,最终实现对机体脂类代谢的调控作用[26-27]。本试验中,羔羊血清低密度脂蛋白、甘油三酯和总胆固醇含量与血清视黄酸含量呈正相关,且与CON组相比整体呈上升趋势。Yehya等[28]研究发现,过量维生素A摄入的人群,血清低密度脂蛋白含量显著升高,同时机体表现出高甘油三酯血症。维生素A通过促进肝脏合成和分泌甘油三酯,进而提高血清甘油三酯含量[29]。基于对小鼠的研究,维生素A缺乏会引起小鼠血清高密度脂蛋白、甘油三酯和胆固醇含量的降低[30-31]。此外,另有报道指出,维生素A及其衍生物促进机体脂肪合成能力强于促进机体脂肪分解能力[32]。上述研究结果与本试验研究结果相似,表明哺乳期滩羔羊灌服维生素A可能会促进机体脂肪的合成。
3.4 维生素A对哺乳期滩羔羊血清抗氧化指标的影响动物体正常生理活动中,机体内各种生化反应会产生造成机体氧化损伤的自由基。但动物机体内存在自身抗氧化防御体系,即酶促体系和非酶促体系,其能切断脂质链式反应,避免自由基产生过剩,维持机体氧化稳定,减少细胞氧化损伤。机体内的抗氧化酶,包括SOD、CAT和GSH-Px,共同组成细胞抵抗自由基攻击的内源性屏障,其活性反映机体消除自由基能力的强弱[33]。T-AOC是反映动物体自身抗氧化防御系统对自由基代谢状况的重要参数;体现动物机体自身酶促体系和非酶促体系抵抗氧化应激能力的重要指标。MDA是脂质过氧化物代谢过程中的最终产物,可间接反映细胞膜结构和功能受损程度。SOD是一种特殊的金属蛋白质,它能够降低超氧阴离子的稳定性,切断自由基链式反应,减少超氧化物对细胞造成的损害,而SOD在降低超氧阴离子的同时会产生少量过氧化氢和分子氧,但其产物可被CAT或GSH-Px所抵消,进而减轻自由基对细胞造成的损害[34]。GSH-Px是一种关键的解毒酶,它能抵消或清除由细胞代谢过程中产生的过氧化氢和细胞毒害物,减少机体有害物质对膜系统攻击。CAT广泛存在于动物体组织中,可避免产生过多羟基自由基,使细胞内外成分免受过氧化物酶体伤害。
研究表明,维生素A能提高机体抗氧化酶活性,增强清除自由基的能力,从而提高机体抗氧化能力[35]。韩磊等[36]证实,适量补充维生素A在提高大鼠体内维生素A储存量的同时增强机体抗氧化能力。王平[37]同样发现,母羊妊娠后期每千克饲粮维生素A添加量为1 100 IU或1 100~2 200 IU时,分别显著提高了妊娠母羊血清中SOD活性和T-AOC,而添加量为2 200 IU时显著降低妊娠母羊血清中MDA含量。本研究发现,灌服维生素A显著提高了哺乳期滩羔羊血清T-AOC和SOD活性,显著降低了血清MDA含量。在不同的维生素A营养水平下,大鼠血清中视黄酸含量与SOD活性呈正相关,与MDA含量呈负相关[38],本研究结果与之相似。以上结果表明,维生素A可提高机体抗氧化酶活性,增强其清除自由基能力,进而提高机体抗氧化能力。然而,维生素A提高机体抗氧化能力机制尚不明确。有研究认为可能与其特殊结构有关,首先维生素A是由β-白芷酮环和2分子的2-甲基丁二烯所构成的不饱和一元醇,侧链拥有4个双键,化学性质活泼,自身容易被氧化,从而有效避免或降低机体内部其他抗氧化酶的消耗[39]。另外,维生素A属于脂溶性维生素,易进入细胞膜,能够抑制细胞膜上发生的脂质过氧化反应,进而降低MDA在脂质代谢反应中的产生,间接提升机体抗氧化能力[35]。值得一提的是,本试验中,LVA组羔羊血清CAT活性以及HVA组血清CAT和GSH-Px活性较CON组无显著差异,可能是由于SOD在降低超氧阴离子的过程中产生的少量过氧化氢和分子氧消耗了CAT和GSH-Px,因此推断随着血清视黄酸含量的提高,血清CAT和GSH-Px活性有上升趋势,但有待进一步研究证实。
4 结论综上所述,灌服维生素A能够提高哺乳期滩羔羊生长性能及抗氧化能力,提高背最长肌脂肪沉积相关基因表达,并对血清脂质代谢指标有一定的影响,且以30 000 IU的添加量为宜。
| [1] |
PIAO M Y, YONG H I, LEE H J, et al. Comparison of fatty acid profiles and volatile compounds among quality grades and their association with carcass characteristics in longissimus dorsi and semimembranosus muscles of Korean cattle steer[J]. Livestock Science, 2017, 198: 147-156. DOI:10.1016/j.livsci.2017.02.021 |
| [2] |
DU M, HUANG Y, DAS A K, et al. Meat science and muscle biology symposium: manipulating mesenchymal progenitor cell differentiation to optimize performance and carcass value of beef cattle[J]. Journal of Animal Science, 2013, 91(3): 1419-1427. DOI:10.2527/jas.2012-5670 |
| [3] |
PENG D Q, SMITH S B, LEE H G. Vitamin A regulates intramuscular adipose tissue and muscle development: promoting high-quality beef production[J]. Journal of Animal Science and Biotechnology, 2021, 12(1): 34. DOI:10.1186/s40104-021-00558-2 |
| [4] |
BONNET M, CASSAR-MALEK I, CHILLIARD Y, et al. Ontogenesis of muscle and adipose tissues and their interactions in ruminants and other species[J]. Animal, 2010, 4(7): 1093-1109. DOI:10.1017/S1751731110000601 |
| [5] |
DU M, YIN J D, ZHU M J. Cellular signaling pathways regulating the initial stage of adipogenesis and marbling of skeletal muscle[J]. Meat Science, 2010, 86(1): 103-109. DOI:10.1016/j.meatsci.2010.04.027 |
| [6] |
LI Y, WONGSIRIROJ N, BLANER W S. The multifaceted nature of retinoid transport and metabolism[J]. Hepatobiliary Surgery and Nutrition, 2014, 3(3): 126-139. |
| [7] |
REICHERT B, YASMEEN R, JEYAKUMAR S M, et al. Concerted action of aldehyde dehydrogenases influences depot-specific fat formation[J]. Molecular Endocrinology, 2011, 25(5): 799-809. DOI:10.1210/me.2010-0465 |
| [8] |
DONG D, RUUSKA S E, LEVINTHAL D J, et al. Distinct roles for cellular retinoic acid-binding proteins Ⅰ and Ⅱ in regulating signaling by retinoic acid[J]. Journal of Biological Chemistry, 1999, 274(34): 23695-23698. DOI:10.1074/jbc.274.34.23695 |
| [9] |
BERRY D C, NOY N. Signaling by vitamin A and retinol-binding protein in regulation of insulin responses and lipid homeostasis[J]. Biochimica et Biophysica Acta, 2012, 1821(1): 168-176. DOI:10.1016/j.bbalip.2011.07.002 |
| [10] |
PENG D Q, JO Y H, KIM S J, et al. Oral vitamin A supplementation during neonatal stage enhances growth, pre-adipocyte and muscle development in Korean native calves[J]. Animal Feed Science and Technology, 2020, 268: 114609. DOI:10.1016/j.anifeedsci.2020.114609 |
| [11] |
MACIEL F C, MACHADO NETO O R, DUARTE M S, et al. Effect of vitamin A injection at birth on intramuscular fat development and meat quality in beef cattle[J]. Meat Science, 2022, 184: 108676. DOI:10.1016/j.meatsci.2021.108676 |
| [12] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业大学出版社, 2007. ZHANG L Y. Feed analysis and feed quality detection technology[M]. 3rd ed. Beijing: China Agricultural University Press, 2007 (in Chinese). |
| [13] |
VALENÇA R D L, SILVA SOBRINHO A G D, ROMANZINI E P, et al. Peanut meal and crude glycerin in lamb diets: meat quality and fatty acid profile[J]. Small Ruminant Research, 2020, 185: 106076. DOI:10.1016/j.smallrumres.2020.106076 |
| [14] |
KIM Y K, QUADRO L. Reverse-phase high-performance liquid chromatography (HPLC) analysis of retinol and retinyl esters in mouse serum and tissues[M]//WALKER J M. Methods in molecular biology. Totowa, NJ: Humana Press, 2010: 263-275.
|
| [15] |
XIAO L, CUI T, LIU S, et al. Vitamin a supplementation improves the intestinal mucosal barrier and facilitates the expression of tight junction proteins in rats with diarrhea[J]. Nutrition, 2019, 57: 97-108. DOI:10.1016/j.nut.2018.06.007 |
| [16] |
KHORAMABADI V, AKBARI M R, KHAJALI F, et al. Influence of xylanase and vitamin A in wheat-based diet on performance, nutrients digestibility, small intestinal morphology and digesta viscosity in broiler chickens[J]. Acta Scientiarum.Animal Sciences, 2014, 36(4): 379-384. DOI:10.4025/actascianimsci.v36i4.23910 |
| [17] |
TIAN Y, NICHOLS R G, CAI J W, et al. Vitamin A deficiency in mice alters host and gut microbial metabolism leading to altered energy homeostasis[J]. Journal of Nutritional Biochemistry, 2018, 54: 28-34. DOI:10.1016/j.jnutbio.2017.10.011 |
| [18] |
冯宇隆. 维生素A对北京鸭生长发育和肠道健康的调节作用与机理研究[D]. 博士学位论文. 北京: 中国农业科学院, 2020: 3-4. FENG Y L. Effects of vitamin A on growth performance and intestinal health as well as underlying mechanism[D]. Ph. D. Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2020: 3-4. (in Chinese) |
| [19] |
LIANG J R, DAI H, YANG H M, et al. The effect of dietary vitamin A supplementation in maternal and its offspring on the early growth performance, liver vitamin A content, and antioxidant index of goslings[J]. Poultry Science, 2019, 98(12): 6849-6856. DOI:10.3382/ps/pez432 |
| [20] |
GUPTA R K, MEPANI R J, KLEINER S, et al. Zfp423 expression identifies committed preadipocytes and localizes to adipose endothelial and perivascular cells[J]. Cell Metabolism, 2012, 15(2): 230-239. DOI:10.1016/j.cmet.2012.01.010 |
| [21] |
GUPTA R K, ARANY Z, SEALE P, et al. Transcriptional control of preadipocyte determination by Zfp423[J]. Nature, 2010, 464(7288): 619-623. DOI:10.1038/nature08816 |
| [22] |
HUANG Y, DAS A K, YANG Q Y, et al. Zfp423 promotes adipogenic differentiation of bovine stromal vascular cells[J]. PLoS One, 2012, 7(10): e47496. DOI:10.1371/journal.pone.0047496 |
| [23] |
GUGGENHEIM K, KOCH W. A liver storage test for the assessment of vitamin A[J]. Biochemical Journal, 1944, 38(3): 256-260. DOI:10.1042/bj0380256 |
| [24] |
TAGLIAFERRO A R, LEVITSKY D A. Overcompensation of food intake following brief periods of food restriction[J]. Physiology & Behavior, 1982, 29(4): 747-750. |
| [25] |
BUDICK-HARMELIN N, ANAVI S, MADAR Z, et al. Fatty acids-stress attenuates gluconeogenesis induction and glucose production in primary hepatocytes[J]. Lipids in Health and Disease, 2012, 11: 66. DOI:10.1186/1476-511X-11-66 |
| [26] |
JEYAKUMAR S M, SHERIL A, VAJRESWARI A. Chronic vitamin A-enriched diet feeding induces body weight gain and adiposity in lean and glucose-intolerant obese rats of WNIN/GR-Ob strain[J]. Experimental Physiology, 2015, 100(11): 1352-1361. |
| [27] |
TRIPATHY S, CHAPMAN J D, HAN C Y, et al. All-trans-retinoic acid enhances mitochondrial function in models of human liver[J]. Molecular Pharmacology, 2016, 89(5): 560-574. DOI:10.1124/mol.116.103697 |
| [28] |
YEHYA A, BAER J T, SMILEY W, et al. Hypervitaminosis a altering the lipid profile in a hypercholesterolemic patient[J]. Journal of Clinical Lipidology, 2009, 3(3): 205-207. DOI:10.1016/j.jacl.2009.03.001 |
| [29] |
SOLOMON L W, ERDMAN J W Jr. Vitamin A induced hypertriglyceridemia in cholesterol-fed rats[J]. Lipids, 1980, 15(3): 157-162. DOI:10.1007/BF02540962 |
| [30] |
OLIVEROS L B, DOMENICONI M A, VEGA V A, et al. Vitamin A deficiency modifies lipid metabolism in rat liver[J]. British Journal of Nutrition, 2007, 97(2): 263-272. |
| [31] |
ZHANG Y, LI R, LI Y, et al. Vitamin a status affects obesity development and hepatic expression of key genes for fuel metabolism in Zucker fatty rats[J]. Biochemistry and Cell Biology, 2012, 90(4): 548-557. |
| [32] |
CHEN W, CHEN G X. The roles of vitamin A in the regulation of carbohydrate, lipid, and protein metabolism[J]. Journal of Clinical Medicine, 2014, 3(2): 453-479. |
| [33] |
赵杰, 徐静茹, 马立, 等. 牛源复合微生态制剂的应用效果评价[J]. 动物营养学报, 2021, 33(7): 4110-4122. ZHAO J, XU J R, MA L, et al. Evaluation of application effects of bovine compound microecologic agent[J]. Chinese Journal of Animal Nutrition, 2021, 33(7): 4110-4122 (in Chinese). |
| [34] |
CURTIS S J, MORITZ M, SNODGRASS P J. Serum enzymes derived from liver cell fractions. Ⅰ. The response to carbon tetrachloride intoxication in rats[J]. Gastroenterology, 1972, 62(1): 84-92. |
| [35] |
刘宁, 崔桂山, 杨玲, 等. 冬季条件下维生素A水平对蛋鸡抗氧化能力及血清、肝脏和鸡蛋维生素A含量的影响[J]. 动物营养学报, 2015, 27(7): 2209-2214. LIU N, CUI G S, YANG L, et al. Effects of vitamin A level on antioxidant capacity in serum, vitamin a contents in serum, liver and egg of laying hens in winter[J]. Chinese Journal of Animal Nutrition, 2015, 27(7): 2209-2214 (in Chinese). |
| [36] |
韩磊, 马爱国, 梁惠. 不同剂量维生素A摄入对大鼠DNA损伤的影响[J]. 中国公共卫生, 2004, 20(8): 943-945. HAN L, MA A G, LIANG H. Influence of vitamin A intake of different dosage on DNA damage in rats[J]. Chinese Journal of Public Health, 2004, 20(8): 943-945 (in Chinese). |
| [37] |
王平. 维生素A对不同生理阶段济宁青山羊生产性能和血液指标影响的研究[D]. 硕士学位论文. 泰安: 山东农业大学, 2011. WANG P. Effects of vitamin A on growth performance and blood constituents of different physiological stage of grey goat[D]. Master's Thesis. Tai'an: Shandong Agricultural University, 2011. (in Chinese) |
| [38] |
黄鸿眉, 魏华, 江伟, 等. 不同维生素A营养状态下血清视黄醇水平与机体抗氧化能力的相关分析[J]. 第四军医大学学报, 2008, 29(10): 893-895. HUANG H M, WEI H, JIANG W, et al. Correlation analysis between serum retinol level and antioxidant abilities under different vitamin A status[J]. Journal of the Fourth Military Medical University, 2008, 29(10): 893-895 (in Chinese). |
| [39] |
马向明, 杨在宾, 杨维仁, 等. 不同水平维生素A对肉牛机体抗氧化能力的影响[J]. 畜牧兽医杂志, 2005, 24(5): 4-9. MA X M, YANG Z B, YANG W R, et al. Effects of different vitamin A level on antioxidant ability of beef cattle[J]. Journal of Animal Science and Veterinary Medicine, 2005, 24(5): 4-9 (in Chinese). |




