肠道微生物对宿主营养物质的消化、吸收及代谢起着重要的调控作用,驴作为单胃草食动物,肠道中更是存在着复杂微生物菌群且发挥着重要的生理功能[1]。肠道中菌群的建立除受到饲粮、环境和疫病等因素影响外,越来越多的研究表明,宿主肠道微生物菌群和特性与动物的遗传背景密切相关[2-3]。探究不同品种(系)动物肠道菌群差异,并同表型进行关联分析,对分筛肠道益生菌种,调控肠道菌群平衡,进而提高动物生产性能具有重要指导意义。
德州驴原产于山东省德州地区,是我国五大著名大型驴品种之一,具有优良的生产性能和稳定的遗传性能,在我国驴产业的发展和资源保护中发挥着重要作用[4-5]。根据外观和生理特征德州驴可分为三粉驴和乌头驴2个品系[6],这2个品系均被黑色毛发覆盖,但三粉驴的眼睛、鼻唇周围被毛和腹部毛色为白色。三粉驴和乌头驴除在外观表现差异外,本实验室前期研究还发现,2个品系的驴驹出生重、脏器系数、肠道长度、屠宰性状(如净肉率和净皮率)等都存在差异[7],检测2个品系的驴奶也发现,乳成分及乳中代谢物也存在明显区别[8],这表明三粉驴和乌头驴具有不同的遗传模式[9]。因此,本研究采用16S rDNA扩增子测序技术对三粉驴和乌头驴直肠菌群结构进行分析,首次研究了三粉驴和乌头驴直肠微生物组成差异的基本信息,并结合血浆生化指标结果,对这些差异与生长、抗病等的相关性进行了探讨,研究结果为了解德州驴肠道菌群提供了新的信息,同时为后续分筛德州驴肠道益生菌种、调控肠道微生态平衡、提高生产性能提供理论指导。
1 材料与方法 1.1 试验动物及样品采集选择3~5岁、体重260~300 kg健康空怀三粉驴母驴和乌头驴母驴各6头,由山东省德州驴原种场提供。试验驴自出生即养殖于同一饲养场地,饲养管理一致,均饲喂商品精料(粗蛋白质含量18.22%,粗脂肪含量1.67%,粗纤维含量4.73%),每日饲喂2次(10:00和18:00),饲喂量为体重的1.5%,粗饲料为小麦秸秆,精粗比为60 ∶ 40,自由饮水。试验用驴3个月以上未接触过抗生素治疗。
所有样本均于当日09:00—10:00饲喂前采集。颈静脉采集乙二胺四乙酸二钾抗凝血20 mL,3 000×g、4 ℃离心10 min后收集血浆,液氮冷冻保藏,用于血浆生化指标测定。直肠内容物采集方法:75%酒精对试验驴肛门周围进行消毒,试验人员戴好无菌长臂手套伸入驴直肠内,取直肠新鲜内容物迅速装入2 mL无菌冻存管,放入液氮速冻保存,运回实验室后,存放于-80 ℃冰箱以待测序。
1.2 血浆生化指标测定采用全自动生化分析仪(迈瑞,BS-420)测定血浆中葡萄糖(GLU)、甘油三酯(TG)、总蛋白(TP)、白蛋白(ALB)、总胆固醇(TC)、总胆红素(T-BIL)含量及谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、谷氨酰转肽酶(γ-GT)、肌酸激酶(CK)活性。
1.3 高通量测序DNA提取、PCR扩增、Illumina MiSeq高通量测序由上海美吉生物医药科技有限公司协助完成。生物信息学分析通过测序公司提供的云平台(https://cloud.majorbio.com)完成。采用fastp(https://github.com/OpenGene/fastp,version 0.20.0)软件对原始测序序列进行质控,使用FLASH(http://www.cbcb.umd.edu/software/flash,version 1.2.7)软件进行序列拼接;应用UPARSE软件(http://drive5.com/uparse,version 7.1),根据97%的相似度对序列进行操作分类单元(OTU)聚类并剔除嵌合体。利用RDP classifier (http://rdp.cme.msu.edu,version 2.2)对每条序列进行物种分类注释;应用MOTHUR(version 1.30.2)和QIIME(version 1.9.1)软件分析菌群的α和β多样性,R(version 3.3.1)软件分析并绘制Spearman相关性热图,BugBase(https://bugbase.cs.umn.edu/index.html)工具进行表型预测。
1.4 数据统计与分析血浆生化指标应用SPSS 22.0软件进行处理,采用Student’s t检验进行统计分析,数据以平均值±标准误表示;菌群分析采用Student’s t检验进行统计分析。P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果与分析 2.1 2个品系德州驴血浆生化指标对比分析由表 1可知,乌头驴血浆中甘油三酯、总蛋白含量显著高于三粉驴(P < 0.05),而总胆固醇含量显著低于三粉驴(P < 0.05);代谢酶活性方面,乌头驴血浆中谷草转氨酶和肌酸激酶活性显著高于三粉驴(P < 0.05),而碱性磷酸酶活性显著低于三粉驴(P < 0.05)。
|
|
表 1 2个品系德州驴血浆生化指标 Table 1 Plasma biochemical parameters in two strains of Dezhou donkeys |
所有样本共得到有效序列600 922条,碱基数目为248 914 591 bp,序列平均长度414 bp。将所得的有效序列在不同水平上进行注释,得到分类单元包括:20个门、39个纲、85个目、151个科、283个属和1 913个OTU。乌头驴、三粉驴特有的OTU数目分别为343和131个,共有的OTU数目为1 439个。
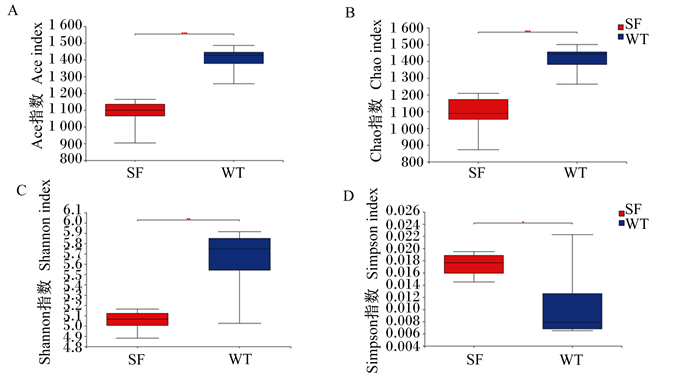
2.2.2 α多样性分析由图 1可知,乌头驴和三粉驴直肠内容物菌群α多样性指数存在显著差异(P < 0.05),乌头驴Ace指数、Chao指数和Shannon指数极显著高于三粉驴(P < 0.01),Simpson指数显著低于三粉驴(P < 0.05),表明乌头驴直肠内容物菌群更为丰富。
|
SF:三粉驴;WT:乌头驴。下图同。 ***、**表示差异极显著(P < 0.01),*表示差异显著(P < 0.05)。图 5和图 6同。 SF: Sanfen donkeys; WT: Wutou donkeys. The same as below. *** and ** mean significant difference (P < 0.01), and * mean significant difference (P < 0.05). The same as Fig. 5 and Fig. 6. 图 1 菌群α多样性指数 Fig. 1 Microbial α diversity indexes |
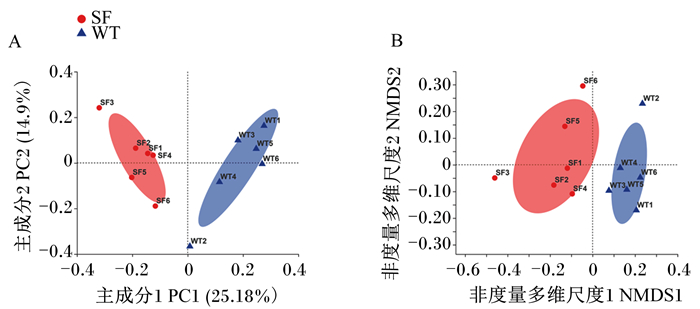
采用主成分分析法(图 2-A)和非度量多维尺度分析法(图 2-B)研究乌头驴和三粉驴直肠内容物菌群整体结构的差异。由图可知,乌头驴和三粉驴直肠内容物菌群整体结构之间区分明显,组内样品聚类程度较高,表明2个品系遗传背景对肠道菌群组成存在影响。
|
A:主成分分析principal coordinate analysis;B:非度量多维尺度分析non-metric multidimensional scaling analysis。 图 2 菌群β多样性分析 Fig. 2 Microbial β diversity analysis |
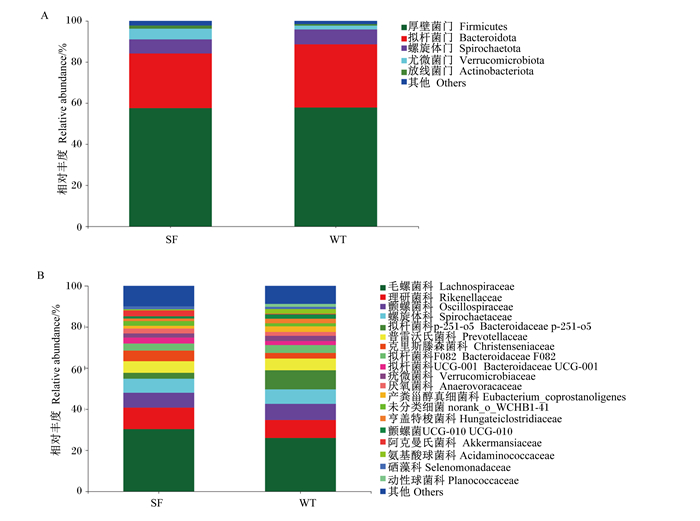
对2个品系12个样本得到的有效序列在门和科水平进行聚类并注释。由图 3-A可知,在门水平上,优势菌门5个,三粉驴和乌头驴直肠内容物微生物均以厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)为主,随后为螺旋体门(Spirochaetota)、尤微菌门(Verrucomicrobiota)和放线菌门(Actinobacteriota),且2个品系直肠菌群在门水平上没有差异。
|
图 3 门(A)和科(B)水平上直肠微生物相对丰度 Fig. 3 Relative abundance of rectal microbiota at phylum (A) and family (B) level |
由图 3-B可知,在科水平上,三粉驴和乌头驴直肠内容物排名前10的优势菌科为毛螺菌科(Lachnospiraceae)、理研菌科(Rikenellaceae)、颤螺菌科(Oscillospiraceae)、螺旋体科(Spirochaetaceae)、拟杆菌科p-251-o5(Bacteroidaceae p-251-o5)、普雷沃氏菌科(Prevotellaceae)、克里斯滕森菌科(Christenseniaceae)、拟杆菌科F082(Bacteroidaceae F082)、拟杆菌科UCG-001(Bacteroidaceae UCG-001)和疣微菌科(Verrucomicrobiaceae)。
由表 2可知,三粉驴和乌头驴直肠内容物差异菌科包括拟杆菌科(Bacteroidaceae)、产粪甾醇真细菌科(Eubacterium_coprostanoligenes)、颤螺菌科(Oscillospiraceae)、阿克曼氏菌科(Akkermansiaceae)、氨基酸球菌科(Acidaminococcaceae)和动性球菌科(Planococcaceae)等(P < 0.05)。
|
|
表 2 直肠内容物中差异性菌科相对丰度分析 Table 2 Analysis of different bacterial family relative abundance in rectum contents |
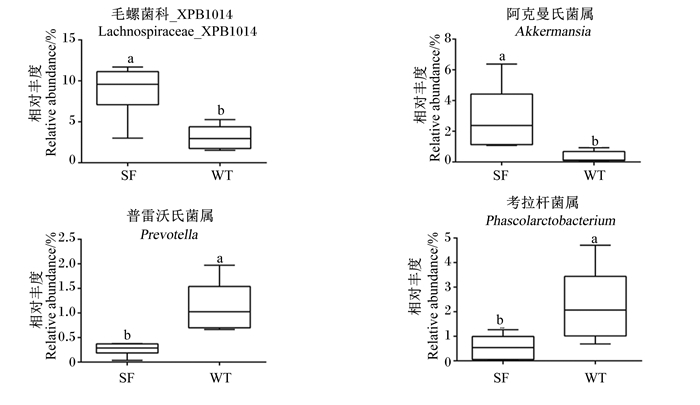
由图 4可知,在属水平,三粉驴直肠内容物毛螺菌科_XPB1014(Lachnospiraceae_XPB1014)、阿克曼氏菌属(Akkermansia)相对丰度显著高于乌头驴(P < 0.05),而普雷沃氏菌属(Prevotella)和考拉杆菌属(Phascolarctobacterium)相对丰度显著低于乌头驴(P < 0.05)。
|
数据柱标不同小写字母表示差异显著(P<0.05)。 Value columns with different small letters mean significant difference (P < 0.05). 图 4 属水平上直肠微生物相对丰度 Fig. 4 Relative abundance of rectal microbiota at genus level |
由图 5可知,Spearman相关分析显示,在12头德州驴直肠内容物菌群微生物相对丰度前30的菌属中,普雷沃氏菌属相对丰度与血浆中谷草转氨酶活性和甘油三酯含量呈极显著正相关(P < 0.01),与血浆中碱性磷酸酶活性和总胆固醇含量呈极显著负相关(P < 0.01);考拉杆菌属相对丰度与血浆中总胆固醇含量呈显著负相关(P < 0.05);阿克曼氏菌属相对丰度与血浆中碱性磷酸酶活性和总胆固醇含量呈极显著正相关(P < 0.01),与血浆中谷草转氨酶活性和甘油三酯含量呈极显著负相关(P < 0.01);毛螺菌科_XPB1014相对丰度与血浆中碱性磷酸酶活性和总胆固醇含量呈显著或极显著正相关(P < 0.05或P < 0.01),与血浆中谷草转氨酶活性呈极显著负相关(P < 0.01)。
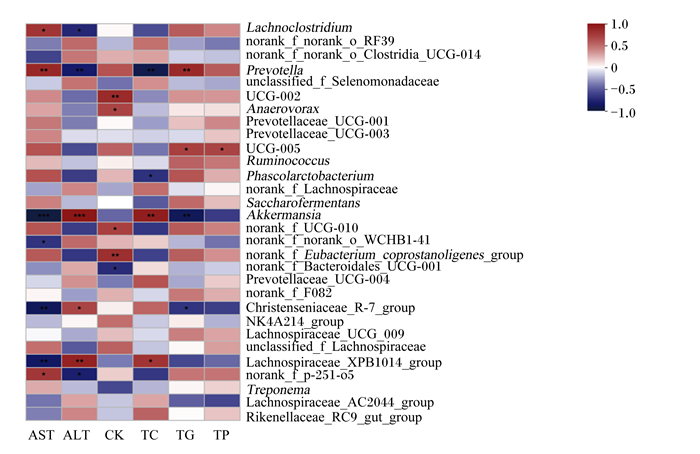
|
Lachnoclostridium:蓝绿藻菌属;Prevotella:普雷沃氏菌属;unclassified_f_Selenomonadaceae:未分类硒藻科;Anaerovorax:优杆菌属;Prevotellaceae_UCG-001:普雷沃氏菌科_UCG-001;Ruminococcus:瘤胃球菌属;Phascolarctobacterium:考拉杆菌;norank_f_Lachnospiraceae:未分类毛螺菌科;Saccharofermentans:乙酸糖发酵菌;Akkermansia:阿克曼氏菌属;norank_f_Eubacterium_coprostanoligenes_group:未分类产粪甾醇真细菌组;norank_f_Bacteroidales_UCG-001:未分类拟杆菌科_UCG-001;Prevotellaceae_UCG-004:普雷沃氏菌科_UCG-004;Christenseniaceae_R-7_group:克里斯滕森菌科_R-7组;Lachnospiraceae_UCG_009:毛螺菌科_UCG_009;Lachnospiraceae_XPB1014:毛螺菌科_XPB1014;Treponema:密螺旋体属;Lachnospiraceae_AC2044_group:毛螺菌科_AC2044组;Rikenellaceae_RC9_gut_group:理研菌科_RC9肠道组;AST:谷草转氨酶aspartate aminotransferase;ALP:谷丙转氨酶alanine aminotransferase;CK:肌酸激酶creatine kinase;TC:总胆固醇total cholesterol;TG:甘油三酯triglyceride;TP:总蛋白total protein。 图 5 血浆生化指标与差异菌属的Spearman相关分析热图 Fig. 5 Spearman correlation analysis heat map between plasma biochemical parameters and differential genus |
借助BugBase分析工具,对2个品系直肠微生物群的7种表型进行了预测。预测结果如图 6所示,乌头驴直肠微生物群的潜在致病性显著高于三粉驴(P < 0.05),而包含的可移动元件显著低于三粉驴(P < 0.05)。
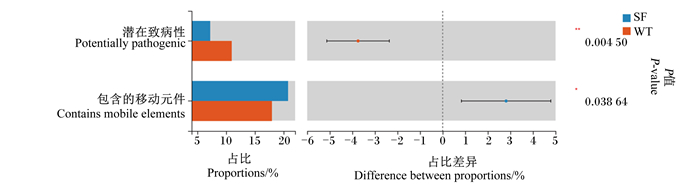
|
图 6 BugBase表型预测 Fig. 6 BugBase phenotypic prediction |
动物胃肠道菌群特征除受到日龄、营养及环境因素影响外,越来越多的研究发现,宿主胃肠道菌群特性与动物的遗传背景也密切相关[10-11]。本试验在前期研究的基础上,首先测定了三粉驴和乌头驴2个品系德州驴的血浆生化指标,再通过16S rDNA高通量测序技术分析其直肠菌群区系,发现2个品系德州驴血浆生化指标、直肠菌群特征及其功能预测等都存在差异,表明2个品系的遗传背景对肠道菌群特征存在影响。
机体的血浆生化指标变化受动物不同品种(系)、生长发育阶段、饲粮营养水平等影响,反映机体的代谢状况。本研究中,所测定的德州驴血浆生化指标结果同以往研究报道相吻合[12-13],但在以往的研究中未见乌头驴和三粉驴2个品系相比较的报道。本试验中,三粉驴血浆中甘油三酯、总蛋白含量显著低于乌头驴,这或许是由于三粉驴具有更加优良的代谢能力[7],血浆中甘油三酯和蛋白质被动员所致。代谢酶活性方面,血浆中碱性磷酸酶为碱性条件下非特异水解的磷酸脂酶总称,能够促进动物发育和骨骼肌生长。Juokslahti等[14]研究发现,血浆中碱性磷酸酶活性与平均日增重呈正相关。本研究中,三粉驴血浆中碱性磷酸酶活性显著高于乌头驴,这可能是三粉驴具有更优异生产性能的原因之一[7]。谷草转氨酶和肌酸激酶是反映肝脏和心肌及骨骼肌功能的重要指标。本研究中,乌头驴血浆中谷草转氨酶和肌酸激酶活性显著高于三粉驴,虽然这些数值都在正常范围之内[12-13],但考虑到试验用三粉驴和乌头驴都处于相同健康状态、生理阶段,这2个指标的差异或许和不同驴品系相关。
分析2个品系德州驴直肠菌群结构发现,菌群α多样性和β多样性存在明显差异,Massacci等[15]研究6个品种马(阿拉伯马、比利时马、法国马、汉诺威马、卢西塔诺马和奥尔登堡马)粪便菌群时也发现了类似的结果,这或许与不同品种(系)动物的遗传背景有关。在门水平上,以往研究发现德州驴后肠及直肠粪便以厚壁菌门和拟杆菌门为优势菌门[1, 16]。本研究中,厚壁菌门和拟杆菌门亦为2个品系德州驴共有相对丰度最高的菌门,这与以往研究结果一致。在2个品系直肠内容物中还发现了螺旋体门、尤微菌门和放线菌门,但均没有差异,这表明2个品系的遗传背景在门水平上未产生影响,同以往研究结果[17]相吻合。然而,Kataev等[18]研究则发现,雅库特和卡尔梅克牛直肠粪便菌门类似,而瘤胃液菌门差异较大,这或许与瘤胃内微生物群落更为复杂、更易受到外部因素影响有关。在科水平和属水平上,2个品系直肠内容物菌群存在较大差异,与本研究结果类似,Zhao等[17]利用16S rRNA高通量测序比较蒙古马和纯种马粪便菌群,发现2个品种马粪便菌群在属水平上存在较大差异。
不同品种(系)间菌属相对丰度的变化可能受特定品种间肠道功能差异的影响,同时差异的菌属也会发挥不同的功能[19]。在猪上的研究发现,普雷沃菌属和拟杆菌属在肥胖哥廷根猪肠道中相对丰度较高,梭状芽胞杆菌属在瘦肉型哥廷根猪肠道中相对丰度较高,然而在奥萨巴猪中情况则完全相反[20]。本实验室前期研究发现,与乌头驴相比,三粉驴的肝脏系数较高,并且小肠、盲肠长度更长,三粉驴具有更优良的消化能力[9],2个品系肠道生理功能的差异对肠道菌群也产生了影响。本研究中发现,三粉驴直肠内容物中与多糖降解相关的毛螺菌科_XPB1014和与抗病相关的阿克曼氏菌属相对丰度显著高于乌头驴,而普雷沃菌属和考拉杆菌属相对丰度则显著低于乌头驴。
毛螺菌科是草食动物肠道中常见的优势菌群,能够分解碳水化合物产生短链脂肪酸,从而为宿主提供能量[21]。本研究中,毛螺菌科_XPB101相对丰度与血浆中碱性磷酸酶活性呈正相关,结合之前讨论,具有较高相对丰度的毛螺菌科_XPB1014可能是三粉驴具有更高水平的消化及代谢能力的原因之一。阿克曼氏菌属以肠道中黏蛋白作为能量来源,大量研究表明阿克曼氏菌能够拮抗病原菌生长,具有维持肠道黏液层厚度和保障肠屏障完整性的作用[22]。本研究中,BugBase表型预测显示三粉驴肠道菌群潜在致病性显著低于乌头驴,这可能与三粉驴肠道中阿克曼氏菌相对丰度显著高于乌头驴有关。普雷沃菌属是食草动物和杂食动物的瘤胃和肠道中常见的优势菌属[23],可通过发酵可溶性碳水化合物和降解不溶性植物纤维产生短链脂肪酸,有效地从复杂多糖中获取能量[24],进而增加宿主脂肪沉积[25]。本研究中,乌头驴肠道中普雷沃菌相对丰度显著高于三粉驴,其相对丰度与血浆中甘油三酯含量呈正相关,与碱性磷酸酶活性呈负相关,乌头驴血浆中甘油三酯含量显著高于三粉驴或许同此菌属有关。然而,本实验室前期研究发现三粉驴具有更优良的生产性能,这与在猪上的研究结果[26]不同,或许是由于除菌群因素外,驴的生长性能还同受肠道长度、脏器系数等因素影响[7]。研究发现,考拉杆菌属相对丰度的增加与动物肠道炎症和病理发生有关[27],而与动物平均日增重和空肠绒毛高度呈负相关[28],这与本研究中乌头驴肠道考拉杆菌属相对丰度较高,同时BugBase表型预测其潜在致病力较高的结果相一致。2个品系的这些差异菌群信息为后续分筛德州驴肠道益生菌种、调控肠道微生态平衡、提高生产性能提供重要参考。
可移动元件主要包括插入序列、转座子、整合子、自转移广宿主质粒、基因岛和噬菌体等,可移动元件的功能除了使细菌耐药基因发生水平迁移外,还包括糖类分解、汞抗性、毒力因子和生物修复等功能[29]。在猪上的研究证实,肠道菌群通过可移动元件实现对ASP250(金霉素+磺胺二甲嘧啶+青霉素)的耐药性[30],虽然在本研究中三粉驴肠道菌群BugBase表型预测所含可移动元件显著高于乌头驴,但德州驴抗病性强,养殖过程中较少应用抗生素[31],耐药基因产生和迁移的风险较低。
4 结论① 三粉驴血浆胆固醇含量和碱性磷酸酶活性更高,乌头驴血浆甘油三酯和总蛋白含量更高。
② 三粉驴肠道中毛螺菌科_XPB1014和阿克曼氏菌属相对丰度更高,菌群功能预测中潜在的致病性更低。
③ 从血浆生化指标和肠道菌群结构角度分析,三粉驴在生产和抗病性能方面或更优于乌头驴。
| [1] |
LIU G Q, BOU G, SU S F, et al. Microbial diversity within the digestive tract contents of Dezhou donkeys[J]. PLoS One, 2019, 14(12): e0226186. DOI:10.1371/journal.pone.0226186 |
| [2] |
CAMPBELL J H, FOSTER C M, VISHNIVETSKAYA T, et al. Host genetic and environmental effects on mouse intestinal microbiota[J]. The ISME Journal, 2012, 6(11): 2033-2044. DOI:10.1038/ismej.2012.54 |
| [3] |
GOODRICH J K, WATERS J L, POOLE A C, et al. Human genetics shape the gut microbiome[J]. Cell, 2014, 159(4): 789-799. DOI:10.1016/j.cell.2014.09.053 |
| [4] |
ZHAO C H, TENG J, ZHANG X H, et al. Optimizing genomic selection in Dezhou donkey using low coverage whole genome sequencing[J/OL]. Research Square: 1-28. (2021-06-16)[2022-12-20]. https://doi.org/10.21203/rs.3.rs-607740/v1. DOI: 10.21203/rs.3.rs-607740/v1.
|
| [5] |
王长法, 孙艳, 杨春红. 德州驴[M]. 北京: 中国农业出版社, 2020. WANG C F, SUN Y, YANG C H. Dezhou donkey[M]. Beijing: China Agriculture Press, 2020 (in Chinese). |
| [6] |
国家畜禽遗传资源委员会组. 中国畜禽遗传资源志: 马驴驼志[M]. 北京: 中国农业出版社, 2011. China National Commission of Animal Genetic Resources. Animal genetic resources in China: horses donkeys camels[M]. Beijing: China Agriculture Press, 2011 (in Chinese). |
| [7] |
高琦璨, 王金鹏, 李玉华, 等. 德州驴生产性能的初步研究[J]. 家畜生态学报, 2021, 42(2): 56-61. GAO Q C, WANG J P, LI Y H, et al. Preliminary study on the production performance of Dezhou donkey[J]. Acta Ecologae Animalis Domastici, 2021, 42(2): 56-61 (in Chinese). DOI:10.3969/j.issn.1673-1182.2021.02.010 |
| [8] |
LI Y, MA Q S, ZHOU M M, et al. A metabolomics comparison in milk from two Dezhou donkey strains[J/OL]. European Food Research and Technology. (2022-01-24)[2022-12-20]. https://doi.org/10.1007/s00217-022-03962-8. DOI: 10.1007/s00217-022-03962-8.
|
| [9] |
高琦璨. 德州驴种质资源研究[D]. 硕士学位论文. 济南: 山东师范大学, 2020. GAO Q C. Research on germplasm resources of Dezhou donkey[D]. Master's Thesis. Jinan: Shandong Normal University, 2020. (in Chinese) |
| [10] |
MCKNITE A M, PEREZ-MUNOZ M E, LU L, et al. Murine gut microbiota is defined by host genetics and modulates variation of metabolic traits[J]. PLoS One, 2012, 7(6): e39191. DOI:10.1371/journal.pone.0039191 |
| [11] |
ORG E, PARKS B W, JOO J W J, et al. Genetic and environmental control of host-gut microbiota interactions[J]. Genome Research, 2015, 25(10): 1558-1569. DOI:10.1101/gr.194118.115 |
| [12] |
刘新峰, 丁向彬, 石彦虎, 等. 德州驴血糖和血脂检测及分析[J]. 动物医学进展, 2014, 35(8): 115-117. LIU X F, DING X B, SHI Y H, et al. Detection and analysis of biochemical indexes of glucose and lipids in serum of Dezhou donkeys[J]. Progress in Veterinary Medicine, 2014, 35(8): 115-117 (in Chinese). DOI:10.3969/j.issn.1007-5038.2014.08.026 |
| [13] |
罗延洪, 李永霞, 李青修, 等. 引入高寒牧区德州驴和本地驴生理生化指标的测定[J]. 山东畜牧兽医, 2020, 41(11): 3-6. LUO Y H, LI Y X, LI Q X, et al. Determination of physiological and biochemical indexes of Dezhou donkeys and local donkeys in alpine pastoral areas[J]. Shandong Journal of Animal Science and Veterinary Medicine, 2020, 41(11): 3-6 (in Chinese). DOI:10.3969/j.issn.1007-1733.2020.11.002 |
| [14] |
JUOKSLAHTI T, LINDBERG P, TYÖPPÖNEN J. Organ distribution of some clinically important enzymes in mink[J]. Acta Veterinaria Scandinavica, 1980, 21(3): 347-353. DOI:10.1186/BF03546866 |
| [15] |
MASSACCI F R, CLARK A, RUET A, et al. Inter-breed diversity and temporal dynamics of the faecal microbiota in healthy horses[J]. Journal of Animal Breeding and Genetics, 2020, 137(1): 103-120. DOI:10.1111/jbg.12441 |
| [16] |
XING J Y, LIU G Q, ZHANG X Z, et al. The composition and predictive function of the fecal microbiota differ between young and adult donkeys[J]. Frontiers in Microbiology, 2020, 11: 596394. DOI:10.3389/fmicb.2020.596394 |
| [17] |
ZHAO Y P, LI B, BAI D Y, et al. Comparison of fecal microbiota of Mongolian and thoroughbred horses by high-throughput sequencing of the V4 region of the 16S rRNA gene[J]. Asian-Australasian Journal of Animal Sciences, 2016, 29(9): 1345-1352. |
| [18] |
KATAEV V Y, SLEPTSOV I I, MARTYNOV A A, et al. Data on rumen and faeces microbiota profiles of Yakutian and Kalmyk cattle revealed by high-throughput sequencing of 16S rRNA gene amplicons[J]. Data in Brief, 2020, 33: 106407. DOI:10.1016/j.dib.2020.106407 |
| [19] |
ZHANG J C, GUO Z, XUE Z S, et al. A phylo-functional core of gut microbiota in healthy young Chinese cohorts across lifestyles, geography and ethnicities[J]. The ISME Journal, 2015, 9(9): 1979-1990. DOI:10.1038/ismej.2015.11 |
| [20] |
PEDERSEN R, INGERSLEV H C, STUREK M, et al. Characterisation of gut microbiota in Ossabaw and Göttingen minipigs as models of obesity and metabolic syndrome[J]. PLoS One, 2013, 8(2): e56612. DOI:10.1371/journal.pone.0056612 |
| [21] |
MEEHAN C J, BEIKO R G. A phylogenomic view of ecological specialization in the Lachnospiraceae, a family of digestive tract-associated bacteria[J]. Genome Biology and Evolution, 2014, 6(3): 703-713. |
| [22] |
DERRIEN M, BELZER C, DE VOS W M. Akkermansia muciniphila and its role in regulating host functions[J]. Microbial Pathogenesis, 2017, 106: 171-181. DOI:10.1016/j.micpath.2016.02.005 |
| [23] |
BOWEN J M, MCCABE M S, LISTER S J, et al. Evaluation of microbial communities associated with the liquid and solid phases of the rumen of cattle offered a diet of perennial ryegrass or white clover[J]. Frontiers in Microbiology, 2018, 9: 2389. DOI:10.3389/fmicb.2018.02389 |
| [24] |
GÁLVEZ E J C, ILJAZOVIC A, AMEND L, et al. Distinct polysaccharide utilization determines interspecies competition between intestinal Prevotella spp.[J]. Cell Host & Microbe, 2020, 28(6): 838-852.e6. |
| [25] |
DURBÁN A, ABELLÁN J, LATORRE A, et al. Effect of dietary carbohydrate restriction on an obesity-related Prevotella-dominated human fecal microbiota[J]. Metagenomics, 2013, 2: 235722. |
| [26] |
AMAT S, LANTZ H, MUNYAKA P M, et al. Prevotella in pigs: the positive and negative associations with production and health[J]. Microorganisms, 2020, 8(10): 1584. |
| [27] |
LECOMTE V, KAAKOUSH N O, MALONEY C A, et al. Changes in gut microbiota in rats fed a high fat diet correlate with obesity-associated metabolic parameters[J]. PLoS One, 2015, 10(5): : e0126931. |
| [28] |
YAN J S, ZHOU B, XI Y M, et al. Fermented feed regulates growth performance and the cecal microbiota community in geese[J]. Poultry Science, 2019, 98(10): 4673-4684. |
| [29] |
BRITO I L. Examining horizontal gene transfer in microbial communities[J]. Nature Reviews Microbiology, 2021, 19(7): 442-453. |
| [30] |
LOOFT T, JOHNSON T A, ALLEN H K, et al. In-feed antibiotic effects on the swine intestinal microbiome[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(5): 1691-1696. |
| [31] |
CANISSO I F, MCDONNELL S M. Donkey breeding behavior with an emphasis on the Pêga breed[M]//MATTHEWS N S, TAYLOR T S. Veterinary care of donkeys. Ithaca: International Veterinary Information Service, 2015.
|




