我国作为畜禽生产和消费大国,抗生素滥用导致的耐药性问题已严重影响到养殖业的发展,直接或间接影响到公众健康[1]。耐药病菌引起畜禽疫病时将会更难治疗,且会影响畜禽养殖的可持续发展[2];畜禽食品中抗生素残留也极易使人体产生过敏、耳聋及人体菌群失调导致的二次感染等不良反应[3]。因此,寻找一种无毒副作用、无残留的抗生素替代品已迫在眉睫。其中,益生菌可以克服抗生素所带来的负面影响,具有广阔的发展前景。
益生菌作为一种在适当剂量下给宿主带来健康益处的活微生物,主要种类有乳酸菌、芽孢杆菌和酵母等[4]。芽孢杆菌可使胃肠道处于一种厌氧环境,导致需氧和兼氧性致病菌的数量减少[5];酵母可分泌具有生物活性的酶,促进肠道有益菌群的生长[6];乳酸菌既可通过自身代谢的产物抑制病原菌的活性,又可通过黏附性影响其免疫调节活性,保护宿主肠道健康[7]。虽然益生菌具有抗菌活性、免疫调节等益生功能,但不同的菌株,即使为同一种属,其功能也可能会有很大差别,再加之目前我国自主开发的菌种很少,市售的益生菌相关产品中的菌株几乎被国外菌株所垄断[7],所以筛选优良的生产菌株是研制益生菌制品的关键步骤[8]。
因此,本试验旨在筛选出一株抗逆性强、抗菌效果好的乳酸菌,系统研究其环境耐受能力、抑菌能力、黏附能力、产酸能力以及生长曲线,为抗生素替代提供助力,为开发安全有效的益生菌微生态制剂或菌体产物相关免疫调节制剂提供理论依据。
1 材料与方法 1.1 试验材料 1.1.1 试剂MRS肉汤培养基、乳酸菌专用生化管(蔗糖、乳糖、麦芽糖、山梨醇、水杨苷、甘露醇、纤维二糖、棉子糖、七叶苷)购于青岛海博生物技术有限公司,溴甲酚绿购于天津市广复精细化工研究所,二甲苯购于西陇化工股份有限公司,抗荧光淬灭封片剂购于山东思科捷生物技术有限公司,异硫氰酸荧光素(FITC)购于上海源叶生物科技有限公司,革兰氏染色液试剂盒购于北京索莱宝科技有限公司。
1.1.2 样品和菌株猪粪来源于安庆六白猪,大肠杆菌CMCC 44102来源于中国医学细菌保藏管理中心,沙门氏菌ATCC 9150、金黄色葡萄球菌ATCC 25923来源于美国菌种保藏中心。
1.2 试验方法 1.2.1 乳酸菌的分离鉴定 1.2.1.1 菌株的分离筛选配制1%碳酸钙(CaCO3)的MRS固体培养基,取猪粪1 g与1 mL无菌磷酸盐缓冲液(PBS)混合,倍比稀释后涂布于含有1% CaCO3的MRS固体培养基上,于37 ℃恒温培养箱培养48 h,挑取其中有明显溶钙圈的单菌落进行纯化培养。
将纯化后的乳酸菌培养至对数期后,按1%接种量接种于无菌MRS液体培养基中,于50 ℃水浴20 min,培养4 h后吸取200 μL至96孔板中,使用酶标仪测定620 nm处的吸光度值(OD600),计算其存活率。
乳酸菌培养至对数期后,按1%接种量接种于pH=3的MRS液体培养基中,培养4 h后吸取200 μL至96孔板中,测定OD600,计算其存活率。
乳酸菌培养至对数期后,按1%接种量接种于含0.1%猪胆盐的MRS液体培养基中,培养4 h后吸取200 μL至96孔板中,测定OD600,计算其存活率。
存活率计算公式[9]:
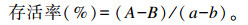
|
式中:A为处理后菌液培养4 h后的OD600;B为处理后菌液培养0 h的OD600;a为37 ℃静置培养4 h的菌液的OD600;b为37 ℃静置培养0 h的菌液的OD600。
根据以上3种耐受性试验结果进行初筛,耐受优秀的乳酸菌采用凝胶打孔方法进行抑菌活性测定,根据抑菌活性结果进行复筛。
1.2.1.2 菌株的鉴定对筛选出来的菌株进行生化管试验鉴定[10]。纯化3次后挑取单菌落于1.5 mL EP管中,培养至对数期,使用通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-AAGTCGTAACAAGGTAACC-3’)进行PCR扩增,按照2 μL菌液,8 μL Mix,1 μL引物27F,1 μL引物1492R,8 μL双蒸水配制20 μL反应体系,进行PCR扩增。16S rRNA反应程序为[11]:预变性94 ℃ 5 min,变性95 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 90 s,以上重复30个循环,终端延伸72 ℃ 10 min。
配制1.5%琼脂糖凝胶,于1×TAE缓冲液中,以80 V、80 mA电泳30 min,使用凝胶成像系统分析结果,产物送至上海生工有限公司进行测序,所得结果使用BLAST分析,使用MAGE 7.0绘制进化树。
1.2.1.3 生长曲线测定于培养基上挑取单菌落,培养至对数期后,按1%接种量转接至无菌的MRS液体培养基内,每2 h测定菌液的OD600。
1.2.2 乳酸菌的环境耐受性评价 1.2.2.1 耐热评价菌株培养至对数期后,按1%接种量接种于无菌的MRS液体培养基中,于40、50、60、70、80、90 ℃水浴15 min,培养4 h后吸取200 μL至96孔板中,测定OD600,计算其存活率,计算公式见1.2.1.1。
1.2.2.2 耐酸评价菌株培养至对数期后,按1%接种量接种于pH=2.0、2.5、3.0、3.5、4.0、4.5、5.0的MRS液体培养基中,培养4 h后吸取200 μL至96孔板中,测定OD600,计算其存活率,计算公式见1.2.1.1。
1.2.3 乳酸菌的生物学功能评价 1.2.3.1 产酸能力测定按1%接种量接种菌液至无菌的液体MRS中,培养24 h,每隔2 h测1次pH。
配制溴甲酚绿蛋白胨培养基,每升水加入蛋白胨10 g,葡萄糖5 g,溴甲酚绿0.012 g,琼脂15 g。凝固后使用打孔器打孔,每孔注入200 μL培养至对数期菌液(pH=6.0),当pH变为3.6时固体培养基从蓝绿色变成黄色。冰箱放置3 h后放入培养箱,过夜后观察。
1.2.3.2 抑菌能力测定于LB固体培养基按1%接种量加入OD600=1.0的大肠杆菌CMCC 44102、金黄色葡萄球菌ATCC 25923、沙门氏菌ATCC 9150,轻摇混匀,凝固后使用打孔器打孔,每板一孔加入200 μL OD600=1.0的乳酸菌菌液,一孔加入离心过滤后的上清,最后一孔加入无菌的MRS液体培养基,于冰箱放置4 h后恢复室温30 min,放入培养箱过夜即可观察结果[12]。
1.2.3.3 疏水能力测定将乳酸菌菌液5 000×g离心弃去上清,加入PBS清洗3次菌体,使用0.1 mol/L的KNO3重悬,调整OD600=0.5,取3 mL菌悬液+1 mL二甲苯静置10 min,振荡1 min,静置30 min,取水相测定OD600,计算公式如下:
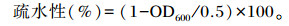
|
将乳酸菌菌液5 000×g离心弃去上清,加入PBS清洗3次菌体,使用PBS重悬,调整OD600=0.5,振荡10 s,37 ℃静置2 h,取上层清液测定OD600,计算公式如下:
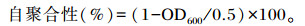
|
将各菌菌液调整OD600=0.5,取等量乳酸菌的菌悬液与大肠杆菌CMCC 44102、金黄色葡萄球菌ATCC 25923、沙门氏菌ATCC 9150分别混合,室温静置,于0和18 h取上清液测OD600,计算公式如下:
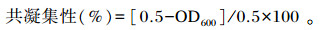
|
使用无菌PBS将FITC粉末稀释为200 μg/mL的储备液,于4 ℃冰箱避光保存备用,将乳酸菌培养至对数期,4 ℃、5 000×g离心10 min,去上清,使用无菌PBS洗涤菌体3次,使用FITC储备液重悬成109 CFU/mL的菌悬液,避光37 ℃孵育2 h取出,使用无菌PBS洗涤其至无色,并使用PBS将其配制为109 CFU/mL的菌悬液。
选择20只小鼠,随机分为2组,分别为饲喂菌液组和对照组,每组10只,公母各占1/2。饲喂菌液组小鼠灌胃被FICT标记过的109 CFU/mL菌悬液0.5 mL,对照组小鼠灌胃PBS稀释后的FITC溶液0.5 mL,12 h后安乐处死小鼠并快速收集肠组织(0.5 mm×0.5 mm),PBS避光清洗,放置于玻片上滴加1滴抗荧光猝灭剂,于上方轻轻盖上盖玻片,于荧光显微镜下观察[13]。
1.2.4.2 乳酸菌诱导脏器指数变化观察选择20只小鼠,随机分为2组,分别为饲喂菌液组和对照组,每组10只,公母各占1/2。饲喂菌液组小鼠灌胃0.5 mL 109 CFU/mL乳酸菌,对照组小鼠灌胃0.5 mL PBS,7 d后安乐处死小鼠并采集胸腺和脾脏,进行称重,计算脏器指数。计算公式如下:
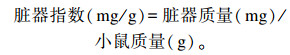
|
选择20只小鼠,随机分为2组,分别为饲喂菌液组和对照组,每组10只,公母各占1/2。饲喂菌液组小鼠灌胃0.5 mL 109 CFU/mL乳酸菌,对照组小鼠灌胃0.5 mL PBS,饲喂14 d后,观察小鼠精神状态、生病或死亡情况以及解剖腔(包括胸腔、腹腔与其中脏器)是否有病理变化。
1.3 数据的处理及分析所有试验均进行了6次重复试验,去最高与最低数据后,剩余数据进行处理分析。试验数据均使用SPSS 19.0软件进行单因素方差分析。数据以平均值±标准差表示,P<0.05表示差异显著。
2 结果与分析 2.1 乳酸菌的分离筛选与鉴定结果 2.1.1 初筛结果从健康六白猪粪便中获得了6株疑似乳酸菌,分别命名为T’-1、T’-2、J’-1、J’-3、Tβ、J’-4,对其进行酸处理(pH=3)、热处理(50 ℃)和胆盐处理(0.1%),根据结果进行初筛。由表 1可见,J’-1、J’-3、Tβ、J’-4酸处理下的存活率显著高于T’-2(P<0.05),T’-1、Tβ、J’-4热处理下的存活率显著高于T’-2、J’-1、J’-3(P<0.05),J’-1,Tβ,J’-4胆盐处理下的存活率显著高于T’-1(P<0.05)。综合上述结果,挑选J’-1、Tβ、J’-4进行复筛。
|
|
表 1 酸处理、热处理和胆盐处理下菌株存活率 Table 1 Survival rates of strain under acid treatment, heat treatment and bile salt treatment |
从初筛结果挑选J’-1、Tβ、J’-4进行抑菌试验复筛。由表 2可见,3株菌株对大肠杆菌CMCC 44102、金黄色葡萄球菌ATCC 25923、沙门氏菌ATCC 9150均有不同程度的抑制作用,J’-1、Tβ对大肠杆菌CMCC 44102的抑菌能力显著高于J’-4(P<0.05),Tβ对金黄色葡萄球菌ATCC 25923、沙门氏菌ATCC 9150的抑菌能力显著高于J’-1、J’-4(P<0.05)。
|
|
表 2 J’-1、Tβ、J’-4对不同致病菌的抑菌能力 Table 2 Bactericidal capacity on different pathogenic bacteria of J'-1, Tβ and J'-4 |
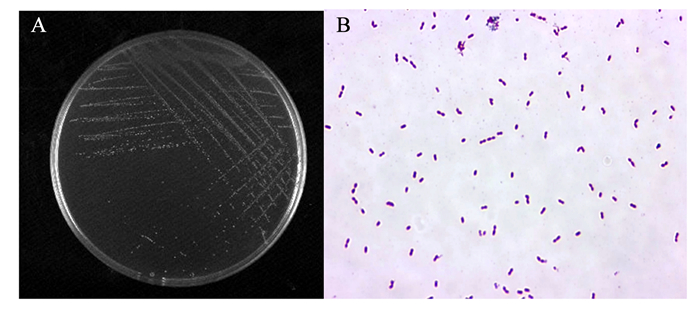
综合以上试验结果,挑取具有优秀抗逆性和抑菌能力的Tβ进行后续试验。由图 1可见,Tβ进行3次纯化培养之后于MRS固体培养基上可以观察到白色湿润、边缘光滑的菌落,菌落直径在1~2 mm;革兰氏染色镜检可以观察到单个或成对存在的革兰氏阳性菌,无芽孢和鞭毛,符合乳酸菌特征。
|
A:菌落形态colony morphology;B:革兰氏染色镜检Gram stain microscopy (1 000×)。 图 1 乳酸菌形态特征及革兰氏染色 Fig. 1 Morphological characteristics and Gram staining of lactic acid bacteria |
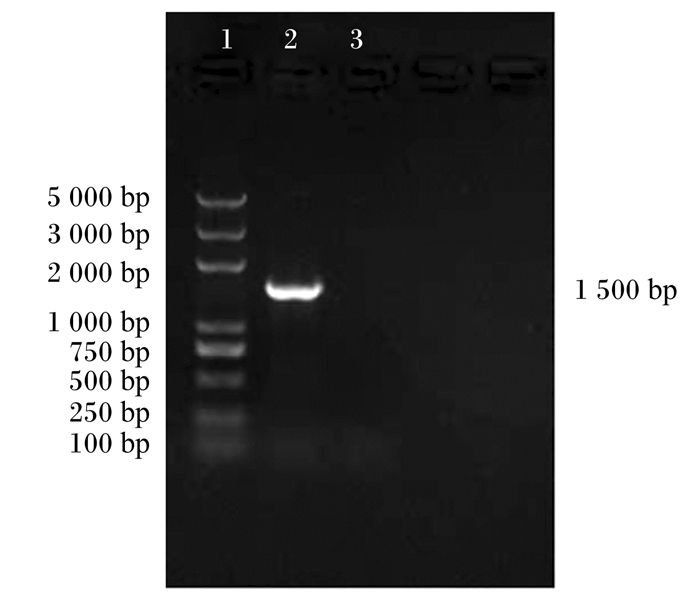
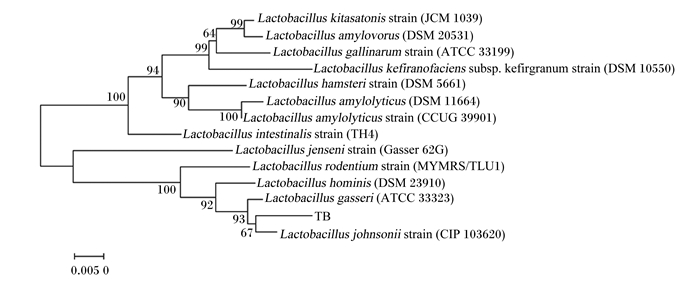
由图 2可见,通过通用引物(27F、1492R)对Tβ进行扩增,在1 500 bp处出现条带。由图 3可见,通过核苷酸同源性比对,Tβ与约翰氏乳杆菌同源性高达99.50%。
|
1:Trans2K Plus DNA Ladder;2:Tβ;3:阴性对照negative control。 图 2 16S rDNA凝胶电泳结果 Fig. 2 Results of 16S rDNA gel electrophoresis |
|
Lactobacillus kitasatonis strain:北卡罗来纳乳杆菌菌株;Lactobacillus amylovorus:淀粉乳杆菌;Lactobacillus gallinarum strain:鸡乳杆菌菌株;Lactobacillus kefiranofaciens:鸡乳杆菌;Lactobacillus hamsteri strain:哈姆斯特乳杆菌菌株;Lactobacillus amylolyticus:淀粉乳杆菌;Lactobacillus amylolyticus strain:淀粉乳杆菌菌株;Lactobacillus intestinalis strain:肠道乳酸杆菌菌株;Lactobacillus jenseni strain:詹森乳杆菌菌株;Lactobacillus rodentium strain:乳酸杆菌菌株;Lactobacillus hominis:人乳杆菌;Lactobacillus gasseri:格氏乳杆菌;Lactobacillus johnsonii strain:约氏乳杆菌菌株。 分支点上的数字为Boototrap值,用来评估这一分支的可信度;该进化树按比例绘制,分支长度与用于推断系统发育树的进化距离单位相同,进化距离采用p-distance方法计算[14]。 The numbers on the branch points are Boototrap values, which were used to evaluate the credibility of this branch; the tree was plotted to scale, with branched of the same length as the units of evolutionary distance used to infer phylogenetic trees, evolutionary distance was calculated by p-distance method[14]. 图 3 16S rRNA基因遗传与进化分析 Fig. 3 Genetic and evolutionary analysis of 16S rRNA gene |
由表 3可见,通过形态观察、染色结果、分子生物学鉴定结果、生理生化试验结果综合分析可知,该菌株为约翰氏乳杆菌。
|
|
表 3 Tβ的生理生化鉴定结果 Table 3 Physiological and biochemical identification results of Tβ |
由图 4可见,Tβ在4~8 h为生长对数期,生长较快,10 h开始生长速度下降,16 h之后进入平稳期。
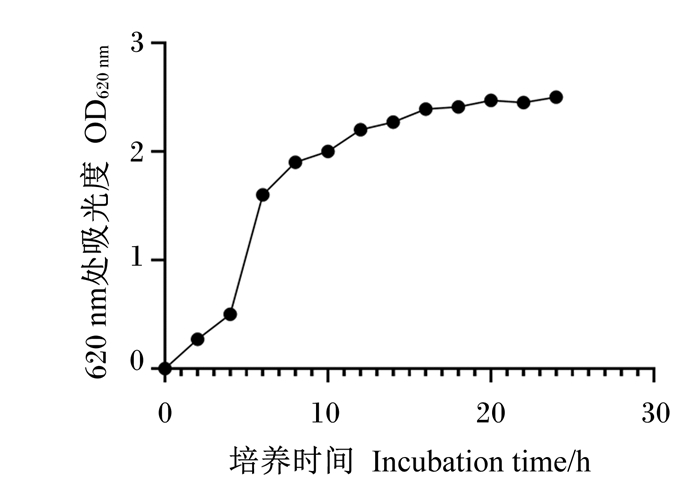
|
图 4 Tβ生长曲线 Fig. 4 Growth curve of Tβ |
由图 5-A可见,40 ℃热处理之后的Tβ存活率为93.54%,50 ℃热处理之后的Tβ存活率为73.09%,60 ℃热处理之后的Tβ存活率为60.33%,说明在60 ℃之前,温度对于Tβ的存活与生长没有太大的影响。70 ℃热处理之后的Tβ存活率为16.82%,80 ℃热处理之后的Tβ存活率为15.05%,90 ℃热处理之后的Tβ存活率为14.02%。70、80、90 ℃热处理之后的Tβ存活率显著低于40、50、60 ℃(P<0.05)。以上结果表明,70 ℃及以上较为不利于Tβ生长,但是在90 ℃时Tβ依旧可以存活并且缓慢生长,说明此菌耐热性较强。
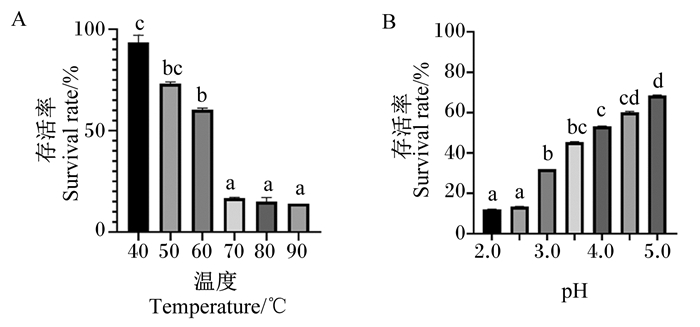
|
A:不同温度处理后的Tβ存活率survival rate of Tβ treated at different temperatures;B:不同pH培养时Tβ存活率survival rate of Tβ when cultured at different pH。 数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。图 8同。 Value columns with the same small letter mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as Fig. 8. 图 5 Tβ的环境耐受性评价结果 Fig. 5 Evaluation results of environmental tolerance of Tβ |
由图 5-B可见,pH为2.0培养时Tβ存活率为12.1%,pH为2.5培养时Tβ存活率为13.45%,pH为3.0培养时Tβ存活率为32.01%,pH为3.5培养时Tβ存活率为45.41%,pH为4.0培养时Tβ存活率为53.2%,而当pH为4.5培养时Tβ存活率为60.13%,pH为5.0培养时Tβ存活率为68.47%。pH为4.0、4.5、5.0培养时Tβ存活率显著高于pH为2.0、2.5、3.0培养时(P<0.05)。以上结果表明,pH为4.0~5.0时Tβ可正常生长,而在pH为2.0时也有Tβ存活生长,说明Tβ的耐酸能力较为优秀。
2.3 乳酸菌的生物学功能评价 2.3.1 产酸能力测定由图 6-A可见,溴甲酚绿在pH为3.6时会由蓝色变为黄色,加入Tβ菌液的培养基有明显变化,且产酸圈直径达到了35 mm,与对照组相比变化明显。由此可见,Tβ产酸效果优异。
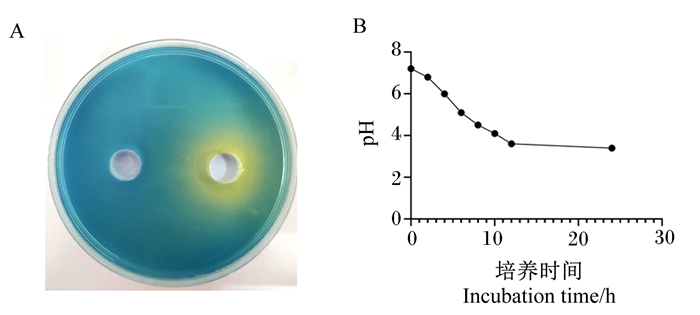
|
A:产酸圈图acid-producing circle diagram;B:产酸曲线acid-producing curve。 图 6 Tβ产酸能力 Fig. 6 Acid production capacity of Tβ |
由图 6-B可见,在0、2 h Tβ菌液的pH分别为7.2、6.8,但在4 h急剧下降至6.0,并且在6 h达到5.1,一直到8 h降至4.5后才回归平稳,后续在10 h到达了4.1,12 h到达了3.6。于培养箱放置24 h后菌液的pH为3.4。由此可见,Tβ产酸能力较好,2~12 h为产酸高峰期。
2.3.2 抑菌能力测定由表 4、图 7可见,Tβ菌悬液和上清液对大肠杆菌CMCC 44102、金黄色葡萄球菌ATCC 25923、沙门氏菌ATCC 9150都有良好的抑菌能力,其中Tβ菌悬液对金黄色葡萄球菌的抑菌能力显著高于上清液(P<0.05)。
|
|
表 4 Tβ菌悬液和上清液对不同致病菌的抑菌能力 Table 4 Bactericidal capacity on different pathogenic bacteria of Tβ bacterial suspension and supernatant |

|
1:空白对照blank control;2:Tβ上清液Tβ supernatant;3:Tβ菌悬液Tβ bacterial suspension。 图 7 Tβ对金黄色葡萄球菌ATCC 25923的抑菌圈图 Fig. 7 Bacteriostatic circle diagram of Tβ against Staphylococcus aureus ATCC 25923 |
细菌对于自聚合能力的划分标准为,自聚合性在16%~35%为低自聚合能力,在36%~50%为中等自聚合能力,在50%以上为高自聚合能力。Tβ的自聚合性为16.77%,说明Tβ具有较低的自聚合能力。
2.3.4 疏水能力测定细菌对于疏水能力的划分标准为,疏水性在20%以下为非疏水,在20%~50%为中度疏水,在50%以上为高度疏水。Tβ的疏水性为51.80%,说明Tβ具有较高的疏水能力。
2.3.5 共凝集能力测定由图 8可见,Tβ与金黄色葡萄球菌ATCC 25923共凝集性为52.11%,与沙门氏菌ATCC 9150共凝集性为75.64%,与大肠杆菌CMCC 44102共凝集性为73.95%;Tβ与金黄色葡萄球菌ATCC 25923的共凝集性显著低于沙门氏菌ATCC 9150和大肠杆菌CMCC 44102(P<0.05)。由此可知,Tβ与沙门氏菌ATCC 9150的共凝集能力最好,对金黄色葡萄球菌ATCC 25923的共凝集能力较弱。
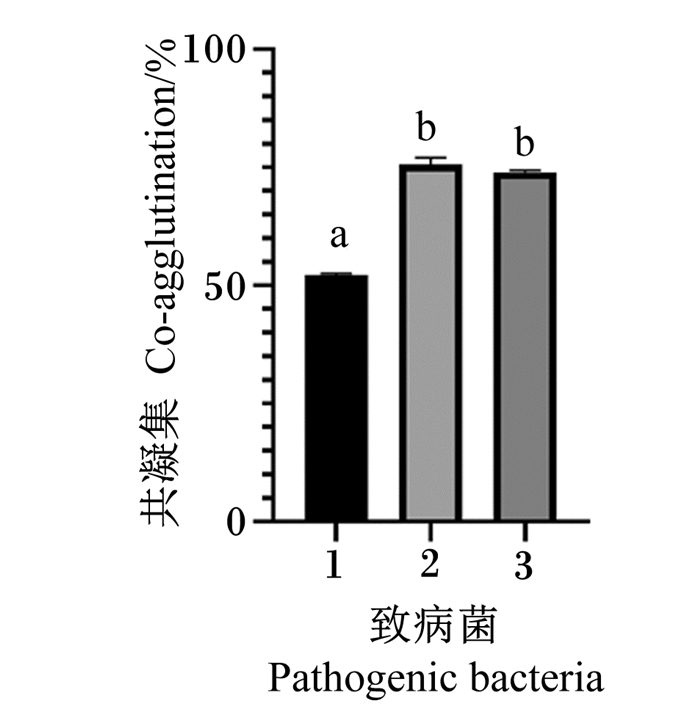
|
1:金黄色葡萄球菌ATCC 25923 Staphylococcus aureus ATCC 25923;2:沙门氏菌ATCC 9150 Salmonella ATCC 9150;3:大肠杆菌CMCC 44102 Escherichia coli CMCC 44102。 图 8 Tβ与不同致病菌的共凝集结果 Fig. 8 Results of Tβ co-agglutination with different pathogenic bacteria |
由图 9可见,取肠道组织于荧光显微镜下观察,饲喂菌液组肠道组织可观察到大量荧光,荧光来源于被FITC标记的菌体,说明Tβ肠道黏附能力优秀。
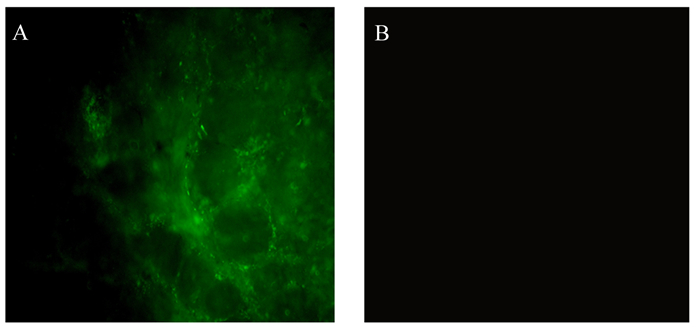
|
A:饲喂菌液组的肠道组织显微镜观察图microscopic view of intestinal tissue of the fed bacteria solution group;B:对照组的肠道组织显微镜观察图microscopic view of intestinal tissue of the control group。 图 9 肠道荧光观察 Fig. 9 Intestinal fluorescence observation (100×) |
由表 6可见,饲喂菌液组的小鼠脾脏指数和肝脏指数较对照组均增加,饲喂菌液组的肝脏指数显著高于对照组(P<0.05),且解剖观察到饲喂菌液组和对照组小鼠免疫器官均无病理变化,说明Tβ有促进免疫器官生长的效果。
|
|
表 6 脏器指数结果 Table 6 Organ index results |
经过14 d的饲喂,试验小鼠精神状态良好,无生病或者死亡,解剖观察解剖腔无病理变化,证明Tβ无致病性,是一种安全无毒的优秀的微生态制剂备用菌。
3 讨论乳酸菌是哺乳动物肠道内的益生菌之一,对动物机体有着不可小觑的益生作用。张在等[15]通过溶钙圈法从猪粪中提取出了10株疑似乳酸菌。本试验借鉴了此方法,通过在MRS培养基中加入CaCO3,挑取具有溶钙圈的菌落,在耐受性试验初筛与抑菌活性测定复筛后,选择最优菌进行乳酸菌专用生化管鉴定,再通过16S rRNA反应程序进行PCR扩增,出现正确条带后送检,得到核苷酸序列进行比对建立进化树,确定此菌株是约翰氏乳杆菌。
在动物的胃肠道内存活是乳酸菌在动物体内产生作用的基础[16],因此我们检测了Tβ的耐酸能力、耐热能力和耐胆盐能力,证明了其具有优良的在动物消化道内存活的能力。考虑饲料的发酵以及环境保存不当可能会导致强酸、高温等恶劣环境,我们检测了其在pH为2时的存活率,平均存活率为12.1%,付浩等[17]研究了乳酸菌于不同pH(3.5、4.5、5.5、6.5、7.5)处理后的存活率,在pH为3.5时菌株存活明显下降,与本试验结果相符。同时本试验也检测了Tβ在90 ℃时的存活率,其在90 ℃时也可存活并且生长,平均存活率为14.02%。曹海鹏等[18]测定了乳酸菌在30~60 ℃时的存活率,在30~45 ℃时乳酸菌存活率基本无变化,45 ℃以上随着温度升高存活率逐渐降低,与本试验结果一致。以上结果证明了Tβ具有优异的抗逆能力。
乳酸菌具有优秀的抑菌能力,是因为其可以产生乳酸以及一些抑菌物质[19]。孔祥丽等[20]证实了乳酸对致病菌有抑制作用;顾彬涛[13]也证实了乳酸菌对肠毒素性大肠杆菌ETEC 10和金黄色葡萄球菌A65具有体外抗菌能力,以上研究成果与本研究结果相符。Tβ具有十分优异的产酸能力,由此我们可以将两者联系起来,测定Tβ的抑菌能力,得到结果证明Tβ对大肠杆菌和沙门氏菌具有优秀的抑菌能力,Tβ上清液与菌悬液结果差异不显著;对金黄色葡萄球菌的抑菌能力,Tβ上清液与菌悬液结果相差较大,Tβ菌悬液的抑菌效果更优秀。针对以上结果我们可以得出结论,Tβ具有良好的抑菌效果,其菌悬液对大肠杆菌、金黄色葡萄球菌、沙门氏菌均有一定抑菌效果。
益生菌的益生效果与其黏附能力息息相关,在消化道内黏附时间越长,发挥作用越大[21]。孙笑非等[22]通过禽类动物试验证实了乳酸菌可以通过提高肠绒毛高度、改善黏膜结构来提高营养成分的消化吸收、增强上皮细胞的调节功能、防御病原菌和维持细胞稳态等。想要消灭病原菌,与病原菌共凝集也是十分重要的一环[23]。通过本试验结果可知,Tβ具有一定的自凝集能力和较高的疏水能力,在病原菌共凝集试验中结果较为优异。龚虹等[24]测定了不同乳酸菌的黏附能力,结果显示德氏乳杆菌与罗伊乳杆菌具有良好的疏水能力和自凝集能力,而戊糖片球菌则疏水能力与自凝集能力较弱。本试验选用菌株为约翰氏乳杆菌,试验结果显示具有较优秀的黏附能力,推测乳酸杆菌的黏附能力会较优于乳酸球菌。
石水琴[25]通过FITC标记乳酸菌,成功观测到了被FITC标记的乳酸菌。本试验结果表明,饲喂菌液组小鼠肠道组织于荧光显微镜下可观察到大量荧光,证明Tβ肠道黏附能力十分优秀。饲喂菌液组的小鼠脏器指数高于对照组,且饲喂菌液组的小鼠无任何异常,解剖腔也无肉眼可观察到的病变,说明Tβ在一定程度上可以提高机体免疫能力。
4 结论从安庆六白猪粪便中纯化而来的Tβ经过16S rDNA核酸同源性分析、生化管鉴定、细菌形态及菌落特征综合分析,确定其为约翰氏乳杆菌。Tβ是一株优异的微生态制剂备用菌,具有耐热和耐酸能力强、产酸丰富、抑菌谱广、生长迅速、黏附能力优秀等特点。动物试验显示,Tβ具有优良的肠道益生功能。
| [1] |
毛成兴. 风险认知视角下的畜禽养殖场户"无抗化"生产响应行为研究[D]. 硕士学位论文. 武汉: 华中农业大学, 2018. MAO C X. A study on the production response behavior of livestock and poultry farmers without antibiotics under risk awareness[D]. Master's Thesis. Wuhan: Huazhong Agricultural University, 2018. (in Chinese) |
| [2] |
王何中. 养殖业抗生素使用现状及应对措施[J]. 现代农业科技, 2019(22): 164-166. WANG H Z. Current situation and countermeasures of antibiotic used in aquaculture industry[J]. Modern Agricultural Science and Technology, 2019(22): 164-166 (in Chinese). |
| [3] |
胡燕, 白继庚, 胡先明, 等. 我国抗生素滥用现状、原因及对策探讨[J]. 中国社会医学杂志, 2013, 30(2): 128-130. HU Y, BAI J G, HU X M, et al. Exploring on the status, reasons and countermeasures of antibiotics abuse[J]. Chinese Journal of Social Medicine, 2013, 30(2): 128-130 (in Chinese). |
| [4] |
刘艳玲. 复合益生菌制剂对奶牛泌乳性能和山羊肠道防御机能的影响[D]. 博士学位论文. 扬州: 扬州大学, 2020. LIU Y L. Effects of compound probiotics on lactation performance of cows and intestinal defense function of goats[D]. Ph. D. Thesis. Yangzhou: Yangzhou University, 2020. (in Chinese) |
| [5] |
郭庆丰, 陈林, 马经纬. 凝结芽孢杆菌益生机制及应用研究进展[J]. 食品研究与开发, 2018, 39(18): 208-213. GUO Q F, CHEN L, MA J W. Research advances in the probiotics mechanism and application of Bacillus coagulans[J]. Food Research and Development, 2018, 39(18): 208-213 (in Chinese). DOI:10.3969/j.issn.1005-6521.2018.18.037 |
| [6] |
张艳艳, 赵国先, 李树鹏, 等. 益生菌-酵母菌综合开发利用的研究进展[J]. 饲料博览, 2015(11): 28-31. ZHANG Y Y, ZHAO G X, LI S P, et al. Research progress of comprehensive development and utilization of probiotics-yeast[J]. Feed Review, 2015(11): 28-31 (in Chinese). DOI:10.3969/j.issn.1001-0084.2015.11.008 |
| [7] |
任大勇. 益生乳酸杆菌的黏附及免疫调节作用研究[D]. 博士学位论文. 长春: 吉林大学, 2013. REN D Y. Research on adhesion and immunoregulation of probiotic Lactobacillus strains[D]. Ph. D. Thesis. Changchun: Jilin University, 2013. (in Chinese) |
| [8] |
胡东兴, 潘康成. 微生态制剂及其作用机理[J]. 中国饲料, 2001, 1(3): 14-16. HU D X, PAN K C. Microecological preparations and their mechanism of action[J]. China Feed, 2001, 1(3): 14-16 (in Chinese). DOI:10.3969/j.issn.1004-3314.2001.03.008 |
| [9] |
李利, 孔丽, 张宁, 等. 耐酸耐胆盐乳酸菌的鉴定及筛选[J]. 食品科学, 2015, 36(21): 123-128. LI L, KONG L, ZHANG N, et al. Identification and selection of lactic acid bacteria resistant to acid and bile salt[J]. Food Science, 2015, 36(21): 123-128 (in Chinese). DOI:10.7506/spkx1002-6630-201521024 |
| [10] |
布坎南, 吉本斯. 伯杰细菌鉴定手册[M]. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组, 译. 8版. 北京: 科学出版社, 1984. BUCHANAN R E, GIBBONS N E. Bergey's manual of determinative bacteriology[M]. Translation Group of Bergey's Manual of Determinative Bacteriology, Chinese Academy of Sciences, translated. 8th ed. Beijing: Science Press, 1984. (in Chinese) |
| [11] |
秦文飞, 宋馨, 夏永军, 等. 乳酸菌在肠道定植的影响因素及研究方法[J]. 食品科学, 2021, 42(23): 275-283. QIN W F, SONG X, XIA Y J, et al. Factors affecting intestinal colonization of lactic acid bacteria and research methods for it[J]. Food Science, 2021, 42(23): 275-283 (in Chinese). DOI:10.7506/spkx1002-6630-20200811-140 |
| [12] |
王翌, 李淼, 李永锋, 等. 野猪粪便中乳酸菌的分离鉴定及特性研究[J]. 中国农业科学, 2020, 53(14): 2964-2973. WANG Y, LI M, LI Y F, et al. Identification and properties of lactic acid bacteria isolated from wild boar feces[J]. Scientia Agricultura Sinica, 2020, 53(14): 2964-2973 (in Chinese). DOI:10.3864/j.issn.0578-1752.2020.14.019 |
| [13] |
顾彬涛. 猪源乳酸菌Lactobacillus animal 20的筛选及其复合制剂的制备[D]. 硕士学位论文. 合肥: 安徽农业大学, 2020. GU B T. Screening of pig-derived lactic acid bacteria Lactobacillus animal 20 and preparation of its compound preparation[D]. Master's Thesis. Hefei: Anhui Agricultural University, 2020. (in Chinese) |
| [14] |
NEI M, KUMAR S. Molecular evolution and phylogenetics[M]. Oxford: Oxford University Press, 2000.
|
| [15] |
张在, 郑瑞程, 方庆励, 等. 广西猪源益生菌的分离鉴定与生物学特性研究[J]. 中国畜牧兽医, 2020, 47(6): 1921-1933. ZHANG Z, ZHENG R C, FANG Q L, et al. Isolation, identification and biological characteristics of probiotics from swine origin in Guangxi[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(6): 1921-1933 (in Chinese). |
| [16] |
柴振宇, 苑丽园, 张彪, 等. 益生元, 益生菌复合微生态制剂作用机理的研究[J]. 粮食与食品工业, 2020, 27(2): 34-38. CHAI Z Y, YUAN L Y, ZHANG B, et al. Research on the action mechanism of prebiotics and probiotics compound microecological preparation[J]. Cereal & Food Industry, 2020, 27(2): 34-38 (in Chinese). DOI:10.3969/j.issn.1672-5026.2020.02.012 |
| [17] |
付浩, 金晶, 朱欣, 等. 贵州地区青贮饲料中天然乳酸菌分离鉴定及优良菌株筛选[J]. 中国饲料, 2021(15): 17-23. FU H, JIN J, ZHU X, et al. Isolation and identification of natural lactic acid bacteria in silage and screening of excellent strains in Guizhou[J]. China Feed, 2021(15): 17-23 (in Chinese). |
| [18] |
曹海鹏, 姬邓红, 黄作芳, 等. 一株强吸附胆固醇乳酸菌的分离鉴定及益生特性研究[J]. 中国酿造, 2022, 41(3): 110-116. CAO H P, JI D H, HUANG Z F, et al. Isolation, identification and probiotic properties of a lactic acid bacterium strain with strong cholesterol-adsorbing ability[J]. China Brewing, 2022, 41(3): 110-116 (in Chinese). |
| [19] |
孙存鑫, 刘波, 陈春光, 等. 微生态制剂概念及其作用机理[J]. 科学养鱼, 2020(1): 86. SUN C X, LIU B, CHEN C G, et al. The concept of microecological agents and their mechanism of action[J]. Scientific Fish Farming, 2020(1): 86 (in Chinese). DOI:10.3969/j.issn.1004-843X.2020.01.047 |
| [20] |
孔祥丽, 吴昕雨, 许晓曦. 植物乳杆菌代谢产物抑菌机制与应用研究进展[J]. 食品安全质量检测学报, 2021, 12(8): 3131-3140. KONG X L, WU X Y, XU X X. Research progress on metabolites and bacteriostasis mechanism of Lactobacillus plantarum[J]. Journal of Food Safety & Quality, 2021, 12(8): 3131-3140 (in Chinese). |
| [21] |
徐国辉, 周顺, 郭广鑫, 等. 一株鱼源乳酸菌的分离鉴定及其生物学特性[J]. 青岛农业大学学报(自然科学版), 2020, 37(3): 219-224. XU G H, ZHOU S, GUO G X, et al. Isolation and biological characteristics of a fish-derived lactic acid bacterial strain[J]. Journal of Qingdao Agricultural University(Natural Science), 2020, 37(3): 219-224 (in Chinese). DOI:10.3969/J.ISSN.1674-148X.2020.03.010 |
| [22] |
孙笑非, 王文娟, 孙冬岩, 等. 益生菌在家禽饲料中应用的研究进展[J]. 饲料研究, 2021, 44(4): 107-110. SUN X F, WANG W J, SUN D Y, et al. Research progress of probiotics used in poultry feed[J]. Feed Research, 2021, 44(4): 107-110 (in Chinese). |
| [23] |
王英, 周剑忠, 黄开红, 等. 泡菜中一株植物乳杆菌的分离筛选及鉴定[J]. 江苏农业学报, 2010, 26(1): 219-221. WANG Y, ZHOU J Z, HUANG K H, et al. Isolation and identification of one Lactobacillus plantarum strain from pickles[J]. Jiangsu Journal of Agricultural Sciences, 2010, 26(1): 219-221 (in Chinese). DOI:10.3969/j.issn.1000-4440.2010.01.043 |
| [24] |
龚虹, 王海霞, 马征途, 等. 乳酸菌粘附力与生物膜、疏水性和自凝集特性的研究[J]. 中国微生态学杂志, 2016, 28(9): 1026-1028, 1033. GONG H, WANG H X, MA Z T, et al. Biofilm hydrophobicity and auto-agglutination properties of five Lactobacillus strains[J]. Chinese Journal of Microecology, 2016, 28(9): 1026-1028, 1033 (in Chinese). |
| [25] |
石水琴. 鸡罗伊氏乳杆菌S5抗肠炎沙门氏菌感染及其对肠道菌群微生态的调控作用研究[D]. 博士学位论文. 合肥: 安徽农业大学, 2020. SHI S Q. Chicken Lactobacillus reuteri S5 resistant to Salmonella enteritidis infection and its regulation on intestinal microflora[D]. Ph. D. Thesis. Hefei: Anhui Agricultural University, 2020. (in Chinese) |




