2. 浙江惠嘉生物科技股份有限公司, 安吉 313300
2. Zhejiang Vegamax Biotechnology Co., Ltd., Anji 313300, China
畜禽养殖业的发展壮大为国民物质生活水平提供了重要保障,畜禽养殖过程中饲料成本占60%以上,且养殖过程中排放的粪便、污水、臭气和药物残留等给环境造成了巨大负担[1-2],据报道,我国每年由畜禽养殖场排放污水的化学耗氧量(COD)总量已接近工业废水的COD排放总量,而排放的总固体含量是工业固体废弃物的4倍,达19亿t[2]。因此,改善饲粮营养物质利用效率,降低畜禽养殖中饲粮养分排放,对于促进绿色畜禽养殖和环境生态健康发展及粮食节约均具有重要意义。
乳酸杆菌(Lactobacilus)是一种产乳酸的无芽孢、革兰氏染色阳性细菌。植物乳杆菌(Lactobacillus plantarum,LPM)是一种兼性厌氧乳酸杆菌[3-4],其代谢产物主要是乳酸、细菌素和蛋白酶等,添加到饲粮中可改善肠道生态,提高机体免疫能力,促进动物生长[5]。类干酪乳杆菌(Lactobacillus casei,LPI)是一种兼性异发酵乳酸杆菌[6]。研究发现,在饲粮中添加LPI可提高肉鸡平均日增重(ADG)和饲料转化率[7]。但是关于LPM和LPI及其复配产品对肉鸡消化功能和营养物质代谢的影响研究鲜见报道。因此,本试验以黄羽肉鸡为研究对象,通过在饲粮中添加LPM、LPI及其复配产品,研究其对肉鸡生长性能、消化器官指数、血清生化指标、消化酶活性和营养物质表观消化率的影响,以期为不同乳酸杆菌在肉鸡饲粮中的合理应用和畜禽养殖节粮减排提供参考依据。
1 材料与方法 1.1 试验设备和材料电热鼓风干燥箱(101-3型,上海锦屏仪器仪表有限公司)、陶瓷纤维马弗炉(SX2-4-10NP,上海一恒科学仪器有限公司)、酶联免疫检测仪(iMark,美国伯乐公司)、分光光度计(T6新世纪,北京普析通用仪器有限责任公司)。淀粉酶、脂肪酶、蛋白酶、尿素氮、葡萄糖、甘油三酯、总胆固醇测定试剂盒(南京建成生物工程研究所)。
1.2 试验设计本试验采用单因子完全随机设计,选取健康、体重均匀的1日龄雄性岭南黄羽肉仔鸡480只,随机分为4组,每组8个重复,每个重复15只。对照组(CON组)饲喂基础饲粮,试验组分别饲喂在基础饲粮中添加1 000 mg/kg的LPI(LPI组,活菌数3×109 CFU/g)、1 000 mg/kg的LPM(LPM组,活菌数3.5×108 CFU/g)和2 000 mg/kg的复合益生菌制剂(CL组,LPI活菌数1.5×109 CFU/g,LPM活菌数1.75×108 CFU/g)的试验饲粮。基础饲粮参考NRC(1994)[8]配制,其组成及营养水平见表 1。基础饲粮为粉料形式。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of basal diets(air-dry basis) |
试验在浙江惠嘉生物科技股份有限公司试验基地进行。试验鸡饲养于同一栋鸡舍,第1周饲养在温度保持在34~36 ℃的环境里,随后每周减少2~3 ℃,最终温度为20 ℃左右,24 h光照(白天自然光照,晚上白炽灯补光),试验期间肉鸡全程自由采食和饮水。消毒、免疫接种及疾病预防程序按常规进行。
1.4 样品采集在试验开始和结束时,对肉鸡进行称重,计算肉鸡的平均日增重、平均日采食量(ADFI)和料重比(F/G)、存活率。在28和56日龄时,禁食12 h,每个重复随机选取1只肉鸡,停止喂食12 h后称重,取翅静脉血(5 mL左右),4 ℃、4 500×g离心10 min,取上清保存在-80 ℃待测。
采血后,颈部静脉放血处死。分离空肠食糜于干净的离心管内,存储在-20 ℃用于分析酶活性。
采集腺胃、肌胃、胰腺并称重计算器官指数,计算公式如下:

|
然后采集胰腺样本保存在-80 ℃,用于分析酶活性。
在23~25日龄和54~56日龄时,每个重复收集粪便标本,去除粪样中的羽毛、皮屑,保存在密封的塑料袋中放置于-20 ℃,用于测定营养物质表观消化率[9]。
1.5 血清生化指标将血清解冻后,使用商业试剂盒按说明书检测血清尿素氮(C013-2,脲酶法)、葡萄糖(A154-1,葡萄糖氧化酶法)、甘油三酯(A110-1,单试剂GPO-PAP法)、总胆固醇(A111-1,单试剂GPO-PAP法)含量。
1.6 消化酶活性称取一定量的空肠食糜样本或胰腺样本(约0.3 g),按照1 ∶ 9(质量/体积比)的比例加入提前预冷的生理盐水溶液,用均质器匀浆。4 ℃,4 500×g离心10 min收集上清液体,用于后续的酶活性测定。利用商业试剂盒测定上清液中的淀粉酶(C016-1,淀粉-碘比色法)、脂肪酶(A054-2,甲基试卤灵底物法)、胰蛋白酶(A080-2,紫外比色法)活性。
1.7 营养物质表观消化率将采集的同一重复的粪便样品混合;随后,在65 ℃的烘箱中将粪便样本干燥48 h,随后回潮24 h,用粉碎机粉碎[9]。粪样参照《饲料中水分的测定》(GB/T 6435—2014)、《饲料中粗脂肪的测定索氏提取法》(GB/T 6433—2018)、《饲料中粗脂肪的测定乙醚提取法》(GB/T 6433—2006)、《饲料中粗灰分的测定》(GB/T 6438—2007)、《饲料中盐酸不溶灰分的测定灼烧处理法》(GB/T 23742—2009)方法测定水分、粗蛋白质、粗脂肪和酸不溶灰分含量。营养物质表观消化率计算公式如下:

|
利用Excel 2019初步处理数据,采用SPSS 20.0统计软件进行单因素方差分析(one-way ANOVA),若存在显著性则采用Duncan氏法进行多重比较,P<0.05表示差异显著。结果以平均值和均值标准误(SEM)表示。
2 结果 2.1 乳酸杆菌对肉鸡生长性能的影响由表 2可知,与CON组相比,饲粮添加LPM显著提高了肉鸡末重和平均日增重(P < 0.05),而LPI组、CL组对肉鸡末重和平均日增重无显著影响(P>0.05)。饲粮添加LPM、LPI、CL对肉鸡平均日采食量和料重比均无显著影响(P>0.05)。
|
|
表 2 乳酸杆菌对黄羽肉鸡生长性能的影响 Table 2 Effects of Lactobacilus on growth performance of yellow feather broilers |
由图 1可知,与CON组相比,饲粮添加LPM和CL显著提高了56日龄肉鸡胰腺指数(P < 0.05),而饲粮添加LPM或CL则对28、56日龄腺胃指数、肌胃指数和28日龄胰腺指数无显著影响(P>0.05)。与CON组相比,LPI组对28、56日龄腺胃指数、肌胃指数和胰腺指数均无显著影响(P>0.05)。
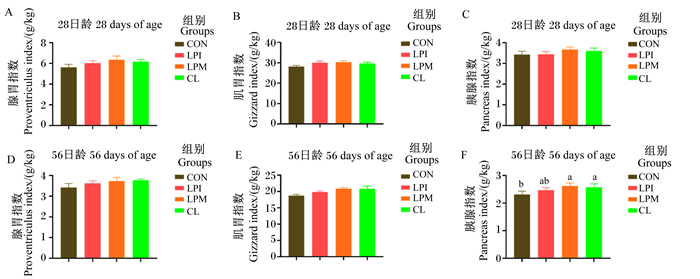
|
数据柱标注不同小写字母表示差异显著(P < 0.05),无字母或相同字母表示差异不显著(P>0.05)。下图同。 Value bars with different small letters mean significant difference (P < 0.05), while with no letters or the same letters mean no significant difference (P>0.05). The same as below. 图 1 乳酸杆菌对黄羽肉鸡消化器官指数的影响 Fig. 1 Effects of Lactobacilus on digestive organ indexes of yellow feather broilers |
由图 2可知,与CON组相比,LPM组和CL组28和56日龄肉鸡血清尿素氮含量显著降低(P < 0.05);饲粮添加LPM、LPI、CL对28和56日龄的肉鸡血清中葡萄糖、总胆固醇、甘油三酯含量均无显著影响(P>0.05)。
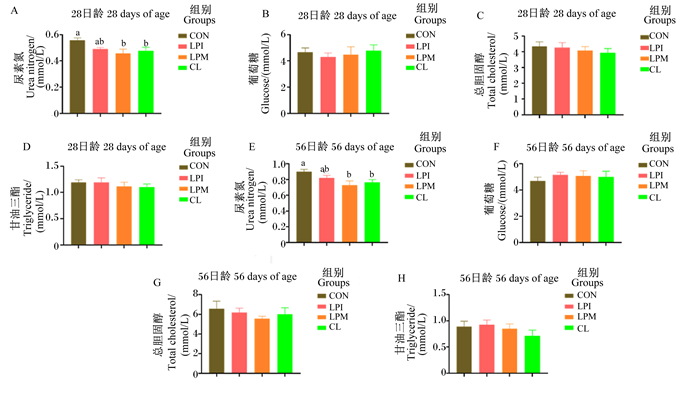
|
图 2 乳酸杆菌对黄羽肉鸡血清生化指标的影响 Fig. 2 Effects of Lactobacilus on serum biochemical indexes of yellow feather broilers |
由图 3可知,与CON组相比,饲粮添加LPM可以显著提高28、56日龄肉鸡胰腺淀粉酶活性和28日龄胰腺胰蛋白酶活性(P < 0.05);添加LPI、LPM和CL显著提高了56日龄胰腺胰蛋白酶活性(P < 0.05);添加LPI、LPM和CL对28、56日龄胰腺脂肪酶活性无显著影响(P>0.05)。
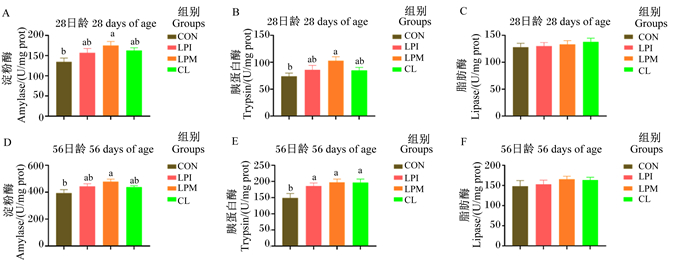
|
图 3 乳酸杆菌对黄羽肉鸡胰腺消化酶活性的影响 Fig. 3 Effects of Lactobacilus on pancreatic digestive enzyme activities of yellow feather broilers |
由图 4可知,与CON组相比,添加LPM和CL显著提高了肉鸡56日龄空肠食糜淀粉酶活性和28日龄空肠食糜胰蛋白酶活性(P < 0.05),添加LPI、LPM和CL能够显著提高56日龄空肠食糜的胰蛋白酶活性(P < 0.05);各组间28、56日龄空肠食糜的脂肪酶活性无显著差异(P>0.05)。
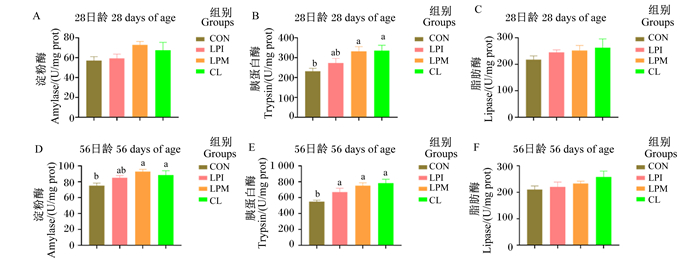
|
图 4 乳酸杆菌对黄羽肉鸡空肠食糜消化酶活性的影响 Fig. 4 Effects of Lactobacilus on jejunum chyme digestive enzyme activities of yellow feather broilers |
由图 5可知,与CON组相比,LPM组肉鸡54~56日龄有机物表观消化率和23~25日龄粗蛋白质表观消化率显著提高(P < 0.05),LPM组和CL组肉鸡54~56日龄粗蛋白质表观消化率显著增加(P < 0.05);而各组间粗脂肪表观消化率和23~25日龄粗蛋白质表观消化率无显著差异(P>0.05)。
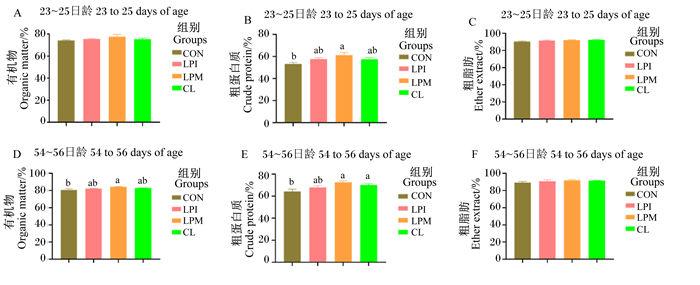
|
图 5 乳酸杆菌对黄羽肉鸡营养物质表观消化率的影响 Fig. 5 Effects of Lactobacilus on nutrient apparent digestibilities of yellow feather broilers |
Wang等[10]研究了植物乳酸菌对肉鸡生长性能的影响,结果表明,饲粮中添加植物乳杆菌可以提高肉仔鸡的生长性能。在本试验中,饲粮中添加LPM提高了肉鸡末重和平均日增重。分析其原因可能是乳酸杆菌提升了肉鸡的免疫功能,Shen等[11]的研究表明,植物乳杆菌可通过提高淋巴细胞增殖,促进T淋巴细胞活化增殖的重要调控因子白细胞介素-2(IL-2)的分泌水平,改善机体免疫力,调节肠道微生物群落,提高肉鸡的生长性能和抗病力。李阳[7]研究了类干酪乳杆菌对肉鸡生长性能的影响,结果表明,饲粮中添加类干酪乳杆菌可显著提高平均日增重,这与本试验结果存在差异,这可能与饲养环境和饲粮组成等有关。
3.2 乳酸杆菌对肉鸡消化器官指数的影响消化器官发育正常与否对动物的生长和健康有着重要的作用。本试验结果表明,饲粮添加LPM和CL的肉鸡56日龄胰腺指数显著提高,这与前人的研究结果一致。有研究指出,益生菌具有改善有益细菌和抑制肠道中潜在致病细菌的潜力,而肠道微生物被视为胃肠道健康的重要决定因素[12]。Wang等[10]研究表明,植物乳杆菌能激活鸡肠道的保护性免疫反应以抑制病原菌活性,进而促进动物消化器官的生长发育。这与本试验中植物乳杆菌提高了肉鸡的生长性能结果一致。
3.3 乳酸杆菌对肉鸡血清生化指标的影响血液是机体内环境的重要组成部分,是物质代谢交换的主要场所,体内培养物由血液转运,其成分的变化可反映机体的代谢情况和健康状况[11]。血清中尿素氮含量是机体的氨基酸代谢水平的重要标志[13-14],血清尿素氮含量和氮在体内的沉积呈负相关[15],血清中尿素氮含量升高,表明动物体内蛋白质分解代谢增强,合成代谢减弱,氮在动物机体的沉积量减少[16];相反,血清尿素氮含量降低,表明动物机体对氮的利用效率增强[17],本研究结果表明,与CON组相比,LPM组28和56日龄肉鸡血清尿素氮含量显著降低;CL组28和56日龄肉鸡血清尿素氮含量显著降低,这一结果解释了LPM之所以能提高肉仔鸡生长性能的原因可能在于其改善了动物机体氨基酸的代谢[17]。
3.4 乳酸杆菌对肉鸡消化酶活性的影响本试验研究表明,LPM添加可以显著提高28、56日龄肉鸡胰腺淀粉酶活性和28日龄胰腺胰蛋白酶活性。LPI、LPM和CL添加能够显著提高56日龄胰腺胰蛋白酶活性,LPM和CL添加提高了56日龄肉鸡空肠食糜淀粉酶活性和28日龄空肠食糜胰的蛋白酶活性;LPI、LPM和CL添加改善了56日龄空肠食糜的胰蛋白酶活性。王煜琦等[18]的研究发现,乳酸菌能够显著提高饲粮中主要营养物质的消化率,是由于乳酸杆菌在消化道内不仅能间接提高内源消化酶的活性,而且还可分泌一些消化酶以补充内源消化酶的不足,以及可通过乳酸杆菌发酵作用来降解一些难以消化利用的物质,产生寡糖、维生素、生长因子等直接供机体利用。
3.5 乳酸杆菌对肉鸡营养物质表观消化率的影响有研究表明,饲粮中添加益生菌可提高粗蛋白质的消化率[19]。本研究表明,饲粮中添加LPM显著提高肉鸡54~56日龄有机物表观消化率和23~25日龄粗蛋白质表观消化率,在饲粮中添加LPM和CL显著提高肉鸡54~56日龄粗蛋白质表观消化率。这与本试验中改善的消化酶活性结果一致,分析其原因可能是乳酸杆菌可以通过调节动物肠道微生态平衡、产酸和合成维生素来改善动物胃肠道功能,进而增强肠道内养分消化和吸收,提高饲料利用率,且可通过产生酶促进机体对钙、锌、铜等养分的吸收以改善动物整体的营养物质表观消化率,促进动物生长[20-21]。同时Khonyoung等[22]的研究结果表明,植物乳杆菌可以增加肉鸡肠绒毛高度和肠绒毛面积,从而增加对有效营养物质的吸收,以提高肉鸡的营养物质表观消化率。
4 结论饲粮中添加LPM和LPI均可提高消化酶活性,且LPM效果更佳,同时LPM具有提高肉鸡生长性能、消化器官发育和改善肉鸡有机物和粗蛋白质表观消化率,降低血清尿素氮含量的作用。此外,LPM和LPI复配未表现出协同益生效果。
| [1] |
HU Y A, CHENG H F, TAO S. Environmental and human health challenges of industrial livestock and poultry farming in China and their mitigation[J]. Environment International, 2017, 107: 111-130. DOI:10.1016/j.envint.2017.07.003 |
| [2] |
QIAN Y, SONG K H, HU T, et al. Environmental status of livestock and poultry sectors in China under current transformation stage[J]. Science of the Total Environment, 2018, 622/623: 702-709. DOI:10.1016/j.scitotenv.2017.12.045 |
| [3] |
DE VRIES M C, VAUGHAN E E, KLEEREBEZEM M, et al. Lactobacillus plantarum-survival, functional and potential probiotic properties in the human intestinal tract[J]. International Dairy Journal, 2006, 16(9): 1018-1028. DOI:10.1016/j.idairyj.2005.09.003 |
| [4] |
王水泉, 包艳, 董喜梅, 等. 植物乳杆菌的生理功能及应用[J]. 中国农业科技导报, 2010, 12(4): 49-55. WANG S Q, BAO Y, DONG X M, et al. Physiological function and application of Lactobacillus plantarum[J]. Journal of Agricultural Science and Technology, 2010, 12(4): 49-55 (in Chinese). DOI:10.3969/j.issn.1008-0864.2010.04.10 |
| [5] |
THU T V, LOH T C, FOO H L, et al. Effects of liquid metabolite combinations produced by Lactobacillus plantarum on growth performance, faeces characteristics, intestinal morphology and diarrhoea incidence in postweaning piglets[J]. Tropical Animal Health and Production, 2011, 43(1): 69-75. DOI:10.1007/s11250-010-9655-6 |
| [6] |
HOLZAPFEL W H, HABERER P, GEISEN R, et al. Taxonomy and important features of probiotic microorganisms in food and nutrition[J]. The American Journal of Clinical Nutrition, 2001, 73(2): 365s-373s. DOI:10.1093/ajcn/73.2.365s |
| [7] |
李阳. 壳寡糖和干酪乳杆菌对肉鸡肉品质和脂肪代谢的影响及其作用机理[D]. 硕士学位论文. 北京: 中国农业科学院, 2016. LI Y. Effects of chitosan oligosaccharide and Lactobacillus casei on meat quality and lipid metabolism of broilers and its underlying mechanism[D]. Master's Thesis. Beijing: Chinese Academy of Agricultural Sciences, 2016. (in Chinese) |
| [8] |
DALE N. National research council nutrient requirements of poultry-ninth revised edition (1994)[J]. Journal of Applied Poultry Research, 1994, 3(1): 101. DOI:10.1093/japr/3.1.101 |
| [9] |
ZHANG L, YAN R, ZHANG R Q, et al. Effect of different levels of palygorskite inclusion on pellet quality, growth performance and nutrient utilization in broilers[J]. Animal Feed Science and Technology, 2017, 223: 73-81. DOI:10.1016/j.anifeedsci.2016.10.019 |
| [10] |
WANG L F, LIU C H, CHEN M, et al. A novel Lactobacillus plantarum strain P-8 activates beneficial immune response of broiler chickens[J]. International Immunopharmacology, 2015, 29(2): 901-907. DOI:10.1016/j.intimp.2015.07.024 |
| [11] |
SHEN X J, YI D, NI X Q, et al. Effects of Lactobacillus plantarum on production performance, immune characteristics, antioxidant status, and intestinal microflora of bursin-immunized broilers[J]. Canadian Journal of Microbiology, 2014, 60(4): 193-202. DOI:10.1139/cjm-2013-0680 |
| [12] |
SONG J, XIAO K, KE Y L, et al. Effect of a probiotic mixture on intestinal microflora, morphology, and barrier integrity of broilers subjected to heat stress[J]. Poultry Science, 2014, 93(3): 581-588. DOI:10.3382/ps.2013-03455 |
| [13] |
XIE R T, AMENYOGBE E, CHEN G, et al. Effects of feed fat level on growth performance, body composition and serum biochemical indices of hybrid grouper (Epinephelus fuscoguttatus×Epinephelus polyphekadion)[J]. Aquaculture, 2021, 530: 735813. DOI:10.1016/j.aquaculture.2020.735813 |
| [14] |
BROWN J A, CLINE T R. Urea excretion in the pig: an indicator of protein quality and amino acid requirements[J]. The Journal of Nutrition, 1974, 104(5): 542-545. DOI:10.1093/jn/104.5.542 |
| [15] |
HAHN J D, BIEHL R R, BAKER D H. Ideal digestible lysine level for early- and late-finishing swine[J]. Journal of Animal Science, 1995, 73(3): 773-784. DOI:10.2527/1995.733773x |
| [16] |
BUYSE J, JANSSENS G P J, DECUYPERE E. The effects of dietary L-carnitine supplementation on the performance, organ weights and circulating hormone and metabolite concentrations of broiler chickens reared under a normal or low temperature schedule[J]. British Poultry Science, 2001, 42(2): 230-241. DOI:10.1080/00071660120048492 |
| [17] |
唐志刚. 益生菌对饲喂不同营养水平日粮肉鸡消化和免疫功能的影响[D]. 硕士学位论文. 南京: 南京农业大学, 2010. TANG Z G. Effect of probiotics on immune and digestive functions of broilers fed diets with different nutrient levels[D]. Master's Thesis. Nanjing: Nanjing Agricultural University, 2010. (in Chinese) |
| [18] |
王煜琦, 吴腾龙, 宋春阳, 等. 植物乳杆菌与枯草芽孢杆菌对育肥猪生长性能和养分表观消化率及血清生化指标的影响[J]. 中国畜牧杂志, 2021, 57(8): 237-241. WANG Y Q, WU T L, SONG C Y, et al. Effects of Lactobacillu plantarum and Bacillus subtilis on growth performance, nutrient apparent digestibility and serum biochemical indexes of finishing pigs[J]. Chinese Journal of Animal Science, 2021, 57(8): 237-241 (in Chinese). |
| [19] |
SHON K S, HONG J W, KWON O S, et al. Effects of Lactobacillus reuteri-based direct-fed microbial supplementation for growing-finishing pigs[J]. Asian-Australasian Journal of Animal Sciences, 2005, 18(3): 370-374. DOI:10.5713/ajas.2005.370 |
| [20] |
VIGORS S, O'DOHERTY J V, KELLY A K, et al. The effect of divergence in feed efficiency on the intestinal microbiota and the intestinal immune response in both unchallenged and lipopolysaccharide challenged ileal and colonic explants[J]. PloS One, 2016, 11(2): e0148145. DOI:10.1371/journal.pone.0148145 |
| [21] |
HARDING S V, FRASER K G, WYKES L J. Probiotics stimulate liver and plasma protein synthesis in piglets with dextran sulfate-induced colitis and macronutrient restriction[J]. The Journal of Nutrition, 2008, 138(11): 2129-2135. DOI:10.3945/jn.108.090019 |
| [22] |
KHONYOUNG D, YAMAUCHI K E. Effects of heat-killed Lactobacillus plantarum L-137 on morphology of intestinal villi and epithelial cells in broiler chickens[J]. Journal of Applied Animal Research, 2012, 40(2): 140-147. DOI:10.1080/09712119.2011.640208 |




