2. 中国农业科学院北京畜牧兽医研究所, 北京 100193
2. Beijing Institute of Animal Science and Veterinary Medicine, Chinese Academy of Agricultural Sciences, Beijing 100193, China
沙棘是胡颓子科、沙棘属落叶性灌木,又称醋柳果、酸刺等,具有耐旱、抗风沙和在盐碱土地上生存的特性,因此在中国西北部常被用于沙漠绿化。同时沙棘也是一种药食同源的植物,含有黄酮类、皂苷类、维生素、糖类和有机酸等多种功能性成分,具有抗氧化、抗应激、促生长、抗肿瘤、降血压和降血脂等生理作用,其发挥作用的主要成分为黄酮类化合物[1-2]。沙棘黄酮还具有很强的体外抑菌作用,对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌等常见的病原菌都有抑制作用[3]。沙棘黄酮在人类生产生活中应用广泛,并且其在绵羊、鸡和猪上的应用已有报道[4-5]。有研究表明,沙棘黄酮可提高肉鸡平均日增重,降低腹脂率[6];提高断奶仔猪血清中瘦素含量,有助于改善猪的胴体品质[7]。在反刍动物方面,刘艳丰[8]在阿勒泰羊的饲粮中添加沙棘叶黄酮,发现其能显著提高瘤胃挥发性脂肪酸(VFA)的浓度,降低氨态氮(NH3-N)浓度,促进瘤胃代谢和微生物蛋白的合成,并提高其免疫性能。白齐昌等[9]通过体外产气法研究表明,沙棘黄酮可以改善绵羊的体外发酵,提高干物质降解率、有机物降解率和代谢能,添加水平过高会对纤维降解菌具有抑制作用,适宜添加水平为0.3%。目前,沙棘黄酮在反刍动物上多以羊为研究对象,并且大多进行体外试验,无法真正反映出沙棘黄酮在动物体内的作用效果。同时,在以往的研究中可知,黄酮对奶牛瘤胃发酵的改善及瘤胃微生物菌群的影响具有显著效果[10-12],而沙棘黄酮在奶牛上的应用却鲜有文献报道。本实验室前期已探究了沙棘黄酮对奶牛生长性能、乳中生物活性成分、血清免疫指标的影响[13],发现沙棘黄酮能够提高奶牛产奶量和乳成分含量以及抗氧化能力。因此,本研究在前期研究的基础上,进一步探讨沙棘黄酮对泌乳中期荷斯坦奶牛瘤胃发酵参数、细菌菌群结构及代谢产物的影响,以期为今后沙棘黄酮在反刍动物上的相关研究提供理论基础。
1 材料与方法 1.1 试验材料本试验所用沙棘黄酮购自西安某科技有限公司,纯度为40%,其他成分为沙棘多糖(20%)、灰分(20%)、粗蛋白质(10%)、水分(3%)、其他(7%)。
1.2 试验设计与饲养管理本试验在北京奶牛中心延庆基地良种场进行,选择产奶量[(35.5±3.6) kg/d]、泌乳日龄[(91.0±22.1) d]、胎次(1.3±0.5)相近的健康中国荷斯坦奶牛30头,随机分为3组,每组10头,在饲喂全混合日粮(TMR)的基础上,分别以口腔投喂方式饲喂0、60、100 g/(d·头)的沙棘黄酮,依次标记为BC组、BL组和BM组(沙棘黄酮的添加量根据本实验室前期对竹叶黄酮的研究经验及查阅沙棘黄酮的相关文献[9, 14-15]确定)。每组的试验牛均单独采用散栏带卧床式饲养,每天07:00、13:00、18:00对奶牛进行投料,09:30、15:30、21:30进行挤奶。试验期间奶牛自由采食,自由饮水,牛舍每天清扫、清粪。试验期共计75 d,其中预试期15 d,正试期60 d。基础饲粮参照NRC(2001)奶牛饲养标准配制,以TMR形式饲喂,TMR组成及营养水平见表 1。
|
|
表 1 TMR组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the TMR (DM basis) |
在正试期最后1天于晨饲前1 h使用口腔采液器采集瘤胃液。每头奶牛采集200 mL瘤胃液,采集的前50 mL瘤胃液舍弃(避免奶牛口腔黏液和采液器中的残留液体产生影响),采集后立即用4层纱布过滤,测定pH,然后将滤液分装到2 mL冻存管和10 mL离心管(按照瘤胃液体积与25%偏磷酸体积为10 ∶ 1的比例加入25%偏磷酸)。2 mL冻存管立即置于液氮中,于-80 ℃保存,用于测定瘤胃细菌菌群结构及代谢物含量;10 mL离心管置于-20 ℃冰箱中保存,用于测定NH3-N及VFA浓度。
1.4 瘤胃发酵参数的测定pH使用PHS-10型便携式pH计测量。NH3-N浓度参照冯宗慈等[17]的比色法测定。使用安捷伦7890B气相色谱仪检测瘤胃中VFA的浓度,气相色谱条件如下:硝基对苯二甲酸改性的聚乙二醇(DB-FFAP)填充柱,进样量为2 μL,氮气(N2)流速为30 mL/min,氢气(H2)流速为40 mL/min,空气流速为400 mL/min,总流量为54 mL/min,吹扫流量为3 mL/min,平均线速度为27.8 cm/s,分流比为50 ∶ 1,柱温为180 ℃,检测温度为280 ℃,进样口温度为250 ℃。
1.5 瘤胃细菌多样性的测定与分析本实验室前期研究结果表明,在饲粮中添加60 g/d的沙棘黄酮对生产性能的提高效果更佳[13]。因此,本研究只探究了0与60 g/d的沙棘黄酮对奶牛瘤胃细菌菌群及代谢物的影响。
瘤胃液在冰上解冻后使用PowerSoil DNA Isolation Kit试剂盒进行DNA提取,使用PCR进行扩增(引物:V3~V4区域,338F:5’-ACTCCTACGGGAGGCAGCAG-3’,806R:5’-GGACTACHVGGGTWTCTAAT-3’),将特定的接头序列拼接在目的DNA两端,构建瘤胃微生物16S rRNA基因文库。基于Illumina HiSeq双端测序得到原始数据,经碱基识别后转为sequencedreads,结果以FASTQ(fq)格式保存。
将HiSeq测序得到的数据拼接(merge)成1条序列Tags,并对reads质量和merge效果进行质控过滤。具体步骤参照余诗强等[11]的方法进行分析。
1.6 瘤胃代谢产物的测定与分析 1.6.1 代谢物萃取及衍生化瘤胃液室温解冻后涡旋10 s混匀,取50 μL瘤胃液加入300 μL分析甲醇,涡旋3 min,12 000 r/min、4 ℃下离心10 min;取上清液200 μL,20 ℃下静置30 min,12 000 r/min、4 ℃下离心3 min;取150 μL上清液用于上机分析。
1.6.2 代谢组学数据分析数据采集仪器系统主要包括超高效液相色谱(UPLC)和四级杆飞行时间质谱(AB SCIEX Triple TOF6600)。代谢物的定性定量分析使用三重四级杆质谱的多反应监测模式(MRM)完成,得到不同样品的液相色谱数据,对所有代谢物的提取离子色谱峰的峰面积进行积分,并校正不同样品中同一代谢物的色谱峰。
1.7 数据统计与分析采用Excel 2021进行数据整理,用SPSS 25.0中one-way ANOVA程序进行单因素方差分析,使用Duncan氏多重比较对组间差异进行分析,P≤0.05为差异显著。16S rRNA高通量测序结果采用SPSS 25.0统计软件中的独立样品t检验进行分析,P < 0.05为差异显著。
2 结果与分析 2.1 沙棘黄酮对泌乳中期荷斯坦奶牛瘤胃发酵参数的影响由表 2可知,饲粮中添加沙棘黄酮对泌乳中期荷斯坦奶牛瘤胃pH及NH3-N、丙酸、异丁酸、丁酸、异戊酸和总挥发性脂肪酸浓度均无显著影响(P>0.05)。与BC组相比,BL组的乙酸浓度及乙酸/丙酸显著升高(P < 0.05),但BL组及BM组的戊酸浓度显著降低(P < 0.05)。
|
|
表 2 沙棘黄酮对泌乳中期荷斯坦奶牛瘤胃发酵参数的影响 Table 2 Effects of seabuckthorn flavonoids on rumen fermentation parameters in mid-lactation Holstein dairy cows |
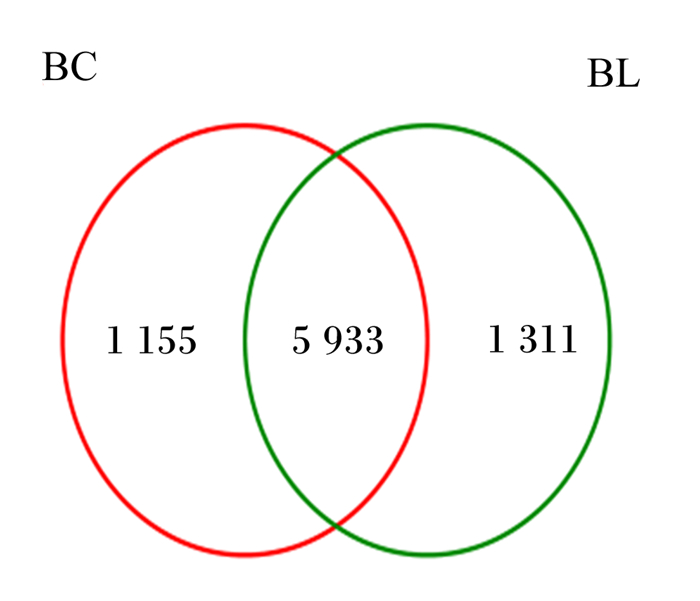
由图 1可以看出,随着测量的样本量的增加,稀释曲线趋于平缓。由图 2可知,BC组和BL组泌乳中期荷斯坦奶牛瘤胃液中共含有8 399个OTU,2组共有5 933个OTU,BC组特有1 155个OTU,占总OTU的13.75%,BL组特有1 311个OTU,占总OTU的22.10%,2组之间OTU数目存在一定的差异,且BL组含有的OTU数目较多。
|
横坐标代表随机抽取的测序数据量;纵坐标代表观测到的物种数量。 The abscissa represents the amount of sequencing data randomly extracted; the vertical axis represents the number of species observed. 图 1 稀释曲线 Fig. 1 Dilution curve |
|
BC代表BC组;BL代表BL组。下图同。 BC represents group BC; BL represents group BL. The same as below. 图 2 Venn图 Fig. 2 Venn diagram |
由表 3可知,BL组的Chao1指数和Shannon指数与BC组相比均无显著差异(P>0.05),与BC组相比,BL组的Simpson指数有下降的趋势(P=0.06),Coverage指数有上升的趋势(P=0.09)。
|
|
表 3 沙棘黄酮对泌乳中期荷斯坦奶牛瘤胃细菌多样性指数的影响 Table 3 Effects of seabuckthorn flavonoids on rumen bacterial diversity indexes in mid-lactation Holstein dairy cows |
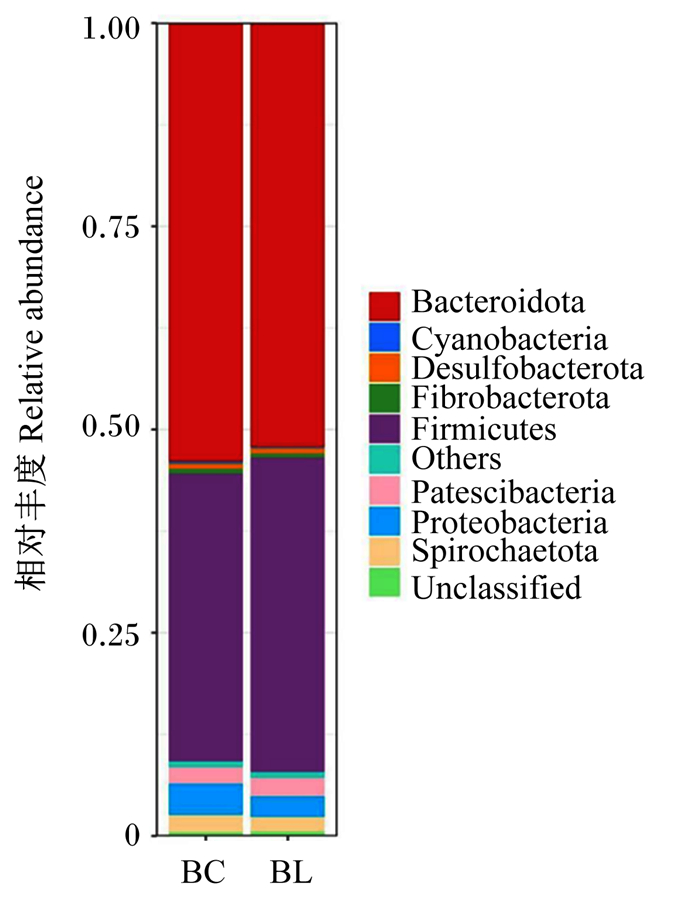
由图 3可知,BC组、BL组瘤胃液中共检测出24个细菌菌门,其中拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、螺旋体门(Spirochaetota)及Patescibacteria相对丰度>1%;拟杆菌门、厚壁菌门的相对丰度占比前2,为门水平上的优势菌门。与BC组相比,BL组的厚壁菌门、Patescibacteria相对丰度较高,其他菌门相对丰度较低,但差异均不显著(P>0.05)。
|
Bacteroidota: 拟杆菌门; Cyanobacteria: 蓝菌门; Desulfobacterota: 脱硫杆菌门; Fibrobacterota: 纤维杆菌门; Firmicutes: 厚壁菌门; Others: 其他; Proteobacteria: 变形菌门; Spirochaetota: 螺旋菌门; Unclassified: 未分类序列。 图 3 门水平上主要菌群分布图 Fig. 3 Distribution diagram of main microflora at phylum level |
图 4可知,BC组、BL组瘤胃液中共检测出334个细菌菌属,其中18个菌属的相对丰度>1%;普雷沃氏菌属(Prevotella)、解琥珀酸菌属(Succiniclasticum)和Muribaculaceae_norank的相对丰度占比前3,为属水平上的优势菌属。与BC组相比,BL组泌乳中期荷斯坦奶牛瘤胃液中拟杆目菌RF16菌群(Bacteroidales_RF16_group)、理研菌科_RC9_肠道群(Rikenellaceae_RC9_gut_group)的相对丰度显著增加(P < 0.05),F082_norank的相对丰度有增加的趋势(0.05 < P < 0.01);普雷沃氏菌属(Prevotella)、解琥珀酸菌属(Succiniclasticum)、Muribaculaceae_norank的相对丰度有所下降(P>0.05)。

|
[Eubacterium]coprostanoligenes group_norank: 产粪甾醇真杆菌属未分类群; [Eubacterium]ruminantium group: 啮齿真杆菌属群; Anaeroplasma: 厌氧枝原体属; Anaerovibrio: 厌氧弧菌属; Bacteroidales RF16 group_norank: 拟杆菌目RF16未分类菌群; Bacteroidales_norank: 未分类拟杆菌目; Butyrivibrio: 丁酸弧菌属; Christensenellaceae R-7 group: 克里斯滕森菌科R-7菌群; Clostridia UCG-014_norank: 梭状芽孢杆菌属UCG-014未分类; Fibrobacter: 丝状杆菌属; Lachnospiraceae_NK3A20_group: 毛螺菌科_NK3A20_菌群; Lachnospiraceae_Unclassified: 毛螺菌科_未分类序列; Others: 其他; Prevotella: 普雷沃氏菌属; Prevotellaceae Ga6A1 group: 普雷沃氏菌科Ga6A1菌群; Prevotellaceae UCG-001:普雷沃氏菌科UCG-001; Prevotellaceae UCG-003:普雷沃氏菌科UCG-003; Prevotellaceae UCG-004:普雷沃氏菌科UCG-004; Pseudobutyrivibrio: 假丁酸弧菌属; Rikenellaceae_RC9_gut_group: 理研菌科_RC9_菌群; Ruminococcus: 瘤胃球菌属; Succiniclasticum: 解琥珀酸菌属; Succinivibrionaceae UCG-001:琥珀酸弧菌科UCG-001; Succinivibrionaceae UCG-002:琥珀酸弧菌科UCG-002; Treponema: 密螺旋体属; Unclassified: 未分类序列; Veillonellaceae UCG-001:韦荣球菌科UCG-001。 图 4 属水平上主要菌群分布图 Fig. 4 Distribution diagram of main microflora at genus level |
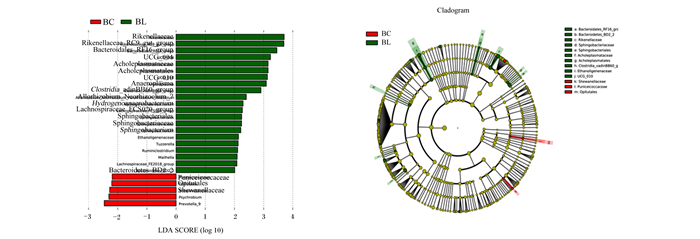
由图 5可知,丰佑菌目(Opitutales)、希瓦氏菌科(Shewanellaceae)、紫红球菌科(Puniceicoccaceae)、普雷沃氏菌属_9(Prevotella_9)及菖苣属(Psychrobium)这5种细菌在BC组中发挥重要作用;无胆甾原体目(Acholeplasmatales)、Ethanoligenenaceae、瘤胃梭菌属(Ruminiclostridium)、梭状芽孢杆菌属_vadinBB60_菌群(Clostridia_vadinBB60_group)、鞘氨醇杆菌科(Sphingobacteriaceae)、厌氧原体属(Anaeroplasma)、理研菌科_RC9_肠道菌群(Rikenellaceae_RC9_gut_group)、理研菌科(Rikenellaceae)、胆质菌科(Acholeplasmataceae)、拟杆菌目_RF16_菌群(Bacteroidales_RF16_group)、拟杆菌门_BD2_2(Bacteroidetes_BD2_2)、鞘氨杆菌属(Sphingobacterium)、毛螺菌科_FCS020_菌群(Lachnospiraceae_FCS020_group)、鞘氨醇杆菌目(Sphingobacteriales)、噬糖厌氧产氢杆菌属(Hydrogenoanaerobacterium)、毛螺菌科_FE2018_菌群(Lachnospiraceae_FE2018_group)、UCG-004、Allorhizobium_Neorhizobium_Pararhizobium_Rhizobium这18个细菌在BL组中发挥重要作用。
|
Opitutales: 丰佑菌目; Shewanellaceae: 希瓦氏菌科; Puniceicoccaceae: 紫红球菌科; Prevotella_9:普雷沃氏菌属_9; Psychrobium: 菖苣属; Acholeplasmatales: 无胆甾原体目; Ruminiclostridium: 瘤胃梭菌属; Clostridia_vadinBB60_group: 梭状芽孢杆菌_vadinBB60_菌群; Sphingobacteriaceae: 鞘氨醇杆菌科; Anaeroplasma: 厌氧原体属; Rikenellaceae_RC9_gut_group: 理研菌科_RC9_肠道菌群; Rikenellaceae: 理研菌科; Bacteroidales_RF16_group: 拟杆菌目_RF16_菌群; Bacteroidetes_BD2_2:拟杆菌门_BD2_2; Sphingobacterium: 鞘氨杆菌属; Lachnospiraceae_FCS020_group: 毛螺菌科_FCS020_菌群; Sphingobacteriales: 鞘氨醇杆菌目; Hydrogenoanaerobacterium: 噬糖厌氧产氢杆菌属; Lachnospiraceae_FE2018_group: 毛螺菌科_FE2018_菌群; Acholeplasmataceae: 胆质菌科。A:LDA分析柱状图LDA analysis column chart;B:进化分枝图evolutionary branching chart。 A、B图中,不同颜色代表不同分组。红色代表在BC组发挥重要的菌群,绿色代表在BL组起重要作用的微生物群。 In A and B charts, different colors represent different groups. Red represents the important microflora in group BC, and green represents the important microbial group in group BL. 图 5 LEFSE差异分析图 Fig. 5 LEFSE difference analysis diagram |
从图 6可以看出,BC组、BL组之间的分离是较好的,代表组间聚类差异显著。
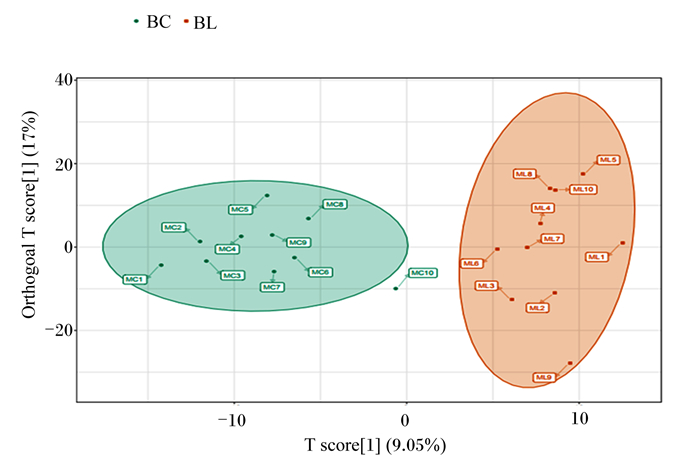
|
横坐标表示预测成分得分值,横坐标方向可以看出组间的差距;纵坐标表示正交成分得分值,纵坐标方向可以看出组内的差距;百分比表示成分对数据集的解释度。 The abscissa represents the score values of the predicted components. The abscissa direction shows the difference between the groups. The ordinate represents the scores of orthogonal components, and the ordinate direction shows the difference within the group. Percentage represents the degree of interpretation of the data set by the components. 图 6 OPLS-DA得分图 Fig. 6 OPLS-DA score diagram |
由表 4可知,2组共筛选出25种差异代谢物。与BC组相比,BL组6种差异代谢物含量显著下调(P<0.05),包括(2S)-2-氨基-5-戊酮酸[(2S)-2-amino-5-oxopentanoic acid]、3-脱氢奎尼酸(3-dehydroquinic acid)、D-来苏糖(D-lyxose)、磷酸高丝氨酸(o-phosphohomoserine)、5, 6-二羟基-1, 3-二烯-1-羧酸(5, 6-dihydroxycyclohexa-1, 3-diene-1-carboxylate)以及N-acetylpuromycin;19种差异代谢物含量显著上调(P<0.05),包括苯丙酮酸(phenylpyruvic acid)、邻氨基苯甲酸(anthranilic acid)、岩白菜素(bergenin)、烟胺比林(nifenazone)、天竺葵色素(pelargonidin)、芦丁(rutin)、7, 8, 4′-三羟基异黄酮(7, 8, 4′-trihydroxyisoflavone)、西阿尼醇(cianidanol)、顺-3, 4-白天竺葵甙元(cis-3, 4-leucopelargonidin)、2-羟基-2, 3-染料木素(2-hydroxy-2, 3-dihydrogenistein)、(2S)-2-azaniumyl-3-[4-(3-methylbut-2-enyl)-1H-indol-3-yl]propanoate2-phenyl-1H-benzimidazole-5-sulfonic acid、大黄素(emodin)、2, 3, 7, 9-tetrahydroxy-1-methyl-6H-benzo[c]chromen-6-one、2, 6, 7, 4′-tetrahydroxyisoflavanone、2-[2-(1H-indol-3-yl)acetyl]amino]propanoate、香橙素(aromadendrin)、4-[(E)-2-carboxyethenyl]-2, 6-dimethoxyphenolate及黄颜木素(fustin)。
|
|
表 4 差异代谢物 Table 4 Differential metabolites1) |
从图 7、图 8可知,25种差异代谢物主要分布在与蛋白质代谢、糖类代谢相关的9条代谢途径上,其中代谢产物显著富集在苯丙氨酸、酪氨酸和色氨酸生物合成途径以及氨基酸生物合成途径中。相比于其他代谢途径,富集在上述2个代谢途径上的差异代谢物相对较多,分别为3和5个。
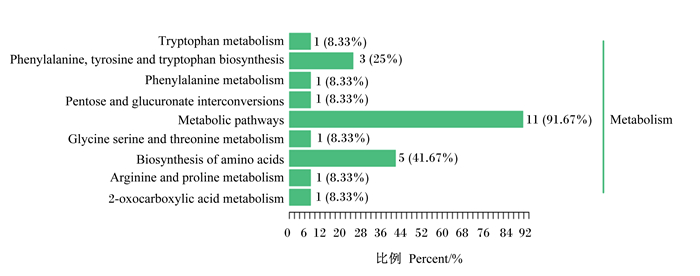
|
Tryptophan metabolism: 色氨酸代谢; Phenylalanine, tyrosine and tryptophan biosynthesis: 苯丙氨酸、酪氨酸和色氨酸的生物合成; Phenylalanine metabolism: 苯丙氨酸代谢; Pentose and glucuronate interconversions: 戊糖和葡糖醛酸的相互转化; Metabolic pathways: 代谢途径; Glycine serine and threonine metabolism: 甘氨酸、丝氨酸和苏氨酸代谢; Biosynthesis of amino acids: 氨基酸的生物合成; Arginine and proline metabolism: 精氨酸和脯氨酸代谢; 2-oxocarboxylic acid metabolism: 2-氧代羧酸代谢。下图同the same as below。 纵坐标为KEGG代谢通路的名称,横坐标为注释到该通路下的差异代谢物个数及其个数占被注释上的代谢物总数的比例。The ordinate is the name of KEGG metabolic pathway, and the abscissa is the number of differential metabolites annotated to this pathway and the proportion of their number to the total number of metabolites annotated. 图 7 差异代谢物KEGG分类图 Fig. 7 KEGG classification diagram of differential metabolites |
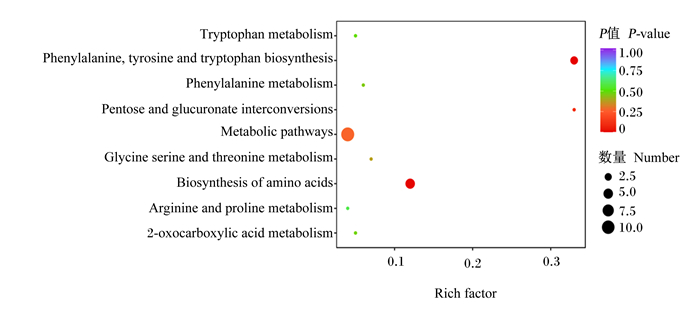
|
横坐标表示每个通路对应的Rich factor,纵坐标为通路名称,点的颜色为P值,越红表示富集越显著。点的大小代表富集到的差异代谢物的个数多少。 The abscissa represents the Rich factor corresponding to each pathway; the ordinate represents the name of the pathway; the color of the dot is P-value. The redder the color of the dot, and the more significant the enrichment. The size of the point represents the number of differential metabolites enriched. 图 8 差异代谢物KEGG富集图 Fig. 8 KEGG enrichment diagram of differential metabolites |
VFA包括乙酸、丙酸、丁酸、戊酸和异戊酸等,是淀粉等碳水化合物在瘤胃内发酵的终产物,也是反刍动物维持正常生命活动及生产所需的主要能量来源[18]。乙酸是动物合成脂肪的前体,也是合成乳脂的主要成分[19-20]。丙酸主要被转移到肝脏通过糖异生作用生成葡萄糖,为葡萄糖合成提供80%~90%的原料[21]。戊酸与异戊酸、异丁酸等含4~5个碳原子的短链VFA称为异位酸,异位酸可以提高瘤胃内微生物蛋白的合成,抑制脲酶活性,增加非蛋白氮的利用,同时,还可以促进瘤胃内乙酸的合成[22-24]。白齐昌等[9]通过体外产气法研究沙棘黄酮对绵羊体外产气、瘤胃发酵参数和微生物菌群的影响,结果发现添加0.3%的沙棘黄酮显著增加了乙酸和丙酸的浓度。此结果与本研究相似,添加60 g/d的沙棘黄酮使泌乳奶牛瘤胃内乙酸浓度及乙酸/丙酸显著升高,戊酸浓度显著下降。这说明添加60 g/d的沙棘黄酮促进了瘤胃微生物中有益菌的生长,促进乙酸生成菌的繁殖与代谢,有助于其对碳水化合物的发酵与分解,进而促进泌乳奶牛对营养物质的代谢与吸收;并且沙棘黄酮并没有改变奶牛的发酵类型,奶牛仍是乙酸型发酵,甚至使乙酸生成量升高,在后续的研究中可知沙棘黄酮可促进奶牛瘤胃内能生成乙酸的纤维素分解菌生长,并促进氨基酸代谢。而对于某些纤维素分解菌来讲氨是唯一合成自身蛋白质的氮源[25]。这说明沙棘黄酮有利于瘤胃内产生乙酸的纤维素分解菌的生长,进而使乙酸生成增加。同时作为异位酸的戊酸含量下降、乙酸含量升高,也可进一步推测沙棘黄酮可促进异位酸向乙酸转化,乙酸可进一步转化为乙酰辅酶A作为脂肪酸合成的前体参与合成脂肪酸,乙酸的增加可为乳脂的合成提供前体物质。
3.2 沙棘黄酮对泌乳中期荷斯坦奶牛瘤胃细菌菌群的影响反刍动物瘤胃内的微生物复杂多样,包括细菌、古菌、真菌、原虫以及少量噬菌体,这些微生物可以帮助宿主消化和同化食物,为宿主提供能量和营养,与动物机体存在着共生关系[26-27]。本研究以泌乳中期荷斯坦奶牛为研究对象,利用16S rRNA高通量测序技术探讨饲粮中添加沙棘黄酮对奶牛瘤胃细菌多样性的影响。本研究中样本覆盖率高达98%,且稀释曲线趋于平缓,说明样本量充足能够真实地反映泌乳中期荷斯坦奶牛瘤胃细菌的种类和多样性。α多样性指数分析表明,BL组Simpson指数有降低的趋势,其他指数均无显著变化,说明饲粮添加60 g/d的沙棘黄酮可使瘤胃内细菌多样性增加,而对其丰富度无显著影响。研究表明,黄酮类化合物具有抑菌活性,能够抑制一些对动物有害的细菌、真菌等[10, 28]。瘤胃细菌多样性增加可能是因为沙棘黄酮可以抑制一些病原菌生长,从而使一些与其竞争、拮抗的细菌数量增加。
前人研究表明,瘤胃细菌主要由拟杆菌门和厚壁菌门2个门组成,它们共同构成了瘤胃内容物中约90%的16S rRNA基因丰度,且不会随品种、饲粮和饲养环境的改变而改变[29]。本研究中泌乳中期荷斯坦奶牛的优势菌门也为拟杆菌门和厚壁菌门。拟杆菌主要通过分泌碳水化合物反应酶来分解饲粮中的碳水化合物,但对纤维素不起作用[30]。而厚壁菌门主要起到降解纤维素的作用[31]。本研究中,与BC组相比,BL组厚壁菌门的相对丰度较高。Zhan等[32]的研究表明,在初产荷斯坦母牛的饲粮中添加苜蓿黄酮提取物可以改变瘤胃微生物组成,使拟杆菌门相对丰度降低,厚壁菌门相对丰度升高,但差异不显著,此结果与本研究相似。De Nardi等[33]饲喂100 g/d的多酚精油(主要成分为黄酮)给荷斯坦奶牛,增加了厚壁菌门和拟杆菌门的丰富度,说明黄酮可在一定程度上促进厚壁菌的生长与增殖,进一步促进瘤胃内纤维素的降解,提升荷斯坦奶牛对营养物质的消化与吸收功能。本试验中添加沙棘黄酮后,瘤胃中厚壁菌门和拟杆菌门等优势菌门的丰富度并没有显著变化,说明沙棘黄酮对瘤胃菌群无不良影响。
从属水平上分析,本次研究2组的优势菌属为普雷沃氏菌属,这与前人研究结果[34-36]一致。普雷沃氏菌属主要代谢瘤胃中的半纤维素、果胶、蛋白质等,主要产生乙酸、甲酸等[37]。本研究中,BL组较BC组的普雷沃氏菌属、解琥珀酸菌属的相对丰度有所下降,可能是由于厚壁菌门的相对丰度升高,厚壁菌门中纤维降解菌的相对丰度升高抑制了普雷沃氏菌的生长。有研究表明,解琥珀酸菌属中的产琥珀酸杆菌相对丰度与乙酸的生成呈负相关与戊酸的生成呈正相关[38]。与本试验的研究结果一致,产琥珀酸菌相对丰度的下降使乙酸的生成增加,戊酸的生成减少。毛螺菌科_FE2018_菌群、毛螺菌科_FCS020_菌群和Tuzzerella 3个菌属同属于毛螺菌科厚壁菌门,均为BL组中发挥重要作用的菌群,能够降解多糖、纤维生成乙酸[39]。并且与BC组相比,BL组的泌乳中期荷斯坦奶牛瘤胃细菌中氢氧杆菌属、瘤胃梭菌属及理研菌科_RC9_肠道菌群的相对丰度显著增加。研究表明,理研菌科主要在降解纤维多糖方面发挥作用,瘤胃梭菌属也具有降解纤维素的功能,二者均能生成乙酸,而氢氧杆菌属也具有降解葡萄糖生成乙酸的功能[40-43]。占今舜[10]在奶牛饲粮中添加苜蓿黄酮,发现普雷沃氏菌属、琥珀酸菌属的相对丰度随着苜蓿黄酮添加量的升高呈线性下降趋势,该结果与本研究相似。这说明沙棘黄酮可以提高瘤胃内细菌的丰富度和多样性,并且通过提高瘤胃内纤维降解菌的相对丰度,提高乙酸的浓度,进而提高乳脂率。
3.3 沙棘黄酮对泌乳中期荷斯坦奶牛瘤胃代谢物的影响相对于一些传统的研究方法,代谢组学可以通过核磁共振、液相色谱/质谱(LC/MS)等高通量技术更加清晰直观地检测到机体代谢物和代谢通路的变化[44]。与BC组相比,BL组的泌乳中期荷斯坦奶牛瘤胃中6种差异代谢物含量显著下调,19种差异代谢物含量显著上调。对上述25种差异代谢物进行KEGG富集分析,结果表明,25种代谢物分别分布在9条代谢通路上,代谢物显著富集的通路有2条,分别是苯丙氨酸、酪氨酸和色氨酸生物合成通路、氨基酸的生物合成通路。
与氨基酸代谢相关的通路中共检测到5种代谢产物,其中2种代谢物在BL组中峰值更高,分别是苯丙酮酸以及邻氨基苯甲酸;剩余3种代谢物在BC组的峰值更高,分别是谷氨酰胺、3-脱氢奎尼酸以及高丝氨酸邻磷酸。芳香族氨基酸是高等动物所必需的,通常在细菌和植物中通过莽草酸途径由葡萄糖合成[45]。芳香族氨基酸包括苯丙氨酸、酪氨酸和色氨酸,在蛋白质生产和糖原合成等过程中都发挥着重要的作用[46]。苯丙氨酸为生糖生酮氨基酸,主要通过不可逆的羟基化反应生成酪氨酸,还可通过转氨基作用先生成对羟基苯乙酸之后再生成苯丙酮酸,苯丙酮酸可以转化为富马酸盐进入三羧酸循环供能,若生成过多则会损伤中枢神经系统或出现苯丙酮尿症[47]。
3-脱氢奎尼酸、谷氨酰胺和邻氨基苯甲酸均为莽草酸代谢途径的中间产物,在微生物合成芳香族氨基酸过程中发挥着重要作用[48]。首先,磷酸烯醇式丙酮酸(PEP)和赤藓糖-4-磷酸发生缩合作用生成3-脱氢奎尼酸,之后转化为莽草酸,再与PEP结合生成分支酸,一部分分支酸在羧甲基变位酶(CM)的催化下转化为预苯酸,另一部分则经脱羧、脱水、脱羟基等过程生成苯丙氨酸、酪氨酸等氨基酸。预苯酸可被邻氨基苯甲酸合成酶(AS)催化生成谷氨酰胺后转化为邻氨基苯甲酸,之后进一步生成色氨酸[49]。本研究中观察到3-脱氢奎尼酸和谷氨酰胺的生成下调,苯丙酮酸和邻氨基苯甲酸的生成上调,说明沙棘黄酮对芳香族氨基酸的代谢过程具有调节作用。苯丙酮酸含量适当上调有助于能量的生成,而邻氨基苯甲酸含量上调有助于色氨酸的生成,进而有助于动物性蛋白质的补充,有利于奶牛对蛋白质的吸收利用。
4 结论本研究表明,在泌乳中期荷斯坦奶牛饲粮中添加60 g/(d·头)沙棘黄酮提高了乙酸浓度和乙酸/丙酸,降低了戊酸浓度,提高了奶牛瘤胃中拟杆菌目RF16菌群、理研菌科_RC9_肠道菌群、瘤胃梭菌属的相对丰度,同时提高了泌乳中期荷斯坦奶牛瘤胃中与苯丙氨酸、酪氨酸和色氨酸生物合成通路相关的代谢物含量,为脂质的合成提供了更多的前体物。
| [1] |
张东, 邬国栋. 沙棘黄酮的化学成分及药理作用研究进展[J]. 中国药房, 2019, 30(9): 1292-1296. ZHANG D, WU G D. Advances in chemical constituents and pharmacological action of flavonoids from seabuckthorn[J]. China Pharmacy, 2019, 30(9): 1292-1296 (in Chinese). |
| [2] |
崔立柱, 付依依, 刘士伟, 等. 沙棘营养价值及产业发展概况[J]. 食品研究与开发, 2021, 42(11): 218-224. CUI L Z, FU Y Y, LIU S W, et al. Nutritional value and industry development of sea buckthorn[J]. Food Research and Development, 2021, 42(11): 218-224 (in Chinese). |
| [3] |
焦岩, 常影, 余世锋, 等. 大果沙棘总黄酮体外抗氧化和抑菌作用研究[J]. 食品研究与开发, 2015, 36(19): 12-15. JIAO Y, CHANG Y, YU S F, et al. Study on the antioxidant and antibacterial activities in vitro of seabuckthorn flavonoids[J]. Food Research and Development, 2015, 36(19): 12-15 (in Chinese). DOI:10.3969/j.issn.1005-6521.2015.19.004 |
| [4] |
胡高爽, 高山, 王若桦, 等. 沙棘活性物质研究及开发利用现状[J]. 食品研究与开发, 2021, 42(3): 218-224. HU G S, GAO S, WANG R H, et al. Research on development and utilization of active substances in seabuckthorn[J]. Food Research and Development, 2021, 42(3): 218-224 (in Chinese). |
| [5] |
李苗苗, 曹阳. 沙棘枝叶的营养价值及其在畜禽生产中的应用[J]. 中国饲料, 2018(23): 77-81. LI M M, CAO Y. The nutritional value of seabuckthorn leaves and its application in livestock and poultry production[J]. China Feed, 2018(23): 77-81 (in Chinese). |
| [6] |
郑伟, 王勇, 王慧媛, 等. 沙棘叶和沙棘叶黄酮对肉鸡生产性能、屠宰性能及血液生化指标的影响[J]. 当代畜禽养殖业, 2015(12): 6-8. ZHENG W, WANG Y, WANG H Y, et al. Effects of seabuckthorn leaves and flavonoids on performance, slaughter performance and blood biochemical indices of broilers[J]. Modern Livestock and Poultry Breeding Industry, 2015(12): 6-8 (in Chinese). |
| [7] |
张志宏, 李垚, 金赛勉, 等. 沙棘总黄酮对不同品种猪胭体品质与瘦素表达的影响[C]//中国畜牧兽医学会动物营养学分会第八届全国会员代表大会暨第十次动物营养学术研讨会. 杭州: 中国畜牧兽医学会动物营养学分会, 2008: 549. ZHANG Z H, LI Y, JIN S M, et al. Effect of total flavonoids of Hippophae on carcass traits and leptin mRNA expression in different breed of pig[C]//Animal Nutrition Branch of Chinese Society of Animal Husbandry and Veterinary Medicine 8th National Member Congress and 10th animal nutrition symposium. Hangzhou: Animal Nutrition Branch of Chinese Society of Animal Husbandry, 2008: 549. (in Chinese) |
| [8] |
刘艳丰. 沙棘叶及其黄酮对阿勒泰羊生产性能、血液指标和脂代谢影响的研究[D]. 博士学位论文. 石河子: 石河子大学, 2019. LIU Y F. Effects of seabuckthorn leaves and flavonoids of seabuckthorn leaves on production performance, blood indexes and lipid metabolism of altay sheep[D]. Ph. D. Thesis. Shihezi: Shihezi University, 2019(in Chinese) |
| [9] |
白齐昌, 郝小燕, 项斌伟, 等. 沙棘黄酮对绵羊体外产气量、瘤胃发酵参数和微生物菌群的影响[J]. 动物营养学报, 2020, 32(3): 1405-1414. BAI Q C, HAO X Y, XIANG B W, et al. Effects of sea buckthorn flavone on gas production, rumen fermentation parameters and microflora population of sheep in vitro[J]. Chinese Journal of Animal Nutrition, 2020, 32(3): 1405-1414 (in Chinese). |
| [10] |
占今舜. 苜蓿黄酮对奶牛生产性能、瘤胃代谢和免疫性能影响的研究[D]. 博士学位论文. 扬州: 扬州大学, 2016. ZHAN J S. Effect of alfalfa flavonoids on production performance, ruminal metabolism and immunity[D]. Ph. D. Thesis. Yangzhou: Yangzhou University, 2016. (in Chinese) |
| [11] |
余诗强, 熊安然, 潘予琮, 等. 青蒿提取物对泌乳奶牛瘤胃发酵参数及微生物区系的影响[J]. 动物营养学报, 2021, 33(11): 6431-6444. YU S Q, XIONG A R, PAN Y C, et al. Effects of Artemisia annua L. extracts on rumen fermentation parameters and microflora of lactating dairy cows[J]. Chinese Journal of Animal Nutrition, 2021, 33(11): 6431-6444 (in Chinese). |
| [12] |
王帅, 贾琦珍, 陈根元, 等. 小花棘豆黄酮对绵羊瘤胃微生物数量的影响[J]. 华北农学报, 2014, 29(z1): 136-141. WANG S, JIA Q Z, CHEN G Y, et al. Effects of flavonoid of Oxytropis glabra DC on microbial number in rumen of sheep[J]. Acta Agriculturae Boreali-sinica, 2014, 29(z1): 136-141 (in Chinese). |
| [13] |
张一涵, 贺李莹, 陈逸, 等. 沙棘黄酮对泌乳中期荷斯坦奶牛生产性能、乳中生物活性成分及血清生化和抗氧化指标的影响[J]. 动物营养学报, 2022, 34(6): 1-10. ZHANG Y H, HE L Y, CHEN Y, et al. Effects of seabuckthorn flavonoids on performance, milk bioactive components and serum biochemical and antioxidant indexes of holstein cows in mid-lactation[J]. Chinese Journal of Animal Nutrition, 2022, 34(6): 1-10 (in Chinese). |
| [14] |
刘艳丰, 唐淑珍, 聂存喜, 等. 沙棘黄酮对阿勒泰羊冬羔生长性能和脂肪酶活性的影响[J]. 饲料工业, 2019, 40(15): 44-48. LIU Y F, TANG S Z, NIE C X, et al. Effects of seabuckthorn flavonoids on growth performance and lipase activity of Altay lambs[J]. Feed Industry, 2019, 40(15): 44-48 (in Chinese). |
| [15] |
李义, 童津津, 栗明月, 等. 竹叶提取物对热应激奶牛泌乳性能及血清生化、抗氧化和免疫指标的影响[J]. 动物营养学报, 2021, 33(2): 900-912. LI Y, TONG J J, LI M Y, et al. Effects of bamboo leaf extract on lactation performance and indexes of biochemical, antioxidant and immune in serum of dairy cows during heat stress[J]. Chinese Journal of Animal Nutrition, 2021, 33(2): 900-912 (in Chinese). |
| [16] |
冯仰廉, 周建民, 张晓明, 等. 我国奶牛饲料产奶净能值测算方法的研究[J]. 中国畜牧杂志, 1987(1): 8-11. FENG Y L, ZHOU J M, ZHANG X M, et al. Study on the calculation method of net energy value of dairy milk production from feed in China[J]. Chinese Journal of Animal Science, 1987(1): 8-11 (in Chinese). |
| [17] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010(6): 37. FENG Z C, GAO M. Improvement of colorimetric method for determination of ammonia nitrogen in rumen fluid[J]. Animal Husbandry and Feed Science, 2010(6): 37 (in Chinese). |
| [18] |
张帆, 王彦芦, 李文娟, 等. 蒸汽压片玉米调控瘤胃发酵与营养物质消化的研究进展[J]. 中国畜牧杂志, 2022, 58(1): 1-5. ZHANG F, WANG Y L, LI W J, et al. The regulation role of steam-flaked corn in rumen fermentation and nutrient digestion: a review[J]. Chinese Journal of Animal Science, 2022, 58(1): 1-5 (in Chinese). |
| [19] |
王淑玲, 王后福, 盖叶顶, 等. 反刍动物生成VFA的研究进展[J]. 中国草食动物科学, 2019, 39(5): 46-49. WANG S L, WANG H F, GAI Y D, et al. Advances in research on the production of VFA by ruminants[J]. China Herbivore Science, 2019, 39(5): 46-49 (in Chinese). |
| [20] |
李旺. 瘤胃挥发性脂肪酸的作用及影响因素[J]. 中国畜牧杂志, 2012, 48(7): 63-66. LI W. The effect and influence factors of rumen volatile fatty acid[J]. Chinese Journal of Animal Science, 2012, 48(7): 63-66 (in Chinese). |
| [21] |
陈希, 姜婉茹, 叶平生, 等. 麦秸对湖羊瘤胃发酵代谢及肠道组织形态的影响[J]. 中国农业大学学报, 2021, 26(8): 120-130. CHEN X, JIANG W R, YE P S, et al. Effect of wheat straw feeding on rumen fermentation metabolism and intestinal tissue morphology of Hu sheep[J]. Journal of China Agricultural University, 2021, 26(8): 120-130 (in Chinese). |
| [22] |
ROMAN-GARCIA Y, DENTON B L, MITCHELL K E, et al. Conditions stimulating neutral detergent fiber degradation by dosing branched-chain volatile fatty acids.Ⅰ: comparison with branched-chain amino acids and forage source in ruminal batch cultures[J]. Journal of Dairy Science, 2021, 104(6): 6739-6755. DOI:10.3168/jds.2020-20054 |
| [23] |
FELIX A, COOK R M, HUBER J T. Effect of feeding isoacids with urea on growth and nutrient utilization by lactating cows[J]. Journal of Dairy Science, 1980, 63(11): 1943-1946. DOI:10.3168/jds.S0022-0302(80)83162-6 |
| [24] |
FELIX A, COOK R M, HUBER J T. Isoacids and urea as a protein supplement for lactating cows fed corn silage[J]. Journal of Dairy Science, 1980, 63(7): 1098-1103. DOI:10.3168/jds.S0022-0302(80)83052-9 |
| [25] |
韩正康, 陈杰. 反刍动物瘤胃的消化和代谢[M]. 北京: 科学出版社, 1988: 19-20. HAN Z K, CHEN J. Rumen digestion and metabolism in ruminants[M]. Beijing: Science Press, 1988: 19-20 (in Chinese). |
| [26] |
LIU X, SHA Y Z, DINGKAO R Q, et al. Interactions between rumen microbes, VFAs, and host genes regulate nutrient absorption and epithelial barrier function during cold season nutritional stress in tibetan sheep[J]. Frontiers in Microbiology, 2020, 11: 593062. DOI:10.3389/fmicb.2020.593062 |
| [27] |
崔浩然, 郭雪峰, 金巍. 反刍动物瘤胃微生物菌群结构影响因素的研究进展[J]. 中国畜牧杂志, 2021, 57(11): 6-11. CUI H R, GUO X F, JIN W. Research progress on factors affecting rumen microbial flora structure[J]. Chinese Journal of Animal Science, 2021, 57(11): 6-11 (in Chinese). |
| [28] |
王海涛. 大豆异黄酮的抑菌活性及其机制的研究[D]. 硕士学位论文. 大连: 辽宁师范大学, 2009. WANG H T. Anti-microoganism activity and anti-microbial mechanism of soybean isoflavone[D]. Master's Thesis. Dalian: Liaoning Normal University, 2009. (in Chinese) |
| [29] |
BICKHART D M, WEIMER P J. Symposium review: host-rumen microbe interactions may be leveraged to improve the productivity of dairy cows[J]. Journal of Dairy Science, 2018, 101(8): 7680-7689. DOI:10.3168/jds.2017-13328 |
| [30] |
NAAS A E, MACKENZIE A K, MRAVEC J, et al. Do rumen Bacteroidetes utilize an alternative mechanism for cellulose degradation?[J]. mBio, 2014, 5(4): e01401-e01414. |
| [31] |
MYER P R, SMITH T P L, WELLS J E, et al. Rumen microbiome from steers differing in feed efficiency[J]. PLoS One, 2015, 10(6): e0129174. DOI:10.1371/journal.pone.0129174 |
| [32] |
ZHAN J S, LIU M M, WU C X, et al. Effects of alfalfa flavonoids extract on the microbial flora of dairy cow rumen[J]. Asian-Australasian Journal of Animal Sciences, 2017, 30(9): 1261-1269. DOI:10.5713/ajas.16.0839 |
| [33] |
DE NARDI R, MARCHESINI G, LI S C, et al. Metagenomic analysis of rumen microbial population in dairy heifers fed a high grain diet supplemented with dicarboxylic acids or polyphenols[J]. BMC Veterinary Research, 2016, 12: 29. DOI:10.1186/s12917-016-0653-4 |
| [34] |
甄玉国, 陈雪, 朴光赫, 等. 米曲霉培养物与酵母培养物组合对绵羊瘤胃菌群多样性的影响[J]. 中国畜牧杂志, 2018, 54(6): 96-100. ZHEN Y G, CHEN X, PIAO G H, et al. Effects of aspergillus oryzae culture and yeast culture combination on rumen microbial diversity of sheep[J]. Chinese Journal of Animal Science, 2018, 54(6): 96-100 (in Chinese). |
| [35] |
李希, 毛杨毅, 罗惠娣, 等. 饲粮纤维水平对育肥羔羊瘤胃微生物组成及多样性的影响[J]. 中国畜牧兽医, 2021, 48(4): 1251-1263. LI X, MAO Y Y, LUO H D, et al. Effects of dietary crude fiber level on rumen microbial composition and diversity of fattening lambs[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(4): 1251-1263 (in Chinese). |
| [36] |
黎凌铄, 彭忠利, 陈仕勇, 等. 小肽与酵母培养物对舍饲牦牛瘤胃微生物多样性和发酵参数的影响[J]. 中国饲料, 2021(5): 16-23. LI L S, PENG Z L, CHEN S Y, et al. Effects of small peptide and yeast culture on rumen microbial diversity and fermentation parameters of yaks[J]. China Feed, 2021(5): 16-23 (in Chinese). |
| [37] |
王贺泽. 月桂酸单甘油酯对断奶羔羊生长性能、血清指标及瘤胃微生物区系的影响[D]. 硕士学位论文. 北京: 中国农业科学院, 2021. WANG H Z. Effects of monoglyceride laurate on growth performance, serum indexes and rumen microbial community of weaned lambs[D]. Master's Thesis. Beijing: The Chinese Academy of Agricultural Sciences, 2021. (in Chinese) |
| [38] |
史浩, 沙玉柱, 魏红, 等. 藏绵羊暖、冷季瘤胃微生物菌群密度与其短链脂肪酸浓度互作分析[J]. 动物营养学报, 2021, 33(2): 1191-1200. SHI H, SHA Y Z, WEI H, et al. Interaction between rumen microbial density and short chain fatty acid concentration in Tibetan sheep during warm and cold seasons[J]. Chinese Journal of Animal Nutrition, 2021, 33(2): 1191-1200 (in Chinese). |
| [39] |
王炳. 基于16srRNA和代谢组技术研究三萜皂苷调控犊牛瘤胃代谢机制[D]. 博士学位论文. 北京: 中国农业科学院, 2018. WANG B. Study on the mechanism of triterpenoid saponins regulating rumen metabolism based on 16s rRNA sequencing and metabolomics in calves[D]. Ph. D. Thesis. Beijing: The Chinese Academy of Agricultural Sciences, 2018. (in Chinese) |
| [40] |
HE B K, NOHARA K, AJAMI N J, et al. Transmissible microbial and metabolomic remodeling by soluble dietary fiber improves metabolic homeostasis[J]. Scientific Reports, 2015, 5: 10604. DOI:10.1038/srep10604 |
| [41] |
SU X L, TIAN Q, ZHANG J, et al. Acetobacteroides hydrogenigenes gen.nov., sp.nov., an anaerobic hydrogen-producing bacterium in the family Rikenellaceae isolated from a reed swamp[J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(Pt 9): 2986-2991. |
| [42] |
SONG L, DONG X Z. Hydrogenoanaerobacterium saccharovorans gen.nov., sp.nov., isolated from H2-producing UASB granules[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(2): 295-299. DOI:10.1099/ijs.0.000349-0 |
| [43] |
RETTENMAIER R, KOWOLLIK M L, KLINGL A, et al. Ruminiclostridium herbifermentans sp.nov., a mesophilic and moderately thermophilic cellulolytic and xylanolytic bacterium isolated from a lab-scale biogas fermenter fed with maize silage[J]. International Journal of Systematic and Evolutionary Microbiology, 2019, 71(3): 004692. |
| [44] |
沈义媛, 童津津, 熊本海, 等. 多组学技术在奶牛瘤胃微生物与宿主互作机制中的研究进展[J]. 中国乳业, 2021(8): 68-75. SHEN Y Y, TONG J J, XIONG B H, et al. Progress of multi-omics in interaction mechanism between rumen microorganism and host in dairy cows[J]. China Dairy, 2021(8): 68-75 (in Chinese). |
| [45] |
KHAN R I, ONODERA R, AMIN M R, et al. Aromatic amino acid biosynthesis and production of related compounds from p-hydroxyphenylpyruvic acid by rumen bacteria, protozoa and their mixture[J]. Amino Acids, 2002, 22(2): 167-177. DOI:10.1007/s007260200005 |
| [46] |
苏卫卫, 刘苹. 芳香族氨基酸及其衍生物的研究进展[J]. 廊坊师范学院学报(自然科学版), 2021, 21(2): 27-34. SU W W, LIU P. Advances in the study of aromatic amino acids and their derivatives[J]. Journal of Langfang Teachers University (Natural Science Edition), 2021, 21(2): 27-34 (in Chinese). |
| [47] |
张翠羽. 奶牛泌乳早期亚临床维生素E缺乏的血浆代谢组学分析[D]. 硕士学位论文. 大庆: 黑龙江八一农垦大学, 2020. ZHANG C Y. Plasma metabolomics analysis of subclinical vitamin E deficiency in dairy cows during early lactation[D]. Master's Thesis. Daqing: Heilongjiang Bayi Agricultural University, 2020. (in Chinese) |
| [48] |
江晶洁, 刘涛, 林双君. 基于莽草酸途径微生物合成芳香族化合物及其衍生物的研究进展[J]. 生命科学, 2019, 31(5): 430-448. JIANG J J, LIU T, LIN S J. Research progress on the biosynthesis of aromatic compounds by microorganisms[J]. Chinese Bulletin of Life Sciences, 2019, 31(5): 430-448 (in Chinese). |
| [49] |
陈园, 赵淑娟. 微生物莽草酸代谢途径的研究进展[J]. 江苏农业科学, 2019, 47(7): 19-23. CHEN Y, ZHAO S J. Research progress of shikimic acid metabolic pathway in microorganisms[J]. Jiangsu Agricultural Sciences, 2019, 47(7): 19-23 (in Chinese). |




