2. 北京挑战生物技术有限公司, 北京 100081
2. Beijing Challenge Bio-Technology Co., Ltd., Beijing 100081, China
在反刍动物瘤胃中存在着大量的微生物,包括细菌、真菌、原虫和古菌等。瘤胃内微生物区系与宿主的营养、代谢和免疫密切相关[1]。在微生物作用下,碳水化合物被发酵成为挥发性脂肪酸(VFA),如乙酸、丙酸和丁酸等,这些是主要的产能物质,占总能量的70%~80%。非纤维性碳水化合物(non-fiber carbohydrate,NFC)是反刍动物营养的重要组成部分,在瘤胃内可被微生物快速降解。在饲粮中添加NFC(如淀粉)可促进微生物蛋白(MCP)的合成[2],增强乳腺摄取游离氨基酸的能力[3-4],改善乳腺中氨基酸的利用,促进乳蛋白合成[5]。中性洗涤纤维(neutral detergent fiber,NDF)主要包括半纤维素、纤维素和木质素,常被用作纤维性碳水化合物的指标。虽然上述成分不容易被单胃动物消化利用,但可以被瘤胃微生物发酵代谢,同时还能促进反刍动物的咀嚼和胃肠蠕动,有利于保持其健康状态[6]。因此,二者在奶牛饲粮中均不可或缺,都为奶牛的健康生产提供了保障。
Nocek等[7]提出NFC和NDF之间存在交互作用,并认为奶牛饲粮中理想的NFC/NDF水平为0.9~1.2。而随着全球范围内奶牛产奶量的普遍提高,饲粮中NFC含量也随之增长,以满足奶牛泌乳等方面营养需求。有研究报道,提高饲粮NFC/NDF水平有助于奶牛生产性能的提高[8-9];但是过高的精料往往导致乳酸菌和革兰氏阴性菌异常生长和死亡,使得乳酸和脂多糖大量产生,对动物的健康和泌乳性能产生负面作用[10]。因此,有必要进一步研究饲粮NFC/NDF水平对奶牛的影响,探究饲粮营养成分与瘤胃微生物之间的相互作用,增强人们对奶牛瘤胃发酵代谢特点的认识与了解。
鉴于此,本试验旨在研究不同饲粮NFC/NDF水平下瘤胃发酵和微生物组成的动态变化,选取3头健康的中国荷斯坦奶牛采集瘤胃液,以3种NFC/NDF水平全混合日粮(TMR)作为发酵底物,建立体外发酵体系,探究饲粮碳水化合物在发酵代谢过程中与瘤胃微生物之间的互作关系,为奶牛饲粮合理配制提供理论支撑。
1 材料与方法 1.1 试验材料 1.1.1 发酵底物NFC/NDF水平分别为1.38(饲粮A)、1.19(饲粮B)和1.08(饲粮C)的3种饲粮(其组成及营养水平见表 1),于烘箱内65 ℃烘干(48 h),经粉碎机粉碎10 s,过20目筛。
|
|
表 1 饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of diets (DM basis) |
选取3头健康奶牛[体重(605±35) kg],屠宰后迅速于瘤胃上、下、左、右不同点位釆集足够量的瘤胃液(合计1 L),用4层纱布过滤后,灌入充满二氧化碳(CO2)并经过预热的保温瓶中(约39 ℃),灌满后瓶口封严,立刻带回实验室。
1.1.3 培养基的制备培养基的配制参照Theodorou等[11]描述的方法,制备完成后,与瘤胃液按1 ∶ 2比例均匀混合,用于体外发酵试验。
1.2 试验设计试验根据发酵底物分为3个组(A组、B组和C组),每组4个重复,每个重复有4个发酵瓶。发酵瓶(170 mL)中按组别称量发酵底物1 g,然后用分装仪加入100 mL混合培养液(持续充入CO2保持厌氧环境)。分装完毕后,用橡胶塞和铝盖将发酵瓶密封并放入气浴摇床中,在39 ℃条件下恒温培养48 h。
1.3 样本采集与发酵参数测定培养期间分别在2、4、6、12、18、24、36和48 h时测定发酵瓶的气压,根据气压体积公式计算相对应的产气量(GP)[12]。计算公式为:
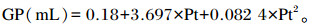
|
式中:Pt为检测到的气压值。
分别在6、12、24和48 h时,从每组4个重复中分别取出1个发酵瓶(共12个),立即置于冰水中终止发酵。取出发酵液测定pH,并将样品分装冻存在-20 ℃,用于测定VFA、乳酸、氨态氮(NH3-N)和MCP含量;用于瘤胃细菌16S rRNA基因测序分析的样品则置于液氮中保存。发酵液中VFA含量采用GC-14B型气相色谱仪(日本岛津)进行测定,方法参照秦为琳[13]的气相色谱法;发酵液中乳酸含量采用比色法测定,试剂盒来自南京建成生物工程研究所;发酵液中NH3-N含量参照Searle[14]的方法进行测定;发酵液中MCP含量根据Makkar等[15]描述的方法进行测定。
1.4 微生物DNA提取与16S rRNA基因测序微生物总DNA采用Tiangen DNA试剂盒[天根生化科技(北京)有限公司]进行提取,采用琼脂糖凝胶电泳和分光光度法检测基因组DNA的浓度和纯度。16S rRNA基因测序以V3~V4为目标区域进行引物设计,引物信息[16]见表 2。第1轮PCR扩增反应之后,使用AMPure XP Beads对PCR产物进行纯化,再进行第2轮PCR扩增。扩增完成的PCR产物纯化和质检之后,构建MiSeq文库并进行测序。MiSeq测序完成后,利用overlap将双端数据进行拼接,并进行质控、嵌合体过滤,获得高质量的有效数据,并对最终获得有效数据进行97%的相似度聚类,获得最终的操作分类单元(OTU)丰度及代表序列,进一步进行物种分类注释和差异分析。试验使用RDP和NT-16S数据库资源做物种分类及差异分析,以保证注释结果完整准确,并使用R软件对发酵参数和微生物区系进行Pearson相关性分析。
|
|
表 2 微生物引物信息 Table 2 Primer information of microorganism |
使用SPSS 20.0软件分析试验数据,结果用平均值和均值标准误(SEM)表示。基于一般线性模型(generalized linear model, GLM)评估比较平均值,采用最小显著差(least significant difference, LSD)法进行组间多重比较。P < 0.01表示差异极显著,P < 0.05表示差异显著。
2 结果与分析 2.1 饲粮NFC/NDF水平对奶牛瘤胃体外发酵参数的影响由表 3可知,2 h时,A组和B组GP显著高于C组(P < 0.05);4、6和12 h时,A组GP显著高于B组和C组(P < 0.05)。此外,GP随发酵时间延长极显著升高(P < 0.01),且饲粮和发酵时间对GP有极显著交互作用(P < 0.01)。
|
|
表 3 饲粮NFC/NDF水平对奶牛瘤胃体外发酵GP的影响 Table 3 Effects of dietary NFC/NDF levels on GP in rumen fermentation of dairy cows in vitro |
由表 4可知,12 h时,A组和B组pH显著低于C组(P < 0.05);24 h时,A组pH显著高于B组和C组(P < 0.05)。6和24 h时,A组MCP含量显著高于B组和C组(P < 0.05);48 h时,A组MCP含量显著低于B组和C组(P < 0.05)。6 h时,A组和B组NH3-N含量显著高于C组(P < 0.05)。此外,3组pH随发酵时间延长均先降低后升高,且均在12 h时达到最低;乳酸含量随发酵时间延长先升高再降低,在12 h时达到最高;NH3-N和MCP含量随发酵时间延长均逐渐升高,在48 h时二者含量显著高于其他时间点(P < 0.05)。
|
|
表 4 饲粮NFC/NDF水平对奶牛瘤胃体外发酵特性的影响 Table 4 Effects of dietary NFC/NDF levels on rumen fermentation characteristics of dairy cows in vitro |
由表 5可知,12 h时,B组乙酸/丙酸值显著高于C组(P < 0.05);24 h时,A组总挥发性脂肪酸(TVFA)含量显著低于C组(P < 0.05),A组乙酸含量显著低于B组和C组(P < 0.05),而A组和B组戊酸含量低于C组(P < 0.05);48 h时,A组TVFA和异戊酸含量显著高于C组(P < 0.05),A组和B组乙酸含量显著高于C组(P < 0.05),A组丙酸含量显著高于B组(P < 0.05),A组和C组乙酸/丙酸值显著低于B组(P < 0.05)。此外,A组TVFA和乙酸含量随发酵时间延长逐渐升高,而B组和C组TVFA和乙酸含量均先升高再降低;3组丙酸、丁酸、异丁酸、戊酸和异戊酸含量均随发酵时间延长逐渐升高,而乙酸/丙酸值均先升高再降低。饲粮和发酵时间对TVFA(P < 0.01)、乙酸(P < 0.01)、丙酸(P < 0.01)、戊酸(P < 0.01)、异戊酸(P < 0.01)含量和乙酸/丙酸值(P < 0.05)有显著或极显著交互作用。
|
|
表 5 饲粮NFC/NDF水平对奶牛瘤胃体外发酵VFA组成的影响 Table 5 Effects of dietary NFC/NDF levels on VFA composition in rumen fermentation of dairy cows in vitro |
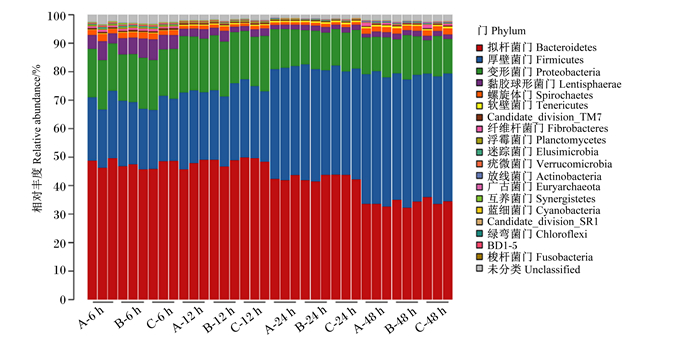
由图 1和表 6可知,在门水平上共鉴别出19种细菌,其中相对丰度超过1%的核心细菌有5种,平均相对丰度由高到低分别为为拟杆菌门、厚壁菌门、变形菌门、黏胶球形菌门和螺旋体门。在门水平上,细菌相对丰度受发酵时间极显著影响(P < 0.01),但相对丰度超过1%的菌群种类未发生改变;拟杆菌门、变形菌门和黏胶球菌门的相对丰度随发酵时间延长逐渐降低,厚壁菌门的相对丰度随发酵时间延长逐渐升高。此外,3组之间菌群在门水平上的相对丰度均无显著差异(P>0.05),这表明饲粮类型对门水平的菌群相对丰度无显著影响。
|
图 1 细菌门水平相对丰度热图 Fig. 1 Heatmap of relative abundance of bacteria at phylum level |
|
|
表 6 细菌门水平相对丰度 Table 6 Relative abundance of bacteria at phylum level |
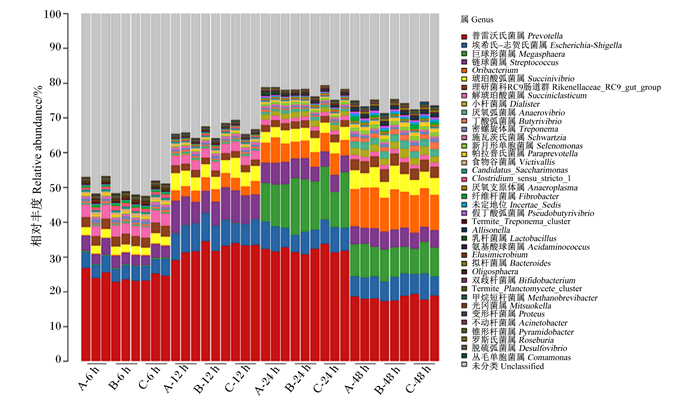
由图 2和表 7可知,在属水平上,菌群相对丰度随发酵时间延长而极显著变化(P < 0.01),部分细菌的优势地位发生改变。其中,未分类的RF16和未分类的克里斯滕森菌科在12 h后相对丰度降到1%以下,而Oribacterium和巨球形菌属从低于1%逐渐增加到10%以上,小杆菌属、丁酸弧菌属、厌氧弧菌属和新月形单胞菌属从低于1%逐渐增加到1%以上。此外,部分菌群相对丰度在发酵过程中受饲粮类型影响,其中普雷沃氏菌属和丁酸弧菌属受饲粮类型和发酵时间的交互作用(P < 0.05)。6 h时,B组小杆菌属相对丰度显著高于A组和C组(P < 0.05);12 h时,C组普雷沃氏菌属相对丰度显著低于A组和B组(P < 0.05),A组厌氧弧菌属相对丰度显著高于B组(P < 0.05),C组小杆菌属相对丰度显著高于A组和B组(P < 0.05);24 h时,C组未分类的拟杆菌门相对丰度显著低于A组和B组(P < 0.05);48 h时,B组未分类的γ-变形菌纲相对丰度显著高于A组和C组(P < 0.05)。
|
图 2 细菌属水平相对丰度热图 Fig. 2 Heatmap of relative abundance of bacteria at genus level |
|
|
表 7 细菌属水平相对丰度 Table 7 Relative abundance of bacteria at genus level |
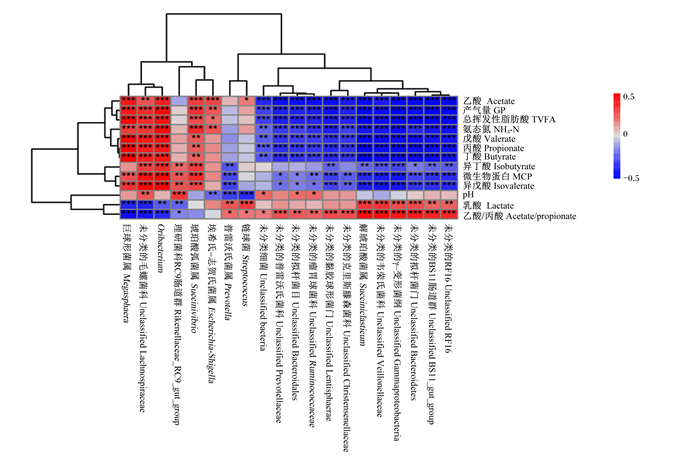
对有显著差异的发酵参数和属水平细菌(相对丰度超过1%至少出现1次)进行Pearson相关性分析,结果如图 3所示。|r|大于0.9的结果如下:与GP呈正相关的有Oribacterium(r=0.901 9,P < 0.01),呈负相关的有未分类的拟杆菌门(r=-0.911 7,P < 0.01)、未分类的BS11肠道群(r=-0.965 4,P < 0.01)、未分类的RF16(r=-0.961 4,P < 0.01)和解琥珀酸菌属(r=-0.951 7,P < 0.01)等;与MCP呈正相关的有Oribacterium(r=0.954 3,P < 0.01);与NH3-N呈负相关的有未分类的γ-变形菌纲(r=-0.912 9,P < 0.01);与TVFA呈正相关的有巨球形菌属(r=0.900 5,P < 0.01),呈负相关的有未分类的拟杆菌门(r=-0.946 4,P < 0.01)、未分类的BS11肠道群(r=-0.948 4,P < 0.01)和解琥珀酸菌属(r=-0.968 5,P < 0.01)等;与乙酸呈负相关的有未分类的拟杆菌门(r=-0.942 0,P < 0.01)、未分类的瘤胃球菌科(r=-0.907 5,P < 0.01)和未分类的BS11肠道群(r=-0.968 3,P < 0.01)等;丙酸与巨球形菌属呈正相关(r=0.921 5,P < 0.01),而乙酸/丙酸值与巨球形菌属呈负相关(r=-0.901 6,P < 0.01);此外,乳酸与未分类的毛螺菌科(r=-0.783 0,P < 0.01)和巨球型菌属(r=-0.776 0,P < 0.01)呈负相关。结果表明,部分已知的瘤胃微生物如解琥珀酸菌属与GP、TVFA、乙酸、丙酸和丁酸呈显著负相关(P < 0.05);Oribacterium与GP和MCP呈显著正相关(P < 0.05);巨球形菌属与TVFA、丙酸和丁酸呈显著正相关(P < 0.05),与乙酸/丙酸值和乳酸呈显著负相关(P < 0.05)。同时,还有大量未分类细菌也与瘤胃发酵关系密切,需要进一步分析。
|
基于发酵参数和属相对丰度对应的关系矩阵绘制了顶部和左侧的层次聚类,并根据发酵参数和属相对丰度的Pearson相关系数进行着色,红色代表正相关,蓝色代表负相关(*表示P < 0.05,* *表示P < 0.01,* * *表示P < 0.001)。 The top and left hierarchical clusters were plotted based on the corresponding correlation matrix between fermentation parameters and genus relative abundances. Cells were colored based on the Pearson correlation coefficient between fermentation parameters and genus relative abundance, the red color represented a positive correlation, and the blue color represented a negative correlation (* mean P < 0.05, * * mean P < 0.01, and * * * mean P < 0.001). 图 3 发酵参数和属水平细菌的相关性 Fig. 3 Correlation between fermentation parameters and bacteria at genus level |
GP是反映瘤胃发酵程度的综合指标,与瘤胃细菌活性呈正相关[17]。本试验结果发现,12 h之前,高NFC/NDF水平饲粮组(A组)GP显著高于低NFC/NDF水平饲粮组(C组),这可能与高NFC/NDF水平饲粮快速产生了大量VFA有关。Rodriguez等[18]研究发现,饲粮碳水化合物在瘤胃中发酵产生大量气体,主要包括氢气(H2)、CO2和甲烷(CH4)。当瘤胃pH小于6.2时,纤维素分解菌的生长和繁殖会受到抑制,此时有利于高淀粉、高可溶性糖等NFC发酵分解。因此,瘤胃液pH的动态变化间接反映瘤胃发酵过程,有助于人们对瘤胃消化代谢的了解。本试验结果显示,奶牛瘤胃体外发酵pH随发酵时间延长而逐渐降低,降到一定水平后会恢复到较高的水平,但pH始终维持在6.4~6.8的正常水平,这与前人的研究结果[19]基本一致。pH的降低主要与VFA和乳酸的产生有关,但较低pH会刺激瘤胃上皮细胞对VFA的吸收。Nocek等[20]认为pH的先降后升可能与饲粮发酵速率的降低、乳酸和VFA的吸收利用以及瘤胃自身强大的缓冲能力有关。本试验中,12和24 h时的发酵液pH受饲粮NFC/NDF水平的显著影响。12 h时,高NFC/NDF水平饲粮组的pH显著低于低NFC/NDF水平饲粮组;而24 h时,高NFC/NDF水平饲粮组的pH显著高于低NFC/NDF水平饲粮组。这些结果可能与饲粮碳水化合物结构特性有关,高NFC/NDF水平饲粮组中易发酵的碳水化合物较多,发酵速率快,而这些碳水化合物的发酵产物为乳酸和VFA,造成pH降低;而低NFC/NDF水平饲粮组的pH变化则相对缓慢。
NH3-N是瘤胃氮代谢的综合体现,饲粮蛋白质降解程度、瘤胃微生物合成率、瘤胃上皮细胞对NH3-N的吸收、内源氮物质周转以及能量水平都会影响瘤胃中NH3-N含量[21]。此外,在瘤胃中约80%的细菌将NH3-N作为直接氮源合成MCP。因此检测NH3-N含量可判断蛋白质在瘤胃内代谢与利用的平衡[22]。Grummer等[23]研究发现,NH3-N在瘤胃中适宜的含量范围为6.3~27.5 mg/dL,这与本试验中NH3-N变化范围基本一致。本试验中,6 h时,高NFC/NDF水平饲粮组的NH3-N含量显著高于低NFC/NDF水平饲粮组,这可能与高NFC/NDF水平组中饲粮蛋白质水平较高有关。此外,结果显示,6和24 h时,高NFC/NDF水平饲粮组的MCP含量显著高于低NFC/NDF水平饲粮组,而48 h时结果则相反。这可能与饲粮的能量供应有关,充足的能量供应有利于微生物的生长繁殖,促进MCP的合成。此外,本试验中MCP和NH3-N含量随发酵时间延长而显著提高,汪水平等[24]认为这可能与饲粮蛋白质在瘤胃中的降解程度和MCP的合成有关。
VFA是瘤胃发酵的重要产物,也是微生物和宿主的重要能量来源。研究表明,VFA可为机体提供70%~80%的能量,其中乙酸、丙酸和丁酸约占TVFA的95%[25]。因此,乙酸、乙酸/丙酸值可以反映饲粮在瘤胃中的发酵类型。本试验结果发现,乙酸/丙酸值受饲粮NFC/NDF水平的显著影响,同时受饲粮类型和发酵时间交互作用的影响。通常情况下,饲粮中过高NFC会造成瘤胃pH快速降低,当pH低于6.2时,纤维素分解菌会受到抑制,此时的发酵类型以产丙酸为主。但在48 h过程中,pH一直维持在6.4~6.8,因此组间的发酵类型并没有呈现规律性差异。本试验结果显示,12 h之后TVFA的含量显著提高而乳酸含量显著降低,可能是VFA的增加与乳酸的降低密切相关。此外,有研究表明,饲粮碳水化合物结构并不影响TVFA的产量[26-27],这与本试验的结果基本一致。
3.2 饲粮NFC/NDF水平对奶牛瘤胃体外发酵微生物区系的影响本试验结果显示,24 h之前,拟杆菌门是最主要的菌群,其相对丰度但随发酵时间延长逐渐降低;而厚壁菌门相对丰度逐渐升高,到48 h时超过了拟杆菌门,这可能与瘤胃pH有关。研究表明,低pH环境下革兰氏阴性菌的丰度会降低[28-29]。此外,Hook等[30]也发现,瘤胃pH降低会引起瘤胃微生物中拟杆菌门的减少和厚壁菌门的增加。本试验结果还显示,门水平优势菌群的相对丰度随发酵时间显著变化,但其种类未受饲粮和发酵时间的影响,这与Jami等[31]的研究结果基本一致。同时,属水平上优势菌群的相对丰度会也随发酵时间显著变化,且部分菌群的优势地位发生改变,其中Oribacterium和巨球形菌属随发酵时间延长而逐渐增多成为主要菌群,这可能与细菌降解功能和饲粮的发酵程度有关。通过相关性分析发现,Oribacterium与GP和MCP的产生有很大关联,而巨球形菌属则与VFA呈强正相关。
普雷沃氏菌属属于拟杆菌门,是瘤胃内主要的淀粉降解菌,且能够降解饲粮蛋白质[32]。本试验中,普雷沃氏菌属是瘤胃内的优势细菌且相对丰度最高,且不受饲粮类型影响,这与多数研究结果[33-34]基本一致。本试验中,12 h时,高NFC/NDF水平饲粮组普雷沃氏菌属相对丰度显著高于低NFC/NDF水平饲粮组,同时相关性分析显示普雷沃氏菌属与pH呈负相关。新月形单胞菌属属于革兰氏阴性厚壁菌,是一种淀粉降解菌,但不能发酵纤维素和果胶,其主要发酵产物是乙酸和丙酸,丰度随发酵时间逐渐提高,这可能与饲粮发酵程度有关。解琥珀酸菌属在瘤胃内的数量较少,具有降解淀粉的功能[35],产物主要是乙酸和琥珀酸。本试验相关性分析表明,解琥珀酸菌属与GP、TVFA、乙酸、丙酸和丁酸呈负相关。巨型球菌属是主要的乳酸利用菌,在高谷物饲粮瘤胃中主要对D型和L型乳酸进行发酵,产物主要为丙酸、丁酸、戊酸和CO2。此外,巨型球菌属还可利用葡萄糖进行发酵和生长,产物为甲酸和己酸。本试验发现,巨型球菌属与丙酸和丁酸呈正相关,与乙酸/丙酸值呈负相关。丁酸弧菌属可发酵淀粉、非纤维多糖以及单糖,主要产物是乙醇、乙酸、丁酸、甲酸和乳酸,还伴有CO2和H2的产生。相关性分析显示,琥珀酸弧菌属与乙酸、丙酸和丁酸密切相关,这与Iqbal等[36]的研究结果基本一致。此外,本试验还发现一些没有分类的细菌在瘤胃发酵中发挥着重要作用,需要进一步挖掘研究。
4 结论饲粮NFC/NDF水平、发酵时间及其交互作用显著影响奶牛瘤胃体外发酵GP、pH、MCP、NH3-N、丙酸含量和乙酸/丙酸值。在本试验饲粮NFC/NDF水平范围内(1.08~1.38),高NFC水平饲粮会导致pH在发酵前期出现下降,但pH均在正常水平,未出现瘤胃酸中毒风险;结合本团队动物饲养试验研究结果[37],推荐饲粮NFC/NDF水平为1.19时,效果较好。
此外,在发酵过程中,瘤胃微生物群的组成仅受发酵时间的显著影响。在门水平上,优势菌群地位没有发生改变;在属水平上,部分优势菌群随着发酵时间的延长而发生显著变化。相关分析表明,瘤胃发酵代谢产物与部分细菌存在显著相关性。
| [1] |
SOMMER F, BÄCKHED F. The gut microbiota-masters of host development and physiology[J]. Nature Reviews Microbiology, 2013, 11(4): 227-238. DOI:10.1038/nrmicro2974 |
| [2] |
HUHTANEN P, HRISTOV A N. A meta-analysis of the effects of dietary protein concentration and degradability on milk protein yield and milk N efficiency in dairy cows[J]. Journal of Dairy Science, 2009, 92(7): 3222-3232. DOI:10.3168/jds.2008-1352 |
| [3] |
CANTALAPIEDRA-HIJAR G, LEMOSQUET S, RODRIGUEZ-LOPEZ J M, et al. Diets rich in starch increase the posthepatic availability of amino acids in dairy cows fed diets at low and normal protein levels[J]. Journal of Dairy Science, 2014, 97(8): 5151-5166. DOI:10.3168/jds.2014-8019 |
| [4] |
CRAIG A, GORDON A W, STEWART S, et al. Supplementation strategies for lactating dairy cows offered very high quality grass silages: starch-based or fibre-based concentrates offered with or without straw[J]. Livestock Science, 2020, 234: 103973. DOI:10.1016/j.livsci.2020.103973 |
| [5] |
CANTALAPIEDRA-HIJAR G, ORTIGUES-MARTY I, LEMOSQUET S. Diets rich in starch improve the efficiency of amino acids use by the mammary gland in lactating Jersey cows[J]. Journal of Dairy Science, 2015, 98(10): 6939-6953. DOI:10.3168/jds.2015-9518 |
| [6] |
CAO Y C, WANG D D, WANG L M, et al. Physically effective neutral detergent fiber improves chewing activity, rumen fermentation, plasma metabolites, and milk production in lactating dairy cows fed a high-concentrate diet[J]. Journal of Dairy Science, 2021, 104(5): 5631-5642. DOI:10.3168/jds.2020-19012 |
| [7] |
NOCEK J E, RUSSELL J B. Protein and energy as an integrated system. relationship of ruminal protein and carbohydrate availability to microbial synthesis and milk production[J]. Journal of Dairy Science, 1988, 71(8): 2070-2107. DOI:10.3168/jds.S0022-0302(88)79782-9 |
| [8] |
OBERSON J L, PROBST S, SCHLEGEL P. Magnesium absorption as influenced by the rumen passage kinetics in lactating dairy cows fed modified levels of fibre and protein[J]. Animal, 2019, 13(7): 1412-1420. DOI:10.1017/S1751731118002963 |
| [9] |
DONG L F, JIA P, LI B C, et al. Quantification and prediction of enteric methane emissions from Chinese lactating Holstein dairy cows fed diets with different dietary neutral detergent fiber/non-fibrous carbohydrate (NDF/NFC) ratios[J]. Journal of Integrative Agriculture, 2022, 21(3): 797-811. DOI:10.1016/S2095-3119(21)63825-X |
| [10] |
MALEKKHAHI M, TAHMASBI A M, NASERIAN A A, et al. Effects of supplementation of active dried yeast and malate during sub-acute ruminal acidosis on rumen fermentation, microbial population, selected blood metabolites, and milk production in dairy cows[J]. Animal Feed Science and Technology, 2016, 213: 29-43. DOI:10.1016/j.anifeedsci.2015.12.018 |
| [11] |
THEODOROU M K, WILLIAMS B A, DHANOA M S, et al. A simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminant feeds[J]. Animal Feed Science and Technology, 1994, 48(3/4): 185-197. |
| [12] |
MAURICIO R M, MOULD F L, DHANOA M S, et al. A semi-automated in vitro gas production technique for ruminant feedstuff evaluation[J]. Animal Feed Science and Technology, 1999, 79(4): 321-330. DOI:10.1016/S0377-8401(99)00033-4 |
| [13] |
秦为琳. 应用气相色谱测定瘤胃挥发性脂肪酸方法的研究改进[J]. 南京农业大学学报, 1982(4): 110-116. QIN W L. Determ naton of rumen volatile fatty acids by means of gas chromatography[J]. Journal of Nanjing Agricultural University, 1982(4): 110-116 (in Chinese). |
| [14] |
SEARLE P L. The berthelot or indophenol reaction and its use in the analytical chemistry of nitrogen.A review[J]. Analyst, 1984, 109(5): 549-568. DOI:10.1039/an9840900549 |
| [15] |
MAKKAR H P, SHARMA O P, DAWRA R K, et al. Simple determination of microbial protein in rumen liquor[J]. Journal of Dairy Science, 1982, 65(11): 2170-2173. DOI:10.3168/jds.S0022-0302(82)82477-6 |
| [16] |
KLINDWORTH A, PRUESSE E, SCHWEER T, et al. Evaluation of general 16S ribosomal RNA gene PCR primers for classical and next-generation sequencing-based diversity studies[J]. Nucleic Acids Research, 2013, 41(1): e1. DOI:10.1093/nar/gks808 |
| [17] |
KANG S, WANAPAT M. Using plant source as a buffering agent to manipulating rumen fermentation in an in vitro gas production system[J]. Asian-Australasian Journal of Animal Sciences, 2013, 26(10): 1424-1436. |
| [18] |
RODRIGUEZ M P, MARIEZCURRENA M D, MARIEZCURRENA M A, et al. Influence of live cells or cells extract of Saccharomyces cerevisiae on in vitro gas production of a total mixed ration[J]. Italian Journal of Animal Science, 2015, 14(4): 3713. DOI:10.4081/ijas.2015.3713 |
| [19] |
JOUANY J P. Optimizing rumen functions in the close-up transition period and early lactation to drive dry matter intake and energy balance in cows[J]. Animal Reproduction Science, 2006, 96(3/4): 250-264. |
| [20] |
NOCEK J E, ALLMAN J G, KAUTZ W P. Evaluation of an indwelling ruminal probe methodology and effect of grain level on diurnal pH variation in dairy cattle[J]. Journal of Dairy Science, 2002, 85(2): 422-428. DOI:10.3168/jds.S0022-0302(02)74090-3 |
| [21] |
KENNELLY J J, ROBINSON B, KHORASANI G R. Influence of carbohydrate source and buffer on rumen fermentation characteristics, milk yield, and milk composition in early-lactation Holstein cows[J]. Journal of Dairy Science, 1999, 82(11): 2486-2496. DOI:10.3168/jds.S0022-0302(99)75500-1 |
| [22] |
栗明月. 竹叶提取物对奶牛瘤胃发酵、血液中抗氧化酶、免疫球蛋白及炎性因子的影响[D]. 硕士学位论文. 北京: 北京农学院, 2019. LI M Y. Effects of bamboo leaf extract on rumen fermentation, antioxidant enzymes, immunoglobulins and inflammatory factors in the blood of dairy cows[D]. Master's Thesis. Beijing: Beijing University of Agriculture, 2019. (in Chinese) |
| [23] |
GRUMMER R R, CLARK J H, DAVIS C L, et al. Effect of ruminal ammonia-nitrogen concentration on protein degradation in situ[J]. Journal of Dairy Science, 1984, 67(10): 2294-2301. DOI:10.3168/jds.S0022-0302(84)81577-5 |
| [24] |
汪水平, 王文娟, 王加启, 等. 日粮精粗比对奶牛瘤胃发酵及泌乳性能的影响[J]. 西北农林科技大学学报(自然科学版), 2007, 35(6): 44-50. WANG S P, WANG W J, WANG J Q, et al. Effects of dietary concentrate-to-forage ratio on rumen fermentation and performance of dairy cows[J]. Journal of Northwest A&F University(Natural Science Edition), 2007, 35(6): 44-50 (in Chinese). DOI:10.3321/j.issn:1671-9387.2007.06.010 |
| [25] |
李旺. 瘤胃挥发性脂肪酸的作用及影响因素[J]. 中国畜牧杂志, 2012, 48(7): 63-66. LI W. The effect and influence factors of rumen volatile fatty acid[J]. Chinese Journal of Animal Science, 2012, 48(7): 63-66 (in Chinese). DOI:10.3969/j.issn.0258-7033.2012.07.017 |
| [26] |
AGUERRE M J, WATTIAUX M A, POWELL J M, et al. Effect of forage-to-concentrate ratio in dairy cow diets on emission of methane, carbon dioxide, and ammonia, lactation performance, and manure excretion[J]. Journal of Dairy Science, 2011, 94(6): 3081-3093. DOI:10.3168/jds.2010-4011 |
| [27] |
CHEN G J, SONG S D, WANG B X, et al. Effects of forage: concentrate ratio on growth performance, ruminal fermentation and blood metabolites in housing-feeding yaks[J]. Asian-Australasian Journal of Animal Sciences, 2015, 28(12): 1736-1741. DOI:10.5713/ajas.15.0419 |
| [28] |
KHAFIPOUR E, LI S C, PLAIZIER J C, et al. Rumen microbiome composition determined using two nutritional models of subacute ruminal acidosis[J]. Applied and Environmental Microbiology, 2009, 75(22): 7115-7124. DOI:10.1128/AEM.00739-09 |
| [29] |
MAO S Y, ZHANG R Y, WANG D S, et al. Impact of subacute ruminal acidosis (SARA) adaptation on rumen microbiota in dairy cattle using pyrosequencing[J]. Anaerobe, 2013, 24: 12-19. DOI:10.1016/j.anaerobe.2013.08.003 |
| [30] |
HOOK S E, STEELE M A, NORTHWOOD K S, et al. Impact of subacute ruminal acidosis (SARA) adaptation and recovery on the density and diversity of bacteria in the rumen of dairy cows[J]. FEMS Microbiology Ecology, 2011, 78(2): 275-284. DOI:10.1111/j.1574-6941.2011.01154.x |
| [31] |
JAMI E, MIZRAHI I. Composition and similarity of bovine rumen microbiota across individual animals[J]. PLoS One, 2012, 7(3): e33306. DOI:10.1371/journal.pone.0033306 |
| [32] |
李蒋伟, 周力, 马博研, 等. 饲粮非纤维性碳水化合物/中性洗涤纤维对藏羊瘤胃发酵参数及菌群结构的影响[J]. 四川农业大学学报, 2022, 40(2): 253-259, 275. LI J W, ZHOU L, MA B Y, et al. Effects of dietary non fibrous carbohydrate/neutral detergent fiber on rumen fermentation parameters and flora structure of Tibetan sheep[J]. Journal of Sichuan Agricultural University, 2022, 40(2): 253-259, 275 (in Chinese). |
| [33] |
BOWEN J M, MCCABE M S, LISTER S J, et al. Evaluation of microbial communities associated with the liquid and solid phases of the rumen of cattle offered a diet of perennial ryegrass or white clover[J]. Frontiers in Microbiology, 2018, 9: 2389. DOI:10.3389/fmicb.2018.02389 |
| [34] |
PITTA D W, PINCHAK W E, DOWD S, et al. Longitudinal shifts in bacterial diversity and fermentation pattern in the rumen of steers grazing wheat pasture[J]. Anaerobe, 2014, 30: 11-17. DOI:10.1016/j.anaerobe.2014.07.008 |
| [35] |
HENDERSON G, COX F, GANESH S, et al. Rumen microbial community composition varies with diet and host, but a core microbiome is found across a wide geographical range[J]. Scientific Reports, 2015, 5: 14567. DOI:10.1038/srep14567 |
| [36] |
IQBAL M W, ZHANG Q, YANG Y B, et al. Ruminal fermentation and microbial community differently influenced by four typical subtropical forages in vitro[J]. Animal Nutrition, 2018, 4(1): 100-108. DOI:10.1016/j.aninu.2017.10.005 |
| [37] |
张林, 李烨青, 王泽栋, 等. 日粮NFC/NDF水平对泌乳后期奶牛生产性能、血液生化及抗氧化指标的影响[J]. 畜牧与兽医, 2018, 50(6): 29-32. ZHANG L, LI Y Q, WANG Z D, et al. Effects of NFC/NDF levels on performance, blood biochemical and antioxidant index of cows in late lactation[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(6): 29-32 (in Chinese). |




