2. 青海省高原放牧家畜营养与饲料科学重点实验室, 西宁 810016;
3. 青海省牦牛工程技术研究中心, 西宁 810016
2. Key Laboratory of Plateau Grazing Animal Nutrition and Feed Science in Qinghai Province, Xi'ning 810016, China;
3. Yak Engineering Technology Research Center of Qinghai Province, Xi'ning 810016, China
牦牛是青藏高原特殊的气候环境条件下形成的特有畜种,牦牛产业在青藏高原牧业中占有很大的比例,对青藏地区牧民的收入和地方经济的发展有着至关重要的影响[1]。牦牛犊牛是整个牦牛产业发展的基础,在牦牛的养殖过程中犊牛育肥是一个关键时期。牦牛犊牛的传统培育方式为自然放牧,牧草供需严重的季节不平衡无法实现犊牛对营养物质的需求,这严重制约着牦牛产业的发展[2-3],同时传统的放牧饲养方式导致畜群结构不合理,母畜生产性能低下、牦牛出栏率、商品率低[4]。为了使牦牛生产过程中这些问题得到缓解,使牦牛犊牛更快、更好的生长,提高养殖效益,增加牧民的经济收入,近年来研究者们通过借鉴肉牛养殖经验开展了牦牛的舍饲育肥工作,但相关研究主要集中在提高生长性能、营养物质消化率和改善肉品质等方面,对牦牛瘤胃微生物区系的研究鲜有报道。瘤胃作为反刍动物特有的器官,聚集着大量的微生物,共同维持瘤胃内环境的稳态[5],同时瘤胃微生物还可将饲粮中的大分子营养物质降解为动物体易吸收的小分子营养物质[6]。研究发现,瘤胃菌群结构易受到环境、遗传、个体因素及饲粮结构等的影响,其中饲粮结构的影响最大[7]。Mao等[8]发现,随着饲粮中精料水平的提高,奶牛瘤胃液挥发性脂肪酸浓度和淀粉降解菌的相对丰度逐渐上升,而瘤胃液pH和纤维降解菌相对丰度呈下降趋势。研究显示,改善饲粮的营养水平可以有效地促进牦牛瘤胃的发酵,提高营养物质的利用率,进而提高生产性能[9]。本试验将6月龄的断奶牦牛犊牛作为试验对象,开展舍饲与放牧2种不同饲养方式对牦牛犊牛生长性能、瘤胃发酵和菌群结构影响的研究,以期为6月龄断奶牦牛犊牛饲养方式的选择提供理论依据。
1 材料与方法 1.1 试验地点及时间牦牛犊牛的舍饲试验在青海省黄南州贵德县新街乡建民牦牛养殖基地进行;牦牛犊牛的放牧在贵德县拉脊山分水岭山进行,该区地处东经101.44°,北纬36.04°,位于贵德县南部,平均海拔3 500 m,平均气温-3.5~7.4 ℃,年降水量约为253.2 mm,此地区主要以高山草甸和草原为主,水源充足,牧草茂盛[10]。试验时间为2020-11-01—2021-06-13。
1.2 试验动物与试验设计试验采用单因子完全随机试验设计,选择30头出生日期接近、体重在(51.72±3.15) kg的6月龄断奶健康牦牛犊牛,该批牦牛犊牛在6月龄前随母哺乳,自由进食草场上的牧草。将30头健康的断奶牦牛犊牛随机分为舍饲组、放牧组,每组15头。预试期10 d,正试期210 d。
1.3 饲养管理舍饲组牦牛犊牛进行单独饲养,每天早、晚各进行1次精料补充料的饲喂,根据犊牛群每日采食量的增加,饲喂量也随之增加。放牧组牦牛犊牛与母牛分开放牧,08:30放牧、17:30归牧,整个试验期间不进行补饲。
1.4 试验饲粮舍饲组所用的精料补充料组成及营养水平如表 1所示,为颗粒状,由青海省湟源县某饲料厂提供。舍饲组饲粮精粗比为65 ∶ 35,粗饲料为燕麦干草。燕麦干草、放牧牧草的营养水平如表 2所示。
|
|
表 1 精料补充料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the concentrate supplement (DM basis) |
|
|
表 2 燕麦干草、放牧牧草的营养水平(干物质基础) Table 2 Nutrient levels of oat hay and grazing grass (DM basis) |
在试验正试期最后1天晨饲前从2组中随机各选取5头牦牛犊牛,采用口腔导管采集瘤胃液150 mL,4层纱布过滤后立即测定pH,剩余瘤胃液样品一部分装至15 mL离心管中于-20 ℃保存,便于测定氨态氮(NH3-N)、微生物蛋白(MCP)、挥发性脂肪酸(VFA)浓度;另一部分装至5 mL冻存管于-80 ℃冻存备用,用于测定瘤胃菌群多样性的测定。
1.5.2 生长性能的测定在试验正试期第1天和最后1天,这2个时间段晨饲前对2组牦牛犊牛进行空腹称重,软皮尺测量体高、体斜长、胸围、管围,计算出为期7个月牦牛犊牛的总增重(TWG)和平均日增重(ADG)。
体高:鬐甲顶点至地面的垂直距离。
体斜长:肩端最前缘至臀端(坐骨结节)后缘的直线距离。
胸围:肩胛骨后角处垂直于体躯的周径。
管围:左前肢管部(管骨)上1/3(最细处)的水平周径。
1.5.3 瘤胃发酵参数的测定瘤胃液pH采用pHS-10型便携式pH计测定,测定前用相应的校准液对pH计进行校准。瘤胃液NH3-N浓度参照冯宗慈等[11]的比色法测定。瘤胃液MCP浓度采用考马斯亮蓝法[12]进行测定,经过前期离心处理后采用721分光光度计在595 nm波长处比色。瘤胃液VFA浓度使用GC-2014气相色谱仪测定,测定条件为:火焰离子化检测仪(FID)检测器,色谱柱为毛细管柱(FFAP,30.00 m×0.32 mm×0.50 μm);起始温度为60 ℃,随后温度以10 ℃/min上升至120 ℃,经过2 min后又以15 ℃上升至180 ℃持续5 min;FID温度250 ℃;进样量1 μL,载气为高纯氮气(99.99%),压力为0.7 MPa;氢气和空气压力同为0.4 MPa,毛细管柱压力为0.6~0.8 MPa,分流比为40 ∶ 1。
1.5.4 瘤胃微生物DNA提取、测序每个组随机选择5个瘤胃液样品进行解冻并充分混合,使用CTBA方法提取瘤胃液样品基因组DNA,用1.0%琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样本于离心管中,用无菌水稀释样本至1 ng/UL。根据细菌16S rDNA基因的V3~V4区,合成带有Barcode的特异引物。通用引物序列:515F,5′-GTGCCAGCMGCCGCGG-3′;806R,5′-GGACTACHVGGGTWTCTAAT-3′。PCR采用25 μL扩增体系;DNA模板5 ng,5 μmol/L的上、下游引物各1 μL,2 ng/μL的牛血清白蛋白(BSA)3 μL,2×Taq Plus Master Mix 12.5 μL,双蒸水(ddH2O)补加至25 μL;PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸60 s,共30个循环;72 ℃延伸7 min。PCR扩增产物用1.0%琼脂糖凝胶电泳检测,用QIAquickPCR纯化试剂盒(德国Qiagen公司)纯化回收,符合要求的DNA样品送至北京诺禾基因科技有限公司测序,测序平台为NovaSeq。
1.5.5 瘤胃菌群多样性分析测序平台得到的原始数据使用软件Trim-momatic (Version 0.36)软件去除低质量数据,然后通过vsearch软件和物种数据库去除嵌合体,得到有效序列。筛选相似性在97%以上的序列归类为操作分类单元(OTU),然后对OTU聚类、物种分类学、多样性指数、群落结构进行统计分析。
1.6 数据统计与分析试验所得数据采用SPSS 20.0软件的单因素方差(one-way ANOVA)程序进行方差分析,并用Duncan氏法进行组间多重比较。结果以平均值±标准差表示,P < 0.05表示差异显著,P < 0.01表示差异极显著,P>0.05表示差异不显著。
2 结果与分析 2.1 不同饲养方式对牦牛犊牛生长性能的影响如表 3所示,试验开始时2组的牦牛犊牛体重差异不显著(P>0.05),在不同饲养方式下经过7个月的饲喂,舍饲组牦牛犊牛的ADG比放牧组提高了174%,TWG是放牧组的2.74倍,组间差异极显著(P < 0.01)。
|
|
表 3 不同饲养方式下牦牛犊牛的体重变化 Table 3 Body weight changes of yak calves under different feeding methods |
如表 4所示,试验开始时2组牦牛犊牛的体尺各项指标无显著差异(P>0.05),在不同饲养方式下经过7个月的饲喂,舍饲组牦牛犊牛的体高、体斜长、胸围、管围比放牧组分别增加了27.6%、21.8%、13.0%、17.5%,组间差异极显著(P < 0.01)。
|
|
表 4 不同饲养方式下牦牛犊牛的体尺变化 Table 4 Changes of body size of yak calves under different feeding methods |
由表 5可知,舍饲组牦牛犊牛瘤胃液NH3-N、TVFA、丙酸、丁酸、异丁酸、戊酸和异戊酸浓度极显著高于放牧组(P < 0.01),MCP和乙酸浓度显著高于放牧组(P < 0.05),而pH和乙酸/丙酸值极显著低于放牧组(P < 0.01)。上述试验结果显示,舍饲高精料饲粮可以有效地促进牦牛犊牛的瘤胃发酵。
|
|
表 5 不同饲养方式对牦牛犊牛瘤胃发酵参数的影响 Table 5 Effects of different feeding methods on rumen fermentation parameters of yak calves |
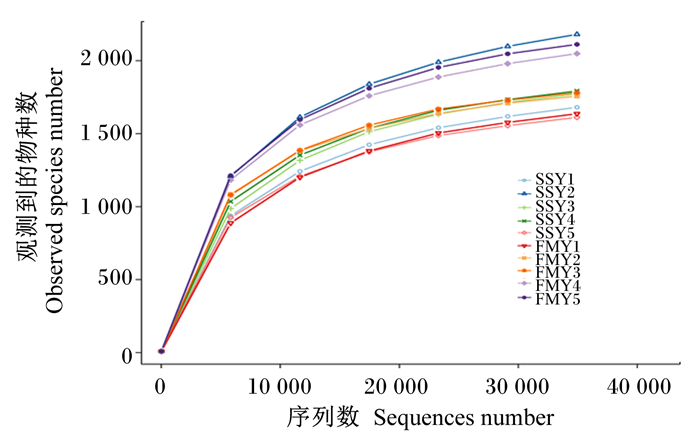
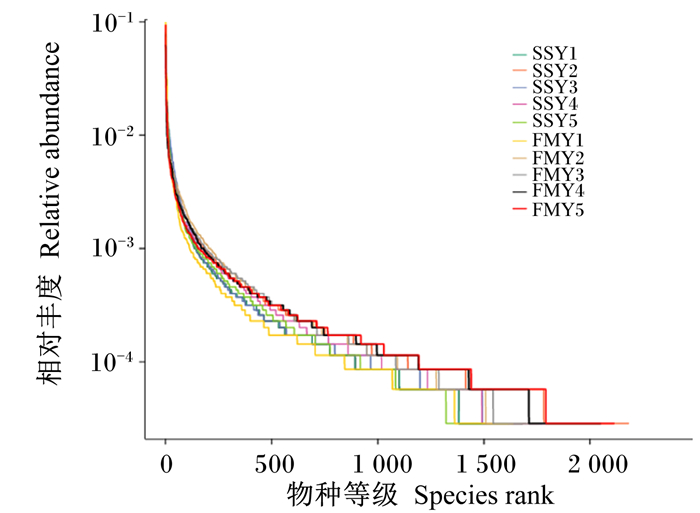
图 1是在97%一致性条件下绘制的稀释曲线,随着测序深度的增加,2组牦牛犊牛瘤胃菌群稀释曲线趋于平缓,说明本试验中2组牦牛犊牛瘤胃液测序数据合理。如图 2所示,丰度等级曲线在横轴水平方向上的所占范围大小表示牦牛犊牛瘤胃菌群的丰富度,在纵轴上的平滑程度表示牦牛犊牛瘤胃菌群分布的均匀情况,图像越平缓则说明牦牛犊牛瘤胃液菌群分布越均匀。
|
SSY表示舍饲组,FMY表示放牧组。图 2同。 SSY indicated barn feeding group, and FMY indicated grazing group. The same as Fig. 2. 图 1 稀释曲线 Fig. 1 Rarefaction curve |
|
图 2 丰度等级曲线 Fig. 2 Rank abundance curve |
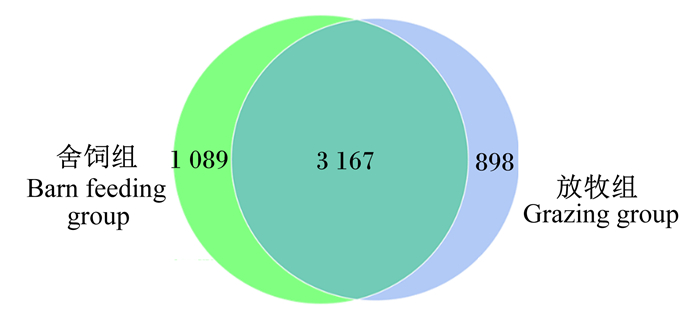
由图 3可知,2组OTU总数为5 154个,其中舍饲组和放牧组分别为4 256和4 065个,特有OTU数分别为1 089和898个,分别占OTU总数的21.13%和17.42%,2组共有OTU数为3 167个,占OTU总数的61.45%,舍饲组牦牛犊牛特有OTU数相对放牧组牦牛犊牛较高。
|
图 3 韦恩图 Fig. 3 Venn graph |
由表 6可知,2组牦牛犊牛瘤胃菌群序列覆盖度均大于0.99,Simpson指数均大于0.98,组间不存在显著差异(P>0.05),说明牦牛犊牛瘤胃菌群的分布都比较均匀;放牧组牦牛犊牛瘤胃菌群中观测到的物种数、ACE指数、Chao1指数、Shannon指数均显著或极显著高于舍饲组(P < 0.05或P < 0.01),以上结果表明放牧组牦牛犊牛瘤胃菌群的物种丰富度与多样性高于舍饲组。
|
|
表 6 牦牛犊牛瘤胃菌群Alpha多样性指数 Table 6 Alpha diversity indexes of rumen microbial community of yak calves |
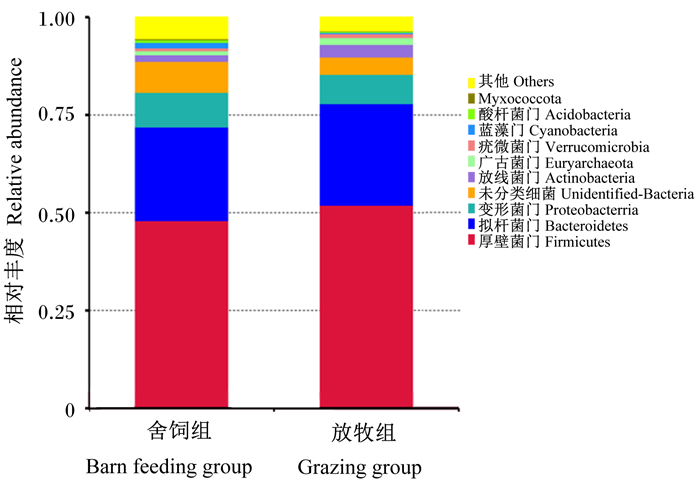
由图 4可,2种不同饲养方式下牦牛犊牛瘤胃微生物在门水平上均由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacterria)和未分类细菌(Unidentified-Bacteria)4个优势菌门主导。在舍饲组和放牧组中,Firmicutes的相对丰度分别为46.02%、53.96%;Bacteroidetes的相对丰度分别为23.94%、25.62%;Proteobacterria的相对丰度分别为8.86%、7.50%;Unidentified-Bacteria的相对丰度分别为7.90%、4.43%。与舍饲组相比,放牧组中Firmicutes的相对丰度提高了17.25%,差异显著(P=0.017)。
|
图 4 门水平上瘤胃微生物组成 Fig. 4 Rumen microbial composition at phylum level |
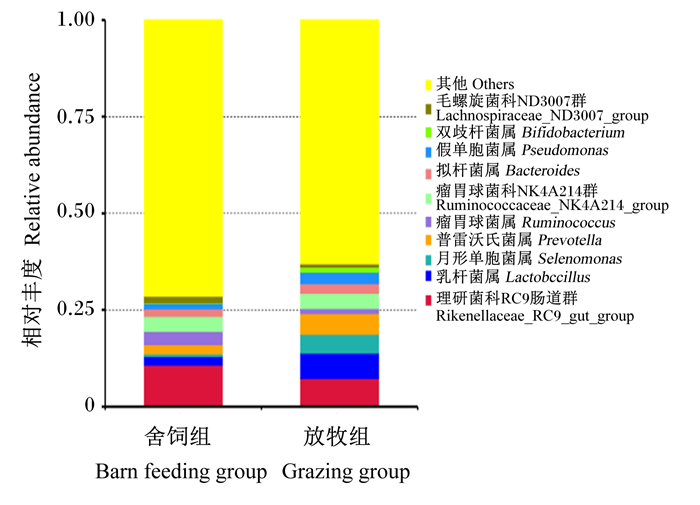
由图 5可知,2种不同饲养方式下牦牛犊牛瘤胃微生物在属水平上的优势菌属为理研菌科RC9肠道群(Rikenellaceae_RC9_gut_group)和乳杆菌属(Lactobccillus)。Rikenellaceae_RC9_gut_group属于拟杆菌门,舍饲组和放牧组的相对丰度分别为11.77%、6.92%,舍饲组显著高于放牧组(P=0.023);Lactobccillus属于Firmicutes,舍饲组和放牧组的相对丰度分别为2.21%、6.57%,放牧组显著高于舍饲组(P=0.019);舍饲组中次优势菌属为瘤胃球菌科NK4A214群(Ruminococcaceae_NK4A214_group)、瘤胃球菌属(Ruminococcus)、普雷沃氏菌属(Prevotella);放牧组中次优势菌属为Lactobacillus、Prevotella、月形单胞菌属(Selenomonas)。2种不同饲养方式下的牦牛犊牛瘤胃中都存在上述这几种微生物,但相对丰度有所不同。
|
图 5 属水平上瘤胃微生物组成 Fig. 5 Rumen microbial composition at genus level |
在家畜的饲养过程中,饲粮中的营养物质对动物的生长发育起着关键性的作用,体重、体尺可以最直观有效地反映出动物的生长情况。胸围的大小可以反映出动物肌肉的发育情况,体斜长和体高可判断骨骼发育是否良好[13]。孙光明等[14]研究发现,饲粮营养水平的提高可以有效地促进舍饲育肥牦牛体尺的发育。本试验结果显示,舍饲组牦牛犊牛在高精料饲粮的饲喂下12月龄体重、体尺均极显著高于放牧组,与Li等[15]的试验结果相同。这说明,在本试验条件下,6月龄的断奶牦牛犊牛由于瘤胃尚未完全发育成熟,给舍饲牦牛犊牛饲喂营养水平高、适口性好的精料补充料加快了牦牛犊牛的生长发育。放牧组牦牛犊牛每天所需的营养物质是从牧草中获得,其所需的营养物质得不到满足,相比于舍饲组牦牛犊牛生长发育明显迟缓,严重影响生长性能。因此,在牦牛犊牛的饲养过程适当的提高饲粮营养水平可以有效地促进牦牛犊牛的生长发育,进而提高成年后的生产、繁殖性能。
3.2 不同饲养方式对牦牛犊牛瘤胃发酵参数的影响饲粮中碳水化合物的水平及瘤胃中有机酸的浓度决定了反刍动物的瘤胃液pH,而瘤胃液pH可以有效地反映出瘤胃微生物的发酵状况[16]。秦正君等[17]研究发现,瘤胃液pH会随着饲粮精料水平的增加而降低,这与本试验结果相似,舍饲组牦牛犊牛在高精料饲粮的饲喂下瘤胃液pH极显著低于放牧组。NH3-N为瘤胃中的微生物提供18%~100%的氮,是饲粮中蛋白质的降解产物,为了保证瘤胃液中MCP产量的正常,要确保瘤胃液中NH3-N浓度在适宜范围内。在本试验条件下,舍饲组牦牛犊牛瘤胃液NH3-N和MCP浓度极显著或显著高于放牧组,这与王书祥等[9]、董利锋等[18]的研究结果相一致,其可能是由于精料中的可溶性蛋白质、易消化碳水化合物和非蛋白含氮物含量高,且降解速率缓慢,有利于NH3-N和MCP的合成。该结果也与Agle等[19]的研究结果相似,即奶牛饲粮中粗料水平增加则瘤胃液NH3-N浓度降低,可能是粗料中的结构性碳水化合物降低了氨的产量,从而提高了瘤胃微生物对氨的利用率。反刍动物的能量主要来自于瘤胃最终的发酵产物VFA,VFA是由常见的几种短链脂肪酸构成[20]。杨靖等[21]研究表明,高精料饲粮饲喂下的奶牛瘤胃液TVFA、丁酸、丙酸浓度增加,乙酸浓度降低。在本试验中,高精料饲粮饲喂下的舍饲组牦牛犊牛瘤胃液TVFA、丁酸、丙酸、乙酸浓度极显著或显著高于放牧组,而乙酸/丙酸值显著低于放牧组,可能是因为放牧组的牧草营养水平不能满足牦牛犊牛正常的营养需要量,未能为瘤胃微生物的发酵提供更多适宜发酵的底物,最终导致瘤胃液中VFA浓度降低。
3.3 不同饲养方式对牦牛犊牛瘤胃菌群结构的影响在本试验中2组的覆盖度均高于0.99,表明取样合格(测序样品的覆盖度大于0.97),所取样品可以真实反映2组低丰度OTU覆盖率及测序深度合理。Shannon指数是反映瘤胃菌群分布及多样性的指标;ACE指数是检测物种丰度的指标,Chao1指数反映物种的总数。Liu等[22]研究发现,饲粮中精料水平上升会显著降低牦牛瘤胃菌群Chao1指数和Shannon指数,可能是由于瘤胃液pH随精料水平的增加而降低,pH的下降导致牦牛瘤胃液中纤维降解菌的生长与繁殖受到抑制[23]。在本试验中,放牧组中观测到的物种数、ACE指数、Chao1指数、Shannon指数均显著高于舍饲组,表明在本试验条件下放牧组牦牛犊牛瘤胃菌群多样性显著高于舍饲组,印证了瘤胃菌群结构会随饲粮的不同而发生很大的变化[24]。这与谭子璇等[25]的研究结果一致,但与曹连宾等[26]研究结果相反,原因可能是饲粮的精粗比差距悬殊又或是饲粮的组成成分不同造成的。
牦牛瘤胃微生物中的优势菌门为Bacteroidetes、Firmicutes、Proteobacterria和螺旋菌门(Spirochaetae)[27],本试验中2组牦牛犊牛瘤胃微生物中排名前三的优势菌门分别是Bacteroidetes、Firmicutes和Proteobacterria。Bacteroidetes可以促进机体对碳水化合物的消化吸收及脂肪的沉积[28];Firmicutes可以促进动物机体对蛋白质的消化吸收、降解植物中的多糖[29]。在本试验条件下,舍饲组和放牧组中Firmicutes的相对丰度分别为46.02%、53.96%;Bacteroidetes的相对丰度分别为23.94%、25.62%,与曹连宾等[26]和An等[30]的研究结果相一致。放牧组Firmicutes的相对丰度显著高于舍饲组,说明舍饲组牦牛犊牛体重的显著增加与Bacteroidetes等可在瘤胃中促进食物的消化吸收,从而促进脂肪的沉积有关。Proteobacterria参与饲粮在瘤胃的发酵及消化可溶性碳水化合物[31],舍饲组和放牧组中Proteobacterria的相对丰度分别为8.43%、7.21%,说明舍饲组牦牛犊牛的消化吸收效率较放牧组有所提高;疣微菌门(Verrucomicrobiota)可以有效增强哺乳动物瘤胃及肠道的免疫功能[32],舍饲组和放牧组中Verrucomicrobiota的相对丰度分别为1.40%、0.03%,舍饲组牦牛犊牛在高精料饲粮的饲喂下瘤胃液中Verrucomicrobiota的相对丰度高于放牧组,说明高营养水平饲粮可以增强牦牛犊牛的免疫力。
张红涛[33]对荷斯坦奶牛的研究发现,在属水平上瘤胃微生物中的优势菌属为Prevotella和琥珀酸弧菌属。曾钰等[34]在牦牛的研究上显示舍饲牦牛瘤胃微生物中的优势菌属为Prevotella 1、拟杆菌目BS11和Rikenellaceae_RC9_gut_group。而在本试验中,2种不同饲养方式下的牦牛犊牛瘤胃微生物在属水平上的优势菌属为Rikenellaceae_RC9_gut_group和Lactobccillus。Rikenellaceae_RC9_gut_group属于Bacteroidetes,在舍饲组和放牧组中的相对丰度分别为11.77%、6.92%;Lactobccillus属于Firmicutes,在舍饲组和放牧组中的相对丰度分别为2.21%、6.57%,放牧组显著高于舍饲组。Fernando等[35]对肉牛的研究显示,饲喂精料的肉牛瘤胃微生物中Bacteroidetes的相对丰度比饲喂青干草的肉牛高,Firmicutes的相对丰度则相反。在本试验中,Bacteroidetes中占比最高的菌属是Rikenellaceae_RC9_gut_group,与Fernando等[35]的研究结果一致,这可能是由于舍饲组精料补充料中粗蛋白质、淀粉含量较高,可以有效促进反刍动物瘤胃中蛋白质和淀粉降解菌的增殖。有研究显示Bacteroidetes可以降解植物中的二糖、果糖等[36]。舍饲组瘤胃微生物中次优势菌属为Ruminococcaceae_NK4A214_group、Ruminococcus、Prevotella;放牧组瘤胃微生物中次优势菌属为Lactobccillus、Prevotella、Selenomonas,这与上述前人研究结果不完全一致,可能是由于牦牛犊牛品种、年龄以及饲粮组成等不同所造成。
4 结论在本试验条件下,与放牧相比,舍饲的饲养方式对牦牛犊牛的生长性能具有极显著的促进作用,并能有效地促进瘤胃发酵,但在一定程度上降低了瘤胃菌群的多样性及丰富度。
| [1] |
LONG R J, DING L M, SHANG Z H, et al. The yak grazing system on the Qinghai-Tibetan Plateau and its status[J]. The Rangeland Journal, 2008, 30(2): 241-246. DOI:10.1071/RJ08012 |
| [2] |
石红梅, 杨勤, 马登录, 等. 甘南牦牛繁殖性能调查及提高繁殖性能的技术措施[J]. 中国牛业科学, 2013, 39(1): 80-83. SHI H M, YANG Q, MA D L, et al. Investigations of reproductive performance and technical measures to improve reproductive performance for Gannan yak[J]. China Cattle Science, 2013, 39(1): 80-83 (in Chinese). DOI:10.3969/j.issn.1001-9111.2013.01.024 |
| [3] |
张潭瑛, 杨勤, 马桂琳, 等. 甘南牦牛种质资源保护及开发利用[J]. 畜牧兽医杂志, 2016, 35(4): 78-79, 81. ZHANG T Y, YANG Q, MA G L, et al. Protection and development and utilization of Gannan yak germplasm resources[J]. Journal of Animal Science and Veterinary Medicine, 2016, 35(4): 78-79, 81 (in Chinese). DOI:10.3969/j.issn.1004-6704.2016.04.026 |
| [4] |
DING X Z, LONG R J, KREUZER M, et al. Methane emissions from yak (Bos grunniens) steers grazing or kept indoors and fed diets with varying forage: concentrate ratio during the cold season on the Qinghai-Tibetan Plateau[J]. Animal Feed Science and Technology, 2010, 162(3/4): 91-98. |
| [5] |
BI Y L, ZENG S Q, ZHANG R, et al. Effects of dietary energy levels on rumen bacterial community composition in Holstein heifers under the same forage to concentrate ratio condition[J]. BMC Microbiology, 2018, 18(1): 69. DOI:10.1186/s12866-018-1213-9 |
| [6] |
SHABAT S K B, SASSON G, DORON-FAIGENBOIM A, et al. Specific microbiome-dependent mechanisms underlie the energy harvest efficiency of ruminants[J]. The ISME Journal, 2016, 10(12): 2958-2972. DOI:10.1038/ismej.2016.62 |
| [7] |
徐琴. 饲粮和品种对山羊瘤胃微生物多样性的影响[D]. 硕士学位论文. 雅安: 四川农业大学, 2015. XU Q. The impact of ration and goat breeds on the composition and the relative abundance of microbial species in goat rumen[D]. Master's Thesis. Ya'an: Sichuan Agricultural University, 2015. (in Chinese) |
| [8] |
MAO S Y, ZHANG R Y, WANG D S, et al. Impact of subacute ruminal acidosis (SARA) adaptation on rumen microbiota in dairy cattle using pyrosequencing[J]. Anaerobe, 2013, 24: 12-19. DOI:10.1016/j.anaerobe.2013.08.003 |
| [9] |
王书祥, 戴东文, 杨英魁, 等. 补饲精料对冷季放牧牦牛生长性能、瘤胃发酵及菌群结构的影响[J]. 动物营养学报, 2021, 33(11): 6266-6276. WANG S X, DAI D W, YANG Y K, et al. Effects of concentrate supplementation on growth performance, rumen fermentation and microbial community structure of grazing yaks in cold season[J]. Chinese Journal of Animal Nutrition, 2021, 33(11): 6266-6276 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.11.027 |
| [10] |
马玲玲. 青海省拉脊山地区植物群落结构、植被生产力及土壤因子对海拔梯度变化的响应[D]. 硕士学位论文. 西宁: 青海师范大学, 2012. MA L L. The response of the structure of plant community, vegetation productivity and soil factors on the altitude gradient changes at Laji Mountain area of Qinghai Province[D]. Master's Thesis. Xining: Qinghai Normal University, 2012. (in Chinese) |
| [11] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010, 31(增刊1): 37. FENG Z C, GAO M. Improvement of the method for determining the ammonia nitrogen content in rumen liquid by colorimetry[J]. Animal Husbandry and Feed Science, 2010, 31(Suppl.1): 37 (in Chinese). |
| [12] |
高雨飞. 高精料日粮条件下烟酸对牛瘤胃微生物区系的影响[D]. 硕士学位论文. 南昌: 江西农业大学, 2016. GAO Y F. Effects of niacin on microorganism system in the rumen of cattle under high-concentrate diet[D]. Master's Thesis. Nanchang: Jiangxi Agricultural University, 2016. (in Chinese) |
| [13] |
李广, 韩雄, 贾晶, 等. 不同能量水平代乳料对羔羊生长性能的影响[C]//2014年全国养羊生产与学术研讨会论文集. 聊城: 中国畜牧兽医学会养羊学分会, 2014: 302-306. LI G, HAN X, JIA J, et al. The effect of different energy levels of milk replacer on the growth performance of lambs[C]//Proceedings of the 2014 National Sheep Production and Academic Symposium. Liaocheng: Sheep Raising Branch of Chinese Association of Animal Science and Veterinary Medicine, 2014: 302-306. (in Chinese) |
| [14] |
孙光明, 洛桑顿珠, 巴桑旺堆, 等. 饲粮能量水平对舍饲育肥牦牛生长性能、体尺增长及血清生化和内分泌激素指标的影响[J]. 动物营养学报, 2021, 33(8): 4511-4519. SUN G M, LUO S D Z, BA S W D, et al. Effects of dietary energy level on growth performance, body size increasement and serum biochemical and endocrine hormone parameters of fattening yaks under stall-feeding[J]. Chinese Journal of Animal Nutrition, 2021, 33(8): 4511-4519 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.08.031 |
| [15] |
LI L Y, ZHU Y K, WANG X Y, et al. Effects of different dietary energy and protein levels and sex on growth performance, carcass characteristics and meat quality of F1 Angus×Chinese Xiangxi yellow cattle[J]. Journal of Animal Science and Biotechnology, 2014, 5(1): 21. DOI:10.1186/2049-1891-5-21 |
| [16] |
ANANTASOOK N, WANAPAT M, CHERDTHONG A, et al. Effect of plants containing secondary compounds with palm oil on feed intake, digestibility, microbial protein synthesis and microbial population in dairy cows[J]. Asian-Australasian Journal of Animal Sciences, 2013, 26(6): 820-826. DOI:10.5713/ajas.2012.12689 |
| [17] |
秦正君, 王若勇, 时国峰, 等. 日粮精粗比对奶牛瘤胃发酵及生产性能的影响[J]. 畜牧兽医杂志, 2018, 37(1): 83-85. QIN Z J, WANG R Y, SHI G F, et al. Effect of dietary concentration and roughage ratio to rumen fermentation and production performance on dairy cow[J]. Journal of Animal Science and Veterinary Medicine, 2018, 37(1): 83-85 (in Chinese). |
| [18] |
董利锋, 杨修竹, 高彦华, 等. 日粮不同NDF/NFC水平对周岁后荷斯坦奶牛生产性能、营养物质消化率、瘤胃发酵特征和甲烷排放的影响[J]. 草业学报, 2021, 30(2): 156-165. DONG L F, YANG X Z, GAO Y H, et al. Effects of dietary NDF: NFC ratio on growth performance, nutritive digestibility, ruminal fermentation characteristics and methane emissions of Holstein heifers[J]. Acta Prataculturae Sinica, 2021, 30(2): 156-165 (in Chinese). |
| [19] |
AGLE M, HRISTOV A N, ZAMAN S, et al. Effect of dietary concentrate on rumen fermentation, digestibility, and nitrogen losses in dairy cows[J]. Journal of Dairy Science, 2010, 93(9): 4211-4222. DOI:10.3168/jds.2009-2977 |
| [20] |
杨宏波, 刘红, 占今舜, 等. 不同精粗比颗粒饲料对断奶公犊牛瘤胃发酵参数和微生物的影响[J]. 草业学报, 2015, 24(12): 131-138. YANG H B, LIU H, ZHAN J S, et al. Effects of diet pellets with different concentrate-roughage ratios on rumen fermentation parameters and microorganism abundance in weaned bull calves[J]. Acta Prataculturae Sinica, 2015, 24(12): 131-138 (in Chinese). |
| [21] |
杨靖, 崔巧荣, 张力莉, 等. 日粮精粗比对奶牛瘤胃挥发酸模式及血液糖脂代谢相关指标的影响[J]. 中国饲料, 2019(5): 33-35. YANG J, CUI Q R, ZHANG L L, et al. Effects of dietary concentrate to forage ratio on rumen volatile acid pattern and serum indices related with glucose and lipid metabolism in dairy cows[J]. China Feed, 2019(5): 33-35 (in Chinese). |
| [22] |
LIU C, WU H, LIU S J, et al. Dynamic alterations in yak rumen bacteria community and metabolome characteristics in response to feed type[J]. Frontiers in Microbiology, 2019, 10: 1116. DOI:10.3389/fmicb.2019.01116 |
| [23] |
张瑞阳. 组学技术研究亚急性瘤胃酸中毒对奶牛瘤胃微生物、代谢和上皮功能的影响[D]. 博士学位论文. 南京: 南京农业大学, 2015. ZHANG R Y. Omics-based approaches to assess the effects of subacute ruminal acidosis on rumen microbiota, metabolism and epithelial function in dairy cows[D]. Ph. D. Thesis. Nanjing: Nanjing Agricultural University, 2015. (in Chinese) |
| [24] |
KONG Y H, HE M L, MCALISTER T, et al. Quantitative fluorescence in situ hybridization of microbial communities in the rumens of cattle fed different diets[J]. Applied and Environmental Microbiology, 2010, 76(20): 6933-6938. |
| [25] |
谭子璇, 柏雪, 罗璠, 等. 不同饲养方式对牦牛瘤胃微生物区系及肌肉品质的影响[J]. 食品科学, 2020, 41(15): 79-87. TAN Z X, BAI X, LUO F, et al. Effects of different feeding systems on rumen microflora and muscle quality of yaks[J]. Food Science, 2020, 41(15): 79-87 (in Chinese). |
| [26] |
曹连宾, 崔占鸿, 孙红梅, 等. 全放牧牦牛与舍饲牦牛瘤胃细菌多样性比较[J]. 江苏农业科学, 2016, 44(3): 242-248. CAO L B, CUI Z H, SUN H M, et al. Comparison of rumen bacterial diversity between all-grazing yak and house-fed yak[J]. Jiangsu Agricultural Sciences, 2016, 44(3): 242-248 (in Chinese). |
| [27] |
ZHOU Z M, FANG L, MENG Q X, et al. Assessment of ruminal bacterial and archaeal community structure in yak (Bos grunniens)[J]. Frontiers in Microbiology, 2017, 8: 179. |
| [28] |
李岚捷, 成述儒, 刁其玉, 等. 不同NFC/NDF水平饲粮对犊牛瘤胃发酵参数和微生物区系多样性的影响[J]. 畜牧兽医学报, 2017, 48(12): 2347-2357. LI L J, CHENG S R, DIAO Q Y, et al. Effects of diets with different NFC/NDF levels on the rumen fermentation parameters and bacterial community in male calves[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(12): 2347-2357 (in Chinese). |
| [29] |
POPE P B, MACKENZIE A K, GREGOR I, et al. Metagenomics of the Svalbard reindeer rumen microbiome reveals abundance of polysaccharide utilization loci[J]. PLoS One, 2012, 7(6): e38571. |
| [30] |
AN D D, DONG X Z, DONG Z Y. Prokaryote diversity in the rumen of yak (Bos grunniens) and Jinnan cattle (Bos taurus) estimated by 16S rDNA homology analyses[J]. Anaerobe, 2005, 11(4): 207-215. |
| [31] |
PITTA D W, PINCHAK W E, INDUGU N, et al. Metagenomic analysis of the rumen microbiome of steers with wheat-induced frothy bloat[J]. Frontiers in Microbiology, 2016, 7: 689. |
| [32] |
DERRIEN M, VAN BAARLEN P, HOOIVELD G, et al. Modulation of mucosal immune response, tolerance, and proliferation in mice colonized by the mucin-degrader Akkermansia muciniphila[J]. Frontiers in Microbiology, 2011, 2: 166. |
| [33] |
张红涛. 不同玉米青贮水平对荷斯坦后备牛瘤胃液微生物组及其代谢组的影响[D]. 博士学位论文. 北京: 中国农业大学, 2017. ZHANG H T. Effects of corn silage levels on rumen fluid microbiota and its metabolome in Holstein heifers[D]. Ph. D. Thesis. Beijing: China Agricultural University, 2017. (in Chinese) |
| [34] |
曾钰, 高彦华, 彭忠利, 等. 饲粮中添加酵母培养物对舍饲牦牛瘤胃发酵参数及微生物区系的影响[J]. 动物营养学报, 2020, 32(4): 1721-1733. ZENG Y, GAO Y H, PENG Z L, et al. Effects of yeast culture supplementation in diets on rumen fermentation parameters and microflora of house-feeding yak[J]. Chinese Journal of Animal Nutrition, 2020, 32(4): 1721-1733 (in Chinese). |
| [35] |
FERNANDO S C, PURVIS H T 2ND, NAJAR F Z, et al. Rumen microbial population dynamics during adaptation to a high-grain diet[J]. Applied and Environmental Microbiology, 2010, 76(22): 7482-7490. |
| [36] |
PURUSHE J, FOUTS D E, MORRISON M, et al. Comparative genome analysis of Prevotella ruminicola and Prevotella bryantii: insights into their environmental niche[J]. Microbial Ecology, 2010, 60(4): 721-729. DOI:10.1007/s00248-010-9692-8 |




