2. 青海大学农牧学院, 西宁 810016
2. College of Agriculture and Animal Husbandry, Qinghai University, Xi'ning 810016, China
牦牛是青藏高原地区牧民主要饲养的优势反刍家畜,能够适应当地较为恶劣的自然生态气候和生存环境。然而在牦牛犊牛的早期培育过程中,仍存在吃奶不足、生长较慢、体况薄弱和腹泻疾病易发等的突出问题,是牦牛培育的重要窗口期[1]。同时,在冬季极度严寒的状态下,由于牦牛犊牛早期适时断奶、补饲不到位而出现营养摄入不足,不能满足前期生长发育也会影响后期培育质量,严重时引发的疾病问题会导致牦牛犊牛发生死亡,给当地牧民造成较大的经济损失[2]。通过对牦牛犊牛进行早期断奶和补饲精料,提高了其生产性能和培育效果,促进了其胃肠道和免疫器官的良好发育,说明早期断奶培育和合理营养补饲对牦牛犊牛后期生长发育至关重要[3-6]。Van Niekerk等[7]研究发现,从液体牛乳过渡到固体饲粮的采食方式对早期牦牛犊牛的发育至关重要。因此,用代乳粉代替母乳,在适当饲喂优质饲粮的同时再补饲精料,大大提高了其摄入的干物质含量和营养水平,有利于其生长发育,也能为后期的高质量生产奠定良好基础。
胰腺作为内脏器官中进行消化代谢的腺体,其内分泌部和外分泌部分泌的酶和激素对机体维持血糖稳定和代谢平衡具有重要作用[8]。徐春卓等[9]研究发现,胰腺内外分泌部面积的增加可以促进其内外分泌部细胞分化和细胞分裂,促进胰腺发育及其生物学功能的完善。江来等[10]运用核磁共振代谢组学技术研究重症胰腺炎大鼠的血液后发现,相较正常大鼠,其机体中的糖、蛋白质、脂肪和核酸都发生了严重的代谢紊乱,说明了基于代谢组学技术可以更加精确地揭示其内在的生理机制。王菊等[11]研究发现,给1日龄肉鸭饲喂不同磷酸氢钙水平的饲粮,其中饲喂中等水平组肉鸭的胰腺重量、胰淀粉酶和胰蛋白酶的活性高于低水平组和高水平组。郭龙[12]研究发现,功能性氨基酸可以调控奶牛胰腺的发育,提高其生长发育和生产性能,但对于牦牛早期营养补饲从而调控胰腺发育的报道较少。哺乳期补饲精料可以提高牦牛犊牛营养摄入水平,提高胰腺分泌的消化酶和激素含量,进而也影响了胰腺的生长发育。本试验以牦牛犊牛为研究对象,以哺乳期合理补饲精料为切入点,利用非靶向代谢组学技术,在早期断奶后筛选其胰腺中小分子差异代谢物进行通路分析,揭示哺乳期补饲精料对牦牛犊牛生长及胰腺发育的影响及作用机制,为建立牦牛犊牛培育的营养调控技术提供科学依据。
1 材料与方法 1.1 试验动物选取体况健康、体重相近的断奶(30±4)日龄的牦牛犊牛(公)20头,分为对照组和试验组,每组10个重复。试验在青海海北藏族自治州海晏海北高原生态畜牧业科技示范园的牧场中进行。
1.2 饲养管理在试验开始时,对照组饲喂代乳粉和苜蓿干草,试验组在对照组饲粮基础上补饲精料。牦牛犊牛经过30 d的预试期后,逐渐适应饲喂水平和养殖环境。正式试验开始时,2组每天每头犊牛饲喂0.48 kg代乳粉,每5 d增加0.01 kg。对照组每天每头犊牛饲喂0.25 kg苜蓿干草,每5 d增加0.14 kg。试验组每天每头犊牛饲喂0.125 kg苜蓿干草和0.125 kg精料,两者每5 d都增加0.07 kg,即其苜蓿干草和精料饲喂量比例为1 ∶ 1。代乳粉、苜蓿干草、精料的组成及营养水平如表 1所示。2组的固体干物质采食量相同。试验期间牦牛犊牛实行单栏单圈饲养,自由饮水,定期做好消毒和清理活动。
|
|
表 1 代乳粉、苜蓿干草、精料营养水平(干物质基础) Table 1 Nutrient levels of milk replacer powder, alfalfa hay and concentrate (DM basis) |
2组在经过预试期30 d,正试期100 d后,牦牛犊牛平均日采食量达到1 kg时进行屠宰试验。解剖后取出牦牛犊牛胰腺组织,采集长、宽、高分别为1.5、1.5、2.0 cm的组织样本,用生理盐水冲洗后,放入装有4%多聚甲醛的50 mL离心管中固定;采集边长为0.5 cm的小块正方体组织样本,装入5 mL冻存管中再投入-196 ℃液氮罐中冷藏,最后转入-80 ℃超低温冰箱中备用。
1.4 胰腺发育屠宰试验前称量牦牛犊牛体重,饲养试验结束后分别从2组中各选取5头牦牛犊牛进行屠宰试验,取出胰腺组织进行称量计重,计算胰腺指数,计算公式如下:
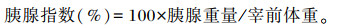
|
经过苏木精-伊红(HE)染色在显微镜下观察胰腺组织切片,并在每张切片中随机选取4个视野拍照。在统一视野内总面积为1×105 μm2的情况下,使用Image-Pro Plus 6.0软件测量并记录其视野内的胰腺面积,计算胰腺外分泌部面积总占比、胰腺内分泌部面积总占比、胰腺内外分泌部面积比,计算公式如下:

|
将胰腺组织样品取100 mg后用液氮研磨,加入500 μL的80%甲醇溶液充分混和均匀后置于EP管中。再用涡旋振荡仪摇匀后水浴静置5 min,在4 ℃离心机离心20 min。离心后取一定体积的上清液加质谱水稀释,直至甲醇含量为53%。再次在4 ℃离心机离心20 min,收集一定量的上清液,使用液相色谱仪-质谱仪(LC-MS)进行分析。
1.5.2 仪器分析在确定色谱柱HypesilGoldcolumn (C18)后,选择柱温40 ℃,流速0.2 mL/min。在正离子模式下,流动相A液0.1%甲酸,B液甲醇;在负离子模式下,流动相A液5 mmol/L醋酸铵(pH=9.0),B液甲醇。再经过质谱扫描质荷比(m/z)100~1 500后得到数据文件。将其导入CD 3.1软件中进行处理,设置质量偏差5 ppm、信号强度偏差30%、信噪比3等信息进行峰提取与面积定量。进行分子式预测后与mzCloud、mzVault和Masslist数据库进行比对,对定量结果标准化处理后得到代谢物的鉴定和相对定量结果。
1.6 数据处理生长发育数据运用SPSS 25.0软件进行统计学t检验分析,结果用“平均值±标准差”表示,以P≤0.05作为判断存在差异显著性的标准。
代谢组学数据使用Meta X 21.0软件进行主成分分析(PCA)和偏最小二乘法分析和判别(PLS-DA),得出PCA图和PLS-DA图,并分析得出代谢物的变量投影重要度(VIP)值。利用SPSS 25.0软件计算得出各个代谢物含量的统计学显著性P值和差异倍数(FC)值。一般情况下,差异代谢物筛选的默认标准为VIP>1,P<0.05且FC≥2或FC≤0.5。火山图和聚类热图分别用Ggplot 2.0和Pheatmap 1.0软件进行绘制后,筛选出差异代谢物。而对鉴定得到的小分子代谢物通过KEGG数据库进行分析注释。
2 结果与分析 2.1 补饲精料对早期断奶牦牛犊牛胰腺发育的影响由表 2可知,试验组牦牛犊牛的体重、胰腺重量、胰腺指数显著高于对照组(P<0.05)。
|
|
表 2 哺乳期补饲精料对早期断奶牦牛犊牛胰腺指数的影响 Table 2 Effects of supplemental concentrate on pancreatic index of early-weaned yak calves during lactation |
由表 3可知,试验组牦牛犊牛的胰腺外分泌部面积总占比、胰腺内分泌部面积总占比显著高于对照组(P<0.05),而试验组胰腺内外分泌部面积比显著低于对照组(P<0.05)。
|
|
表 3 哺乳期补饲精料对早期断奶牦牛犊牛胰腺内外分泌部面积的影响 Table 3 Effects of supplemental concentrate on area of pancreatic endocrine and exocrine parts of early-weaned yak calves during lactation |
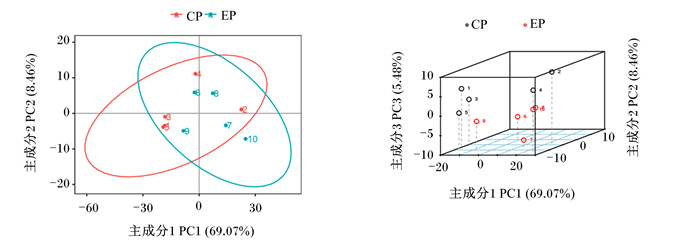
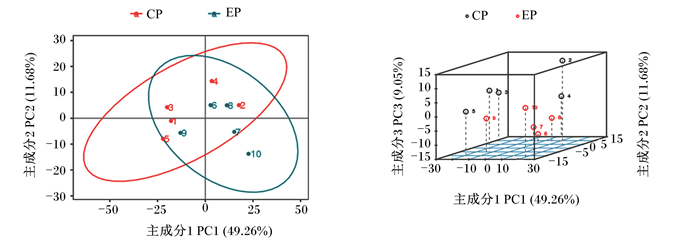
由图 1可知,在正离子模式下的PCA图中,从试验组与对照组之间的胰腺样本散点图可以看出,其PCA1、2、3分别为49.26%、11.68%、9.05%。
|
CP为对照组;EP为试验组。图 6同。 CP was the control group; EP was the test group. The same as Fig. 6. 图 1 正离子模式下的PCA得分散点图 Fig. 1 Scatter plot of principal component analysis score in positive ion mode |
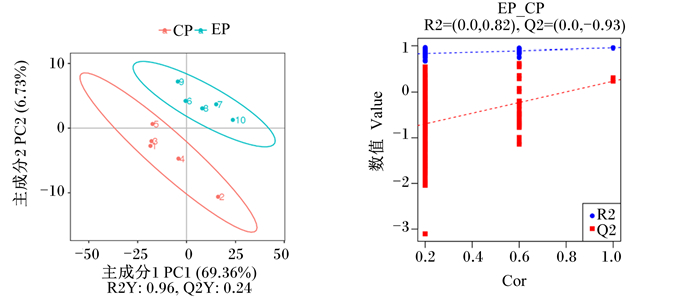
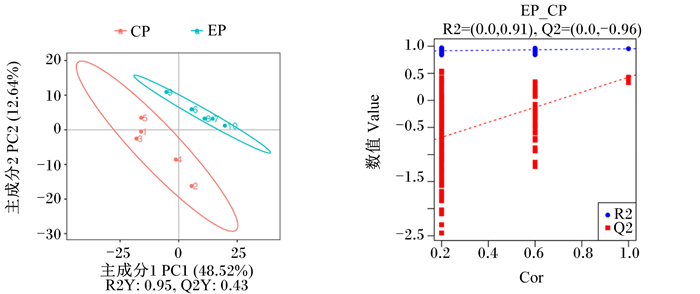
由图 2可知,在正离子模式下的PLS-DA图中,R2Y=0.95,Q2Y=0.43,R2Y>Q2Y,Q2与Y轴截距小于0,说明样本数据描述良好。
|
左图中R2Y代表该模型解释率;Q2Y代表该模型预测能力;右图中R2、Q2代表运用偏最小二乘回归方法建立模型的评价参数, Cor代表R2与Q2的相关性。图 7同。 R2Y in the left figure represents the explanatory rate of the model; Q2Y represents the predictive power of the model; R2 and Q2 in the right figure are the evaluation parameters of this model using the partial least squares regression method, and Cor represents the correlation between R2 and Q2. The same as Fig. 7. 图 2 正离子模式下的PLS-DA得分图及模型排列验证图 Fig. 2 PLS-DA score plot and model alignment validation plot in positive ion mode |
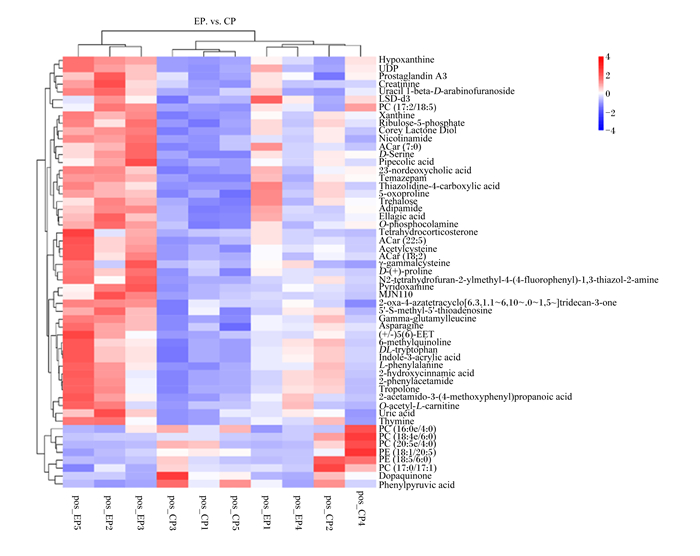
由图 3中可知,在正离子模式下的聚类热图中,2组胰腺样品含有55种差异代谢物。
|
图中pos代表正离子模式pos in the figure represents the positive ion mode;Hypoxanthine: 次黄嘌呤;Uridine diphosphate:尿苷二磷酸;Prostaglandin A3:前列腺素A3;Creatinine:肌酐;Uracil 1-beta-D-arabinofuranoside:尿嘧啶1-β-D-阿拉伯呋喃糖苷;LSD-d3:麦角酸二乙酰胺-d3;Phosphatidylcholine (17 ∶ 2/18 ∶ 5):磷脂酰胆碱(17 ∶ 2/18 ∶ 5);Xanthine:黄嘌呤;Ribulose-5-phosphate:核糖-5-磷酸;Corey Lactone Diol:科立内酯二醇;Nicotinamide:烟酰胺;ACar (7 ∶ 0):丁酰肼(7 ∶ 0);D-Serine:D-丝氨酸;Pipecolic acid:哌咯酸;23-nordeoxycholic acid:23-脱氧胆酸;Temazepam:替马西泮;Thiazolidine-4-carboxylic acid:噻唑烷-4-羧酸;5-oxoproline:5-氧代脯氨酸;Trehalose:海藻糖;Adipamide:己二胺;Ellagic acid:鞣花酸;O-phosphocolamine:O-磷胆胺;Tetrahydrocorticosterone:四氢皮质酮;ACar (22 ∶ 5):丁酰肼(22 ∶ 5);Acetylcysteine:乙酰半胱氨酸;ACar (18 ∶ 2):丁酰肼(18 ∶ 2);Gamma-glutamylcysteine:γ-谷氨酰半胱氨酸;D-(+)-proline:D-(+)-脯氨酸;N2-tetrahydrofuran-2-ylmethyl-4-(4-fluorophenyl)-1, 3-thiazol-2-amine:N2-四氢呋喃-2-基甲基-4-(4-氟苯基)-1, 3-噻唑-2-胺;Pyridoxamine:吡哆胺;MJN110;2-oxa-4-azatetracyclo[6.3.1.1~6, 10~.0~1, 5~]tridecan-3-one:2-氧杂-4-氮杂四环[6.3.1.1~6, 10~.0~1, 5~]十三烷-3-酮;5′-S-methyl-5′-thioadenosine:5-甲基-5-硫代腺苷;Gamma-glutamylleucine:γ-谷氨酰-亮氨酸;Asparagine:天冬酰胺;(+/-)5(6)-EET:5(6)-环氧乙烷;6-methylquinoline:6-甲基喹啉;DL-tryptophan:DL-色氨酸;Indole-3-acrylic acid:吲哚-3-丙烯酸;L-phenylalanine:L-苯丙氨酸;2-hydroxycinnamic acid:2-羟基肉桂酸;2-phenylacetamide:2-苯乙酰胺;Tropolone:托普隆;2-acetamido-3-(4-methoxyphenyl)propanoic acid:2-乙酰氨基-3-(4-甲氧基苯基)丙酸;O-acetyl-L-carnitine:O-乙酰基-L-肉碱;Uric acid:尿酸;Thymine:胸腺嘧啶;Phosphatidylcholine (16 ∶ 0e/4 ∶ 0):磷脂酰胆碱(16 ∶ 0e/4 ∶ 0);Phosphatidylcholine (18 ∶ 4e/6 ∶ 0):磷脂酰胆碱(18 ∶ 4e/6 ∶ 0);Phosphatidylcholine (20 ∶ 5e/4 ∶ 0):磷脂酰胆碱(20 ∶ 5e/4 ∶ 0);Phosphatidylethanolamine (18 ∶ 1/20 ∶ 5):磷脂酰乙醇胺(18 ∶ 1/20 ∶ 5);Phosphatidylethanolamine (18 ∶ 5e/6 ∶ 0):磷脂酰乙醇胺(18 ∶ 5e/6 ∶ 0);Phosphatidylcholine (17 ∶ 0/17 ∶ 1):磷脂酰胆碱(17 ∶ 0/17 ∶ 1);Dopaquinone:多巴醌;Phenylpyruvic acid:苯丙酮酸。 图 3 正离子模式下的聚类热图 Fig. 3 Heat map of clustering in positive ion mode |
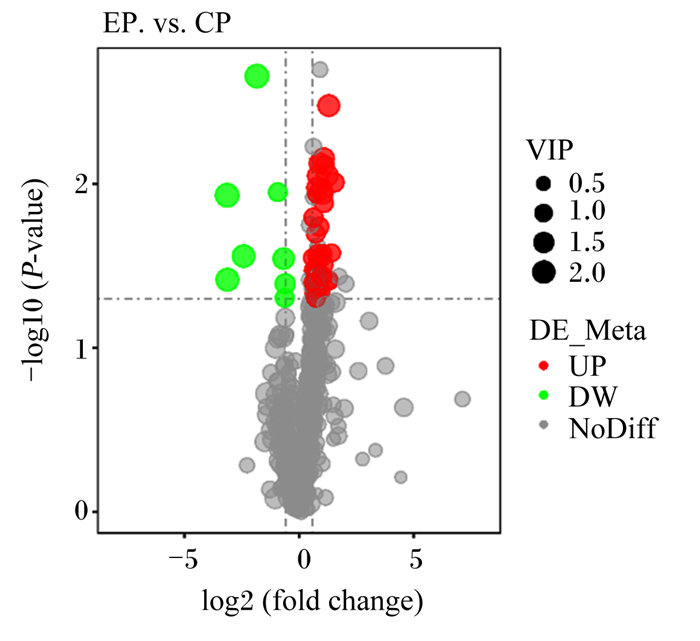
在正离子模式下,试验组与对照组相比较共鉴定出583个小分子代谢物,其中55个差异代谢物含量存在显著变化。由图 4中可知,在正离子模式下的火山图中,差异代谢物含量显著上调的有47个,下调的有8个。
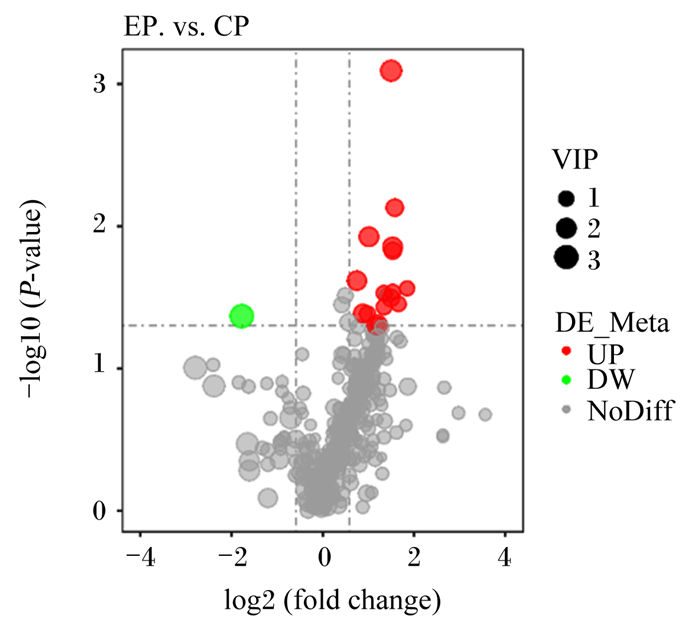
|
图中log2(fold change)代表代谢物的差异倍数变化;-log10(P-value)代表差异显著性水平;VIP代表变量投影重要度;UP代表上调;DW代表下调;NoDiff代表无显著差异性。图 9同。 In the figure, log2(fold change) represents the variance fold change of metabolites; -log10(P-value) represents the level of variance significance; VIP represents the projected importance of the variable; UP represents upregulation; DW represents downregulation; NoDiff represents no variance significance. The same as Fig. 9. 图 4 正离子模式下的火山图 Fig. 4 Volcano map in positive ion mode |
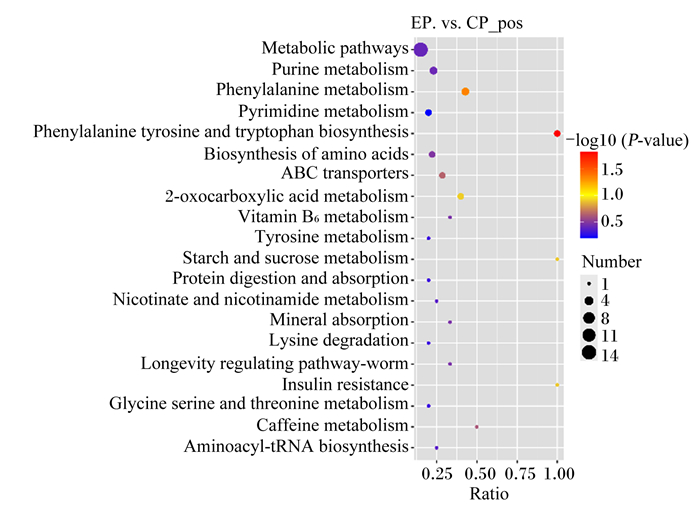
由图 5可知,在正离子模式下的KEGG气泡图中,对照组和试验组共筛选出20条代谢途径。
|
pos:正离子模式positive ion mode;Metabolic pathways:代谢途径;Purine metabolism:嘌呤代谢;Phenylalanine metabolism:苯丙氨酸代谢;Pyrimidine metabolism:嘧啶代谢;Phenylalanine:苯丙氨酸;Tyrosine and tryptophan biosynthesis:酪氨酸和色氨酸的生物合成;Biosynthesis of amino acids:氨基酸生物合成;ABC transporters:ABC转运蛋白;2-oxocarboxylic acid metabolism:2-氧代羧酸代谢;Vitamin B6 metabolism:维生素B6代谢;Tyrosine metabolism:酪氨酸代谢;Starch and sucrose metabolism:淀粉和蔗糖代谢;Protein digestion and absorption:蛋白质消化吸收;Nicotinate and nicotinamide metabolism:烟酸盐和烟酰胺代谢;Mineral absorption:矿物质吸收;Lysine degradation:赖氨酸降解;Longevity regulating pathway-worm:长寿调控途径-蠕虫;Insulin resistance:胰岛素抵抗;Glycine:甘氨酸;Serine and threonine metabolism:丝氨酸和苏氨酸代谢;Caffeine metabolism;咖啡因代谢;Aminoacyl-tRNA biosynthesis:氨基酰基-tRNA生物合成。 图中-log10(P-value)代表差异显著性水平;Number代表代谢通路中差异代谢物的数目;Ratio代表代谢通路中差异代谢物的数目/该通路中鉴定出总代谢物数目的比率。图 10同。 In the figure, -log10(P-value) represents the level of differential significance; Number represents the number of differential metabolites in the metabolic pathway; Ratio represents the ratio of the number of differential metabolites in the metabolic pathway/the number of total metabolites identified in the pathway. The same as Fig. 10. 图 5 正离子模式下的代谢通路KEGG气泡图 Fig. 5 KEGG bubble diagram of metabolic pathway in positive ion mode |
由表 4可知,在正离子模式下,与对照组相比,试验组在苯丙氨酸、酪氨酸和色氨酸的生物合成代谢途径中,差异代谢物L-苯丙氨酸的含量显著上升(P<0.05),苯丙酮酸的含量显著下降(P<0.05);在苯丙氨酸代谢途径中,差异代谢物L-苯丙氨酸、2-苯乙酰胺的含量显著上升(P<0.05),苯丙酮酸的含量显著下降(P<0.05)。
|
|
表 4 正离子模式下的代谢通路以及相关差异代谢物 Table 4 Metabolic pathways in positive ion mode and associated differential metabolites |
由图 6可知,在负离子模式下的PCA图中,2组之间的散点图可以清晰直观地观察出来,胰腺样本PCA1、2、3分别为69.07%、8.46%、5.48%。
|
图 6 负离子模式下的PCA得分散点图 Fig. 6 Scatter plot of PCA scores for principal component analysis in negative ion mode |
由图 7可知,在负离子模式下的PLS-DA图中,R2Y=0.96,Q2Y=0.24,R2Y>Q2Y,Q2与Y轴截距小于0,说明样本数据描述良好。
|
图 7 负离子模式下的PLS-DA得分图及模型排列验证图 Fig. 7 PLS-DA score plot and model alignment validation plot in negative ion mode |
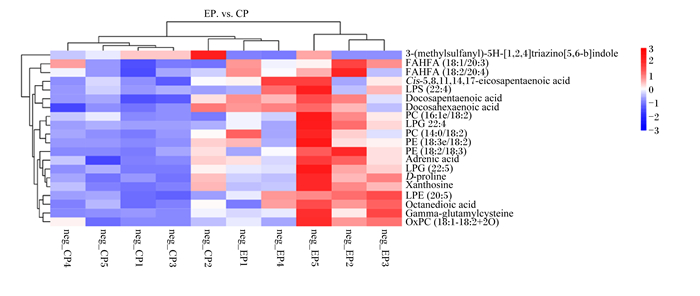
由图 8中可知,在负离子模式下的聚类热图中,2组胰腺样品含有20种差异代谢物。
|
图中neg代表负离子模式neg in the figure represents the negative ion mode;3-(methylsulfanyl)-5H-[1, 2, 4]triazino[5, 6-b]indole:3-(甲硫基)-5H-[1, 2, 4]三嗪[5, 6-b]吲哚;FAHFA (18 ∶ 1/20 ∶ 3):羟基脂肪酸(18 ∶ 1/20 ∶ 3);FAHFA (18 ∶ 2/20 ∶ 4):羟基脂肪酸(18 ∶ 2/20 ∶ 4);Cis-5, 8, 11, 14, 17-eicosapentaenoic acid:顺式-5, 8, 11, 14, 17-二十碳五烯酸;Lyso-phosphatidylserine (22 ∶ 4):溶血磷脂酰丝氨酸(22 ∶ 4);Docosapentaenoic acid:二十二碳五烯酸;Docosahexaenoic acid:二十二碳六烯酸;Phosphatidylcholine(16 ∶ 1e/18 ∶ 2):磷脂酰胆碱(16 ∶ 1e/18 ∶ 2);Lyso-phosphatidylglycerol(22 ∶ 4):溶血磷脂酰甘油(22 ∶ 4);Phosphatidylcholine (14 ∶ 0/18 ∶ 2):磷脂酰胆碱(14 ∶ 0/18 ∶ 2);Phosphatidylethanolamine (18 ∶ 3e/18 ∶ 2):磷脂酰乙醇胺(18 ∶ 3e/18 ∶ 2);Phosphatidylethanolamine (18 ∶ 2/18 ∶ 3):磷脂酰乙醇胺(18 ∶ 2/18 ∶ 3);Adrenic acid:肾上腺酸;Lyso-phosphatidylglycerol (22 ∶ 5):溶血磷脂酰甘油(22 ∶ 5);D-proline:D-脯氨酸;Xanthosine:黄嘌呤核苷;Lyso-phosphatidylethanolamine (20 ∶ 5):溶血磷脂酰乙醇胺(20 ∶ 5);Octanedioic acid:辛二酸;Gamma-glutamylcysteine:γ-谷氨酰半胱氨酸;Oxycodone phosphatidylcholine (18 ∶ 1-18 ∶ 2+2O):氧杂磷脂酰胆碱(18 ∶ 1-18 ∶ 2+2O)。 图 8 负离子模式下的聚类热图 Fig. 8 Heat map of clustering in negative ion mode |
在负离子模式下,试验组与对照组相比较共鉴定出402个小分子代谢物,其中20个差异代谢物含量存在显著变化。由图 9中可以看出,在负离子模式下的火山图中,差异代谢物含量显著上调的有19个,下调的有1个。
|
图 9 负离子模式下的火山图 Fig. 9 Volcano map in negative ion mode |
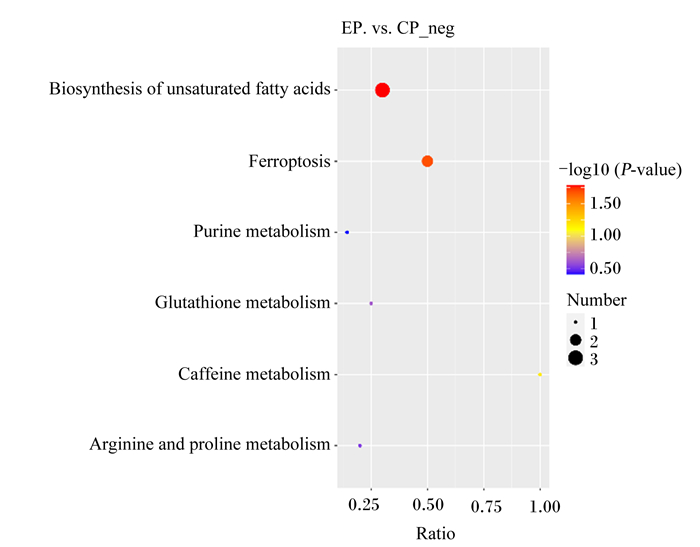
由图 10可知,在负离子模式下的KEGG气泡图中,对照组和试验组共筛选出6条代谢途径。
|
neg:负离子模式negative ion mode;Biosynthesis of unsaturated fatty acids:不饱和脂肪酸生物合;Ferroptosis:铁凋亡;Purine metabolism:嘌呤代谢;Glutathione metabolism:谷胱甘肽代谢;Caffeine metabolism:咖啡因代谢;Arginine and proline metabolism精氨酸和脯氨酸代谢。 图 10 负离子模式下的代谢通路KEGG气泡图 Fig. 10 KEGG bubble diagram of metabolic pathway in negative ion mode |
由表 5可知,在负离子模式下,与对照组相比,试验组在不饱和脂肪酸生物合成的代谢途径中,差异代谢物二十二碳五烯酸、二十二碳六烯酸、肾上腺酸的含量显著上升(P<0.05);在铁凋亡代谢途径中,差异代谢物γ-谷氨酰半胱氨酸、肾上腺酸的含量显著上升(P<0.05)。
|
|
表 5 负离子模式下的代谢通路以及相关差异代谢物 Table 5 Metabolic pathways in negative ion mode and associated differential metabolites |
通过结果可以看出,补饲精料可以提高哺乳期牦牛犊牛的体重、胰腺重量及胰腺指数。李平业[13]通过研究发现,牧民在青草期和枯草期补饲精料,可以有效增加牦牛犊牛的体重,有利于其早期的生长发育。Hirai等[14]研究发现,肉牛育肥期间补充玉米粉等精料后,可以显著提高其平均日增重和屠宰重。这说明在哺乳期固体干物质采食量相同的情况下,适当补饲精料可以很好地促进牦牛犊牛肌肉胴体的发育和生长,显著影响并提高牦牛犊牛自身的生长和发育,从而得出补饲精料对犊牛牦牛的生长发育具有重要促进作用。吐日根白乙拉等[15]研究发现,适当增加精料类饲料的同时,可以促进畜体胰岛分泌释放胰岛素,有利于胰腺腺体自身的生长与发育。哺乳期补饲精料也减少了闰管和导管等的分布程度,增加牦牛犊牛胰腺腺泡和胰岛的分布密集程度,也增加了胰腺外分泌部面积总占比和胰腺内分泌部面积总占比。Svensson等[16]将胰腺内分泌和外分泌实质中的毛细血管面积进行比较后发现,胰岛的毛细血管体积约为3.5%,而外分泌胰腺的毛细血管体积显著降低为2%。这些参数之间存在差异的原因可能是缺乏淋巴毛细血管,胰岛中的毛细血管腔相对较小。Wang等[17]研究发现,胰腺部分区域胰岛细胞密度高于腺泡区域,尤其在富含胰高血糖素的胰岛中细胞数量更多。刘梅英等[18]研究发现,给奶牛补饲精料后,其蛋白质含量会影响胰腺外分泌功能。而内外分泌部面积比则显著降低,这是由于补饲精料大大增加了胰腺外分泌部的面积,从而使得内分泌部在其中所占面积比例相对较低,也反映了补饲精料对胰腺外分泌部的影响效果最大。这说明补饲精料对哺乳期牦牛犊牛胰腺内部的腺泡和胰岛、内分泌部和外分泌部有积极的作用效果,对牦牛犊牛胰腺的生长发育也有着积极的推动作用。
3.2 补饲精料对早期断奶牦牛犊牛胰腺代谢组学的影响早期补饲精料对牦牛犊牛的苯丙氨酸、酪氨酸和色氨酸的生物合成和苯丙氨酸代谢途径有着明显的作用机制。在苯丙氨酸、酪氨酸和色氨酸的生物合成中,牦牛犊牛补饲精料后L-苯丙氨酸含量显著上升,苯丙酮酸含量显著下降。Aubi等[19]发现L-苯丙氨酸是机体的必需氨基酸,在牦牛犊牛体内经过苯丙氨酸羟化酶氧化后形成酪氨酸,对机体的糖代谢和脂肪代谢有促进和推动作用。L-苯丙氨酸也是一种营养增补剂,可以提高饲粮的适口性和营养水平。Zhu等[20]研究发现,在饲粮中添加适量的L-苯丙氨酸,可以提高断奶仔猪采食适口性,进而也提高了饲料利用率。王志鹏等[21]发现,苯丙酮酸可以降低苯丙氨酸代谢催化酶的活性,导致苯丙氨酸不能转化形成酪氨酸,从而使得苯丙氨酸及其酮酸大量堆积在体内,造成牦牛犊牛早期营养不良并对其生长发育、行为运动都有破坏作用。
而Lopez等[22]提到过苯丙氨酸、酪氨酸和色氨酸的生物合成不能在动物体内进行,必须通过采食植物饲料才能够完成。这说明了早期补饲精料,可以提高牦牛犊牛的营养水平和生长发育,也降低了阻碍和限制其良好生长的风险。同样的,在苯丙氨酸代谢途径中,补饲精料后L-苯丙氨酸和2-苯乙酰胺含量显著上升,苯丙酮酸含量显著下降。Su等[23]研究发现,2-苯乙酰胺是苯丙氨酸代谢的一个中间物。而2-苯乙酰胺可以通过基团取代的方式形成其他衍生物,可以刺激机体中枢神经兴奋和推动调节行为活动。苯丙氨酸代谢通过L-苯丙氨酸、2-苯乙酰胺、苯丙酮酸促进机体的营养水平和行为运动。可以看出,早期补饲精料可以提高牦牛犊牛的营养水平及其生长质量,对牦牛犊牛后期的生长发育有重要的意义。
早期补饲精料对牦牛犊牛的不饱和脂肪酸生物合成和铁凋亡代谢途径有着积极的推动作用。在不饱和脂肪酸生物合成代谢途径中,牦牛犊牛补饲精料后二十二碳五烯酸、二十二碳六烯酸、肾上腺酸含量显著上升。其中二十二碳五烯酸可以提高牦牛犊牛机体免疫力,对牦牛犊牛早期疾病有预防和治疗作用。Hafez等[24]研究发现,二十二碳六烯酸也提高了畜禽的生长性能和免疫力,在保证机体健康的同时也降低了患病死亡的风险。Isolation[25]研究发现,二十二碳六烯酸可以提高牦牛犊牛哺乳期神经发育及其功能的发挥,对其脑力开发有着积极的促进作用。Bruce等[26]研究发现,肾上腺酸对机体炎症和脂肪酸代谢具有重要的调控作用,改善了胰岛素抵抗和脂质代谢,降低了炎症水平。二十二碳五烯酸、二十二碳六烯酸、肾上腺酸共同合成了对牦牛犊牛机体非常重要的不饱和脂肪酸,可以看出,补饲精料对哺乳期牦牛犊牛的营养水平、生长发育和体质健康有极大的推动作用。在铁凋亡代谢途径中,补饲精料后γ-谷氨酰半胱氨酸、肾上腺酸含量显著上升。γ-谷氨酰半胱氨酸可以帮助机体维持正常的免疫功能,还具有抗氧化、加强机体健康的作用。γ-谷氨酰半胱氨酸和肾上腺酸形成的脂肪酸代谢,为铁凋亡提供所需的特定脂质前体。而Xie等[27]研究发现,在癌症等疾病中基于铁凋亡的干预治疗非常重要,铁凋亡在无菌炎症性疾病中起重要作用。Marie等[28]通过铁在糖尿病中胰岛β细胞功能障碍作用,减少铁含量,从而改善胰岛素抵抗。这说明了早期补饲精料,可以提高牦牛犊牛机体的免疫能力,在相关疾病预防中发挥重要作用,也为诊断和治疗干预创造良好的机会和条件。
4 结论综上所述,补饲精料提高了早期断奶牦牛犊牛的胰腺发育水平,对其胰腺的各项代谢机能有着积极的调控作用,有利于改善早期断奶牦牛犊牛的生长发育,为牦牛幼畜早期健康培育的营养调控提供了重要理论依据。
| [1] |
陈学礼, 和嘉华, 邹淑昆, 等. 中甸牦牛犊牛培育的关键技术措施[J]. 畜牧与饲料科学, 2019, 40(3): 57-59. CHEN X L, HE J H, ZOU S K, et al. Key technical measures for rearing of Zhongdian yak calves[J]. Animal Husbandry and Feed Science, 2019, 40(3): 57-59 (in Chinese). |
| [2] |
LONG R J, DING L M, SHANG Z H, et al. The yak grazing system on the Qinghai-Tibetan plateau and its status[J]. The Rangeland Journal, 2008, 30(2): 241-246. DOI:10.1071/RJ08012 |
| [3] |
赵寿保, 武甫德, 杨全寿, 等. 舍饲状态下犊牦牛培育效果观察[J]. 今日畜牧兽医, 2018, 34(7): 58-59. ZHAO S B, WU F D, YANG Q S, et al. Observation on the effect of calving yak under housing condition[J]. Today Animal Husbandry and Veterinary Medicine, 2018, 34(7): 58-59 (in Chinese). DOI:10.3969/j.issn.1673-4092.2018.07.054 |
| [4] |
XICCATO G, TROCINO A, QUEAQUE P I, et al. Rearing veal calves with respect to animal welfare: effects of group housing and solid feed supplementation on growth performance and meat quality[J]. Livestock Production Science, 2002, 75(3): 269-280. DOI:10.1016/S0301-6226(01)00319-0 |
| [5] |
牟永娟, 郭淑珍, 包永清, 等. 冷季补饲和犊牛早期断奶对甘南牦牛生长发育和繁殖性能的影响[J]. 畜牧兽医杂志, 2019, 38(6): 11-13. MOU Y J, GUO S Z, BAO Y Q, et al. The effects of cold-season supplementary feeding and early weaning on the reproductive performance of Gannan yak and the grand development of calf[J]. Journal of Animal Science and Veterinary Medicine, 2019, 38(6): 11-13 (in Chinese). DOI:10.3969/j.issn.1004-6704.2019.06.004 |
| [6] |
崔占鸿. 牦牛犊牛培育方式对生长和消化道发育的影响[D]. 博士学位论文. 杨凌: 西北农林科技大学, 2020. CUI Z H. Effects of rearing patterns on growth and digstive tract development in yak calves[D]. Ph. D. Thesis. Yangling: Northwest A&F University, 2020. (in Chinese) |
| [7] |
VAN NIEKERK J K, FISCHER-TLUSTOS A J, WILMS J N, et al. ADSA Foundation Scholar Award: new frontiers in calf and heifer nutrition-from conception to puberty[J]. Journal of Dairy Science, 2021, 104(8): 8341-8362. DOI:10.3168/jds.2020-20004 |
| [8] |
佟春萌, 陈乃松, 季振尧, 等. 大口黑鲈胰腺的组织学观察[J]. 上海海洋大学学报, 2014, 23(6): 814-819. TONG C M, CHEN N S, JI Z Y, et al. The histological observation of the pancreas of largemouth bass, Micropterus salmoides[J]. Journal of Shanghai Ocean University, 2014, 23(6): 814-819 (in Chinese). |
| [9] |
徐春卓, 辛颖. 宫内发育迟缓对大鼠胰腺中Ngn3表达及内分泌细胞发育的影响[J]. 中国医科大学学报, 2018, 47(10): 891-894, 899. XU C Z, XIN Y. Effects of intrauterine growth retardation on Ngn3 expression and endocrine cell development[J]. Journal of China Medical University, 2018, 47(10): 891-894, 899 (in Chinese). DOI:10.12007/j.issn.0258-4646.2018.10.006 |
| [10] |
江来, 万小健, 卞金俊, 等. 重症胰腺炎大鼠血液的核磁共振谱代谢组学研究[J]. 上海医学, 2009, 32(11): 999-1002. JIANG L, WAN X J, BIAN J J, et al. Metabolism study on blood of rats with severe acute pancreatitis by 1H nuclear magnetic resonance and pattern recognition[J]. Shanghai Medical Journal, 2009, 32(11): 999-1002 (in Chinese). |
| [11] |
王菊, 赵华, 陈小玲, 等. 饲粮非植酸磷水平对肉鸭生长性能和消化功能的影响[J]. 动物营养学报, 2020, 32(1): 206-214. WANG J, ZHAO H, CHEN X L, et al. Effects of dietary non-phytate phosphorus levels on growth performance and digestive function of meat ducks[J]. Journal of Animal Nutrition, 2020, 32(1): 206-214 (in Chinese). DOI:10.3969/j.issn.1006-267x.2020.01.026 |
| [12] |
郭龙. 亮氨酸和苯丙氨酸调控奶牛胰腺酶合成和分泌的信号传导网络[D]. 博士学位论文. 杨凌: 西北农林科技大学, 2019. GUO L. Leucine and phenylalanine regulate pancreatic enzyme synthesis and secretion of dairy cow: the signal transduction network[D]. Ph. D. Thesis. Yangling: Northwest A&F University, 2019. (in Chinese) |
| [13] |
李平业. 浅谈补饲精料对放牧牦牛藏羊的增重影响[J]. 今日畜牧兽医, 2021, 37(12): 59. LI P Y. The effect of supplemental feeding concentrate on weight gain of grazing yaks and Tibetan sheep[J]. Today Animal Husbandry and Veterinary Medicine, 2021, 37(12): 59 (in Chinese). DOI:10.3969/j.issn.1673-4092.2021.12.043 |
| [14] |
HIRAI M M G, MENEZES L F G, KUSS F, et al. Finishing steers on oat pasture intercropped with legumes or receiving energetic supplementation[J]. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, 2015, 67(4): 1141-1149. DOI:10.1590/1678-4162-7122 |
| [15] |
吐日根白乙拉, 金海, 薛树媛, 等. 包头地区不同产犊季节奶牛产奶量和泌乳曲线解析[J]. 家畜生态学报, 2017, 38(4): 71-74. TURIGEN BAIYILA, JIN H, XUE S Y, et al. Analysis on milk yield and lactation curve of dairy cows calved in different seasons in Baotou regions[J]. Journal of Domestic Animal Ecology, 2017, 38(4): 71-74 (in Chinese). DOI:10.3969/j.issn.1673-1182.2017.04.014 |
| [16] |
SVENSSON A M, JANSSON L, HELLERSTRÖM C. The volume and area of the capillaries in the endocrine and exocrine pancreas of the rat[J]. Histochemistry, 1988, 90(1): 43-46. DOI:10.1007/BF00495705 |
| [17] |
WANG X J, MISAWA R, ZIELINSKI M C, et al. Regional differences in islet distribution in the human pancreas-preferential beta-cell loss in the head region in patients with type 2 diabetes[J]. PloS One, 2013, 8(6): e67454. DOI:10.1371/journal.pone.0067454 |
| [18] |
刘梅英, 彭健, 刘敏跃, 等. 从后处理工艺提高植酸酶热稳定性的研究进展[J]. 饲料工业, 2007, 28(11): 1-3. LIU M Y, PENG J, LIU M Y, et al. Research progress in improving phytase thermostability by post-processing technics[J]. Feed Industry, 2007, 28(11): 1-3 (in Chinese). |
| [19] |
AUBI O, PRESTEGÅRD K S, JUNG-KC K, et al. The Pah-R261Q mouse reveals oxidative stress associated with amyloid-like hepatic aggregation of mutant phenylalanine hydroxylase[J]. Nature Communications, 2021, 12(1): 2073. DOI:10.1038/s41467-021-22107-1 |
| [20] |
ZHU L, WANG G, DONG B, et al. Effects of sweetener neotame on diet preference, performance and hematological and biochemical parameters of weaned piglets[J]. Animal Feed Science and Technology, 2016, 214: 86-94. DOI:10.1016/j.anifeedsci.2016.02.013 |
| [21] |
王志鹏, 马新雨, 颜惠娟, 等. 浅析氨基酸代谢在生物有机化学与化学生物学教学中的重要性[J]. 大学化学, 2019, 34(1): 24-32. WANG Z P, MA X Y, YAN H J, et al. Discussion on introducing amino acid metabolism into bioorganic chemistry and chemical biology education[J]. University Chemistry, 2019, 34(1): 24-32 (in Chinese). |
| [22] |
LOPEZ M J, MOHIUDDIN S S. Biochemistry, essential amino acids[M]//StatPearls[Internet]. Treasure Island(FL): StatPearls Publishing, 2022.
|
| [23] |
SU L X, HUANG Y Y, ZHU Y, et al. Discrimination of sepsis stage metabolic profiles with an LC/MS-MS-based metabolomics approach[J]. BMJ Open Respiratory Research, 2014, 1(1): e000056. DOI:10.1136/bmjresp-2014-000056 |
| [24] |
HAFEZ H M, ATTIA Y A. Challenges to the poultry industry: current perspectives and strategic future after the COVID-19 outbreak[J]. Frontiers in Veterinary Science, 2020, 7: 516. DOI:10.3389/fvets.2020.00516 |
| [25] |
ISOLATION Q S. Identification of bioactive agents from yak milk powder with preventive potential against inflammatory.carcinogenesis, and neurodegenerative diseases[M]. [S.l.]: [s.n.], 2020.
|
| [26] |
BRUCE C R, DYCK D J. Cytokine regulation of skeletal muscle fatty acid metabolism: effect of interleukin-6 and tumor necrosis factor-α[J]. American Journal of Physiology-Endocrinology and Metabolism, 2004, 287(4): E616-E621. DOI:10.1152/ajpendo.00150.2004 |
| [27] |
XIE Y, HOU W, SONG X, et al. Ferroptosis: process and function[J]. Cell Death and Differentiation, 2016, 23(3): 369-379. DOI:10.1038/cdd.2015.158 |
| [28] |
BACKE M B, MOEN I W, ELLERVIK C, et al. Iron regulation of pancreatic beta-cell functions and oxidative stress[J]. Annual Review of Nutrition, 2016, 36: 241-273. DOI:10.1146/annurev-nutr-071715-050939 |




