养羊业是国家积极发展“草食畜牧业”和促进山区农民脱贫致富的重点扶持产业。野生牧草生态随着我国养羊业的不断发展而遭受着巨大压力。因此,为了缓解野生牧草生态压力,我国北方养羊模式逐渐由传统的放牧饲养转变为舍饲饲养。在舍饲条件下,动物饲粮组成和生活环境发生巨大的变化,机体遭受氧化应激的风险加大,抵抗不良刺激能力下降,营养物质消化能力下降,从而造成畜禽生长性能降低。开发与应用各类功能性添加剂来缓解氧化应激、提高生长性能,是畜牧业中的常规手段。此外,随着畜禽生产“禁抗令”的颁布,畜禽行业也将研究热点聚焦于开发新型抗生素替代物。大量的植物提取物,如多酚、多糖、黄酮、精油类物质,因其纯天然、健康、多功能等优点而备受关注。
姜黄素(curcumin,CUR)是从姜黄根茎中提取出来的一种植物多酚类物质,也是一种天然色素[1]。CUR具有抗氧化、抑炎、降脂、抗菌抗虫等多种生物学功能[2]。根据中华人民共和国农业农村部第2131号和第123号公告,CUR作为一种天然绿色的添加剂已经被允许在淡水鱼类和肉鸡配合饲料中使用。有研究表明,饲粮中添加CUR可显著提高猪、鸡和水产动物的生长性能。芦娜等[3]研究表明,饲粮中添加200 mg/kg CUR可显著提高断奶仔猪平均日增重、平均日采食量。杨灿等[4]研究表明,饲粮中添加CUR可显著提高不同时期湘黄鸡平均日采食量和平均日增重。张宝彤等[5]研究表明,饲料中添加30 mg/kg CUR显著提高了罗非鱼平均增重率和特定生长率,显著降低了饵料系数。目前,CUR在反刍动物中的应用还处于初级阶段,CUR对反刍动物营养物质消化代谢的研究还鲜有报道,并且添加剂量也没有明确。因此,本试验旨在研究饲粮中添加CUR对舍饲羔羊生长性能、营养物质表观消化率、能氮代谢和血清生化指标的影响,为CUR在肉用绵羊中的应用提供一定的理论基础。
1 材料与方法 1.1 试验材料试验所用CUR为橙黄色粉末,购自江苏省无锡市某生物工程有限公司,纯度≥98%。
1.2 试验设计试验于2021年8—11月在山西省右玉县祥和岭上农牧开发有限公司完成。试验选用体况适中、被毛光滑健康无病、体重[(20.89±1.15) kg]相近的4月龄左右的杜泊×小尾寒羊杂交一代公羔48只,采用单因素完全随机分组设计,将试验羊分成4组,每组12只。各组分别在基础饲粮中添加0(对照组)、300(300CUR组)、600(600CUR组)、900 mg/kg(900CUR组)CUR。试验期90 d,其中预试期15 d,饲养试验60 d,消化代谢试验15 d。基础饲粮参考NRC(2007)绵羊营养需要配制,精粗比为60 ∶ 40,基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验前3 d,对所有试验羔羊进行严格检疫,排除传染病。然后对羊舍进行全面清扫和消毒。预试期内对试验羊进行驱虫和常规免疫。所有试验羊均为单栏(2.4 m2)饲养,每日07:30、17:30分别投料1次,自由采食,并保证充足清洁饮水。晨饲前用分析天平准确称量每只羊CUR饲喂量,晨饲时将CUR与100 g粉状饲粮混合后一次性喂给试验羊。
1.4 样品采集血液样品采集:正试期第60天晨饲前对所有试验羊静脉采血,2 000×g离心15 min,取血清分装到2 mL离心管中,-20 ℃保存待测。
消化代谢粪样及尿样采集:正试期第60天所有试验羊称重后,每组挑选6只体重相近的试验羊放置在单独的代谢笼中,并记录每只羊体重。消化代谢前4 d为适应期,适应期内所有试验羊自由采食,保证充足饮水。试验后3 d为正试采样期,正试期内晨饲前对所有试验羊全收粪收尿,并记录每天每只羊粪量、尿量及采食量。通过代谢笼下的金属网箱收集粪便,尿液则用4层纱布过滤收集到装有100 mL 10%硫酸的塑料桶中,粪样和尿样于-20 ℃保存待测。
1.5 样品采集和指标测定 1.5.1 生长性能正试期第1天晨饲前对所有试验羔羊称重,记录为初始体重(IBW);正试期第60天晨饲前对所有羊称重,记录为终末体重(FBW)。试验期间记录每只羊每天给料量及剩料量,根据数据计算平均日采食量、平均日增重和料重比。
1.5.2 血清生化指标血清甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)含量利用生化分析仪(BS200)测定,试剂盒购自上海酶联生物科技有限公司;血清非脂化脂肪酸(NEFA)含量、一氧化氮合酶(NOS)活性采用酶联免疫吸附测定(ELISA)法利用酶标分析仪(Infinite 50)测定,试剂盒购自上海酶联生物科技有限公司。
1.5.3 饲粮、粪样和尿样指标测定饲粮及粪样于65 ℃烘箱中烘干3 d,回潮1 d后粉碎过0.4 mm筛,分别放置在自封袋中进行后续指标测定。饲粮及粪样干物质(DM)和有机物(OM)含量参考AOAC(2012)[6]方法测定,中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量参照Van Soest等[7]方法测定。饲粮、粪样和尿样粗蛋白质(CP)含量以及粪样和尿样氮含量利用凯氏定氮仪(K9860)测定。饲粮粗脂肪(EE)含量采用索式提取法测定。粪能和尿能利用自动热值测量仪(WZR-1A,长沙奔特仪器有限公司)测定。
参考刘笑梅等[8],各指标计算公式如下:

|

|
甲烷能根据赵一广等[9]的甲烷排放量的预测模型进行估算。
1.6 数据统计与分析试验数据采用Excel 2007进行初步整理,并采用SPSS 22.0统计软件进行单因素方差分析(one-way ANOVA),差异显著时采用Duncan氏法进行多重比较,并进行线性和二次回归分析。数据用平均值和均值标准误(SEM)表示,P < 0.05为差异显著。
2 结果 2.1 饲粮中添加CUR对舍饲羔羊生长性能的影响由表 2可知,各组之间初始体重无显著差异(P>0.05)。300CUR组和600CUR组终末体重显著高于对照组(P < 0.05),900CUR组与其他3组差异不显著(P>0.05),且呈现二次曲线效应(P=0.03)。300CUR组平均日增重显著高于对照组(P < 0.05),且呈现二次曲线效应(P=0.05)。300CUR组料重比显著低于对照组和600CUR组(P < 0.05)。各组之间平均日采食量无显著差异(P>0.05)。
|
|
表 2 饲粮中添加CUR对舍饲羔羊生长性能的影响 Table 2 Effects of dietary CUR on growth performance of barn feeding lambs |
由图 1可知,以1~60 d总增重为评价指标,通过回归分析可以得出饲粮中CUR适宜添加量为487.5 mg/kg。
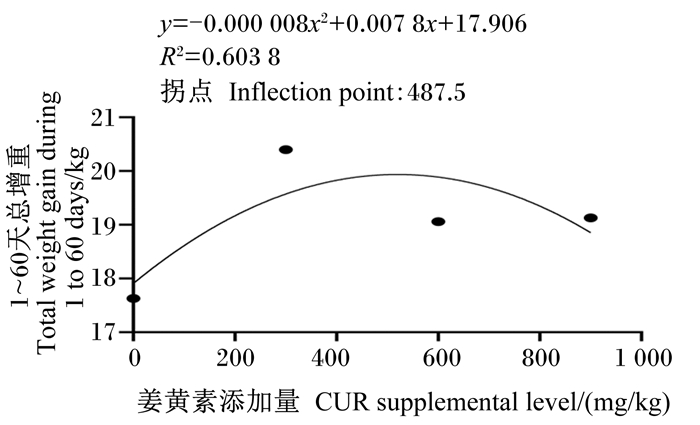
|
图 1 饲粮中添加CUR对舍饲羔羊1~60 d总增重的影响 Fig. 1 Effects of dietary CUR on total weight gain during 1 to 60 days of barn feeding lambs |
由表 3可知,300CUR组NDF表观消化率显著高于对照组(P < 0.05),与600CUR组和900CUR组无显著差异(P>0.05),且呈现二次曲线效应(P=0.05)。各组之间DM、OM、ADF表观消化率无显著差异(P>0.05)。
|
|
表 3 饲粮中添加CUR对舍饲羔羊营养物质表观消化率的影响 Table 3 Effects of dietary CUR on nutrient apparent digestibility of barn feeding lambs |
由表 4可知,各组之间摄入氮、粪氮、尿氮和可消化氮无显著差异(P>0.05)。300CUR组沉积氮显著高于对照组(P < 0.05),与600CUR组和900CUR组无显著差异(P>0.05),且呈现二次曲线效应(P=0.015)。300CUR组氮表观消化率显著高于对照组(P < 0.05),与600CUR组和900CUR组无显著差异(P>0.05),且呈现二次曲线效应(P=0.026)。
|
|
表 4 饲粮中添加CUR对舍饲羔羊氮消化代谢的影响 Table 4 Effects of dietary CUR on nitrogen digestion and metabolism of barn feeding lambs |
由表 5可知,各组之间摄入总能、粪能、尿能和总能表观消化率无显著差异(P>0.05),且尿能呈现二次曲线效应(P=0.011)。300CUR组和600CUR组消化能显著高于对照组(P < 0.05),与900CUR组无显著差异(P>0.05),且呈现二次曲线效应(P=0.016)。300CUR组甲烷能显著低于对照组(P < 0.05),与600CUR组和900CUR组无显著差异(P>0.05)。300CUR组和600CUR组代谢能显著高于对照组(P < 0.05),与900CUR组无显著差异(P>0.05),且呈现二次曲线效应(P=0.009)。300CUR组总能代谢率显著高于对照组和900CUR组(P < 0.05),与600CUR组无显著差异(P>0.05),且呈现二次曲线效应(P=0.01)。
|
|
表 5 饲粮中添加CUR对舍饲羔羊能量代谢的影响 Table 5 Effects of dietary CUR on energy metabolism of barn feeding lambs |
由表 6可知,各组之间血清总胆固醇、高密度脂蛋白、低密度脂蛋白、非酯化脂肪酸含量无显著差异(P>0.05)。300CUR组血清甘油三酯含量显著低于对照组(P < 0.05),与600CUR组和900CUR组无显著差异(P>0.05),且呈现二次曲线效应(P=0.022)。600CUR组一氧化氮合酶活性显著低于对照组、300CUR组和900CUR组(P < 0.05)。
|
|
表 6 饲粮中添加CUR对舍饲羔羊血清生化指标的影响 Table 6 Effects of dietary CUR on serum biochemical indices of barn feeding lambs |
CUR作为一种天然的植物多酚,具有羟基苯基和二酮结构,可以提高畜禽生长性能和畜产品品质[10]。有研究表明,植物多酚提高生长性能主要通过2个方面,一方面是通过抗氧化作用减少动物在生产中的应激,另一方面是多酚类物质可以提高蛋白质消化率[11]。CUR具有双重抗氧化特性,不仅能有效清除活性氧,还能激活抗氧化反应元件,抑制活性氧诱导的氧化应激[12]。但是高剂量的多酚类物质对动物生长性能没有显著效果[13-15],本试验结果也表明饲粮中添加600和900 mg/kg CUR对羔羊生长性能没有显著效果。Marcon等[16]在羔羊饲粮中添加0、100、200和300 mg/kg CUR,发现在饲喂30 d后添加100、200和300 mg/kg CUR组平均日增重均显著高于对照组,其中添加300 mg/kg CUR组最高。本试验发现,300CUR组达到最高的平均日增重和最低的料重比,且通过回归分析后得出饲粮中CUR适量添加量为487.5 mg/kg。一方面可能由于CUR具有极强的抗氧化特性,可以通过清除自由基来减少应激。Cao等[17]研究表明,饲粮中添加CUR可提高断奶仔猪血清超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)活性,并且降低丙二醛(MDA)含量,以此来减少肠道应激损伤;另一方面可能是由于其较高的NDF表观消化率和氮表观消化率,添加CUR可以促进羔羊对饲粮中粗纤维和CP的消化利用。此外还有研究表明,饲粮中添加200 mg/kg CUR可显著提高蛋鸡的生长性能,其作用机理可能是CUR通过刺激消化酶活性来提高平均日采食量和平均日增重[18],因此本试验下一步将通过测定羔羊瘤胃消化酶活性继续深入研究。
3.2 饲粮中添加CUR对舍饲羔羊营养物质表观消化率、氮代谢和能量代谢的影响营养物质表观消化率与动物生长性能密切相关,DM和OM表观消化率是反映动物对饲粮平均消化能力的重要指标[19],NDF和ADF表观消化率则反映动物对饲粮中粗纤维的利用程度。芦娜等[3]在断奶仔猪饲粮中分别添加0(对照组)、100、200、300和400 mg/kg CUR,研究发现添加CUR对断奶仔猪DM和OM表观消化率无显著影响,添加200和400 mg/kg CUR提高了CP表观消化率,但差异不显著。Vorlaphim等[20]在肉牛精料中添加0(对照组)、0.1%和0.2% CUR,研究发现添加CUR对肉牛DM、OM和NDF表观消化率无显著影响,但是显著降低了ADF表观消化率。本试验中,饲粮中添加CUR对DM和OM表观消化率无显著影响,与前人研究结果一致;300CUR组NDF表观消化率显著提高,与生长性能结果一致。一方面,饲粮中的NDF主要由瘤胃内纤维分解菌进行降解,饲粮中添加CUR可提高瘤胃内细菌总数[20],进而提高NDF在瘤胃中的降解率;另一方面,Xun等[21]研究表明,饲粮中添加CUR可显著增加仔猪回肠绒毛高度与隐窝深度的比值,改善回肠黏膜形态,修复大肠杆菌引起的肠道损伤。这说明添加CUR可通过对肠道的保护作用来促进营养物质消化吸收。此外,本试验中,600CUR和900CUR组NDF表观消化率与对照组无显著差异,可能是由于高剂量的多酚类物质会抑制瘤胃中的溶纤维丁酸弧菌和黄色瘤胃球菌增殖[13],从而降低CUR的作用效果。
氮代谢反映动物对饲粮中蛋白质的利用程度,瘤胃中的氮源主要来自饲粮的瘤胃降解蛋白质,而非降解蛋白质则进入小肠。瘤胃细菌、原虫和真菌均能分解饲粮蛋白质,但细菌起主导作用。此外,还有研究表明瘤胃原虫可以通过吞噬细菌获得氨基酸氮来合成自身蛋白,从而调节氮代谢[22]。瘤胃微生物由所分泌的蛋白酶、肽酶和脱氨酶对蛋白质进行降解形成氨态氮(NH3-N),一部分NH3-N被合成微生物蛋白(MCP),从而被小肠吸收利用[23]。与氮表观消化率相比,沉积氮更能准确反映饲粮中蛋白质的消化程度[24]。Vorlaphim等[20]研究表明,饲粮中添加CUR显著降低了肉牛瘤胃NH3-N含量,显著增加了瘤胃细菌总数,显著提高了沉积氮。本试验中,300CUR组氮沉积和氮表观消化率均显著高于对照组,与前人研究结果一致,这可能是由于添加CUR后诱导瘤胃细菌、原虫等瘤胃微生物增加,使瘤胃对氮的利用率提高,促进了蛋白氮的降解。600CUR组和900CUR组沉积氮和氮表观消化率与对照组无显著差异,因此高剂量的CUR可能通过影响相关酶的表达来降低MCP合成,从而降低瘤胃对氮的利用率,具体原因还有待进一步研究。
能量是畜禽活动的基础,畜禽所需的能量主要来自饲粮中的碳水化合物、蛋白质和脂肪,少部分能量以粪能、尿能和甲烷能的形式流失。而摄食量反映畜禽的能量摄入与能量消耗的动态平衡[25],因此畜禽的采食量与摄入总能密切相关。本试验中,各组之间摄入总能差异不显著,平均日采食量也没有显著差异;各组之间尿能虽然无显著差异,但是呈现先降低后升高的二次曲线效应,因此可以推断饲粮中添加CUR可以降低羔羊能量损耗。甲烷的损失主要来源于瘤胃发酵,瘤胃中产生大量甲烷会造成摄入总能的降低[26]。本试验中,300CUR组甲烷能相比对照组显著降低,造成甲烷能降低的原因可能是由于添加CUR后抑制了瘤胃产甲烷菌的丰度;300CUR组的消化能、代谢能和总能代谢率显著高于对照组,进一步验证了CUR对羔羊生长性能的促进作用。Molosse等[27]研究表明,在羔羊饲粮中添加200 mg/kg CUR可显著改变乳酸菌和ATP代谢相关酶的活性,包括肌酸激酶和蛋白激酶,从而促进细胞内大量磷酸肌酸的积累,促进能量代谢。因此,本试验中CUR可能通过调节能量代谢中的相关酶活性来发挥作用。此外,有研究表明,CUR对金黄色葡萄球菌、大肠杆菌[28]具有很强的抗性,因此添加高剂量CUR可能会影响瘤胃微生物区系,反刍动物所需能量大部分来自瘤胃发酵产生的挥发性脂肪酸(VFA),添加高剂量CUR可能会通过影响瘤胃内VFA的生成来降低CUR对能量代谢的调节效果。具体原因还有待通过瘤胃发酵进一步研究。
3.3 饲粮中添加CUR对舍饲羔羊血清生化指标的影响李辉等[29]研究发现,CUR对高脂诱导引发肝病的小鼠具有降脂保肝作用,在CUR的干预下,血清甘油三酯、总胆固醇、低密度脂蛋白含量降低,高密度脂蛋白含量升高;并且其降脂作用的机制可能是CUR通过降低载脂蛋白B(apoB)水平来抑制低密度脂蛋白含量的升高[30]。Xie等[31]研究表明,在肉鸡饲粮中添加CUR后肝脏非酯化脂肪酸含量显著升高,血浆和肝脏总胆固醇含量显著降低,血浆甘油三酯含量显著降低,研究还发现这些变化与ATP柠檬酸裂解酶(ACLY)基因的表达有关,在添加CUR后,ACLY基因的表达量降低。ACLY是脂肪酸生物合成中的一种重要酶,能将柠檬酸转化为乙酰CoA,而乙酰CoA是脂代谢中的重要组成部分。本试验中,饲粮中添加CUR降低了血清甘油三酯含量,其中300CUR组达到显著水平;饲粮中添加CUR后对血清低密度脂蛋白含量无显著影响,但是随着CUR添加量的增加,与对照组相比血清低密度脂蛋白含量分别降低了2.2%、5.7%和8.8%,且血清高密度脂蛋白含量也有增加的趋势。上述试验结果与前人研究结果基本一致。NO是畜禽在肠道中由L-精氨酸通过一氧化氮合酶合成的产物,可以抑制肠道蠕动,同时也是一种炎症因子[32]。廖美娟等[33]研究发现,CUR可以抑制诱导型一氧化氮合酶活性来减轻大鼠肠缺血再灌注损伤。本试验研究发现,羔羊饲粮中添加600 mg/kg CUR可显著降低血清一氧化氮酶活性,因此CUR可通过抑制一氧化氮的合成来促进胃肠蠕动,保护肠道,提高生长性能。
4 结论饲粮中添加CUR可提高舍饲羔羊NDF表观消化率,提高舍饲羔羊氮代谢和能量代谢水平,降低血清甘油三酯含量,从而促进生长性能。通过回归分析得出饲粮中CUR适宜添加量为487.5 mg/kg。
| [1] |
阮栋, 王一冰, 蒋守群, 等. 姜黄素的生物活性及其调节动物肠道黏膜屏障功能的分子机制[J]. 动物营养学报, 2021, 33(4): 1801-1810. RUAN D, WANG Y B, JIANG S Q, et al. Biological activity of curcumin and its molecular mechanism regulating intestinal mucosal barrier function of animals[J]. Chinese Journal of Animal Nutrition, 2021, 33(4): 1801-1810 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.04.001 |
| [2] |
PANDEY A, CHATURVEDI M, MISHRA S, et al. Reductive metabolites of curcumin and their therapeutic effects[J]. Heliyon, 2020, 6(11): e05469. DOI:10.1016/j.heliyon.2020.e05469 |
| [3] |
芦娜, 邱静芸, 应志雄, 等. 日粮添加不同水平姜黄素对断奶仔猪生产性能、消化率和血液指标的影响[J]. 家畜生态学报, 2017, 38(1): 30-35. LU N, QIU J Y, YING Z X, et al. Effects of varying levels of dietary curcumin on growth performance, digestibility and serum parameters of weaned piglets[J]. Acta Ecologae Animalis Domastici, 2017, 38(1): 30-35 (in Chinese). DOI:10.3969/j.issn.1673-1182.2017.01.006 |
| [4] |
杨灿, 张玉婷, 唐小武, 等. 姜黄素对湘黄鸡生长性能、血清生化指标和抗氧化能力的影响[J]. 动物营养学报, 2021, 33(12): 6749-6756. YANG C, ZHANG Y T, TANG X W, et al. Effects of curcumin on growth performance, serum biochemical indexes and antioxidant capacity of Xianghuang broilers[J]. Chinese Journal of Animal Nutrition, 2021, 33(12): 6749-6756 (in Chinese). |
| [5] |
张宝彤, 张波, 萧培珍, 等. 姜黄素对罗非鱼生长性能、血清生化指标及肠道组织形态的影响[J]. 中国饲料, 2014(2): 34-37. ZHANG B T, ZHANG B, XIAO P Z, et al. Effects of curcumin on growth performance, serum biochemical parameters and intestinal morphology of tilapia[J]. China Feed, 2014(2): 34-37 (in Chinese). DOI:10.3969/j.issn.1004-3314.2014.02.020 |
| [6] |
AO AC. Official methods of analysis of AOAC international[M]. 19th ed. Gaithersburg: AOAC International, 2012.
|
| [7] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [8] |
刘笑梅, 郝小燕, 崔乔, 等. 饲粮中添加胍基乙酸对羔羊生长性能和营养物质消化代谢的影响[J]. 动物营养学报, 2021, 33(12): 6910-6918. LIU X M, HAO X Y, CUI Q, et al. Effects of dietary guanidineacetic acid on growth performance and nutrient digestion and metabolism of lambs[J]. Chinese Journal of Animal Nutrition, 2021, 33(12): 6910-6918 (in Chinese). |
| [9] |
赵一广, 刁其玉, 刘洁, 等. 肉羊甲烷排放测定与模型估测[J]. 中国农业科学, 2012, 45(13): 2718-2727. ZHAO Y G, DIAO Q Y, LIU J, et al. Estimation and regression models of methane emissions from sheep[J]. Scientia Agricultura Sinica, 2012, 45(13): 2718-2727 (in Chinese). |
| [10] |
袁欢, 曹敞, 黄若澜, 等. 姜黄素防治畜禽代谢性疾病的研究进展[J/OL]. 中国畜牧杂志: 1-9[2022-01-22]. https://kns.cnki.net/kcms/detail/detail.aspx?FileName=ZGXM20210928002&DbName=CAPJ2021. DOI: 10.19556/j.0258-7033.20210424-02. YUAN H, CAO C, HUANG R L, et al. Research progress of curcumin in the prevention and treatment of metabolic diseases of livestock and poultry[J]. Chinese Journal of Animal Science: 1-9[2022-01-22]. https://kns.cnki.net/kcms/detail/detail.aspx?FileName=ZGXM20210928002&DbName=CAPJ2021. DOI: 10.19556/j.0258-7033.20210424-02.(inChinese) |
| [11] |
张佳, 王园, 安晓萍, 等. 植物多酚的生物活性及在反刍动物生产中的应用[J]. 饲料工业, 2022, 43(1): 18-23. ZHANG J, WANG Y, AN X P, et al. Bioactivity in ruminant of plant polyphenol and its application in ruminant[J]. Feed Industry, 2022, 43(1): 18-23 (in Chinese). |
| [12] |
SURH Y J, KUNDU J K, NA H K. Nrf2 as a master redox switch in turning on the cellular signaling involved in the induction of cytoprotective genes by some chemopreventive phytochemicals[J]. Planta Medica, 2008, 74(13): 1526-1539. DOI:10.1055/s-0028-1088302 |
| [13] |
杨文军, 牟春堂, 刘笑梅, 等. 饲粮中添加葡萄籽原花青素对羔羊生长性能和营养物质消化代谢的影响[J]. 动物营养学报, 2021, 33(6): 3410-3420. YANG W J, MU C T, LIU X M, et al. Effects of dietary supplementation of grape seed proanthocyanidins on growth performance and nutrient digestion and metabolism of lambs[J]. Chinese Journal of Animal Nutrition, 2021, 33(6): 3410-3420 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.06.042 |
| [14] |
剧浩, 郝小燕, 刘森, 等. 饲粮中添加枸杞多糖对羔羊生长性能、屠宰性能和肉品质的影响[J]. 动物营养学报, 2022, 34(3): 1777-1788. JU H, HAO X Y, LIU S, et al. Effects of dietary supplementation of Lycium barbarum polysaccharide on growth performance, slaughter performance and meat quality of lambs[J]. Chinese Journal of Animal Nutrition, 2022, 34(3): 1777-1788 (in Chinese). DOI:10.3969/j.issn.1006-267x.2022.03.038 |
| [15] |
唐青松, 肖明飞, 易宏波, 等. 饲粮添加缩合单宁对肉鸡生长性能、肉品质、免疫功能、抗氧化功能及肠道形态的影响[J]. 动物营养学报, 2021, 33(6): 3228-3236. TANG Q S, XIAO M F, YI H B, et al. Effects of dietary condensed tannins on growth performance, meat quality, immune function, antioxidant function and intestinal morphology of broilers[J]. Chinese Journal of Animal Nutrition, 2021, 33(6): 3228-3236 (in Chinese). DOI:10.3969/j.issn.1006-267x.2021.06.025 |
| [16] |
MARCON H, SOUZA C F, BALDISSERA M D, et al. Effect of curcumin dietary supplementation on growth performance, physiology, carcass characteristics and meat quality in lambs[J]. Annals of Animal Science, 2021, 21(2): 623-638. DOI:10.2478/aoas-2020-0100 |
| [17] |
CAO S T, WANG C C, YAN J T, et al. Curcumin ameliorates oxidative stress-induced intestinal barrier injury and mitochondrial damage by promoting Parkin dependent mitophagy through AMPK-TFEB signal pathway[J]. Free Radical Biology & Medicine, 2020, 147: 8-22. |
| [18] |
刘远, 吴贤锋, 占今舜, 等. 饲粮中添加过瘤胃赖氨酸对福清山羊生长性能、养分表观消化率和氮代谢的影响[J]. 动物营养学报, 2022, 34(1): 432-441. LIU Y, WU X F, ZHAN J S, et al. Effects of dietary rumen-protected lysine on growth performance, nutrient apparent digestibilities and nitrogen metabolism of Fuqing goats[J]. Chinese Journal of Animal Nutrition, 2022, 34(1): 432-441 (in Chinese). DOI:10.3969/j.issn.1006-267x.2022.01.041 |
| [19] |
杨泰. 姜黄素对蛋鸡蛋品质、抗氧化与免疫功能及肠道形态的影响[D]. 硕士学位论文. 长沙: 湖南农业大学, 2018. YANG T. Effect of curcumin on egg quality, antioxidant, immune function and intestinal morphology of layer hens[D]. Master's Thesis. Changsha: Hunan Agricultural University, 2018. (in Chinese) |
| [20] |
VORLAPHIM T, PHONVISAY M, KHOTSAKDEE J, et al. Influence of dietary curcumin on rumen fermentation, macronutrient digestion and nitrogen balance in beef cattle[J]. American Journal of Agricultural and Biological Sciences, 2011, 6(1): 7-11. DOI:10.3844/ajabssp.2011.7.11 |
| [21] |
XUN W J, SHI L G, ZHOU H L, et al. Effects of curcumin on growth performance, jejunal mucosal membrane integrity, morphology and immune status in weaned piglets challenged with enterotoxigenic Escherichia coli[J]. International Immunopharmacology, 2015, 27(1): 46-52. DOI:10.1016/j.intimp.2015.04.038 |
| [22] |
钟荣珍, 谭支良. 反刍动物瘤胃内微生物氮代谢动力学的研究进展[J]. 华北农学报, 2009, 24(S1): 208-213. ZHONG R Z, TAN Z L. Review on intraruminal recycling kinetics of microbial nitrogen in ruminant[J]. Acta Agriculturae Boreali-Sinica, 2009, 24(S1): 208-213 (in Chinese). DOI:10.7668/hbnxb.2009.S1.049 |
| [23] |
崔乔, 郝小燕, 张宏祥, 等. 饲粮中添加肉桂醛对羔羊生长性能、消化代谢以及微生物蛋白合成的影响[J]. 动物营养学报, 2021, 33(6): 3421-3430. CUI Q, HAO X Y, ZHANG H X, et al. Effects of dietary cinnamaldehyde on growth performance, digestion and metabolism, and microbial protein synthesis of lambs[J]. Chinese Journal of Animal Nutrition, 2021, 33(6): 3421-3430 (in Chinese). |
| [24] |
许贵善, 刁其玉, 纪守坤, 等. 不同饲喂水平对肉用绵羊能量与蛋白质消化代谢的影响[J]. 中国畜牧杂志, 2012, 48(17): 40-44. XU G S, DIAO Q Y, JI S K, et al. Effects of different feeding levels on energy and protein digestion and metabolism of meat sheep[J]. Chinese Journal of Animal Science, 2012, 48(17): 40-44 (in Chinese). DOI:10.3969/j.issn.0258-7033.2012.17.011 |
| [25] |
宋阳, 沈维军, 殷磊, 等. 反刍动物瘤胃运动机制、影响因素及其调控[J]. 动物营养学报, 2020, 32(7): 2997-3004. SONG Y, SHEN W J, YIN L, et al. Rumen movement mechanism, influencing factors and its regulation in ruminants[J]. Chinese Journal of Animal Nutrition, 2020, 32(7): 2997-3004 (in Chinese). |
| [26] |
郑玮才, 郝小燕, 张宏祥, 等. 酿酒酵母和地衣芽孢杆菌对绵羊生长性能和营养物质消化代谢的影响[J]. 动物营养学报, 2020, 32(11): 5314-5321. ZHENG W C, HAO X Y, ZHANG H X, et al. Effects of Saccharomyces cerevisiae and Bacillus licheniformis on growth performance and nutrient digestion and metabolism in sheep[J]. Chinese Journal of Animal Nutrition, 2020, 32(11): 5314-5321 (in Chinese). |
| [27] |
MOLOSSE V, SOUZA C F, BALDISSERA M D, et al. Diet supplemented with curcumin for nursing lambs improves animal growth, energetic metabolism, and performance of the antioxidant and immune systems[J]. Small Ruminant Research, 2019, 170: 74-81. DOI:10.1016/j.smallrumres.2018.11.014 |
| [28] |
FADHLURRAHMA A, SAEPUDIN E, RAHAYU D U C. Acetylation of curcuminoids extract from Turmeric Rhizomes (Curcuma longa) as antibacterial compounds against S. aureus and E. coli[J]. IOP Conference Series: Materials Science and Engineering, 2020, 902: 012065. DOI:10.1088/1757-899X/902/1/012065 |
| [29] |
李辉, 刘志虎, 李华, 等. 姜黄素脂质体对高脂诱导的非酒精性脂肪性肝病小鼠的降脂保肝作用[J]. 中国医药, 2020, 15(7): 1053-1057. LI H, LIU Z H, LI H, et al. Effect of curcumin liposomes on lipid-lowering and hepatoprotective effects of hyperlipidemia-induced nonalcoholic fatty liver disease mice[J]. China Medicine, 2020, 15(7): 1053-1057 (in Chinese). |
| [30] |
王舒然, 陈炳卿, 王朝旭, 等. 姜黄素降血脂及抗氧化作用的研究[J]. 中国公共卫生学报, 1999(5): 263-265. WANG S R, CHEN B Q, WANG C X, et al. Studies of curcumin for lowering blood fat and antioxidation[J]. Chinese Journal of Public Health, 1999(5): 263-265 (in Chinese). |
| [31] |
XIE Z L, SHEN G Z, WANG Y, et al. Curcumin supplementation regulates lipid metabolism in broiler chickens[J]. Poultry Science, 2019, 98(1): 422-429. DOI:10.3382/ps/pey315 |
| [32] |
NISHINO H, TOKUDA H, SATOMI Y, et al. Cancer prevention by antioxidants[J]. BioFactors, 2004, 22(1/4): 57-61. |
| [33] |
廖美娟, 梁桦, 梁幸甜, 等. 姜黄素抑制诱导型一氧化氮合酶活性减轻大鼠肠缺血再灌注损伤[J]. 实用医学杂志, 2015, 31(20): 3302-3303. LIAO M J, LIANG H, LIANG X T, et al. Curcumin inhibits inducible nitric oxide synthase activity and alleviates intestinal ischemia-reperfusion injury in rats[J]. The Journal of Practical Medicine, 2015, 31(20): 3302-3303 (in Chinese). DOI:10.3969/j.issn.1006-5725.2015.20.005 |




