福建白兔是中国地方肉兔品种,于2015年列入《福建省畜禽遗传资源保护名录》和《中国畜禽遗传资源志》[1],与大型肉兔相比,其肌肉营养成分高,肉质鲜嫩[2],市场潜力不断增大,但存在着肉兔养殖过程中共性问题,即断奶后幼兔腹泻率高、成活率较低,严重影响了肉兔产业的发展[3-6]。
幼龄动物的限饲对于提高饲料转化率和消化系统紊乱的抗性以及降低胴体脂肪和肉品生产成本具有重要意义[5]。对猪[7]、肉鸡[8]、兔[9]等动物限饲的研究结果表明,动物可以通过提高饲料转化率来补偿限饲引起的生长抑制。Boisot等[10]研究表明,限饲不仅可以提高抗特异性疾病如兔流行性肠病的发生,降低消化道疾病,还能提高饲料转化率。Gidenne等[11-12]研究发现,限饲可以降低幼兔发病率和死亡率,改善幼兔消化道发育,但建议饲喂量控制在自由采食量的80%及以下,才可以降低断奶后幼兔的死亡率;饲喂量控制在自由采食量的70%及以下,才可以降低断奶后幼兔的发病率。Crespo等[13]和Birolo等[3, 14]研究发现,限时限饲显著提高了家兔的饲料转化率,对家兔健康有促进作用。
限制采食量是最常用的方法,其次是限制采食时间。目前生产上家兔没有统一的限饲执行方案,限制采食量和限制采食时间对我国地方肉兔的影响未见报道。因此,本试验旨在研究不同限饲方式对福建白兔生长性能、屠宰性能、肉品质、血清免疫和脂类指标、肠道形态及盲肠菌群的影响,筛选适宜的限饲方式,为制定福建白兔以及肉兔健康限饲标准提供理论参考。
1 材料与方法 1.1 试验设计及饲养管理选用健康、体重相近、食欲正常的4周龄福建白兔300只,采用完全随机分组设计,随机分为5组,每组3个重复,每个重复20只(公母各占1/2)。A组(对照组)自由采食;限饲组(B、C、D、E组)每天饲喂量均为A组前1天平均日采食量的80%,B和C组为每天饲喂1次,B组为08:00饲喂,C组为16:00饲喂;D和E组为每天饲喂2次,D组为08:00和16:00各饲喂50%,E组为08:00饲喂30%和16:00饲喂70%。记录每天每个重复的喂料量,第2天喂料前,称量每个重复前1天剩料量。预试期1周,正试期8周。
饲养试验在本单位工程化兔场进行,试验兔采用全价颗粒料饲喂,参考NRC(1977)家兔营养标准和De Blas[15]的肉兔营养需求,基础饲粮组成及营养水平见表 1。试验兔自由饮水,饲养管理与免疫程序按常规进行。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验开始和结束前1天20:00之后禁食不禁水,第2天08:00对所有试验兔进行空腹称重,获得初始体重和终末体重。试验期间观察试验兔腹泻和死亡情况,统计腹泻率和死亡率。每日记录每只试验兔采食情况,包括每日喂料量、剩料量及浪费料量,计算平均日增重(average daily gain,ADG)、平均日采食量(average daily feed intake,ADFI)及料重比(feed/gain,F/G)。相关指标计算公式如下:

|
试验结束时,选择自由采食的A组和生长性能较好的C和D组,每组选取体重相近的18只(公母各占1/2)福建白兔,进行后续指标测定。参照刘浪等[16]的方法进行屠宰测定,称宰前活重、全净膛重、半净膛重和腹脂重,并分别计算全净膛屠宰率、半净膛屠宰率及腹脂率。全净膛重为屠宰后除去血液、毛皮、头尾、四肢(腕关节和跗关节以下)和内脏的胴体重;半净膛重为全净膛重加上心脏、肝脏、肾脏和腹脂的胴体重。相关指标计算公式如下:

|
试验结束当天清晨空腹屠宰后进行肉品质测定,参照刘浪等[16]测定方法。
肉色:屠宰后1 h将NR20XE色差仪直接插到剪开的肉样(左背最长肌和左后股二头肌)中,测定亮度(L*)、红度(a*)和黄度(b*)值,重复3次,取平均值。
pH:屠宰后1和24 h用Testo205便携式酸度计直接测定肌肉(左背最长肌和左后股二头肌)pH,重复3次,取平均值。
滴水损失:屠宰后1~2 h取第4~7腰椎处左背最长肌,剥去外膜和脂肪,修成正方体,约20 g,称重,在4 ℃冰箱中吊挂24 h贮存,用滤纸吸干肉样表面水分再称重。计算公式如下:

|
熟肉率:屠宰后1~2 h取右后股二头肌,并剥去其外膜和附着的脂肪,称重后置于蒸屉锅上用沸水蒸煮30 min,取出,晾干,30 min后称重。计算公式如下:

|
粗脂肪含量:取第4~7腰椎处右背最长肌,剥除筋膜,测定粗脂肪含量,检测方法参照GB 5009.6—2016进行。
1.2.4 血清免疫和脂类指标试验结束当天清晨,空腹采集试验兔前腔静脉血2 mL,静置30 min,3 500 r/min离心15 min,分离血清。采用南京建成生物工程研究所的酶联免疫吸附测定(ELISA)试剂盒,测定血清免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)和补体3(C3)、补体4(C4)含量。血清脂类指标通过BECKMAN AU2700大型全自动生化分析仪进行测定。
1.2.5 肠道形态及盲肠菌群试验结束当天清晨空腹屠宰后,剪取十二指肠、回肠和空肠的各自中断部位的肠管1 cm,用生理盐水冲洗肠道内容物至干净,并放入福尔马林固定液中。石蜡包埋,苏木精-伊红(HE)染色,应用Image-Pro Plus 6.0软件,每张切片选取5根完整的绒毛,分别5次测量绒毛高度、隐窝深度,并求其平均值。
选择A、C和D组试验兔,每组6只,试验结束当天清晨空腹屠宰后,每只试验兔无菌取盲肠食糜置于5 mL冻存管,并迅速放入液氮,备用。使用DNA试剂盒(Omega Bio-Tek公司,美国)进行盲肠微生物群落总DNA抽提,检测DNA提取质量,测定DNA浓度和纯度;测序引物用338F/806R,引物序列为338F:5'-ACTCCTACGGGAGGCAGCAG-3';806R:5'-GGACTACHVGGGTWTCTAAT-3'。对16S rRNA基因V3~V4可变区进行PCR扩增。利用上海美吉生物医药科技有限公司的Illumina MiSeq PE300平台进行测序[17]。
1.3 数据统计分析采用Excel 2010和SPSS 20.0统计软件对数据进行处理分析,采用单因素方差分析(one-way ANOVA)及Tukey多重比较方法检验组间差异显著性,P > 0.05为差异不显著,P < 0.05为差异显著,P < 0.01为差异极显著,数据以平均值±标准差表示。
2 结果 2.1 限饲对福建白兔生长性能、屠宰性能和肉品质的影响由表 2可知,B、C、D、E组终末体重、平均日增重、平均日采食量和料重比均极显著低于A组(P < 0.01),且在各限饲组中D组的终末体重和平均日增重最高,料重比最低。A组腹泻率和死亡率均为6.67%,B组腹泻率和死亡率分别为5.00%和3.33%,C组腹泻率和死亡率均为1.67%,D、E组在整个试验期均无腹泻和死亡兔出现。A组腹泻率显著或极显著高于C、D、E组(P < 0.05或P < 0.01),死亡率显著高于D、E组(P < 0.05)。
|
|
表 2 限饲对福建白兔生长性能的影响 Table 2 Effects of feed restriction on growth performance of Fujian white rabbits |
对于每天饲喂1次的B组和C组,B组和C组终末体重、平均日增重差异不显著(P>0.05);但C组料重比显著低于B组(P < 0.05),腹泻率和死亡率低于B组(P>0.05)。对于每天饲喂2次的D组和E组,D组和E组终末体重、平均日增重差异不显著(P>0.05);但D组平均日增重高于E组(P>0.05),料重比低于E组(P>0.05)。因此,后续试验选择自由采食的A组及生长性能较好的每天饲喂1次的C组和每天饲喂2次的D组进行屠宰性能、肉品质、血清免疫和脂类指标、肠道形态及盲肠菌群测定。
由表 3可知,C、D组宰前活重、全净膛重、半净膛重、腹脂重和腹脂率均极显著低于A组(P < 0.01)。3组之间全净膛屠宰率、半净膛屠宰率差异不显著(P>0.05)。
|
|
表 3 限饲对福建白兔屠宰性能的影响 Table 3 Effects of feed restriction on slaughter performance of Fujian white rabbits |
由表 4可知,3组之间肌肉肉色、pH、熟肉率、滴水损失、肌纤维密度和肌纤维面积差异不显著(P>0.05)。A组背最长肌粗脂肪含量极显著高于C、D组(P < 0.01),C组和D组之间差异不显著(P>0.05)。
|
|
表 4 限饲对福建白兔肌肉品质的影响 Table 4 Effects of feed restriction on meat quality of Fujian white rabbits |
由表 5可知,C、D组血清IgM、IgA含量显著或极显著高于A组(P < 0.05或P < 0.01);血清总胆固醇(TC)、甘油三酯(TG)和低密度脂蛋白(LDL)含量极显著低于A组(P < 0.01)。3组之间血清IgG、C3、C4、总蛋白(TP)、白蛋白(ALB)和高密度脂蛋白(HDL)含量差异不显著(P>0.05)。
|
|
表 5 限饲对福建白兔血清免疫和脂类指标的影响 Table 5 Effects of feed restriction on serum immune and lipid indexes of Fujian white rabbits |
由表 6可知,D组十二指肠和空肠的绒毛长度显著大于A组(P < 0.05),D组十二指肠的绒毛长度显著大于C组(P < 0.05)。3组之间回肠的绒毛长度及十二指肠和空肠的隐窝深度差异不显著(P>0.05)。A、C、D组肠道组织切片形态见图 1。
|
|
表 6 限饲对福建白兔肠道绒毛长度和隐窝深度的影响 Table 6 Effects of feed restriction on intestinal villus length and crypt depth of Fujian white rabbits |

|
图 1 福建白兔肠道组织切片形态 Fig. 1 Morphology of intestinal tissue sections of Fujian white rabbits (100×) |
对A、C、D组福建白兔肠道内容物进行测序,共获得有效序列数为964 945条,每条序列平均长度为407.84 bp。由表 7可知,A组的Shannon指数显著高于D组(P < 0.05),Simpson指数显著低于D组(P < 0.05)。3组之间Sobs指数、覆盖率、ACE指数、Chaol指数差异不显著(P>0.05)。
|
|
表 7 限饲对福建白兔盲肠菌群Alpha多样性的影响 Table 7 Effects of feed restriction on cecal microflora Alpha diversity of Fujian white rabbits |
由图 2可见,在门水平上,A、C、D组盲肠菌群相对丰度差异不明显,厚壁菌门(Firmicute)在所有样本中相对丰度最高,A组厚壁菌门相对丰度低于C、D组;其次是拟杆菌门(Bacteroidetes),A、D组拟杆菌门相对丰度较高,C组较低。
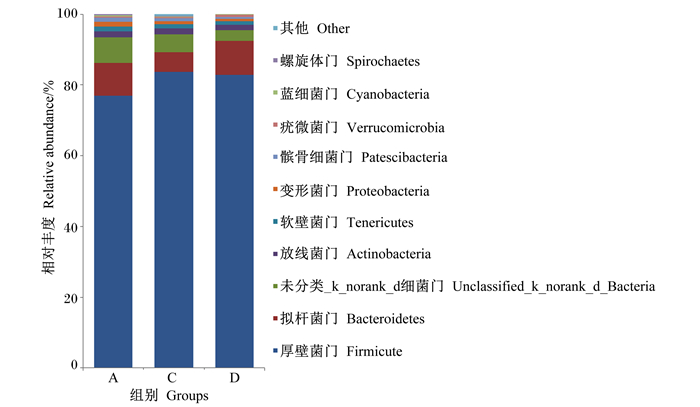
|
图 2 福建白兔盲肠菌群在门水平上的组成 Fig. 2 Composition of cecal microflora of Fujian white rabbits at phylum level |
由图 3可见,在科水平上,瘤胃球菌科(Ruminococcaceae)在所有样本中相对丰度最高,D组瘤胃球菌科相对丰度高于A、C组;其次是毛螺菌科(Lachnospiraceae),D组毛螺菌科相对丰度低于A、C组。
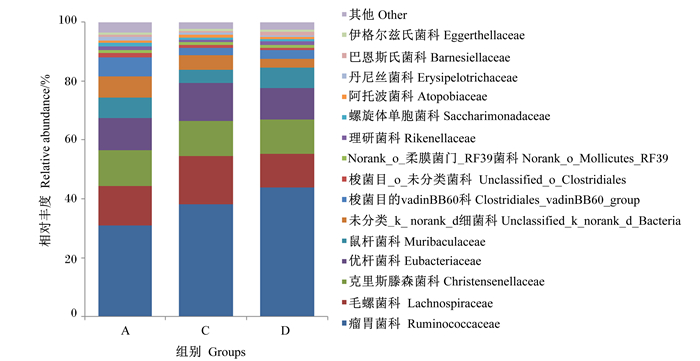
|
图 3 福建白兔盲肠菌群在科水平上的组成 Fig. 3 Composition of cecal microflora of Fujian white rabbits at family level |
由表 8可见,在属水平上,D组瘤胃球菌科_NK4A214_群(Ruminococcaceae_NK4A214_group)相对丰度显著高于A、C组(P < 0.05),D组Marvinbryantia相对丰度显著低于A、C组(P < 0.05),C组罕见小球菌属(Subdoligranulum)相对丰度显著高于A、D组(P < 0.05)。
|
|
表 8 限饲对福建白兔盲肠菌群属水平相对丰度的影响 Table 8 Effects of feed restriction on cecal microflora relative abundance of Fujian white rabbits at genus level |
肉兔的限饲,无论是限制采食量还是限制采食时间,与改善生长兔的健康状况、消化和饲料转化率有关[9]。Romero等[18]研究结果显示,饲粮控制在自由采食量的95%不影响生长兔的生长性能和屠宰性能,控制在自由采食量的85%不影响生长速度且饲料转化率不变。大量的研究表明,断奶后限制采食量可以降低动物发病率和死亡率[11, 19-20]。Gidenne等[11]研究发现,采食量控制在最多自由采食的80%才可以降低家兔断奶后腹泻率和死亡率,同时对生长性能和屠宰性能影响不大。然而,限饲对肠道健康的保护作用在恢复自由采食后就消失[6],从限饲突然恢复自由采食,通常会出现采食量高峰[19],进而出现消化道疾病高峰。采取限饲到自由采食逐步过渡的方法[14],可以防止在恢复自由采食后出现过度摄食和浪费饲粮,但是操作起来较繁琐。
本试验从福建白兔4周龄断奶到13周龄上市,均采用长期的八分饱限饲方法,即80%的限饲,并根据福建白兔生产实际,分为每天1次(08:00或16:00)和2次饲喂(50%、50%;30%、70%)。B组腹泻率和死亡率较高,可能原因是B组08:00饲喂1次,试验兔一次性采食过度而造成的腹泻。A组平均日采食量和料重比均极显著高于B、C、D、E组,说明按自由采食量的80%限饲能提高饲料报酬,且D组料重比最低,效果最好。选择每天饲喂1次效果较好的C组和每天饲喂2次效果较好的D组进行后期的屠宰性能、肉品质和盲肠微生物菌群等测定。
屠宰性能的高低与饲粮营养水平、饲养方式和饲养管理水平等相关,其中全净膛重、半净膛重、腹脂重、全净膛屠宰率、半净膛屠宰率和腹脂率是衡量肉兔屠宰性能的重要指标。本试验对A、C、D组屠宰性能测定结果表明,C、D组宰前活重、全净膛屠宰重、半净膛屠宰重、腹脂重和腹脂率均极显著低于A组,全净膛屠宰率、半净膛屠宰率与A组差异不显著,说明不同时间的限饲80%对屠宰性能影响不大,这与Birolo等[3]研究发现限饲时间对屠宰性能影响不大的结果一致。而Knudsen等[19]对生长兔按自由采食量的75%进行饲喂4周后,发现屠宰率显著降低。杨苏亮等[21]对爱拔益加(AA)肉鸡8~21日龄进行85%的饲喂量限饲,结果显示限饲降低了全净膛率、半净膛率和腹脂率。Tuůmová等[5]研究也显示限饲显著降低了肾周围脂肪百分比。
肉品质包括肉品感官特性(外观色泽、质地等物理性状)、营养特性(氨基酸、脂肪酸等化学成分)等,肉品质常用的性状指标主要是肉色、pH、蒸煮损失等[22]。限饲对肉品质的影响,除了对肌肉粗脂肪含量有显著影响外,对其他指标影响不显著,这验证了前人研究限饲对兔肉品质无显著影响的结果[14, 20, 23]。研究表明,决定肉品质的一个关键因素是肌纤维类型[24],通过限制饲粮采食量不能改变肌纤维类型,所以不会改变其肉品质,如肉色、pH、熟肉率、蒸煮损失等,但可以调节肌肉脂肪沉积[25]。
3.2 限饲对福建白兔血清免疫和脂类指标的影响血清免疫指标主要包括IgA、IgM和IgG,反映了动物机体的免疫水平,间接反映了机体抵抗病原微生物的能力,其中,IgG是体液免疫中主要抗体来源,占血清免疫球蛋白总量的75%~80%[26]。C3是血清中含量最高的补体成分,在补体经典和旁路激活途径中均发挥重要作用;C4是β-球蛋白,在补体活化、中和病毒和促进吞噬等起重要作用。限饲可以提高动物的免疫功能,减少发病率,改善机体的脂质代谢,促进机体健康[27]。本试验中,限饲可以提高福建白兔的免疫力和降低血脂水平,C、D组血清IgM和IgA含量显著或极显著高于A组,同时D组极显著高于C组,说明D组肉兔具有较好的免疫力。
3.3 限饲对福建白兔肠道形态及盲肠菌群的影响肠道是人类和动物的重要防御屏障[28],小肠是消化吸收的部位,其黏膜形态的完整性反映了机体对食物消化吸收的情况。反映小肠黏膜形态完整性最直接的指标是小肠绒毛长度和隐窝深度。小肠绒毛长度越长,吸收面积就越大,对营养物质的吸收利用增强。肠道隐窝深度是指绒毛根部上皮陷入固有层形成的管状腺深度,其反映上皮细胞的成熟率[29],隐窝越深,消化吸收功能就越低。本试验中,D组十二指肠和空肠的绒毛长度显著大于A组,说明限饲并且分2次饲喂有利于提高饲粮营养的吸收利用。
在家兔死亡中,75%是由于腹泻而造成的,而肠道菌群失调是兔腹泻的主要原因[30]。肠道菌群的健康可以促进机体营养代谢、生长发育和提高免疫力,同时肠道菌群与宿主之间还建立了一种共生关系[31]。断奶后限饲的家兔具有更好地抵抗消化问题,原因可能是限饲兔盲肠微生物群具有更丰富的生物多样性和活性[32]。本试验通过对盲肠内容物进行16S rRNA的高通量测序,多样性分析得出D组的群落多样性Shannon指数显著低于A组,Simpson指数显著高于A组。盲肠菌群结构分析得出,门水平上以厚壁菌门、拟杆菌门为主,这与Fang等[31]、Zhu等[33]研究结果相似,两者总和占86.23%以上,肠道内厚壁菌门相对丰度高,能更有效吸收食物中的热量而导致肥胖;拟杆菌门在圈养动物肠道消化方面发挥着重要作用,包括碳水化合物的发酵、含氮物质的利用和固醇类物质的转化等。科水平上以瘤胃球菌科、毛螺菌科、克里斯滕森菌科、优杆菌科、鼠杆菌科为优势菌群。属水平上,C、D组的瘤胃球菌科_NK4A214_组相对丰度显著高于A组,Marvinbryantia相对丰度显著低于A组。瘤胃球菌属对植物细胞壁多糖的变化比较敏感,能发酵不易消化的多糖和胶质产生短链脂肪酸,调节宿主的能量代谢使宿主免于炎症反应,抑制脂肪组织发育。这解释了本试验C、D组瘤胃球菌属较丰富,有利于消化吸收,降低了腹泻率、腹脂率和肌肉粗脂肪含量,提高了饲料转化率,促进了幼兔的生长发育。
4 结论① 福建白兔按自由采食量的80%进行限饲,可降低料重比、腹脂率,减少肌肉脂肪沉积,降低血清脂类含量,提高机体免疫力,改善肠道形态和肠道菌群,促进机体健康。
② 按自由采食的80%限饲,每天饲喂2次(08:00饲喂50%和16:00饲喂50%)对提高福建白兔的生长性能等综合效果最佳。
| [1] |
陈冬金, 陈岩锋, 谢喜平, 等. 福建白兔血液生理生化指标的测定[J]. 江西农业大学学报, 2013, 35(4): 826-830. CHEN D J, CHEN Y F, XIE X P, et al. Determination of blood physiological and biochemical parameters in Fujian white rabbits[J]. Acta Agriculturae Universitatis Jiangxiensis, 2013, 35(4): 826-830 (in Chinese). DOI:10.3969/j.issn.1000-2286.2013.04.028 |
| [2] |
陈岩锋, 陈冬金, 孙世坤, 等. 福建白兔肌肉营养成分分析与评价[J]. 家畜生态学报, 2013, 34(5): 75-79. CHEN Y F, CHEN D J, SUN S K, et al. Analysis and evaluation of nutritional components of Fujian white rabbit muscle[J]. Acta Ecologae Animalis Domastici, 2013, 34(5): 75-79 (in Chinese). DOI:10.3969/j.issn.1673-1182.2013.05.016 |
| [3] |
BIROLO M, TROCINO A, ZUFFELLATO A, et al. Effects of time-based feed restriction on morbidity, mortality, performance and meat quality of growing rabbits housed in collective systems[J]. Animal, 2020, 14(3): 626-635. DOI:10.1017/S1751731119002283 |
| [4] |
TŮMOVÁ E, VOLEK Z, CHODOVÁ D, et al. The effect of 1-week feed restriction on performance, digestibility of nutrients and digestive system development in the growing rabbit[J]. Animal, 2016, 10(1): 1-9. DOI:10.1017/S1751731115001810 |
| [5] |
TŮMOVÁ E, VOLEK Z, CHODOVÁ D, et al. Effect of quantitative feed restriction on the performance, organ development and cecal activity of growing nutrias (Myocastor coypus)[J]. Animal Feed Science and Technology, 2021, 280: 115077. DOI:10.1016/j.anifeedsci.2021.115077 |
| [6] |
ALABISO M, DI GRIGOLI A, MAZZA F, et al. A 3-week feed restriction after weaning as an alternative to a medicated diet: effects on growth, health, carcass and meat traits of rabbits of two genotypes[J]. Animal, 2017, 11(9): 1608-1616. DOI:10.1017/S175173111600269X |
| [7] |
LE FLOC' H N, KNUDSEN C, GIDENNE T, et al. Impact of feed restriction on health, digestion and faecal microbiota of growing pigs housed in good or poor hygiene conditions[J]. Animal, 2014, 8(10): 1632-1642. DOI:10.1017/S1751731114001608 |
| [8] |
VAN DER KLEIN S A S, SILVA F A, KWAKKEL R P, et al. The effect of quantitative feed restriction on allometric growth in broilers[J]. Poultry Science, 2017, 96(1): 118-126. DOI:10.3382/ps/pew187 |
| [9] |
BIROLO M, TROCINO A, TAZZOLI M, et al. Effect of feed restriction and feeding plans on performance, slaughter traits and body composition of growing rabbits[J]. World Rabbit Science, 2017, 25(2): 113-122. DOI:10.4995/wrs.2017.6748 |
| [10] |
BOISOT P, LICOIS D, GIDENNE T. Feed restriction reduces the sanitary impact of an experimental reproduction of epizootic rabbit enteropathy syndrome(ERE), in the growing rabbit[C]//Proceedings of 10ème Journées de Recherches Cunicoles Françaises. Paris: ITAVI Publishing, 2003: 267-270.
|
| [11] |
GIDENNE T, FEUGIER A. Feed restriction strategy in the growing rabbit.1.Impact on digestion, rate of passage and microbial activity[J]. Animal, 2009, 3(4): 501-508. DOI:10.1017/S1751731108003789 |
| [12] |
GIDENNE T, COMBES S, FEUGIER A, et al. Feed restriction strategy in the growing rabbit.2.Impact on digestive health, growth and carcass characteristics[J]. Animal, 2009, 3(4): 509-515. DOI:10.1017/S1751731108003790 |
| [13] |
CRESPO R, ALFONSO C, DEL BARRIO A S, et al. Effect of feed restriction on performance, carcass yield and nitrogen and energy balance in growing rabbits[J]. Livestock Science, 2020, 241: 104278. DOI:10.1016/j.livsci.2020.104278 |
| [14] |
BIROLO M, TROCINO A, ZUFFELLATO A, et al. Time-based feed restriction and group composition in growing rabbits: effects on feed intake pattern, growth performance, carcass traits and meat quality[J]. Livestock Science, 2020, 239: 104086. DOI:10.1016/j.livsci.2020.104086 |
| [15] |
DE BLAS J C. Nutritional impact on health and performance in intensively reared rabbits[J]. Animal, 2013, 7(Suppl.1): 102-111. |
| [16] |
刘浪, 熊国远, 朱秀柏. 家兔的胴体性状和肉品质测定方法[J]. 中国养兔杂志, 2009(3): 11-14. LIU L, XIONG G Y, ZHU X B. Measurement methods on carcass trait and meat quality of rabbit[J]. Chinese Journal of Rabbit Farming, 2009(3): 11-14 (in Chinese). |
| [17] |
ZHENG P, WU J, ZHANG H P, et al. The gut microbiome modulates gut-brain axis glycerophospholipid metabolism in a region-specific manner in a nonhuman primate model of depression[J]. Molecular Psychiatry, 2021, 26(6): 2380-2392. DOI:10.1038/s41380-020-0744-2 |
| [18] |
ROMERO C, CUESTA S, ASTILLERO J R, et al. Effect of early feed restriction on performance and health status in growing rabbits slaughtered at 2 kg live-weight[J]. World Rabbit Science, 2010, 18(4): 211-218. |
| [19] |
KNUDSEN C, COMBES S, BRIENS C, et al. Substituting starch with digestible fiber does not impact on health status or growth in restricted fed rabbits[J]. Animal Feed Science and Technology, 2017, 226: 152-161. DOI:10.1016/j.anifeedsci.2017.01.002 |
| [20] |
BIROLO M, TROCINO A, ZUFFELLATO A, et al. Effect of feed restriction programs and slaughter age on digestive efficiency, growth performance and body composition of growing rabbits[J]. Animal Feed Science and Technology, 2016, 222: 194-203. DOI:10.1016/j.anifeedsci.2016.10.014 |
| [21] |
杨苏亮, 李敏, 夏梦芳, 等. 不同限饲方法对爱拔益加肉鸡生长性能、屠宰性能及骨骼性状的影响[J]. 动物营养学报, 2017, 29(9): 3341-3351. YANG S L, LI M, XIA M F, et al. Effects of different feed restriction methods on growth performance, slaughter performance and skeletal traits of arbor acres chickens[J]. Chinese Journal of Animal Nutrition, 2017, 29(9): 3341-3351 (in Chinese). DOI:10.3969/j.issn.1006-267x.2017.09.039 |
| [22] |
王彬, 王庆争, 郭志强, 等. 茶叶渣替代麸皮对肉兔生长性能、屠宰性能和肉品质的影响[J]. 动物营养学报, 2022, 34(2): 1186-1193. WANG B, WANG Q Z, GUO Z Q, et al. Effects of wheat bran replacement by tea leaf residue on growth performance, slaughter performance and meat quality of meat rabbits[J]. Chinese Journal of Animal Nutrition, 2022, 34(2): 1186-1193 (in Chinese). |
| [23] |
CHODOVÁ D, TŮMOVÁ E, HÄRTLOVÁ H, et al. Changes of haematological and biochemical indices with age in rabbits with ad libitum and limited feed intake[J]. Acta Veterinaria Brno, 2017, 86(1): 29-35. DOI:10.2754/avb201786010029 |
| [24] |
BIANOSPINO E, MOURA A S A M T, WECHSLER F S, et al. Age-related changes in muscle fiber type frequencies and cross-sectional areas in straightbred and crossbred rabbits[J]. Animal, 2008, 2(11): 1627-1632. DOI:10.1017/S1751731108002759 |
| [25] |
CHODOVÁ D, TŮMOVÁ E, VOLEK Z. The effect of limited feed intake on carcase yield and meat quality in early weaned rabbits[J]. Italian Journal of Animal Science, 2019, 18(1): 381-388. DOI:10.1080/1828051X.2018.1530961 |
| [26] |
李玉琴, 李义, 黄新, 等. 解淀粉芽孢杆菌对奶牛泌乳性能、乳成分及血清生化、免疫和抗氧化指标的影响[J]. 动物营养学报, 2022, 34(2): 979-988. LI Y Q, LI Y, HUANG X, et al. Effects of Bacillus amyloliquefaciens on lactation performance, milk composition and serum biochemical, immune and antioxidant indexes of dairy cows[J]. Chinese Journal of Animal Nutrition, 2022, 34(2): 979-988 (in Chinese). |
| [27] |
REBOLLAR P G, PEREDA N, SCHWARZ B F, et al. Effect of feed restriction or feeding high-fibre diet during the rearing period on body composition, serum parameters and productive performance of rabbit does[J]. Animal Feed Science and Technology, 2011, 163(1): 67-76. DOI:10.1016/j.anifeedsci.2010.10.005 |
| [28] |
YANG W Y, HUANG L B, WANG P W, et al. The effect of low and high dose deoxynivalenol on intestinal morphology, distribution, and expression of inflammatory cytokines of weaning rabbits[J]. Toxins, 2019, 11(8): 473. DOI:10.3390/toxins11080473 |
| [29] |
陈冬金, 王锦祥, 孙世坤, 等. 大蒜素及纳豆菌对福建白兔生产性能、抗氧化活性、肠道形态及菌群的影响[J]. 福建农业学报, 2021, 36(12): 1395-1405. CHEN D J, WANG J X, SUN S K, et al. Effects of allicin and Bacillus natto supplements on production, antioxidant enzymes, intestinal morphology, and cecal microbiota of Fujian white rabbits[J]. Fujian Journal of Agricultural Sciences, 2021, 36(12): 1395-1405 (in Chinese). |
| [30] |
KYLIE J. An investigation into the fecal microbiota of domestic rabbits (Oryctolagus cuniculus) and factors influencing its composition[D]. Ph. D. Thesis. Guelph: University of Guelph, 2016.
|
| [31] |
FANG S M, CHEN X, PAN J H, et al. Dynamic distribution of gut microbiota in meat rabbits at different growth stages and relationship with average daily gain (ADG)[J]. BMC Microbiology, 2020, 20(1): 116. DOI:10.1186/s12866-020-01797-5 |
| [32] |
COMBES S, FORTUN-LAMOTHE L, CAUQUIL L, et al. Engineering the rabbit digestive ecosystem to improve digestive health and efficacy[J]. Animal, 2013, 7(9): 1429-1439. DOI:10.1017/S1751731113001079 |
| [33] |
ZHU Y L, WANG C Y, LI F C. Impact of dietary fiber/starch ratio in shaping caecal microbiota in rabbits[J]. Canadian Journal of Microbiology, 2015, 61(10): 771-784. DOI:10.1139/cjm-2015-0201 |




